抗帕颗粒对帕金森病模型小鼠酪氨酸羟化酶神经元的影响
赵晓晖 朱玉萍 杨娟 刘慧琴 沈建
·论 著·
抗帕颗粒对帕金森病模型小鼠酪氨酸羟化酶神经元的影响
赵晓晖 朱玉萍 杨娟 刘慧琴 沈建
目的 探讨抗帕颗粒对1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)帕金森病(PD)模型小鼠黑质纹状体酪氨酸羟化酶(TH)阳性神经元的影响。方法 90只健康雄性C57BL/6小鼠,鼠龄8~12周,并随机分为3组,即正常对照组30只、PD模型对照组30只、PD模型干预组30只;MPTP腹腔注射(40 mg·kg-1·d-1×7 d)制备小鼠PD模型;正常对照组及PD模型对照组予生理盐水1 mL·d-1灌胃,PD模型干预组给予抗帕颗粒40 mg·kg-1·d-1灌胃,连续喂养4个月;黑质纹状体切片、HE染色、免疫组织化学染色TH神经元及Western blotting检测TH蛋白的表达量。结果 ①正常对照组30只(30/30只)最终均存活,PD模型对照组4个月存活27只(27/30只),PD模型干预组4个月存活28只(28/30只);②PD模型对照组、PD模型干预组小鼠每次注射MPTP后先有短暂兴奋[持续(7.61±2.17)min],表现为四处窜跳,随即出现全身中重度震颤,皮毛及尾巴时有竖立,活动减少,持续(24.23±3.89)min后震颤消失,随后出现活动减少;③HE染色显示正常对照组大量褐色TH阳性细胞,PD模型对照组TH阳性细胞数明显减少,PD模型干预组TH阳性细胞数有所增加;④免疫组织化学染色后经Imagepro-Plus 5.1系统分析,正常对照组TH阳性细胞面积为64 145 μm2,高倍镜下可见大量胞质为褐色颗粒的TH阳性细胞;PD模型对照组TH阳性细胞染色面积为40 012 μm2,高倍镜下见TH细胞数明显减少;PD模型干预组TH阳性细胞染色面积为60 952 μm2,高倍镜下见TH阳性细胞数较PD模型对照组增加;⑤Western blotting检测显示正常对照组TH蛋白表达量与PD模型对照组和PD模型干预组比较均有明显差异(P<0.001),PD模型对照组TH蛋白表达量与PD模型干预组比较也有明显差异(P<0.05)。结论 抗帕颗粒可使PD小鼠黑质纹状体中多巴胺能神经元一定程度地减少丢失,对多巴胺能神经元的数量、形态及功能具有一定的保护作用。
帕金森病 1-甲基-4-苯基-1,2,3,6-四氢吡啶 小鼠模型 抗帕颗粒 酪氨酸羟化酶阳性神经元
帕金森病(Parkinson’s disease,PD)是神经系统第二大慢性退行性疾病,近年来中医药在PD中的治疗作用日益受到关注。本研究应用名老中医传统用来治疗脑卒中中痰、半身瘫痪、手足痉挛的经验方药抗帕颗粒,分析其现代药理具有抗氧化应激、抗自由基及提高免疫功能等作用[1];建立1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)致C57BL/6小鼠PD模型[2];观察抗帕颗粒对PD小鼠黑质纹状体酪氨酸羟化酶(tyrosine hydroxylase,TH)阳性神经元的影响。
1 资料与方法
1.1 实验动物与试剂
1.1.1 实验动物 SPF级健康C57BL/6小鼠90只,雄性,鼠龄8~12周,体质量20~22 g,由上海西普尔-必凯实验动物有限公司供应,许可证编号为SCXK(沪)2013-0016;实验动物由上海交通大学附属上海市第六人民医院动物中心喂养,许可证编号为SYXK(沪)2011-0128;均饲养于20~25 ℃环境中,相对湿度40%~70%,工作照度150~300 Ix,动物照度15~20 Ix,12 h昼夜节律喂养。
1.1.2 实验试剂 抗帕颗粒由江苏省南通大学医学院第二附属医院提供[批准文号为通制剂(2001)02-050],MPTP购自美国Sigma公司,生物素标记的羊抗兔IgG及ABC Kit购自Vector公司,DAB-H2O2购自武汉博士德公司,兔抗大鼠TH单克隆抗体购于美国Chemicon公司,小鼠抗大鼠β-actin单克隆抗体、HRP标记的羊抗兔Ⅱ抗及HRP标记的羊抗小鼠Ⅱ抗购自Boster公司。
1.2 方法
1.2.1 实验动物分组 90只上述健康C57BL/6小鼠随机分为3组,即正常对照组30只、PD模型对照组30只、PD模型干预组30只。正常对照组及PD模型对照组予生理盐水1 mL·d-1灌胃,PD模型干预组给予抗帕颗粒(浓度800 mg·mL-1)按40 mg·kg-1·d-1灌胃,每日上午9∶00~10∶00给药,每周称体重1次,按体重调整给药量,连续喂养4个月。
正常对照组30只最终均存活;PD模型对照组4月存活27只,其中1只背部皮肤被同笼小鼠咬伤感染于第92 d死亡,另2只进食逐渐减少,分别于第102 d、114 d衰竭死亡;PD模型干预组4月存活28只,均为进食逐渐减少,于第102 d、119 d衰竭死亡。
1.2.2 PD小鼠模型制备 对照组生理盐水0.1 mL/只,腹腔注射,1次/d,连续7 d;PD模型对照组予MPTP腹腔注射,注射剂量40 mg·kg-1·d-1×7 d;PD模型干预组予MPTP腹腔注射,注射剂量40 mg·kg-1·d-1×7 d[2]。
1.2.3 黑质纹状体切片制备 喂养4个月后每组中随机取一半小鼠即正常对照组15只,PD模型对照组13只,PD模型干预组14只脑组织被用于制作切片;将实验小鼠以麻醉剂(Kentamine 100 mg·kg-1,Xylaxine 10 mg·kg-1,i.p)深度麻醉,经心脏依次灌注生理盐水20 mL和多聚甲醛30 mL;灌注完毕后将小鼠断头取脑,置于4%多聚甲醛中4 ℃条件下后固定24 h;依次浸入15%、20%和30%蔗糖溶液中4 ℃过夜后入包埋剂O.C.T中冰冻包埋;将小鼠脑切至25 μM厚切片,隔5片取一片,入PBS(0.01 mol·L-1)中4 ℃保存。
1.2.4 TH神经元HE染色 用二甲苯去蜡(经2次)5~10 min;无水乙醇、95%乙醇、80%乙醇、70%乙醇各1~2 min,然后蒸馏水洗3 min;苏木紫液染色约10 min(视染液种类和着色情况增减);水洗,1%酸性乙醇(盐酸1 ml,70%乙醇99 mL)或1%盐酸分化,显微镜下控制;流水浸洗至少15 min,至细胞核呈蓝色,也可短时水洗后浸于40 ℃温水使核变蓝;显微镜下观察若核染色过深或不足,应再分化或重染;伊红液染1~2 min后用95%乙醇2次,无水乙醇2次,每次约1~2 min;苯酚、二甲苯(1∶3)5 min;二甲苯2次,每次3~5 min;中性树胶盖片封片。
1.2.5 TH免疫组织化学染色 切片经0.01 mol·L-1的PBS漂洗10 min后移入抗体稀释液包被4 h,再予0.01 mol·L-1PBS漂洗3次(每次10 min)后加入R-TH抗体,4 ℃冰箱内孵育72 h;PBS同法再漂洗3次,移入生物素标记的羊抗兔IgG 4 ℃冰箱中孵育48 h;PBS同法再漂洗3次,移入ABC溶液4 ℃孵育24 h;PBS漂洗3次,每次5 min,DAB-H2O2染色;将切片贴于载玻片上,干燥后脱水透明封片;TH抗体工作浓度1∶5 000,生物素标记的羊抗兔IgG及ABC Kit工作浓度1∶200;应用Imagepro-Plus 5.1系统分析小鼠脑黑质纹状体TH染色细胞形态及面积。
1.2.6 用Western blotting 检测TH蛋白的表达量 喂养4个月后每组中取余下另一半小鼠即正常对照组15只、PD模型对照组14只、PD模型干预组14只脑组织被用于提取蛋白;经麻醉和冰盐水等灌注后断头取脑,冠状位切出包含黑质的脑组织(前囟尾侧4.6~6.2 mm),然后进行匀浆裂解、离心,保留上清于-80 ℃保存备用。
把已提取的蛋白解冻后测定样品的总蛋白含量;每泳道加总蛋白20 μg进行SDS-PAGE凝胶电泳后电转至硝酸纤维素膜上,封闭液封闭3 h,4 ℃孵育兔抗大鼠TH单克隆抗体(1∶500)过夜,室温下分别孵育HRP标记的羊抗兔Ⅱ抗(1∶1 000)及HRP标记的羊抗小鼠Ⅱ抗(1∶1 000)1 h,X线胶片曝光1~10 min,显影、定影;为了证实每个泳道总蛋白量相等,用剥脱液洗膜后以小鼠抗大鼠β-actin单克隆抗体(1∶500)孵育4 ℃过夜,并以HRP标记的羊抗小鼠Ⅱ抗(1∶1 000)室温下孵育1 h,X线胶片曝光1~10 min,显影、定影;用天能化学发光扫描仪对PVDF膜进行扫描;利用Image J软件分析条带吸光度,用GraphPad 6.0进行作图分析。
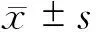
2 结 果
2.1 小鼠造模情况
PD模型对照组、PD模型干预组小鼠每次注射MPTP后先有短暂兴奋[持续(7.61±2.17)min],表现为四处窜跳随即出现全身中重度震颤,皮毛及尾巴时有竖立,活动减少,持续(24.23±3.89)min后震颤消失,随后出现活动减少,并于各时间点以爬杆实验、悬挂实验、游泳实验等行为学评分显示,制模后15 d开始正常对照组与PD模型对照组比较各评分均有明显差异(P<0.05),至4个月2组比较各评分仍有明显差异(P<0.05)。(表1~3)

表1 各组各时间点爬杆实验得分,分)
注:与正常对照组比较,*P<0.05;△P>0.05;与PD模型对照组比较,▲P>0.05,#P<0.05
2.2 各组小鼠黑质纹状体TH神经元HE染色情况见图1。
2.3 各组小鼠黑质纹状体区TH免疫组化染色情况见图2。
2.4 各组小鼠脑黑质纹状体TH蛋白含量见图3。

表2 各组各时间点悬挂实验得分,分)
注:与正常对照组比较,*P<0.05;△P>0.05;与PD模型对照组比较,▲P>0.05,#P<0.05

表3 各组各时间点游泳实验得分,分)
注:与正常对照组比较,*P<0.05;△P>0.05;与PD模型对照组比较,▲P>0.05,#P<0.05

图1 TH神经元HE染色

图2 TH免疫组织化学染色

注:Control为正常对照组;Model为模型对照组;Drug为模型干预组;A为各组小鼠TH蛋白含量变化;B为各组小鼠TH蛋白光密度定量分析;与模型对照组比较,*P<0.05;与正常对照组比较,△P<0.001图3 Westernblotting检测TH蛋白表达量
3 讨 论
帕金森病(PD)是一种以震颤、强直、运动减少为主要临床表现的中老年人常见的中枢神经系统变性疾病,随着PD的进展,轻者可丧失工作能力,重者生活不能自理,甚至出现抑郁、痴呆、完全丧失运动功能等。因此,PD已成为我国乃至世界各国面临的重大医学和社会问题。
迄今为止,医学上还没有预防或治愈帕金森病的方法。左旋多巴作为治疗PD药物治疗的首选,在疾病早期可使患者的运动症状得到有效控制,遗憾的是左旋多巴的治疗并不能改变神经元变性的进展过程,并且长期使用可出现疗效减退及副作用等问题[1-2],因此PD患者亟需更多更全面的治疗来有效阻断或延缓神经元的死亡。
PD的主要病理改变是中脑黑质致密部多巴胺能神经元选择性变性丢失,目前关于神经元选择性退行性变的原因,主要的学说有氧化应激和线粒体功能障碍等。有学者发现,PD患者脑黑质中固醇类过氧化物比正常人增加10倍[3]。近年来随着对中医药研究的深入,中医药在PD中的治疗作用日益受到关注。本研究应用的抗帕颗粒由熟地、山萸肉、红参、生黄芪、丹参、水蛭、全蝎、僵蚕等8味中药组成,现代药理分析显示抗帕颗粒中熟地能调节谷氨酸/γ-氨基丁酸系统递质与受体水平,维持中枢兴奋性与抑制性氨基酸功能的协调平衡,同时可降低脑线粒体单胺氧化酶活性,降低体内过氧化脂含量,具有一定的抗自由基作用[4]。山萸肉能明显抑制二磷酸腺苷、花生四烯酸诱导的血小板聚集,同时可抑制白介素-2的产生和表达[5]。红参中的人参皂甙有促进神经元轴突生长、清除自由基等作用,并可通过抑制氧化应激来对抗多巴胺所诱导的PC-12细胞凋亡[6]。生黄芪能提高网状内皮系统的吞噬功能,增加抗体分泌细胞及T、B淋巴细胞,提高NK细胞活性,具有增强免疫的作用[7]。丹参成分中的丹参酮类、丹参素、丹酚酸类化合物等具有很强的抗氧化、抑制炎症因子、抗氧自由基功能[8-9]。水蛭有较强的抗凝与抗血栓作用,并可减少血小板源生长因子等重要炎症因子的产生,同时通过调节Bax/Bcl-2的表达起到抑制神经细胞凋亡的作用[10]。僵蚕通过其所含的草酸胺具有催眠与抗惊厥作用,并可提高机体免疫力[11]。全蝎可促进乙酰胆碱的释放,并通过调节血栓素B2和6-酮-前列腺素F1α的平衡,起到保护血管内皮、预防血栓的作用[12]。从以上药理分析看到,抗帕颗粒具有抗氧化应激、抗自由基及提高免疫功能等作用,推测这种神经元保护作用很可能在PD治疗中起重要作用。
TH为多巴胺(dopamine,DA)合成的限速酶,黑质纹状体其蛋白含量及活性降低是发病的主要原因,在黑质水平面上连续冰冻切片之后行TH神经元HE、免疫组织化学染色,观察TH阳性神经元并计数,是评价PD病理改变的主要方法,被认为是PD的直接指示剂[13-14]。本研究结果显示,PD模型对照组黑质纹状体TH阳性神经元较正常对照组明显稀疏,数量明显减少;高倍镜下神经元胞体变小,胞质染色变浅,细胞数量减少,突起变短,说明制模有效成功。PD模型干预组黑质纹状体TH阳性神经元较PD模型对照组显著增多,显示抗帕颗粒对TH阳性神经元损害有明显的改善作用;同时运用Western blotting检测显示,正常对照组TH蛋白的表达量与PD模型对照组比较有明显差异(P<0.001),说明模型复制成功;PD模型对照组TH蛋白的表达量与PD模型干预组比较也有明显差异(P<0.05),提示抗帕颗粒干预可提高PD小鼠的黑质纹状体TH蛋白的阳性表达水平,对PD多巴胺神经元具有保护作用,而正常对照组TH蛋白的表达量与PD模型干预组比较也有明显差异(P<0.001),显示抗帕颗粒干预PD虽有效,但仍不能显著改善至正常,分析可能与PD为神经系统退行性、变性疾病的特性有关,同时说明中药治疗的局限性,并提示在下一步的研究中需适当延长干预时间作进一步的研究。
综上所述,抗帕颗粒可使PD小鼠黑质纹状体中多巴胺能神经元一定程度地减少丢失,对多巴胺能神经元的数量、形态及功能具有一定的保护作用,阻断氧化应激反应可能是这种保护作用的关键机制,但还有待于扩大样本、延长干预时间作进一步跟踪研究,并有望在临床进一步推广应用。
[1] Colamartino M,Padua L,Meneghini C,et al.Protective effects of L-Dopa and carbidopa combined treatments on human catecholaminergic cells[J].DNA Cell Biol,2012,31(11):1572-1579.
[2] Quintana A,Sgambato-Faure V,Savasta M.Effects of L-DOPA and STN-HFS dyskinesiogenic treatments on NR2B regulation in basal ganglia in the rat model of Parkinson's disease[J].Neurobiol Dis,2012,48(3):379-390.
[3] Sarrafchi A,Bahmani M,Shirzad HA.Oxidative stress and parkinson's disease: new hopes in treatment with herbal antioxidants[J].Curr Pharm Des,2016,22(2):238-246.
[4] 黄勇,吴建军,刘凯,等.熟地含药血清对骨髓间质干细胞向神经细胞分化的影响[J].中国老年学杂志,2011,31(20):3979-3981.
[5] 李慧敏,刘艳妮,王小蕊,等.以α-葡萄糖苷酶活性抑制率为指标优化山茱萸果肉的提取条件[J].植物资源与环境学报,2013,22(1):112-114.
[6] 王晶,余惠旻,胡胜全,等.红参水提物对Ap25-35诱导SH-SY5 Y细胞凋亡的保护作用[J].华西药学杂志,2008,23(6):627-630.
[7] 左军,张文钊,胡晓阳,等.黄芪现代药理及临床研究进展[J].中医药信息,2014,31(1):111-112.
[8] 范慧霞.中药丹参药理作用研究概况[J].新疆中医药,2007,25(5):113-117.
[9] 齐艳艳,史永照.丹参对缺血性再灌注损伤的保护作用及机制研究进展[J].上海中医药大学学报,2010,24(2):89-91.
[10]李克明,武继彪,隋在云,等.水蛭微粉对脑缺血再灌注损伤大鼠ICAM、VCAM、PDGF的影响[J].中药新药与临床药理,2009,20(2):136-137.
[11]黄海英,彭新君,彭延古.僵蚕的现代研究进展[J].湖南中医学院学报,2003,23(4):62-64.
[12]石雕,吴萍,黄莺,等.全蝎纯化液对大鼠静脉血栓形成TXB2、6-keto-PGF1α的影响[J].中西医结合心脑血管病杂志,2012,10(6):705-706.
[13]Li H,Park G,Bae N,et al.Anti-apoptotic effect of modified Chunsimyeolda-tang,a traditional Korean herbal formula,on MPTP-induced neuronal cell death in a Parkinson's disease mouse model[J].Ethnopharmacol,2015,Dec 24(176):336-344.
[14]Naskar A,Prabhakar V,Singh R,et al.Melatonin enhances L-DOPA therapeutic effects,helps to reduce its dose,and protects dopaminergic neurons in 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-induced Parkinsonism in mice[J].Pineal Res,2015,58(3):262-274.
(2016-06-08收稿)
Effect of anti-Parkinson granule on TH positive-neurons in model mice with Parkinson disease
ZhaoXiaohui,ZhuYuping,YangJuan,etal.
DepartmentofNeurology,thePeople’sHospitalofPudong,Shanghai201200
Objective To explore the pharmaceutical effect of anti-Parkinson granule on substantia nigra and striatum Tyrosine hydroxylase(TH)-positive neurons in model mice with Parkinson disease(PD) induced by 1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine(MPTP).Methods 90 healthy male C57BL/ 6 mice,aged from 8 to 12 weeks,were randomly divided into 3 groups(n=30): normal control group,PD model control group and PD model intervention group.The PD model group was made through intraperitoneal injection with MPTP(40 mg·kg-1·d-1×7 d).The normal control group and the PD model control group were treated with normal saline (1 mL·d-1) intragastrically.The PD model intervention group was treated with anti-Parkinson granule solution(40 mg·kg-1·d-1) intragastrically for 4 months.TH protein expression was detected by HE staining,and immunohistochemistry staining of Western blotting in substantia nigra and striatum slices.At the end of the forth month,TH-positive neurons in substantia nigra and striatum among groups was contrasted and analyzed.Results ①30 mice(30/30 mice)were living in the normal control group,27 mice(27/30 mice)in the PD model control group,and 28 mice(28/30 mice)in the PD model intervention group; ②After injection with MPTP,mice in the PD model control group and the PD model intervention group had short excitements[continued(7.61±2.17)min] with jumping around,followed with the whole body's moderate or severe tremors,fur and tails erected timely and less movement.Tremors ceased after (24.23±3.89)min,and then the movement became less; ③HE staining showed a large number of brown TH positive cells in the control group,the number of PD model control group was significantly reduced,and the number of TH positive cells in the PD model group increased significantly; ④After analysis by Imagepro-Plus 5.1 system,TH positive cells in the normal control group ranged 64 145 μm2,and the mass amount of TH positive cells with brown cytoplasmic granular could be observed under high power microscope.TH positive cells in the PD model control group ranged 40 012 μm2,and the number of TH positive cells decreased significantly.TH positive cells in the PD model intervention group ranged 60 952 μm2,and the number of TH positive cells under high power microscope was significantly increased than that in the PD model control group; ⑤The results of TH protein expression detected by Western Blotting were as follows: the comparison between the normal control group and the PD model group wasP<0.001,between the normal control group and the PD model intervention group wasP<0.001,and between the PD model control group and the PD model intervention group wasP<0.05.Conclusion Anti-Parkinson granule can weaken the lost of TH-positive neurons in PD mice substantia nigra and striatum to some degree.Anti-Parkinson granule can partly protect dopaminergic neurons in aspects of quantity,morphology and function,and may have a hope to improve PD treatment status and a wide application in clinic.
Parkinson’s disease 1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine Mouse Model Anti-Parkinson granule TH-positive neuron
上海市自然科学基金项目(项目编号为13ZR1437400)
201200 上海市浦东新区人民医院神经内科
R742.5
A
1007-0478(2017)01-0008-06
10.3969/j.issn.1007-0478.2017.01.002

