阿尔茨海默病的血管机制
蔡志友 张兆辉
·述 评·
阿尔茨海默病的血管机制
蔡志友 张兆辉
血管是人类个体生命赖以存在的基础。没有血管,就没有人类的生命;没有正常的血管组织结构,就不会有健康正常的人类机体。运动系统中的血管损害,就会出现骨质疏松症、骨坏死、骨折等疾病的发生。消化系统中的血管功能异常,不仅有消化不良的发生,还有消化性溃疡、肠坏死、肠梗阻等疾病的出现。循环系统本身就是由血管腔道组成,它的功能结构异常,会有严重的致命后果发生,比如心肌梗死、心绞痛、严重的心律失常、心绞痛等。周围血管的损害还有发生迁延不愈的坏疽溃疡。在神经系统疾病中脑血管疾病重大危害性众所周知。大脑既是生命中枢,也是思维情感中枢;脑血管出了问题,严重时威胁生命,轻者会出现情感障碍、认知功能损害、痴呆等。因此,血管与人体每个系统和器官的正常组织结构功能密切相关,也和人类的每一个疾病也有着千丝万缕的纠结。
数以千计的文献提示血管因素参与了阿尔茨海默病(Alzheimer’s disease,AD)的发病机制(图1)。AD是一个慢性进行性神经变性疾病,临床上以逐渐加重的认知功能损害、痴呆、精神症状等为特征。无论是脑内的大血管系统病变,还是脑内的小血管病变都是AD的病理生理过程中的积极贡献者。大量研究证实大血管的动脉粥样硬化有助于β-淀粉样蛋白 (beta-amyloid protein,Aβ) 病理和神经元纤维缠结(neurofibrillary tangles,NFTs)形成,因为大血管的动脉粥样硬化不仅促进了Aβ大量生成和tau蛋白的过度磷酸化,而且也阻碍了脑内Aβ的清除,加速了Aβ沉积、老年斑和NFTs的形成。大血管的动脉粥样硬化也促进了神经变性进程,导致大量神经元丢失,表现为认知功能逐渐下降、痴呆、精神症状、步态不稳等。可以这样说,脑内的小血管病变是AD病理过程进展的日夜执行者,和大血管病变一道,促进了Aβ沉积、tau蛋白的过度磷酸化、老年斑和NFTs的形成,最后导致大量神经元丢失,临床症状的渐进性加重。同时,血管因素能够诱发氧化应激、神经炎症和Aβ沉积、tau蛋白的过度磷酸化级联效应,进一步加速神经变性进程,致使AD临床症状的快速恶化。本研究就此讨论AD发病机制的血管基础,以期对AD的今后防治提供清晰的思路和明确的方向。
1 血管危险因素与AD共存
大量的流行病学资料提示血管危险因素是AD的致病原因,比如高龄、高血压病、糖尿病、心脏病、TIA、脑卒中病史、吸烟、高同型半胱氨酸血症等(表1),这里也包括环境和遗传因素[1]。越来越多的证据表明AD和血管危险因素共存,有血管危险因素的个体易患AD。
大量文献表明脑大小血管病变引起的TIA和脑卒中均增加了AD发生率。研究表明作为血管危险因素的载脂蛋白E (ApoE) 基因型是AD发生的独立危险因素[2-3],甚至ApoE是 动脉粥样硬化和AD的链接者[4]。
年龄:随着年龄的增长,血管的柔韧性和弹力日益下降,血管的运输功能也在降低,血管的储备力因此而降低。大量研究资料表明年龄相关的血管结构和功能改变是Aβ病理和tau蛋白过度磷酸化的罪魁祸首[5]。年龄相关的基底膜厚度下降和动脉弹性的降低引起了脉搏强度的减弱,脉搏强度作为清除血液内可溶性蛋白的动力,从而导致了Aβ清除的失败,加快了Aβ的病理形成[6]。
高血压病:高血压病可以损害大脑内的小血管,影响大脑中负责思考和记忆的区域。高血压减少血液流向控制记忆和学习领域的脑区,提高了AD的发病风险。大多数研究表明,中年高血压病患者易患认知能力下降和AD,而且降压药物的服用可以显著抑制AD的病理特征[7]。有研究证实血管紧张素 诱导的高血压加剧了AD样病理改变,如脑血流量减少、神经连接性和认知功能的损害[8]。临床资料也证实高血压病与其它危险因素一道,比如冠状动脉粥样硬化性心脏病、ApoE、血脂异常、肥胖、糖尿病等,共同参与AD的发病机制中,加速了Aβ病理和tau蛋白过度磷酸化[9]。高血压病也会加速脑白质病变和胆碱能神经元的丢失,参与了AD的病理生理过程[10]。高血压病增加了晚期糖化终产物受体的表达,导致Aβ沉积和认知功能障碍[11]。

图1 AD的血管发病机制的4个层面
糖尿病:越来越多的研究证实糖尿病患者具有AD的相似病理特征,甚至要的学者把AD称为3型糖尿病。在过去二十年间已被广泛证明2型糖尿病对脑功能产生重大影响,比如认知能力下降和老年痴呆症发生风险的增加。这种增加的风险可能来自于正常脑老化和胰岛素信号转导功能障碍之间的相互作用。2型糖尿病和AD之所以享有相同的病理特征,可能是因为胰岛素信号转导障碍担当了二者发病机制中相同的关键环节。
心脏病:流行病学和病理学资料显示和AD发病机制相关的心脏病主要有冠状动脉粥样硬化性心脏病、心房纤颤、心肌梗死、心瓣膜功能不全、心功能不全等[12-14]。研究资料证明有效的心脏病防治可以显著降低或者延缓痴呆相关性疾病的发生,比如血管性痴呆和AD[15-16]。
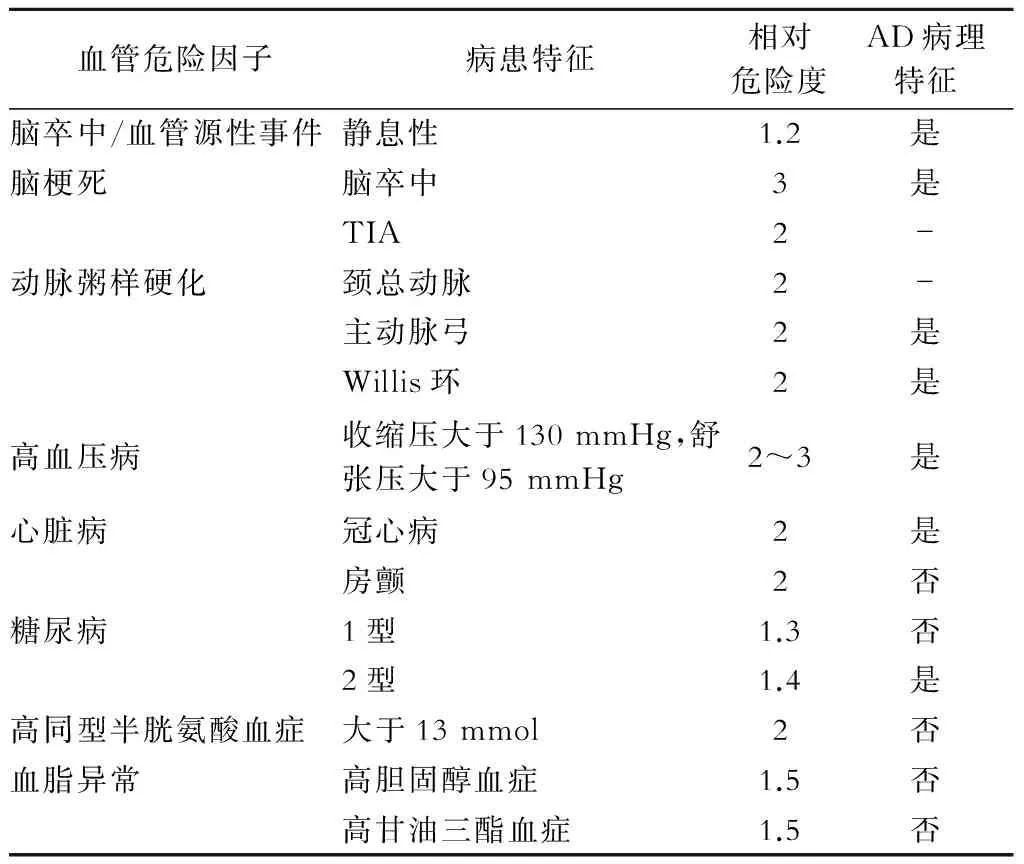
表1 血管危险因素与AD
注:危险度来自与文献中的相对危险度 (relative risk,RR) 和风险比(hazard ratios,HR),表1资料主要来自于文献[17-22]。
2 大血管的动脉粥样硬化
动脉粥样硬化(atherosclerosis,AS)不仅是大面积脑梗死的诱因,也是脑灌注不足和微梗死的易患因素,引起认知能力下降和痴呆的发生。这个过程不仅与血管性认知功能障碍有关,也是AD血管病变的病理学基础(图2)。大量研究资料显示动脉粥样硬化、认知功能损害和痴呆、血管性痴呆和AD交织在一起,密不可分[23]。
自从上个世纪以来,AD颅内动脉粥样硬化的作用一个争论的话题,有资料报道在AD患者中,Willis环与神经炎斑块和神经纤维缠结有着密切关系[24]。大量证据提示颅内动脉粥样硬化是AD的一个独立和重要的危险因素[25]。
在AD患者中低血清对氧磷酶-1(paraoxonase 1,PON1)浓度水平与颈动脉粥样硬化程度有关,二者均为痴呆症状的危险因素[26]。采用量化分析主动脉、心脏和颅内血管动脉粥样硬化,发现在上述任一系统动脉粥样硬化的程度都和AD脑内病理程度之间有关联[27-28]。
在AD中可以发现脑内狭窄的数量更多,闭塞程度的平均指数远远大于AD的对照组,而且狭窄指数和狭窄血管的个案呈正相关,血管狭窄指数与AD病理病变和神经心理认知功能损害程度成正比[29]。同时,与对照组比较,AD患者的大脑前、中、后脑动脉粥样硬化的数量和程度更严重。AD脑内的动脉粥样硬化严重程度与血管淀粉样变的严重性明显关联,且AD的脑白质疏松程度与动脉粥样硬化和血管淀粉样变性的严重程度密切相关的[30]。

图2 AD的可能血管机制
3 脑小血管病与AD
脑小血管病(cerebral small vessel disease,CSVD)是累及到脑小动脉、微动脉、静脉和毛细血管的多病因和病理机制的一组疾病。CSVD主要包含腔隙、腔隙性脑梗死、脑白质疏松症、脑微出血等。CSVD占全世界脑卒中的20%,是血管性痴呆和AD等认知功能障碍和痴呆的最常见原因之一。CSVD可以与AD共存,在AD病理学检查中可以观察到CSVD的存在,这表明CSVD和AD的病理学有着密切联系(图2~3)。CSVD可以促Aβ病变,而AD相关的脑淀粉样病变可增加小血管的进一步损伤。CSVD一直被强调作为一个潜在的主要的AD风险因素,Aβ沉积导致脑血管损伤是其主要病因之一。

图3 脑小血管病与阿尔茨海默病脑小血管病和老化共同促进了阿尔茨海默病的发生,在老化基础上脑小血管病可加速阿尔茨海默病进展
腔隙性脑梗死在AD发病机制上起到重要作用,尤其是在老年AD患者[31]。一些研究提示腔隙性脑梗死和AD的Aβ和tau病理相关联,腔隙性脑梗死与AD患者脑脊液Aβ42以及脑脊液tau蛋白降低有关[32]。
多发性脑微出血在AD中已被证实,且MRI检测显示AD患者的脑微出血发生率高,脑微出血与AD患者神经网络障碍相关。脑微出血也参与了AD的Aβ代谢调节。高龄、Aβ负荷、脑血管病都可能促进脑微出血的发生,且脑微出血与AD临床症状密切相关[33]。
工程上,风机荷载疲劳一般通过雨流计数法将风机时程疲劳载荷转化为等效疲劳载荷,再利用等效疲劳载荷进行疲劳损伤计算。
在影像学上脑白质疏松症被描述为1个弥漫性白质异常的表现,年龄、高血压病、糖尿病和心血管疾病是脑白质疏松症的主要危险因素。大量资料提示脑白质疏松症不仅与脑血管疾病关联,而且也与神经变性疾病密切相关,尤其是与痴呆相关的疾病存在关联。神经影像数据显示脑白质疏松症可出现在AD患者和老年健康人群。从显性遗传的AD网络资料来看,白质高信号 (WMHs)是AD的核心影像学特征[34],而且WMHs容积量是发生AD的重要预测风险因子之一。
此外,有关于Binswanger病和AD关系也被研究资料所证实,而分子生物学方面未见报道。脑萎缩是AD和CSVD的1个共同形态特征;痴呆是AD和CSVD的常见共同临床结果。综上所述,CSVD在AD发病机制中发挥至关重要的作用。
4 氧化应激、神经炎症和AD的血管机制
氧化应激、神经炎症和AD的血管机制有着千丝万缕的联系。其中,血管本身的氧化应激和神经炎症破坏了血管的正常结构和功能,比如动脉硬化、动脉粥样硬化、血脑屏障结构功能的破坏等,破坏了脑内的正常结构和功能,加速老年斑和神经元纤维缠结的形成等[35]。
众所周知,神经炎症是AD的重要病理生理特征之一。在血管机制中炎症在动脉粥样硬化的发生起着重要作用。各种血管危险因素也通过炎症途径参与了AD的病理生理过程,比如心血管病危险因素、代谢综合征、脑卒中等,这些均涉及了多种炎症生物学标志物[36]。在周细胞和内皮细胞ApoE4可以通过炎症途径加速血脑屏障破坏,阻碍脑内Aβ的有效清除[37]。在各种AD动物模型中均发现神经炎症是老年斑和神经元纤维缠结形成的元凶[38]。神经炎症放大了氧化应激效应;神经炎症破坏了正常的细胞信号通路;神经炎症加速了神经元的凋亡和丢失。这些过程均与AD有关[38]。
氧化应激全程参与了AD的发病机制,在AD的血管机制中氧化应激和动脉粥样硬化关系最密切最显著[39]。动脉粥样硬化、血管性痴呆、AD均与氧化应激密不可分,甚至氧化应激、神经炎症和AD病理形成1个互为因果病理恶化环(图4),通过动脉粥样硬化这一具体机制来实现[23]。研究发现氧化低密度脂蛋白不仅加速了AD患者的动脉粥样硬化,而且促进了Aβ的生成和沉积[40]。

图4 氧化应激、神经炎症和AD病理特征
5 展 望
血管机制是AD发生的重要病理生理机制之一。无论是从大血管病变还是小血管病变,都与AD密不可分。可以这样说,血管机制伴随着AD患者的终生。
根据AD的血管学说,对于AD的治疗策略显而易见。如果我们把治疗策略仍投注在清除Aβ上,进而改变AD发病进程,该策略似乎还有继续面临失败的结局。多重内在的和外在的年龄相关因素侵蚀了老年人大脑结构和功能上的完整性,针对年龄相关因素进行预防AD成为可能。如果我们把目标集中在改善微循环和抗衰老上会不会是AD有效的治疗策略?
基于血管学说,脑血管病的防治可以延缓AD的发生。
临床上他汀类药物能让脑血管病患者获益,似乎他汀类药物在防治AD等神经变性疾病也有类似作用。持续运用他汀类药物,8年后随访发现早期坚持使用他汀类药物导致AD的痴呆程度和其他痴呆疾病的痴呆程度大大降低[41]。也有研究证实他汀类药物也能够抑制AD特征性病理发展[42]。
抗血小板聚集药是治疗缺血性脑血管疾病的最常用药物,研究发现抗血小板聚集药比如阿司匹林、氯吡格雷等对AD也有疗效[43]。最近研究显示低剂量的阿司匹林能够抑制小鼠的脑淀粉样血管病变[44]。也有临床资料显示阿司匹林可以增加AD患者脑出血事件的发生[45]。
总之,延缓衰老进程、改善脑微血管功能、增强脑内血管再生将会减缓和抑制AD的神经变性进程,这些措施将会成为AD的有效治疗策略。
改善微循环、预防血管硬化可以延缓AD病程。尽管如此,还没有强有力的循证医学支持这一想法。虽然越来越多分子生物学的基础研究结果表明防治脑血管疾病能使AD患者受益。然而,在临床上仍缺乏对AD和脑血管病两者均有效的特效药物证据。期望在不久将来会有大规模的临床研究资料来阐明这一问题。
[1] Besser LM,Alosco ML,Ramirez GL,et al.Late-Life vascular risk factors and alzheimer disease neuropathology in individuals with normal cognition[J].J Neuropathol Exp Neurol,2016,75(10):955-962.
[2] Bonham LW,Desikan RS,Yokoyama JS.The relationship between complement factor C3,APOE epsilon4,amyloid and tau in Alzheimer's disease[J].Acta Neuropathol Commun,2016,4(1):65.
[3] Dibattista AM,Heinsinger NM,William RG.Alzheimer's disease genetic risk factor APOE-epsilon4 also affects normal brain function[Z],2016.
[4] Stojakovic T,Scharnagl H,Marz W.Crossroads between alzheimer's disease and atherosclerosis[J].Semin Vasc Med,2004,4(3):279-285.
[5] Galvan V,Hart MJ.Vascular mTOR-dependent mechanisms linking the control of aging to Alzheimer's disease[J].Biochimica et Biophysica Acta-Molecular Basis of Disease,2016,1862(5,SI):992-1007.
[6] Meng GF,Zhong XY,Mei HK.A systematic investigation into aging related genes in brain and their relationship with alzheimer's disease[J].PLoS One,2016,11(3):e0150624.
[7] Skoog I,Gustafson D.Update on hypertension and Alzheimer's disease[J].Neurol Res,2006,28(6):605-611.
[8] Wiesmann M,Roelofs M.Van der Lugt R,heerschap a,kiliaan AJ,claassen JA:angiotensin II,hypertension,and angiotensin II receptor antagonism:roles in the behavioural and brain pathology of a mouse model of alzheimer's disease[Z],2016.
[9] Sparks DL.Coronary Artery Disease,hypertension,ApoE.And cholesterol:a Link to alzheimer's disease? [J].Ann N Y Acad Sci 1997,826:128-146.
[10]Connelly PJ,Prentice NP,Fowler KG.Hypertension,white matter change and response to cholinesterase inhibitors in Alzheimer's disease[J].Int J Geriatr Psychiatry,2005,20(7):623-628.
[11]Carnevale D,Perrotta M,Lembo G,et al.Pathophysiological links among hypertension and alzheimer's disease[J].High Blood Press Cardiovasc Prev,2016,23(1):3-7.
[12]Alosco ML,Hayes SM.Structural brain alterations in heart failure:a review of the literature and implications for risk of Alzheimer's disease[J].Heart Fail Rev,2015,20(5):561-571.
[13]Cermakova P,Eriksdotter M,Lund LH,et al.Heart failure and Alzheimer's disease[J].J Intern Med,2015,277(4):406-425.
[14]Rusanen M,Kivipelto M,Levalahti E,et al.Heart diseases and Long-Term risk of dementia and alzheimer's disease: a Population-Based CAIDE study[J].Journal of Alzheimers Disease,2014,42(1):183-191.
[15]Wolozin B,Bednar MM.Interventions for heart disease and their effects on Alzheimer's disease[J].Neurol Res,2006,28(6):630-636.
[16]De La Torre JC.How do heart disease and stroke become risk factors for Alzheimer's disease? [J].Neurol Res 2006,28(6):637-644.
[17]Minagawa H,Watanabe A,Akatsu H,et al.Jung CG et al:homocysteine,another risk factor for alzheimer disease,impairs apolipoprotein E3 function[J].J Biol Chem,2010,285(49):38382-38388.
[18]Warchol-Celinska E,Styczynska M,Prejbisz A,et al.Zdrojewski T et al:hypertension in patients with alzheimer's disease--prevalence,characteristics,and impact on clinical outcome[J].J Am Soc Hypertens,9(9):711-724.
[19]Kivipelto M,Helkala EL,Laakso MP,et al.Midlife vascular risk factors and Alzheimer's disease in later Life:longitudinal,population based study[J].BMJ,2001,322(7300):1447-1451.
[20]Luchsinger JA,Gustafson D.Type 2 diabetes,and alzheimer's disease[J].J Alzheimers Dis,2009,16(4):693-704.
[21]Solomon A,Kivipelto M,Wolozin B,et al.Midlife serum cholesterol and increased risk of Alzheimer's and vascular dementia three decades later[J].Dement Geriatr Cogn Disord,2009,28(1):75-80.
[22]van Oijen M,de Jong FJ,Witteman JC,Hofman A,Koudstaal PJ,Breteler MM: Atherosclerosis and risk for dementia[J].Ann Neurol,2007,61(5):403-410.
[22]Van Oijen M DJ,Risk FD.Atherosclerosis and risk for dementia[J].Ann Neurol, 2007,61(5):403-410.
[23]Ob RB.Vascular dementia:atherosclerosis,cognition and Alzheimer's disease[J].Curr Alzheimer Res,2011,8(4):341-344.
[24]Beach TG,Wilson JR,Li SE,et al.Sabbagh M et al:circle of willis atherosclerosis:association with alzheimer's disease,neuritic plaques and neurofibrillary tangles[J].Acta Neuropathol,2007,113(1):13-21.
[25]Dolan H,Crain B,Troncoso J,et al.Dementia,and alzheimer disease in the Baltimore longitudinal study of aging cohort[J].Ann Neurol,2010,68(2):231-240.
[26]Erlich PM,Lunetta KL,Cupples L,et al.Serum paraoxonase activity is associated with variants in the PON gene cluster and risk of Alzheimer disease[J].Neurobiol Aging,2012,33(5):e1017-e1023.
[27]An,Ozcan KS,Yuksel G,et al.Karaca M et al:altered diastolic function and aortic stiffness in alzheimer's disease[J].Clin Interv Aging,2014,9:1115-1121.
[28]Bektas O,Gunaydin ZY,Karagoz A,et al.Drug therapies and presence of coronary artery disease May affect aortic stiffness in Alzheimer's disease[J].Clin Interv Aging,2015,10:469-470.
[29]Kim TW,Song IU,Jeong DS,et al.Clinical effect of cerebrovascular atherosclerosis on cognition in Alzheimer's disease[J].Arch Gerontol Geriatr,2016,63:55-58.
[30]Kalback W,Esh C,Castano EM,et al.Richardson C et al:atherosclerosis,vascular amyloidosis and brain hypoperfusion in the pathogenesis of sporadic alzheimer's disease[J].Neurol Res,2004,26(5):525-539.
[31]Arai H.Importance of vascular aspects in Alzheimer's disease[J].Nihon Ronen Igakkai Zasshi ,2006,43(4):449-452.
[32] Thal DR,Attems J,Ewers M.Spreading of amyloid,tau,and microvascular pathology in Alzheimer's disease: findings from neuropathological and neuroimaging studies[J].J Alzheimers Dis 2014,42( Suppl 4):S421-S429.
[33]Goos JD,Teunissen CE,Veerhuis R,et al.Van der flier WM:microbleeds Relate to altered amyloid-beta metabolism in alzheimer's disease[J].Neurobiol Aging,2012,33(1011):e1011-e1019.
[34]Lee S,Viqar F,Zimmerman ME,et al.Fox NC et al:white matter hyperintensities are a core feature of alzheimer's disease:evidence from the dominantly inherited alzheimer network[J].Ann Neurol,2016,79(6):929-939.
[35]Gupta A,Iadecola C.Impaired abeta clearance:a potential Link between atherosclerosis and alzheimer's disease[J].Front Aging Neurosci ,2015,7:115.
[36]Fiolaki A,Tsamis KI,Milionis HJ,et al.Biomarkers of atherosclerosis and alzheimer's disease[J].Int J Neurosci,2014,124(1):1-11.
[37]Halliday MR,Rege SV,Ma QY,et al.Accelerated pericyte degeneration and blood-brain barrier breakdown in apolipoprotein E4 carriers with Alzheimer's disease[J].Journal of Cerebral Blood Flow and Metabolism,2016,36(1):216-227.
[38]Sydow A,Hochgrafe K,Konen S,et al.Age-dependent neuroinflammation and cognitive decline in a novel Ala152Thr-Tau transgenic mouse model of PSP and AD[J].Acta Neuropathol Commun ,2016,4:17.
[39]Rafael H.Cerebral atherosclerosis and oxidative stress in Alzheimer's disease[J].J Alzheimers Dis,2003,5(6):479-480.
[40]Weksler ME,Goodhardt M.Do age-associated changes in'physiologic'autoantibodies contribute to infection,atherosclerosis,and Alzheimer's disease? [J].Exp Gerontol 2002,37(8/9):971-979.
[41]Hendrie HC,Hake A,Lane K,et al.Callahan C et al:statin use,incident dementia and alzheimer disease in elderly African americans[J].Ethn Dis,2015,25(3):345-354.
[42]Siegel GJ,Chauhan NB,Feinstein DL.Statin therapy is associated with reduced neuropathologic changes of Alzheimer disease[J].Neurology,2008,71(5):383.
[43]Nilsson SE,Johansson B,Takkinen S,et al.Does aspirin protect against Alzheimer's dementia?A study in a Swedish population-based sample aged>or=80 years[J].Eur J Clin Pharmacol,2003,59(4):313-319.
[44]Hattori Y,Maki T,Saito S,et al.Influence of Low-Dose aspirin on cerebral amyloid angiopathy in mice[J].Journal of Alzheimers Disease,2016,52(3):1037-1045.
[45]Thoonsen H,Richard E,Bentham P,et al.Aspirin in alzheimer's disease:increased risk of intracerebral hemorrhage:cause for concern? [J].stroke 2010,41(11):2690-2692.
(2016-11-07收稿)
442000 湖北医药学院附属人民医院 十堰市人民医院神经内科(蔡志友);武汉大学附属人民医院神经内科(张兆辉)
R749 R742
A
1007-0478(2017)01-0003-06
10.3969/j.issn.1007-0478.2017.01.001

