甲状旁腺素(1-34)对去卵巢大鼠掺锶羟基磷灰石涂层种植体骨整合的影响
孙焘 陶周善 屠凯凯 黄正亮 周强 李杭 白炳力 杨雷*
1. 温州医科大学附属第二医院骨科,浙江 温州 325000 2. 皖南医学院第一附属医院(弋矶山医院)创伤骨科,安徽 芜湖 241000
人工关节置换术是治疗某些关节严重创伤时较为常见且有效的骨科手术,如髋关节、膝关节等损伤。然而,内植入体稳定性不佳仍然是个严重的问题,并常常因包括无菌性松动在内的各种原因而迫使关节置换术后翻修[1]。运用生物活性材料涂层是钛表面性质改性的一种常用方式。羟基磷灰石(hydroxyapatite,HA)涂层植入体在过去用于全髋关节形成术后临床结果显示,HA涂层假体对于非骨水泥假体在关节形成术中是一个有效的替代[2]。尽管HA-涂层加强了植入体周围疏松骨中的骨形成,与在正常骨骼中的植入体相比,骨质疏松骨中植入体的假体并不稳固[3]。近年来,由于锶(Sr)可以抑制破骨活动并增强成骨细胞活性提高骨形成,降低骨的重吸收[4]特性,已有研究显示掺锶羟磷灰石涂层对于内植物的骨整合有积极作用[5]。研究表明甲状旁腺激素(1-34)(parathyroid hormone,PTH)的间断使用通过增加成骨细胞的数量及活性,减弱成骨细胞的凋亡,从而提高其合成作用,可以明显提高内植物的骨整合[6]。综上所述,笔者假设PTH也可能有助于增加掺锶内植物部位骨组织形成,增加内植物的骨整合。本研究的目的在于确认间断给予PTH增加掺锶羟基磷灰石涂层(Sr-HA)钛棒在骨质疏松条件下的骨整合。
1 材料与方法
1.1 涂层种植体的制备
用商业纯钛定制40个直径1.2 mm,长 20 mm的柱状钛棒 (江广磁医疗器械有限公司)。经喷砂、酸蚀后在超声清洗机内分别用70%乙醇、去离子水清洗材料,自然干燥。通过电化学沉积在其表面制备HA和掺锶羟基磷灰石(Strontium-substituted hydroxyapatite,Sr-HA)涂层,具体方法参照文献[5,7]。涂层通过XRD(x—Ray Di ffraction,X射线衍射)来定量定性的分析,扫描电镜(scanning electron microscopy,SEM)观察样品表面的特征来确保涂层和文献的结果相似(具体方案省去)。本实验中采用锶元素置换羟基磷灰石中摩尔分数10%的钙元素。
1.2 实验动物
12 w龄SPF级SD雌性大鼠50只,体重225~250 g,由上海斯莱克动物公司提供,许可证号:(SCXK(沪)2007-0005,合格证号:2007-000548429)。所有动物在温度为(24.0±0.5)℃,湿度为45%~50%,通风良好的环境下饲养,每周称体重1次。
1.3 动物模型的建立及治疗
50只大鼠随机分成2组即OVX组(n=45)切除双侧卵巢以建立骨质疏松动物模型和Sham组不切除双侧卵巢建立假手术模型,具体手术步骤参考以前发表的文章[8]。简单而言,麻醉成功后,于大鼠背部正中线中下1/3处作一长约 2 cm 纵行切口,向两侧钝性分离皮下软组织,于脊柱旁开0.5 cm处钝性分开肌肉组织,显露卵巢脂肪包被组织,轻轻提起卵巢,于输卵管卵巢交界处丝线结扎,完整摘除双侧卵巢,逐层缝合,关闭创口。正常环境下饲养12 w后各组取5只大鼠处死股骨行骨密度测量仪检测检验骨质疏松建立模型建立情况。随后所有的去卵巢(OVX)大鼠随机分成4组:Control组、Sr组、PTH组、PTH+Sr组。每只大鼠植入2枚相同的钛棒,Control组及PTH组大鼠双侧股骨内各植入1枚HA涂层钛棒,Sr组及PTH+Sr组大鼠双侧股骨内植入表面含10%锶元素的Sr-HA涂层的种植体,具体手术步骤参考以前发表的文章[9]。钛棒植入术后第一天开始PTH组、PTH+Sr组大鼠术后给予PTH(Forsteo;Eli Lilly,Houten,荷兰)60 μg/kg皮下注射,每周3次直至去卵巢术后12 w。随后处死所有大鼠,取股骨行Micro-CT、骨生物力学、硬组织组织切片检测。
1.4 Micro-CT 评价
术后12 w,用Micro-CT(SkyScan1176,荷兰)观察种植体周围骨形成情况。每组剩余的10 个标本连同周围骨组织取出后,扫描垂直于股骨的长轴,用 Micro-CT 连续扫描。在所成图像中围绕种植体周围250 μm 厚的区域设为兴趣区,从股骨干骺端板约 2 mm 开始连续 80个断层,以 205 的阈值来提取图像信息。扫描后利用 Micro-CT 配套的软件系统直接计算骨体积分数(bone volume ratio,BV/TV)=所选区域骨组织体积/所选区域总体积,骨小梁厚度(trabecular thickness,Tb.Th),即所选区域骨小梁的平均厚度,骨小梁数量(trabecular number, Tb.N),表示所选区域骨小梁的数量多少, 骨小梁分离度(trabecular separation,Tb.Sp),即所选区域骨小梁间髓腔的平均宽度,连接密度(connectivity density,Conn.D)[7]。
1.5 生物力学测试
Micro-CT 扫描完后将样本放在万用材料测试系统上(Instron 5565,Instron,美国), 以1mm/min的恒定速度沿种植体长轴将其从骨组织中推出, 并用视频引伸计记录整个过程。取加载的最大负荷值为最大推出强度,用最大推出强度除以种植体与骨接触面面积为界面剪切强度[7]。
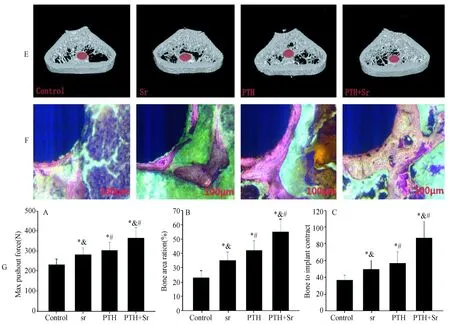
图1 钛棒植入术后12 w各组大鼠股骨内植物Micro-CT、硬组织切片及骨生物力学结果Fig.1 Results of micro-CT, hard tissue sections, and bone biomechanical properties in rats after implantation of titanium rod for 12 weeks注:Vs. Control,*P<0.05;Vs. Sr组,#P<0.05;Vs. PTH组,&P<0.05 (采用单因素方差分析及t检验)
1.6 硬组织切片标本的制备和组织学检查
用于制作硬组织切片的标本被置于4%的中性甲醛缓冲溶液中3d。然后洗净甲醛溶液,梯度浓度乙醇脱水后, 不脱钙包埋于甲基丙烯酸甲酯中, 在骨骺板上约 2 mm处切片(SP1600, Leica,德国),厚约40 μm,经 Van Gieson 染色后显微镜下采集图片,将距种植体表面100 μm 的区域设为兴趣区,并用Image Pro-plus 6.0分析。骨-种植体接触率(bone-to-implant contact rate,BIC)=种植体与骨直接接触部分的长度÷种植体表面的长度×100%,骨面积比率(bone area ratio,BAR)=所选区域骨面积/所选区域的总面积×100%[7]。
1.7 统计学处理
2 结果
所有大鼠都顺利通过了手术并且恢复较快,在整个实验过程都处于良好的健康状态,钛棒植入处未见感染、切口愈合不良等并发症。术后12 w时两组大鼠股骨的骨密度变化骨密度测量仪检测所得,Sham组大鼠的股骨骨密度为(238.34±31.56)mg/cm2,而OVX组大鼠的股骨骨密度为(174.24±29.43)mg/cm2。相对Sham组,OVX组大鼠的骨密度下降36.78%(P<0.05),结果表明骨质疏松模型建立是成功的。安乐死后,植入体周围没有临床显示炎症症状及不良组织反应。这表明局部使用锶联合全身的使用PTH不会产生全身不良反应。
2.1 Micro-CT评估
三维重建图像清晰的显示了对照组组与治疗组钛棒表面及周围骨组织骨小梁微结构的改变情况(图1E)。Micro-CT定量分析结果如表1所示。PTH和Sr涂层的联合使用在所有实验组Micro-CT检测指标中显示出最佳效果。与Control组相比,PTH+Sr组BV/TV增加了2.45倍,Tb.N增加了2.94倍,Conn.D增加了2.31倍,Tb.Th增加了1.56倍,而Tb.Sp降低了1.65倍(P<0.05)。Sr组与PTH组和PTH+Sr组相比表现为更低微观参数(P<0.05)。
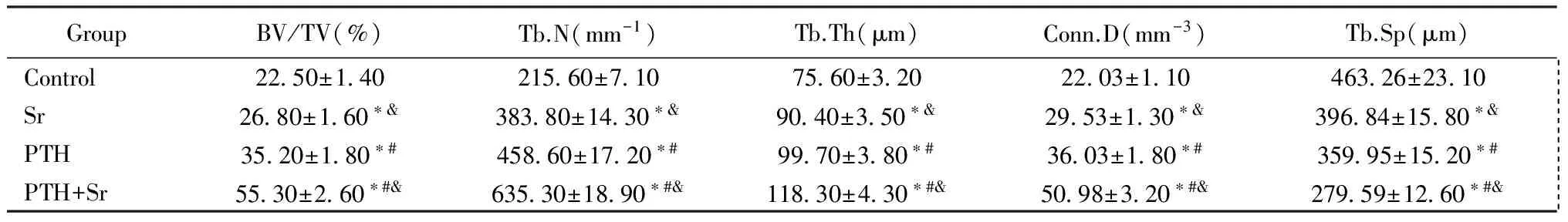
表1 钛棒植入股骨术后12 w时内植物感兴趣区Micro-CT定量分析结果Table 1 Quantitative analysis of micro-CT in the region of interest in 12 weeks after implantation of titanium rod into the femur
Note:*Vs. Control,P<0.05,#Vs. Sr group,P<0.05, &Vs. PTH group,P<0.05(单因素方差分析和t检验)
2.2 组织学评估
硬组织切片结果展示在不同手段干预下钛棒周边骨质改变的情况(图1F)。相较于OVX组,所有的治疗在组织形态定量分析中都有BAR和BIC的显著提高(P<0.05;图1G、B、C)。12w时,Sr组、PTH组及PTH+Sr组的BAR相较于控制组分别提高了1.52倍、1.73倍及2.30倍(P<0.05),它们的BIC接触率分别提高了1.35倍、1.56倍及2.21倍(P<0.05)。
2.3 生物力学测试
Sr组、PTH组及PTH+Sr组的最大推力分别较HA组表现为1.27倍、1.36倍及1.61倍增长(P<0.05)。所有有股骨植入体的组中,PTH+Sr组所观察到的强度效果最大(P<0.05) (图1 G、A)。
3 讨论
此研究评估了系统使用PTH及掺锶涂层对OVX大鼠股骨干骺端植入钛棒的影响。实验结果表明PTH与掺锶涂层在大鼠中的联合使用中显著提高了OVX大鼠钛棒表面的骨形成及其稳定性。PTH+Sr组大鼠钛棒表面更多新骨形成提示联合使用PTH和掺锶涂层对于骨质疏松患者人工关节置换术后假体稳定方面具有重要意义。
实验再次证实了以前研究发现PTH可以促进去卵巢大鼠内植物的骨整合[10]。实验结果显示PTH组的BAR和BIC较HA组分别提高了1.77倍及1.53倍。类似的结果也在生物机械实验中得到,PTH组的最大推力是Control组的1.31倍。最近的研究表明,PTH可以诱导动物成骨细胞形成,增加骨小梁的量和质,提高骨量和强度[11]。此外,PTH可以直接增加骨髓中骨祖细胞复制,通过刺激骨祖细胞向成骨细胞的增殖与分化增加成骨细胞数量,激活骨衬细胞来减缓成骨细胞的凋亡。
目前,有实验比较研究Sr涂层对于内植物骨整合的影响,局部使用Sr涂层不会对骨组织及周围软组织有干扰作用,笔者的研究结果证实Sr涂层可以提高去卵巢大鼠内植物的骨整合[12]。多种实验表明Sr可以通过阻碍破骨细胞活性减少骨吸收,刺激成骨细胞活性增加骨形成[13]。具体来说,Sr可以提高成骨细胞的复制和成骨细胞活性,包括骨基质合成和碱性磷酸酶的产生,减少骨髓细胞分化时产生的破骨细胞标记物,抑制破骨细胞分化,减弱破骨细胞活性,减少其他祖细胞的向破骨细胞分化。笔者的实验结果显示Sr涂层可以明显提高钛植入体表面骨组织重建和新骨形成。本实验中使用PTH的剂量率(60 μg/kg,每周3次)类似于啮齿动物模型实验中常规使用的量[14-15],但远高于人体治疗剂量(40~100 μg/d)[16-17],因此,PTH在啮齿类动物中使用的剂量通常是在人体使用治疗剂量的20~100倍。然而,很少有报道显示类似人类治疗剂量PTH对动物骨密度和骨量有明显的影响。相反,较高剂量的PTH一般认为对骨量或骨密度及血清钙水平有显著的影响[18-19]。
PTH与Sr涂层的联合使用可以明显增加去卵巢大鼠钛棒表面的骨形成。具体机制尚不明确,主要归因于局部骨形成的增加及Sr对于移植体稳定性的局部功能以及PTH的综合功能。 PTH可以刺激胰岛素生长因子,从而增加细胞增殖,减少凋亡[20]。结果显示,PTH增加了骨小梁量及厚度,并最终增加骨密度与骨质。笔者的研究结果证实PTH提高了所有髓腔中骨组织的形成和再生,而不只是植入体的表面。同时,Sr-HA的溶解在植入体骨整合的提高中发挥了重要作用。具体来说,HA溶解可以带来涂层中的锶离子、钙和磷,从而增加植入体表面的这些离子浓度。这些离子都可以增加成骨细胞功能和新骨形成。Sr-HA结晶度的降低进一步提高了溶解度,从而提高了局部锶离子的释放及新骨的形成[21]。因而,高溶解性的Sr-HA涂层刺激骨生长进入植入体的表面。
综上所述,本研究证实在骨质疏松状态下掺锶羟基磷灰石涂层结合间断给予PTH 能有效提高内植物周围的骨形成及稳定性。尽管目前为止所有实验局限于动物实验,随着本实验组研究的进一步深入,将为临床解决骨质疏松骨整合问题提供一条新的思路。

