P75NTR在兔骨折不愈合局部组织中的表达及意义
李家勇 王铭 彭称飞 蒋林彬 张顺 贝朝涌*
1. 桂林医学院附属医院四肢创伤骨科,广西 桂林 541001 2. 桂林医学院生物技术学院,广西 桂林 541001 3. 桂林医学院附属医院,广西 桂林 541001
骨折超过预期时间没有愈合,称为骨折不愈合,其诊断标准是:骨折后至少9个月仍未愈合,或者连续动态观察3个月,未见到骨折有明显的愈合征象[1]。骨折不愈合的治疗一直是骨科领域的热点和难点。
P75NTR是第一个被发现的神经营养因子受体,它能和所有的神经营养因子及神经营养因子前体蛋白结合,调控广泛的细胞功能,包括:细胞生长、分化、增殖、凋亡、神经和突触重构。研究表明:P75NTR能促进纤维蛋白的沉积[2]、抑制血管的生成[3],而纤维蛋白的沉积和血管生成的减少在骨折不愈合的形成中发挥重要作用[4-8]。
本研究拟对兔骨折不愈合骨组织、骨折愈合后骨组织及正常骨组织中P75NTR的表达进行测定,通过了解其在上述三组中的表达,为骨折不愈合的形成机制提供理论基础。
1 材料与方法
1.1 材料
1.1.1主要试剂:鼠抗兔P75NTR单克隆抗体ab157295(abcam公司);通用型二抗来自桂林医学院附属医院病理科。
1.1.2实验动物:纯种新西兰大白兔30只(5~6月龄),体重2.5±0.5kg,雌雄不限,由桂林医学院动物实验部提供,实验过程中对动物处置符合善待动物意见要求。将动物随机分为A、B、C三组,A组骨折不愈合造模组,B组骨折造模组,C组不予处理为正常组。
1.1.3兔骨折模型及骨折不愈合模型的建立:新西兰大白兔用25g/L硫贲妥钠按30 mg/kg剂量腹腔注射麻醉。麻醉后,取俯卧位,常规消毒铺巾,在前臂桡侧沿桡骨作-2.5 cm 长切口,显露桡骨,在距桡骨远端2 cm处截骨(兔骨折模型仅在此处截骨),再向近端距第一截骨线1.5 cm处做第2个截骨线,去除截除的1.5 cm骨段(包括骨膜),彻底止血,依次缝合各层,肌注青霉素8万单位,连注3 d,小夹板外固定,放入笼内喂养。
1.2 方法
1.2.1脱钙染色:三个月后,同时处死上述三组兔子,收集的骨折不愈合组局部组织、骨折组及正常组局部骨组织编号放置于新鲜配制的15% EDTA脱钙液中脱钙,脱钙后清水冲洗去除标本上残留的EDTA。所有组织均浸泡于95%乙醇中脱水2 h,再置于二甲苯中40 min。将脱钙脱水的组织石蜡包埋。
1.2.2免疫组织化学染色:石蜡包埋组织块切片烤干后经二甲苯脱水,0.5% H2O2室温孵育10 min灭活内源性过氧化物酶,EDTA抗原修复,与1∶30稀释的P75NTR抗体反应,4℃过夜。PBS洗涤3次,加入通用型二抗,室温孵育1 h,DAB显色,经苏木精复染后进行常规脱水、封片、显微镜观察。用IPP 6.0病理图像分析软件定量分析三组中P75NTR的表达情况。
1.2.3Western blotting检测P75NTR的表达:将组织研磨离心后取上清,以SDS-PAGE凝胶行蛋白电泳,电泳完毕将蛋白转至PVDF上。转膜后在含5% 脱脂奶粉的TBST中封闭1 h,TBST洗涤3次,与1∶2000稀释的P75NTR抗体及β-actin抗体反应,4℃过夜。洗膜3次,加1∶4000稀释的二抗,室温孵育1 h,ECL化学发光法显色。
1.2.4结果判定:显微镜下肉眼观察三组切片P75NTR表达情况,并进行比较。组织中出现棕黄色颗粒染色的为阳性,每组织切片随机选取5个高倍视野(×400),高分辨率相机拍照后将图像输入计算机储存,使用Image-Pro-Plus IPP6.0医学病理图像分析系统进行半定量分析,计算每个视野的累积光密度值和累积阳性面积值,两者比值为该视野平均吸光度值,将每组5个视野的平均吸光度值算出后取其均数作为统计数据进行分析。
1.3 统计学处理
2 结果
2.1 光镜下三组组织形态差异
光镜下显示骨折不愈合区域存在大量纤维瘢痕组织,断端周围区主要是纤维性骨痂。免疫组织化学染色显示三组骨组织组P75NTR的表达情况,见图1。
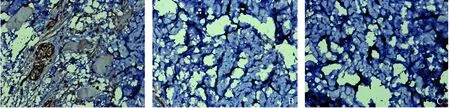
图1 兔骨折不愈合组、骨折组及正常组局部组织P75NTR免疫组织化学染色 200×图中可见P75NTR主要分布在纤维组织、纤维骨痂。 A:骨折不愈合组;B:骨折组;C:正常组Fig.1 Immunohistochemistry of P75NTR in local tissues of rabbits in the nonunion, fracture and untreated groups 200×P75NTR mainly distributed in fibrous tissue and fibrous callus. A: Nonunion group; B: Fracture group; C: Untreated group
2.2 三组标本P75NTR表达的差异
骨折不愈合组P75NTR平均吸光度值为0.3287±0.0419,骨折组P75NTR平均吸光度值为0.0267±0.0187,正常组P75NTR平均吸光度值为0.0159±0.0136。使用SPSS软件进行统计学分析,方差分析表明骨折不愈合组P75NTR平均吸光度值明显高于骨折组及正常组,差别有统计学意义(F=394.875,P<0.05)。骨折组与正常组差别无统计学意义(P>0.05)。见图2。
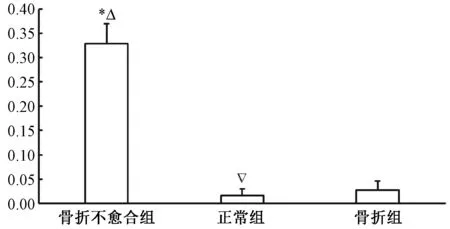
图2 三组标本中P75NTR平均吸光度值注:与正常组比较,*P<0.05;与骨折组比较,△P<0.05;与骨折组比较,▽P>0.05Fig.2 Average absorbance value of P75NTR in the three groupsNote: Compared with the untreated group,*P<0.05; Compared with the fracture group,△P<0.05; Compared with the fracture group,▽P>0.05

图3 Western blotting检测三组中P75NTR表达注:1 骨折不愈合组;2 正常组;3 骨折组Fig.3 Expression of P75NTR in the three groups detected by Western blottingNote: 1 Nonunion group; 2 Untreated group; 3 Fracture group
2.3 Western blotting检测三组中P75NTR蛋白水平
Western blotting检测显示,骨折不愈合组P75NTR表达水平显著高于骨折组和正常组(P<0.05),骨折组和正常组无明显差别(P>0.05),见图3、表1。
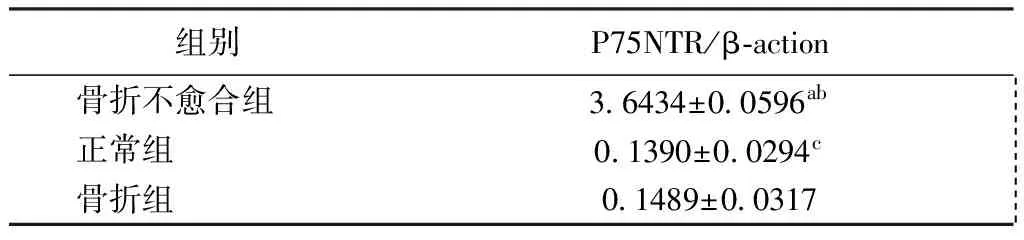
表1 三组标本P75NTR/β-action的比较Table 1 Comparison of the ratio of P75NTR to β-action among the three groups
注:与正常组比较,aP<0.05;与骨折组比较,bP<0.05;与骨折组比较,cP>0.05
Note: Compared with the untreated group,aP<0.05; Compared with the fracture group,bP<0.05; Compared with the fracture group,cP>0.05
3 讨论
正常情况下, 骨折后骨折周围纤维蛋白的表达迅速升高,能促进止血,促进炎症因子趋化,并在骨折修复的起始阶段起支撑作用,随着骨折的愈合进程,其表达水平逐渐下降,至骨折完全愈合时表达水平接近零[9]。在骨折愈合过程中,一些学者观察到持续的纤维蛋白沉积影响骨折愈合:Cole HA等[6]在小鼠模型中发现骨折局部的纤维蛋白持续沉积能直接刺激破骨细胞生成,导致严重的骨质疏松,影响骨折的愈合;Yuasa M等[7]通过在纤维蛋白原和纤维蛋白酶原基因沉默的小鼠股骨骨折模型中发现:持续的纤维蛋白沉积抑制软骨内血管的生成和成骨作用,影响骨折的愈合。亦有学者[4-5]对骨折不愈合局部组织切片进行分析,发现骨折不愈合断端主要是纤维样组织,无骨组织,纤维样组织离体培养后可见其中含纤维母细胞样细胞。本实验亦表明,骨折不愈合区域存在大量纤维瘢痕组织,断端周围区主要是纤维性骨痂(图1)。
同样,血管的生成在骨折愈合的进程中亦起到非常重要的作用:Maes C等[8]研究表明在骨折愈合过程中,血管的生成对成骨细胞基质矿化的调节是必不可少的;软骨内血管的形成能促进成骨细胞分化,同时成骨细胞可以通过血管到达骨折部位,而阻断骨折局部的血管能抑制骨化中心的形成。
综上表明,骨折局部纤维蛋白的持续沉积和血管生成的抑制在骨折不愈合发病中起到非常重要的作用,而P75NTR能抑制纤维蛋白的降解和抑制血管的再生。研究表明P75NTR表达的升高抑制纤维蛋白的降解:P75NTR通过下调丝氨酸蛋白酶(serine endopeptidase)、组织型纤溶酶原激活物(tissue plasminogen activator,tPA)和上调纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor 1,PAI-1)来限制纤维蛋白降解[10];同时P75NTR表达的升高还能抑制四肢血管[11]、肺血管[12-13]和视网膜色素上皮细胞血管[14]的再生。
虽然以上学者的研究能够表明P75NTR影响骨折的愈合,但在骨折不愈合组织中是否存在P75NTR的表达至今未见报道。本实验通过检测P75NTR在兔骨折不愈合组、骨折组及正常组三组中的表达,发现P75NTR在骨折不愈合组高表达,而在骨折组及正常组中表达较低,表明P75NTR可能参与骨折不愈合的形成,可能是骨折不愈合形成的一个重要因素,有望成为骨折不愈合治疗的一个新的靶点。关于P75NTR在骨折不愈合进程中的表达情况及其引起骨折不愈合形成的机制还有待于进一步研究。

