基于适配体-表面等离子共振的生物传感技术及应用
杜 斌, 童朝阳*, 刘志伟, 穆晞惠, 丁志军, 曹 韡
(1. 国民核生化灾害防护国家重点实验室, 北京 102205; 2. 防化研究院, 北京 102205)
基于适配体-表面等离子共振的生物传感技术及应用
杜 斌1, 童朝阳1*, 刘志伟1, 穆晞惠1, 丁志军2, 曹 韡2
(1. 国民核生化灾害防护国家重点实验室, 北京 102205; 2. 防化研究院, 北京 102205)
适配体以其合成、修饰、固定等方面的优势,在生物分子识别领域有广泛的应用。基于表面等离子共振的传感技术具有非标记、无需前处理、实时监测等优点。适配体与表面等离子共振相结合研制的生物传感器在生物传感领域具有重要的应用价值,本文综述了基于适配体-表面等离子共振的生物传感技术及应用。
适配体; 表面等离子共振; 生物传感; 检测; 应用
1 引 言
表面等离子共振(Surface plasmon resonance,SPR)是一种光学现象,当金属表面的物质或者物质的量发生变化时,其折射率发生相应的变化。SPR光谱的共振角对与金属相接触的介质折射率的微小变化极其敏感。SPR生物传感技术是用于生物检测的前沿性技术,具有非标记、实时在线监测、可再生等优点[1]。近年来对SPR传感芯片的改性受到了广泛关注,已有许多课题组对此进行了深入研究,对传感芯片进行修饰并将不同的生物识别基团与传感器芯片偶联。这些生物识别基团包括蛋白[2]、分子印迹聚合物(Molecularly imprinted polymer,MIP)[3-6]、抗体(Antibody)[7-9]等。这些识别基团分子量和空间位阻较大,制备复杂,稳定性易受温度、酸碱度、电解质等因素的影响导致灵敏度难以进一步提高,使其应用受到了一定限制。
适配体(Aptamer)是通过指数富集的配基系统进化技术(Systematic evolution of ligands by exponential enrichment,SELEX)筛选而来的,是一类能以较高亲和力与各类靶分子特异性地结合的单链寡核苷酸(DNA、RNA、修饰RNA)[10-11]。与传统的抗体相比,适配体具有易合成、易修饰、易固定、可反复使用和长期保存的优点,在生物检测方面有广泛的应用[12-17]。利用适配体的这些特性将其修饰至SPR基底上,进而用于生物分析检测可以获得更好的灵敏度和特异性。因此,适配体与SPR技术相结合,在生物检测领域具有重要的应用前景。本文综述了近年来基于适配体-SPR的生物传感技术应用及研究进展。
2 适配体-SPR传感器的构建及检测模式
2.1 传感器的构建
基于适配体-SPR的生物传感器通常由适配体识别基团和SPR检测平台组成。其中,适配体由SELEX筛选得到,SPR检测平台的传感芯片的基底上通常镀有金膜[18]。适配体通常固定于SPR传感芯片的基底上,当目标物流经传感芯片时,连接在SPR基质上的适配体对目标物特异性识别导致共振条件发生变化以改变SPR的输出信号,从而对目标物进行分析检测,而连接在起放大效应物质上的适配体则与目标物相互作用以放大SPR信号输出。
2.2 适配体在SPR传感芯片上固定方法
常用的SPR传感芯片大多以金为基底,另一类则是在金膜表面覆盖葡聚糖层(最常用的为羧甲基葡聚糖)。针对金膜传感芯片,适配体固体方法主要有金硫键自组装[19]与生物素-亲和素法,覆盖有葡聚糖层的芯片则适用于偶联带有氨基、巯基、醛基、羟基或羧基的分子。可根据不同的结构和需求选择不同的固定方式将适配体偶联在相应的传感芯片上。
金硫键自组装是将末端(3′或5′)标记有巯基的适配体在金硫键成键驱动作用力下有序吸附在传感器金膜表面形成单层膜。该方法简单易操作,且适配体易于末端巯基修饰,因此可以很好地固定于传感膜芯片上,由该方法制备的传感芯片稳定性好、覆盖度高、排列有序,应用广泛。Bianco等[20]将巯基修饰的适配体以自组装单层膜(Self-assembled monolayers,SAM)形式固定在金膜表面用来检测赭曲霉毒素A(ochratoxin A,OTA),实验结果表明SAM结构对OTA的检出限为0.005 ng/mL。
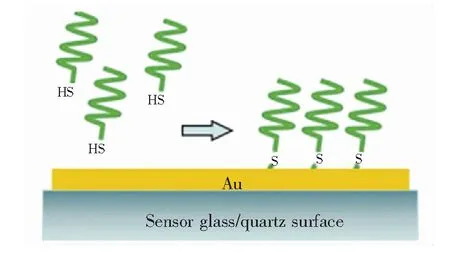
图1 使用硫醇化适配体紧密自组装单层膜(SAM)的功能化过程[20]
Fig.1 Scheme of the functionalization process with the thiolated aptamer compact self-assembled monolayers[20]
生物素-亲和素法:亲和素能够特异性非共价结合生物素,它们之间的亲和作用十分稳定,生物素修饰的适配体可以很好地结合在亲和素覆盖的芯片上。生物素-亲和素法是一种具有高亲和力、灵敏度高、特异性强和稳定性好等优点的信号放大标记技术,因而该方法广泛应用于传感器表面的修饰。Loo等[21]将5′生物素修饰的适配体通过生物素-亲和素法连接至亲和素修饰的SPR金膜表面,该系统被用于细胞色素C的检测,其检测范围为80 pmol/L~80 nmol/L,检出限≥50 pmol/L。
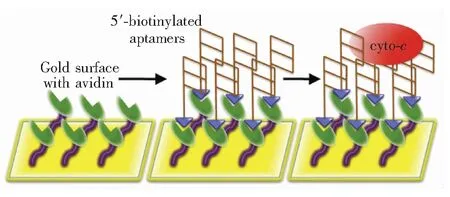
图2 羧基活化的金芯片用于亲和素涂层;细胞色素C的适体通过DNA 5′末端的生物素-亲和素相互作用固定在金表面上[21]。
Fig.2 Gold chip was activated with carboxyl group for avidin coating. The cyto-c specific aptamers are then immobilized on the gold surface at the DNA 5′-endviathe biotin-avidin interactions[21].
适配体在表面覆盖有葡聚糖层的金膜传感芯片上固定时主要采用化学键共价结合的方法。但由于葡聚糖层并不像金膜层那样平整,适配体的表面分布可能受葡聚糖层的影响,且部分适配体会被掩埋在由葡聚糖改性产生的小孔内,影响其构象改变。因此,基于适配体-SPR的传感技术较少选用金膜表面覆盖有葡聚糖层的传感芯片。Wang等[22]将氨基修饰的蓖麻毒素适配体通过化学键共价结合固定在羧甲基葡聚糖改性的金膜上,在SPR实验中测定的蓖麻毒素检出限约为25 pmol/L(1.5 ng/mL)。
2.3 适配体-SPR传感器的检测模式
常用的适配体-SPR传感器检测模式主要有直接测定法、夹心测定法和间接竞争性抑制测定等。
2.3.1 直接测定法
这类传感器是将适配体固定在SPR传感芯片上,适配体直接与被测物相互作用后改变传感芯片表面的光学性质。Janardhanan等[23]将A型肉毒毒素(type A botulinum neurotoxin,BoNT/A)的适配体固定在传感芯片上,进行检测时将BoNT/A的缓冲液注射流经传感芯片表面,适配体直接检测到BoNT/A引起SPR信号的改变,该传感器在90 min内检测到活性毒素,在稀释5倍的人血清中的检出限是22.5 ng/mL,并且可将毒素从变性和失活毒素中有效区分。Lee等[24]筛选出对视黄醇结合蛋白4(Retinol binding protein 4,RBP4)表现出较高的亲和力和特异性的适配体,并将该适配体固定在SPR传感芯片金膜上。当样品中存在RBP4时适配体直接捕获目标物,检出限为75 nmol/L(1.58 μg/mL)。
2.3.2 夹心测定法
夹心测定法的机理为:将可结合至目标物不同位点的一对适配体分别固定在SPR传感芯片和起放大效应的增敏物上,当目标物存在时,增敏物上所连接的适配体与传感芯片上适配体结合住的目标物相结合,以增强SPR信号。Park等[25]筛选得到了可以高亲和力和特异性与1型牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)结合且具有不同结合位点的两种适配体。他们将一个适配体固定在金膜表面,使用Au NPs与另一个适配体偶联,以适配体-病毒-适配体的夹心检测形式对BVDV 1型进行超灵敏检测。该方法检出限为5×102TCID50/mL(约800 copies/mL),这与实时PCR方法相当。Nguyen等[26]筛选出一对可同时与H5N1病毒结合且结合位点不同的适配体,第一个适配体固定于金膜表面,当它与H5N1结合后再加入与Au NPs偶联的次级适配体对检测进行放大,检出限为200 EID50/mL。该传感器可快速、准确地从H5N1感染的粪便样本中检测禽流感全病毒。
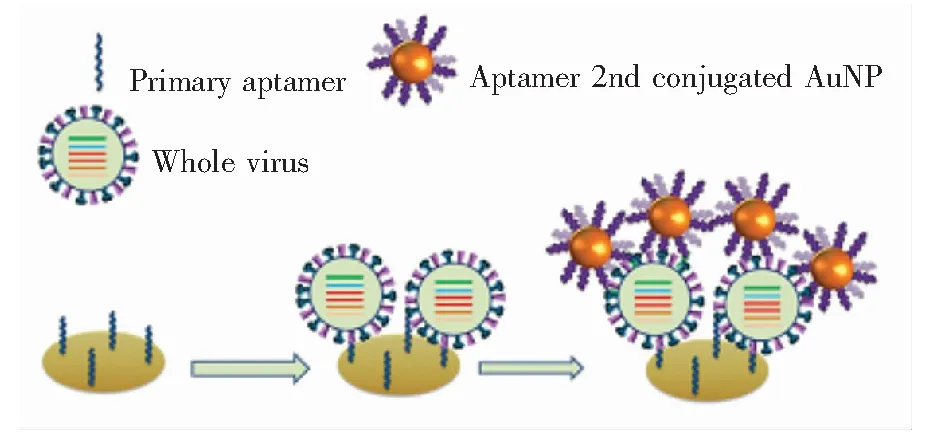
图3 使用次级适配体AuNP偶联物的夹心分析的检测机理示意图[26]
Fig.3 Schematic of detection mechanism of sandwich assay secondary aptamer conjugated-AuNP[26]
2.3.3 间接竞争性抑制测定
间接竞争性抑制测定(Indirect competitive inhibition assay,ICIA)过程如下:目标物适配体的巯基化互补单链DNA首先固定在传感芯片上,目标物适配体与具有放大效应的物质如磁性纳米粒子(Magnetic nanoparticles,MNPs)和金纳米粒子(Gold-nanoparticles,Au NPs)形成偶联物。由于这类物质能够提高传感芯片生物分子的固载量[27-29],具有放大效应,当目标物不存在时偶联物溶液被添加到SPR元件中,偶联物通过DNA杂交反应吸附到SPR芯片表面并导致SPR信号的巨大变化。当偶联物与目标物结合后,SPR信号的变化即降低。这是因为目标物与适配体在偶联物中反应并且将其结构从单链DNA改变为三级结构,不能与固定在SPR金膜表面上的互补单链DNA杂交。因此,SPR信号的变化将随着具有三级结构的偶联物的数量增加而减少,它与目标物的浓度成比例。Wang等[30]通过金硫键将腺苷适配体的互补链在金膜表面自组装成单层膜,再将Fe3O4MNPs-腺苷适配体偶联物在SPR传感芯片基底上组装,以放大传感器检测腺苷的信号。加入腺苷后SPR信号随腺苷浓度的增加而减弱。
2.3.4 组合适配体增强测定
组合适配体增强测定是一个适配体分子中存在两种不同目标物的适配体结构,适配体分子与一个目标物结合后其构型改变并可以与另一个目标物结合以放大检测信号。Chang等[31]设计了一种具有发夹结构的γ干扰素(Interferon-γ,IFN-γ)的适配体,并在该适配体中引入SA的适配体,当IFN-γ存在时,靶分子IFN-γ会诱导适配体探针重折叠,形成SA适配体的结合构象,通过SA分子与适配体探针的结合进一步增强SPR的响应。在优化条件下,测得的检出限为33 pmol/L,浓度范围为0.3~333 nmol/L。
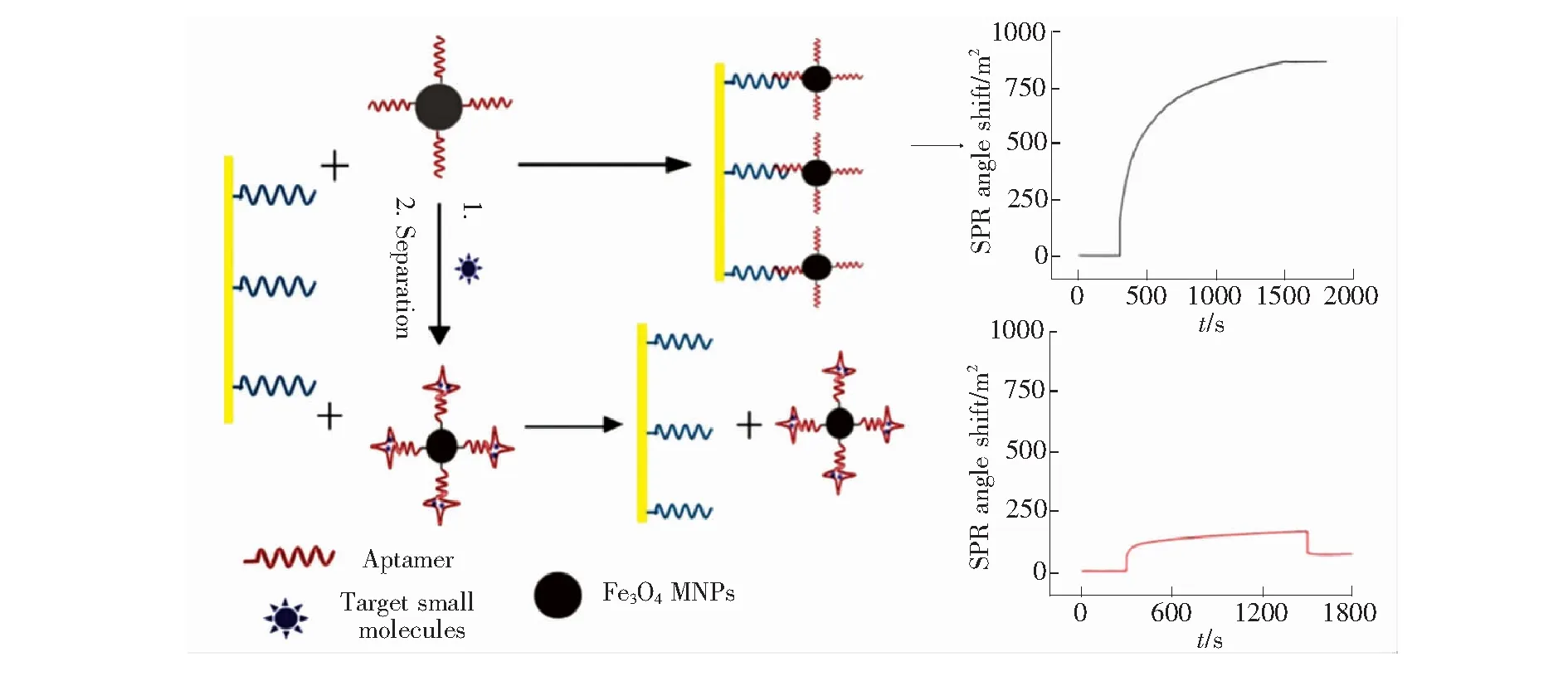
图4 基于SPR生物传感器检测小分子原理图[30]
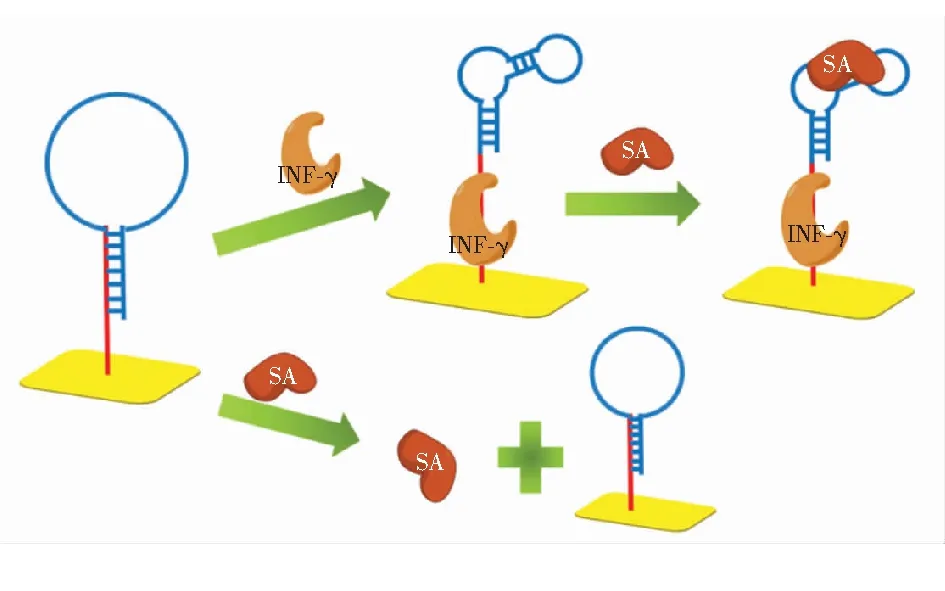
图5 增强IFN-γ检测的流程示意图[31]
Fig.5 Schematic illustration of the procedure for amplified IFN-γ detection[31]
3 适配体-SPR传感器在生物检测中的应用
适配体-SPR生物传感技术结合了适配体与SPR技术的优点,广泛应用于毒素、病毒、蛋白、腺苷和干扰素等生物组分的检测。
3.1 毒素检测
Zhu等[32]使用生物素-亲和素法将赭曲霉毒素A(ochratoxin A,OTA)适配体固定在SPR传感芯片上。该传感器对OTA的检出限可达0.005 ng/mL。Park课题组[33]则是将OTA适配体通过金硫键自组装的方式固定在金纳米棒基底上,当OTA与之结合后会引起适配体折叠形成G-四联体结构,从而导致金纳米棒表面RI的巨大改变并引起波长位移。当OTA浓度在0.1 nmol/L~10 μmol/L范围内时,可观察到局域表面等离子共振(Localized surface plasmon resonance,LSPR)红移与OTA浓度呈线性关系,对OTA的检出限低于1 nmol/L。
3.2 病毒检测
由于高致病性H5N1流感在动物和人类中可能爆发,因此迫切地需要快速和特异性检测禽流感病毒。Wang等[34]筛选和表征了可与H5N1特异性结合的适配体,并使用生物素-亲和素法将其固定在SPR芯片表面。该适配体-SPR传感器可以用于检测禽流感病毒H5N1,当病毒滴度在0.064~0.64 HAU范围内时SPR信号与病毒滴度呈线性关系。Bai等[35]使用生物素-亲和素法将适配体固定在链霉亲和素(Streptavidin,SA)修饰的SPR传感芯片金膜上。优化SA与适配体参数后,当禽流感病毒浓度在0.128~1.28 HUA范围内时,RI值与禽流感病毒浓度线性相关,检出限可达0.128 HUA。Nguyen等[26]筛选出一对可同时与H5N1病毒结合的适配体,且这对适配体结合于同一H5N1全病毒的不同位点。该课题组使用这对适配体发展了一种夹心生物传感器,对H5N1全病毒检测的线性范围为0~105EID50/mL,检出限为200 EID50/mL。
3.3 免疫球蛋白检测
免疫球蛋白(Immunoglobulin,Ig)是一类重要的免疫效应分子,是检查机体体液免疫功能的一项重要指标。Wang等[36]使用巯基修饰的IgE适配体修饰传感器表面,并使半胱氨酸与硫醇适配体共沉积以促进适配体的适当空间排列,以保持其最佳结合效率。实验结果表明IgE和适配体之间存在浓度依赖性的线性关系,IgE浓度在8.4~84 nmol/L范围内时,信号强度和IgE浓度呈线性关系,检出限为2 nmol/L。Kim等[37]使用具有不同摩尔比的各种低聚乙二醇混合物构建SAM,再将适配体通过生物素-亲和素法固定在SAM上用于非标记检测人IgE。他们使用直接测定法和改进的夹心分析法用于实时IgE检测,这两种方法的线性范围都是1.0~1 000 ng/mL,而且样品检出限分别为3.44 ng/mL和2.07 ng/mL。
3.4 腺苷检测
Wang等将腺苷适配体的互补链固定在金膜表面,再将适配体分别与Fe3O4MNPs和Au NPs连结。与Fe3O4MNPs和Au NPs连结的偶联物具有放大效应,他们使用这两种基于ICIA的传感器检测腺苷,线性范围分别为10~10 000 nmol/L[30]和1×10-10~1×10-7mol/L[38]。
3.5 其他蛋白检测
凝血酶是一种生物活性物质,其促凝和抗凝的特性在凝血级联反应中有着重要作用。Henseleitng等[39]把抗凝血酶适配体通过生物素-亲和素法固定在金膜表面,使用注射泵将不同浓度的凝血酶溶液注入传感器表面以测定其相互作用。该方法能够获得可重现、显著和稳定的信号,检出限约26 nmol/L。Wang等[40]使用具有放大效应的Fe3O4MNPs-适配体偶联物构建了一个夹心型生物传感器以检测凝血酶。当凝血酶浓度在0.27~27 nmol/L范围内时,凝血酶浓度的对数与SPR角位移呈线性关系,检出限为0.017 nmol/L。Polonschii等[41]将生物素化的适配体固定在SPR金膜上,测试表明其对凝血酶的检出限为3 nmol/L,在其他干扰蛋白质(血浆)存在时,检测凝血酶的变异系数为5%。
Tran等[42]筛选出花生过敏原Ara h 1的适配体,该适配体在生物素化后通过SA固定在11-巯基十一烷酸SAM修饰的金膜上。当Ara h 1蛋白浓度在0~634 nmol/L范围内时,该适配体修饰的光纤SPR检测系统信号强度和浓度呈线性关系,在缓冲液中用Au NPs增强测定时检出限约为2 nmol/L。
Wu等[43]将C反应蛋白的适配体通过金硫键自组装的方式固定在金膜表面,适配体检测到目标物后加入偶联了C反应蛋白抗体的Au NPs对SPR信号进行放大。该型Au NPs增强的适配体-抗体夹心型SPR生物传感器对C反应蛋白的检出限为10 pmol/L。
核酸适配体与SPR技术相结合,在生物检测领域具有重要的应用价值。适配体-SPR生物传感器主要用于生物蛋白、毒素、病毒等物质的检测。如表1所示,其检测对象主要为IgE、凝血酶、H5N1病毒等。这主要是由于这类免疫球蛋白和生物活性蛋白与人体的生理功能息息相关,各类毒素和病毒深刻地影响着人类的生命健康。因此,这些物质的检测研究成为人们的研究重点。
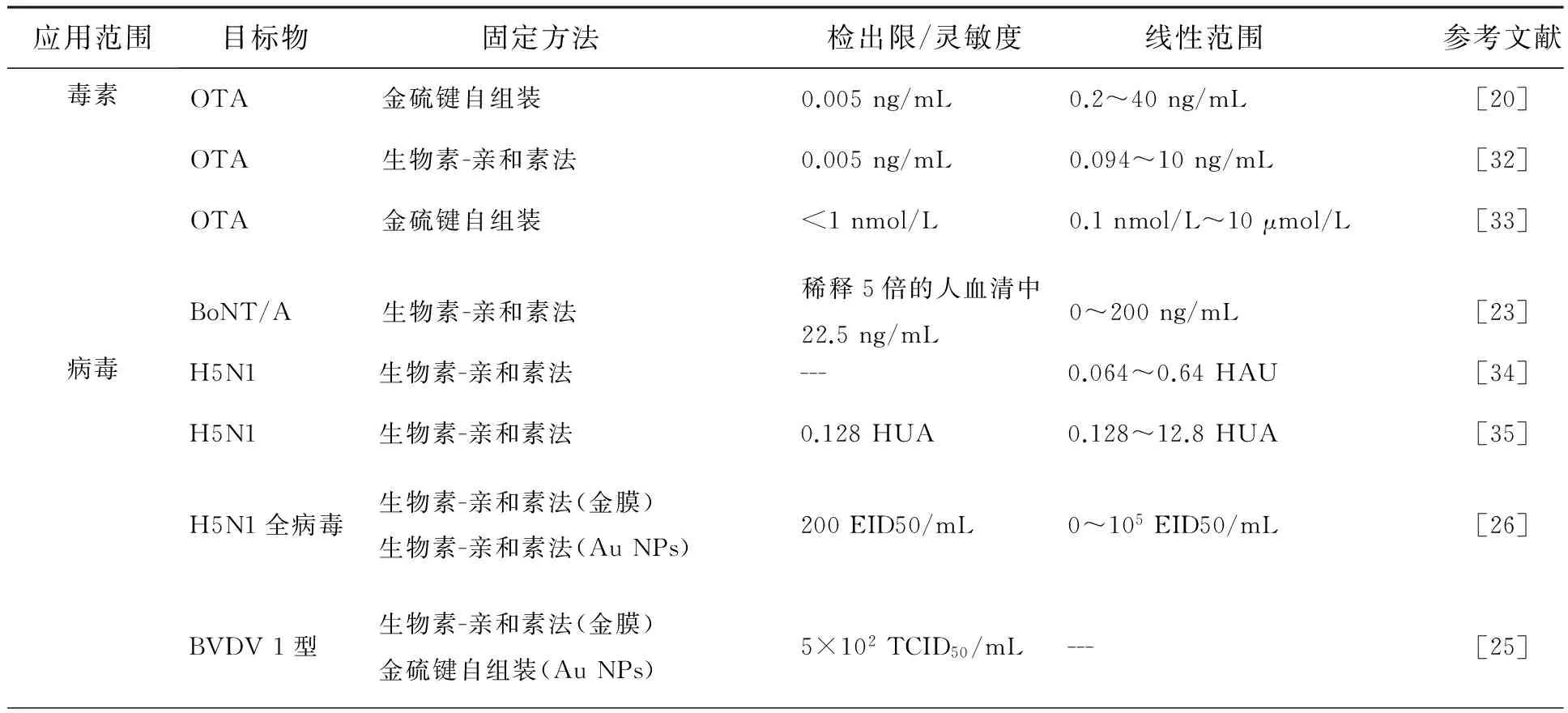
表1 适配体-SPR的传感技术在生物检测中的应用

表1(续)
4 结 论
SPR技术具有检测速度快、无需标记样品、灵敏度高等优点,近些年得到了较大的发展,且已有商业化的SPR传感器推出应用。用适配体检测生物分子具有特异性好、可反复使用和可长期保存的优点。根据目前报道的相关文献可以发现,基于适配体-SPR的生物传感技术,综合了SPR技术与适配体的优点,表现出较高的灵敏度和特异性,可用于检测生物活性蛋白、毒素、病毒等生物分子,是具有应用前景的生物检测技术。虽然目前在实验室中的检测效果十分优异,但将其应用于生化物质的现场快速检测,真正实用化还有一定距离。未来发展方向是研制便携、精确、快速的基于适配体-SPR的生物传感器。
[1] 王志斌, 韩欢欢, 柴君夫, 等. 基于多孔硅的表面等离子共振传感特性 [J]. 发光学报, 2016, 37(9):1152-1158. WANG Z B, HAN H H, CHAI F J,etal.. Prism surface plasmons resonance sensor based on the porous silicon [J].Chin.J.Lumin., 2016, 37(9):1152-1158. (in Chinese)
[2] 栗大超, 李国卿, 张晶鑫, 等. GGBP蛋白修饰的表面等离子共振微创血糖检测仪 [J]. 光学 精密工程, 2013, 21(9):2333-2339. LI D C, LI G Q, ZHANG J X,etal.. Minimally-invasive blood glucose detection instrument based on surface plasmon resonance sensor decorated with GGBP [J].Opt.PrecisionEng., 2013, 21(9):2333-2339. (in Chinese)
[3] CHOI S W, CHANG H J, LEE N,etal.. A surface plasmon resonance sensor for the detection of deoxynivalenol using a molecularly imprinted polymer [J].Sensors, 2011, 11(9):8654-8664.
[4] CHOI S W, CHANG H J, LEE N,etal.. Detection of mycoestrogen zearalenone by a molecularly imprinted polypyrrole-based surface plasmon resonance (SPR) sensor [J].J.Agric.FoodChem., 2009, 57(4):1113-1118.
[5] ALTINTAS Z, GITTENS M, GUERREIRO A,etal.. Detection of waterborne viruses using high affinity molecularly imprinted polymers [J].Anal.Chem., 2015, 87(13):6801-6807.
[6] GUPTA G, SINGH P K, BOOPATHI M,etal.. Molecularly imprinted polymer for the recognition of biological warfare agent staphylococcal enterotoxin B based on surface plasmon resonance [J].ThinSolidFilms, 2010, 519(3):1115-1121.
[7] HERRANZ S, BOCKOVM, MARAZUELA M D,etal.. An SPR biosensor for the detection of microcystins in drinking water [J].Anal.Bioanal.Chem., 2010, 398(6):2625-2634.
[8] HAUGHEY S A, CAMPBELL K, YAKES B J,etal.. Comparison of biosensor platforms for surface plasmon resonance based detection of paralytic shellfish toxins [J].Talanta, 2011, 85(1):519-526.
[9] GUPTA G, SINGH P K, BOOPATHI M,etal.. Surface plasmon resonance detection of biological warfare agent staphylococcal enterotoxin B using high affinity monoclonal antibody [J].ThinSolidFilms, 2010, 519(3):1171-1177.
[10] 王周平, 张维潇. 适配体及其研究进展 [J]. 食品与生物技术学报, 2013, 32(9):897-906. WANG Z P, ZHANG W X. Aptamer and related progress [J].J.FoodSci.Biotechnol., 2013, 32(9):897-906. (in Chinese)
[11] NAKAMURA Y, ISHIGURO A, MIYAKAWA S. RNA plasticity and selectivity applicable to therapeutics and novel biosensor development [J].GenesCells, 2012, 17(5):344-364.
[12] LIU S, ZHANG X Y, LUO W X,etal.. Single-molecule detection of proteins using aptamer-functionalized molecular electronic devices [J].Angew.Chem.Int.Ed.Engl., 2011, 50(11):2496-2502.
[13] FANG X H, TAN W H. Aptamers generated from cell-SELEX for molecular medicine: a chemical biology approach [J].Acc.Chem.Res., 2010, 43(1):48-57.
[14] XIA T, YUAN J H, FANG X H. Conformational dynamics of an ATP-binding DNA aptamer: a single-molecule study [J].J.Phys.Chem. B, 2013, 117(48):14994-15003.
[15] XU L, ZHANG Z, ZHAO Z L,etal.. Cellular internalization and cytotoxicity of aptamers selected from lung cancer cell [J].Am.J.Biomed.Sci., 2013, 5(1):47-58.
[16] SHEN Q L, XU L, ZHAO L B,etal.. Specific capture and release of circulating tumor cells using aptamer-modified nanosubstrates [J].Adv.Mater., 2013, 25(16):2368-2373.
[17] GAO Y M, YU X Y, XUE B B,etal.. Inhibition of hepatitis C virus infection by DNA aptamer against NS2 protein [J].PLoSOne, 2014, 9(2):e90333-1-10.
[18] 王晓萍, 洪夏云, 詹舒越, 等. 表面等离子体共振传感技术和生物分析仪 [J]. 化学进展, 2014, 26(7):1143-1159. WANG X P, HONG X Y, ZHAN S Y,etal.. Surface plasmon resonance sensing technology and bioanalytical instrument [J].Prog.Chem., 2014, 26(7):1143-1159. (in Chinese)
[19] 周玲, 王明华, 王剑平, 等. 传感器表面的适配体固定方法及其在生物传感器中的研究进展 [J]. 分析化学, 2011, 39(3):432-438. ZHOU L, WANG M H, WANG J P,etal. .Application of biosensor surface immobilization methods for aptamers [J].Chin.J.Anal.Chem., 2011, 39(3):432-438. (in Chinese)
[20] BIANCO M, SONATO A, DE GIROLAMO A,etal.. An aptamer-based SPR-polarization platform for high sensitive OTA detection [J].Sens.ActuatorsB:Chem., 2017, 241:314-320.
[21] LOO F C, NG S P, WU C M L,etal.. An aptasensor using DNA aptamer and white light common-path SPR spectral interferometry to detect cytochrome-c for anti-cancer drug screening [J].Sens.ActuatorsB:Chem., 2014, 198:416-423.
[22] WANG B, LOU Z, PARK B,etal.. Surface conformations of an anti-ricin aptamer and its affinity for ricin determined by atomic force microscopy and surface plasmon resonance [J].Phys.Chem.Chem.Phys., 2015, 17(1):307-314.
[23] JANARDHANAN P, MELLO C M, SINGH B R,etal.. RNA aptasensor for rapid detection of natively folded type A botulinum neurotoxin [J].Talanta, 2013, 117:273-280.
[24] LEE S J, YOUN B S, PARK J W,etal.. SSDNA aptamer-based surface plasmon resonance biosensor for the detection of retinol binding protein 4 for the early diagnosis of type 2 diabetes [J].Anal.Chem., 2008, 80(8):2867-2873.
[25] PARK J W, LEE S J, CHOI E J,etal.. An ultra-sensitive detection of a whole virus using dual aptamers developed by immobilization-free screening [J].Biosens.Bioelectron., 2014, 51:324-329.
[26] NGUYEN V T, SEO H B, KIM B C,etal.. Highly sensitive sandwich-type SPR based detection of whole H5Nxviruses using a pair of aptamers [J].Biosens.Bioelectron., 2016, 86:293-300.
[27] LIU Y Z, WU Z T, ZHOU G H,etal.. Simple, rapid, homogeneous oligonucleotides colorimetric detection based on non-aggregated gold nanoparticles [J].Chem.Commun., 2012, 48(26):3164-3166.
[28] HU J T, NI P J, DAI H C,etal.. A facile label-free colorimetric aptasensor for ricin based on the peroxidase-like activity of gold nanoparticles [J].RSCAdv., 2015, 5(21):16036-16041.
[29] LIU R D, HUANG Y S, MA Y L,etal.. Design and synthesis of target-responsive aptamer-cross-linked hydrogel for visual quantitative detection of ochratoxin A [J].ACSAppl.Mater.Interf., 2015, 7(12):6982-6990.
[30] WANG J L, MUNIR A, ZHU Z Z,etal.. Magnetic nanoparticle enhanced surface plasmon resonance sensing and its application for the ultrasensitive detection of magnetic nanoparticle-enriched small molecules [J].Anal.Chem., 2010, 82(16):6782-6789.
[31] CHANG C C, LIN S, LEE C H,etal.. Amplified surface plasmon resonance immunosensor for interferon-Gamma based on a streptavidin-incorporated aptamer [J].Biosens.Bioelectron., 2012, 37(1):68-74.
[32] ZHU Z L, FENG M X, ZUO L M,etal.. An aptamer based surface plasmon resonance biosensor for the detection of ochratoxin A in wine and peanut oil [J].Biosens.Bioelectron., 2015, 65:320-326.
[33] PARK J H, BYUN J Y, MUN H,etal.. A regeneratable, label-free, localized surface plasmon resonance (LSPR) aptasensor for the detection of ochratoxin A [J].Biosens.Bioelectron., 2014, 59:321-327.
[34] WANG R H, ZHAO J J, JIANG T S,etal.. Selection and characterization of DNA aptamers for use in detection of avian influenza virus H5N1 [J].J.Virol.Methods, 2013, 189(2):362-369.
[35] BAI H, WANG R H, HARGIS B,etal.. A SPR aptasensor for detection of avian influenza virus H5N1 [J].Sensors, 2012, 12(9):12506-12518.
[36] WANG Z Z, WILKOP T, XU D K,etal.. Surface plasmon resonance imaging for affinity analysis of aptamer-protein interactions with PDMS microfluidic chips [J].Anal.Bioanal.Chem., 2007, 389(3):819-825.
[37] KIM Y H, KIM J P, HAN S J,etal.. Aptamer biosensor for lable-free detection of human immunoglobulin E based on surface plasmon resonance [J].Sens.ActuatorsB:Chem., 2009, 139(2):471-475.
[38] WANG J L, MUNIR A, ZHOU H S. Au NPs-aptamer conjugates as a powerful competitive reagent for ultrasensitive detection of small molecules by surface plasmon resonance spectroscopy [J].Talanta, 2009, 79(1):72-76.
[39] HENSELEIT A, SCHMIEDER S, BLEY T,etal.. A compact and rapid aptasensor platform based on surface plasmon resonance [J].Eng.LifeSci., 2011, 11(6):573-579.
[40] WANG J L, ZHU Z Z, MUNIR A,etal.. Fe3O4nanoparticles-enhanced SPR sensing for ultrasensitive sandwich bio-assay [J].Talanta, 2011, 84(3):783-788.
[41] POLONSCHII C, DAVID S, TOMBELLI S,etal.. A novel low-cost and easy to develop functionalization platform. Case study: aptamer-based detection of thrombin by surface plasmon resonance [J].Talanta, 2010, 80(5):2157-2164.
[42] TRAN D T, KNEZ K, JANSSEN K P,etal.. Selection of aptamers against Ara h 1 protein for FO-SPR biosensing of peanut allergens in food matrices [J].Biosens.Bioelectron., 2013, 43:245-251.
[43] WU B, JIANG R, WANG Q,etal.. Detection of C-reactive protein using nanoparticle-enhanced surface plasmon resonance using an aptamer-antibody sandwich assay [J].Chem.Commun., 2016, 52(17):3568-3571.

杜斌(1987-),男,山东济宁人,博士研究生,2012年于防化研究院获得硕士学位,主要从事侦检材料与技术的研究。

E-mail: dubin51979@163.com童朝阳(1972-),男,四川乐山人,博士,研究员,2000年于防化研究院获得博士学位,主要从事生物检测技术的研究。
E-mail: billzytong@126.com
Research and Application of Biosensing Technology Based on Aptamer-Surface Plasmon Resonance
DU Bin1, TONG Zhao-yang1*, LIU Zhi-wei1, MU Xi-hui1, DING Zhi-jun2, CAO Wei2
(1.StateKeyLaboratoryofNBCProtectionforCivilian,Beijing102205,China; 2.ResearchInstituteofChemicalDefense,Beijing102205,China)
*CorrespondingAuthor,E-mail:billzytong@126.com
The aptamers have been widely used in biomolecule recognition because of their advantages of synthesis, modification and immobilization. The sensing technology developed by surface plasmon resonance(SPR) has the advantages of non-labeling, no pretreatment, real-time monitoring. The sensors based on aptamer and SPR have important application values in biosensing techniques. The applications of biosensor based on aptamer-SPR are reviewed in this paper.
aptamer; surface plasmon resonance; biosensor; detection; application
1000-7032(2017)08-1039-08
2017-01-10;
2017-04-13
国家自然科学基金(21402237); 国民核生化灾害防护国家重点实验室基础研究基金(SKLNBC2012-01)资助项目 Supported by National Natural Science Foundation of China (21402237); Basic Research Foundation of State Key Laboratory of National NBC Protection for Civilian (SKLNBC2012-01)
TP212.3
A
10.3788/fgxb20173808.1039

