“一锅双酶”法制备L-天冬氨酸的工艺条件优化
刘祥涛,张瑞,冯进辉,仪宏,吴洽庆,朱敦明,马延和(1.中国科学院天津工业生物技术研究所工业酶国家工程实验室,天津300308; 2.中国科学院天津工业生物技术研究所天津市生物催化技术工程中心,天津300308)
“一锅双酶”法制备L-天冬氨酸的工艺条件优化
刘祥涛1,2,张瑞1,2,冯进辉1,2,仪宏1,2,吴洽庆1,2,朱敦明1,2,马延和1,2
(1.中国科学院天津工业生物技术研究所工业酶国家工程实验室,天津300308; 2.中国科学院天津工业生物技术研究所天津市生物催化技术工程中心,天津300308)
L-天冬氨酸作为一种大宗氨基酸产品,在医药、食品和化工等方面有着广泛的用途。笔者所在实验室成员前期已经构建1株含有顺丁烯二酸异构酶与L-天冬氨酸氨基裂解酶、且可直接将顺丁烯二酸铵转化成L-天冬氨酸铵的工程菌,对其培养基、发酵条件以及制备条件进行优化。得到的优化发酵培养基:蛋白胨20 g/L,酵母浸粉5 g/L,NaCl 1.45 g/L,富马酸10 g/L,NH4NO38 g/L,乳糖6 g/L,氨水调节pH至7.5。最佳发酵培养条件:发酵罐的转速150 r/min,通气量1.5 L/min,最佳的接种量0.5%(体积分数)。通过发酵罐对优化后的培养基进行扩大培养,得出1 L发酵液可以转化1 kg顺丁烯二酸铵,优化后相同培养体积的菌体转化的底物量提高了1倍。为实现“一锅双酶”法制备L-天冬氨酸工艺的规模放大奠定了基础。
“一锅双酶”法;顺丁烯二酸;L-天冬氨酸;发酵工艺优化
L-天冬氨酸作为一种大宗氨基酸产品,在医药、食品和化工等方面有着广泛的用途[1]。在医药方面,主要作为治疗心脏病、肝功能促进剂、氨解毒剂、疲劳消除剂和氨基酸输液的主要成分,也是L-天冬氨酸盐(钾、镁、钙和钠盐)、丙氨酸和天门冬酰胺等多种小分子药物的合成原料;在食品工业方面,L-天冬氨酸是一种良好的营养增补剂,添加于各种清凉饮料,是糖代用品阿斯巴甜的主要生产原料;在化工方面,可以作为制造合成树脂的原料,大量用于合成环保材料聚天冬氨酸[2]。
目前,国内工业生产L-天冬氨酸的工艺如图1所示:以苯裂解制备顺丁烯二酸酐(顺酐),水解为顺丁烯二酸(顺酸或马来酸)为原料,在无机催化剂及强酸性条件(pH 1左右)下转化成反丁烯二酸(反酸或富马酸)[3];分离纯化后的反丁烯二酸在L-天冬氨酸氨基裂解酶和过量氨的作用下催化生成L-天冬氨酸铵[4],转化完成的反应液用H2SO4中和过量的氨,并利用L-天冬氨酸在等电点溶解度最低处析出L-天冬氨酸,分离纯化得到产品L-天冬氨酸[5-6]。此工艺中,异构化和铵的加成反应都有诸多缺点,如:顺丁烯二酸异构化成反丁烯二酸的过程中需要在高温、高压、催化剂以及强酸性条件下进行,这一生产工艺过程中产生大量含反丁烯二酸的强酸性废水,强酸对设备的腐蚀性非常大[7]。
近年来,有研究者提出两步生物法催化顺丁烯二酸生产L-天冬氨酸[8],首先利用顺丁烯二酸异构酶的生物催化法取代化学异构法,在温和条件下成功地将顺丁烯二酸铵转化成反丁烯二酸铵[9];再利用天冬氨酸裂解酶在温和的条件下将反丁烯二酸铵转化成L-天冬氨酸铵,然后通过浓H2SO4等电析出L-天冬氨酸,此法在一定程度上实现了节能减排。但是,目前报道的顺丁烯二酸异构酶[10-13]大部分存在热稳定性较差、表达量低、反应时间长等缺点[14],限制了此类菌种在工业生产中的应用[15-17]。同时,该法需要两种菌同时进行发酵,对现有设备进行改造,而且生产操作繁琐。
笔者所在实验室成员通过多年研究获得一种稳定性及活性较高的顺丁烯二酸异构酶,并创新性地将顺丁烯二酸异构酶与L-天冬氨酸氨基裂解酶有效地表达在同一工程菌中,即“一锅双酶”法制备L-天冬氨酸的新工艺,该工艺极大简化生产工艺流程,不需要对现有的设备条件进行改造,直接省去反丁烯二酸的生产环节,大幅降低人工、能耗及废水的排放,为顺丁烯二酸异构酶的工业化应用奠定了基础。
本文中,笔者以“一锅双酶”法制备L-天冬氨酸的工程菌为研究对象,利用正交法优化该工程菌的培养基与发酵条件,并对生产L-天冬氨酸的生产工艺进行改进,以期为L-天冬氨酸的工业化生产提供基本数据。

图1 L-天冬氨酸生产简图Fig.1 Diagram of L-aspartic acid production
1 材料与方法
1.1 菌种
顺丁烯二酸异构酶Escherichia coli BL21 (DE3)-p ET24b-Mtil,简写为Mtil[18];L-天冬氨酸氨基裂解酶Escherichia coli BL21(DE3)-Asp,简写为AspA,“一锅双酶”法工程菌Escherichia coli BL21 (DE3)-p ET24b-Mtil-Asp,简写为MA,均构建并保存
于中国科学院天津工业生物技术研究所工业酶国家工程实验室。
1.2 试剂
蛋白胨、酵母浸粉,Oxoid公司;其他分析纯试剂,国药集团化学试剂有限公司。
1.3 主要仪器
Gel Doc XR+凝胶成像仪、PowerPac basic蛋白电泳仪,Bio-Rad公司;GBJL-5L C型4连发酵罐,镇江东方生物工程设备技术有限公司;BMR-7A发酵罐,上海傲中生物工程设备有限公司。
1.4 培养基
斜面培养基(g/L):蛋白胨10,酵母浸粉5,NaCl 5,琼脂20。
种子培养基(g/L):蛋白胨18,酵母浸粉7,NaCl 5,富马酸10。
发酵培养基(g/L):蛋白胨20,酵母浸粉5,NaCl 5,富马酸10,NH4NO38。
以上培养基都用氨水调节pH至7.5后在121℃灭菌20 min。
1.5 底物反应液制备
称取顺丁烯二酸250 g加入500 mL水,然后浓氨水调节pH至8.2,蒸馏水定容至1 L,得顺丁烯二酸铵(250 g/L,pH 8.2)溶液。
1.6 实验方法
1.6.1 菌种生长量的测定
取1 mL菌液加入无菌水稀释,分光光度计测定600 nm处吸光度。
1.6.2 顺丁烯二酸浓度测定
取出500μL顺丁烯二酸水溶液样品并加入500 μL盐酸(5 mol/L)酸化,高效液相色谱(HPLC)测试前样品再稀释25倍,过0.22μm滤膜。HPLC检测条件:安捷伦C18柱,流动相为30%甲醇-醋酸水溶液(pH 3.0),流速0.4 mL/min,检测波长220 nm,柱温40℃,进样5μL。利用去离子水分别将顺丁烯二酸配制成质量浓度为0、1、2、4、6、8和10 g/L;以顺丁烯二酸浓度为横坐标,以液相顺丁烯二酸的峰面积为纵坐标制作相应的标准曲线。利用样品在HPLC的峰面积得到顺丁烯二酸水溶液的质量浓度。
1.6.3 薄层层析法(TLC)检测发酵液对底物转化能力
将培养完成的20 mL菌体加入20 mL反丁烯二酸铵(200 g/L,pH 8.2),摇床转速200 r/min,42℃进行转化实验。在转化4、5和6 h取500μL转化液于1.5 mL EP管中,加入100μL浓盐酸终止反应,再加入500μL乙酸乙酯萃取,离心,取相同体积的萃取液点样进行TLC检测。TLC法的展开剂,V(20%甲醇)∶V(1,2-二氯乙烷)=1∶4(简写为20% MD),254 nm显色,粗略估算转化率,转化正常则进行下一步转化实验[18]。
1.6.4 后处理
取转化完成的转化液1 000 mL加入10 g活性炭,85℃热处理1 h,过滤得到澄清液体,然后升温至80℃[17],用浓H2SO4调节pH至2.9左右,搅拌2 h后,抽滤0.5 h;1倍体积纯水淋洗固体L-天冬氨酸后抽滤0.5 h,收集固体。重复此步骤3次,烘干至恒质量。
1.6.5 转化产物的鉴定
烘干后的产物通过400 MHz核磁共振波谱仪(AVANCE III型,Bruker公司)进行鉴定。
2 结果与讨论
2.1 发酵培养
依次用灭菌的牙签挑取LB固体平板上的单菌落于1 000 mL种子培养基中,在200 r/min、37℃条件下培养12 h;培养完成的种子培养液按体积分数0.3%的接种量接种到发酵培养基中,在200 r/min、37℃条件下培养18 h。发酵培养过程中每隔3 h取样测定蛋白表达量,结果见图2。由图2可知:Mtil在发酵培养15 h后蛋白表达基本到达峰值,延长至18 h,Mtil的表达量基本不变;而AspA表达量在12 h趋于峰值,综合考虑发酵周期设为15 h。Mtil的等电点为4.97,蛋白分子量为2.67×104;AspA的等电点为5.19,蛋白质的分子量为5.23×104。

图2 “一锅双酶”法工程菌目的蛋白表达分析Fig.2 SDS-PAGE analysis of protein expression by a"one-pot two-enzyme"process
2.2 工程菌对底物转化能力的比较
将3种工程菌进行培养,培养完成的工程菌分别进行底物转化,结果见表1。由表1可知:Mtil对底物的转化能力与AspA对底物的转化能力相差近10倍,MA工程菌转化能力受制于Mtil转化能力。而“一锅双酶”法进行转化实验时,顺丁烯二酸铵在Mtil作用下生成反丁烯二酸铵,然后在AspA的作用下生成L-天冬氨酸铵,使反应向L-天冬氨酸铵方向进行,打破了产物反丁烯二酸浓度反馈抑制,使Mtil对底物的转化能力提高了5倍。

表1 工程菌对底物转化能力Table 1 Conversion ability of different recombinant strains with different substrate
2.3 发酵培养的优化
为降低发酵成本,用乳糖代替IPTG为诱导剂,并对乳糖进行单因素实验,考察不同质量浓度乳糖对工程菌相对酶活的影响,结果见图3。由图3可以看出:当乳糖质量浓度为6 g/L时,工程菌的相对酶活均达到峰值,但继续增加乳糖,相对酶活变化不显著。考虑发酵成本,因此选择诱导时乳糖的质量浓度为6 g/L。

图3 乳糖质量浓度对工程菌转化底物能力影响Fig.3 Effect of the lactose on one-pot two-enzyme relative enzyme activity
氮源优化时,选择的有机氮源为蛋白胨,而酵母粉也可作为有机氮源的一部分进行考察;无机氮源为NH4NO3。利用L9(34)正交试验来考察氮源对工程菌相对酶活的影响,正交试验设计及方差分析见表2~4。由表2~4的结果可以分析得出:培养基中氮源对酶活影响的显著性从大到小依次为蛋白胨、NH4NO3、酵母提取物。由此可见,该工程菌利用蛋白胨为氮源表达两种酶的优势明显高于NH4NO3,并且这2种氮源对工程菌MA的作用高于酵母提取物的。优化后的发酵培养基为20 g/L蛋白胨、5 g/L酵母提取物、8 g/L NH4NO3。

表2 氮源的正交试验L9(34)设计及结果Table 2 Results and design of nitrogen source orthogonal experiments

表4 氮源优化结果的方差分析Table 4 Analysis of variance of nitrogen source
优化后的培养基在3 L的发酵规模下(镇江东方5 L发酵罐)对发酵条件进行L9(34)正交试验,结果及其分析见表5~7。
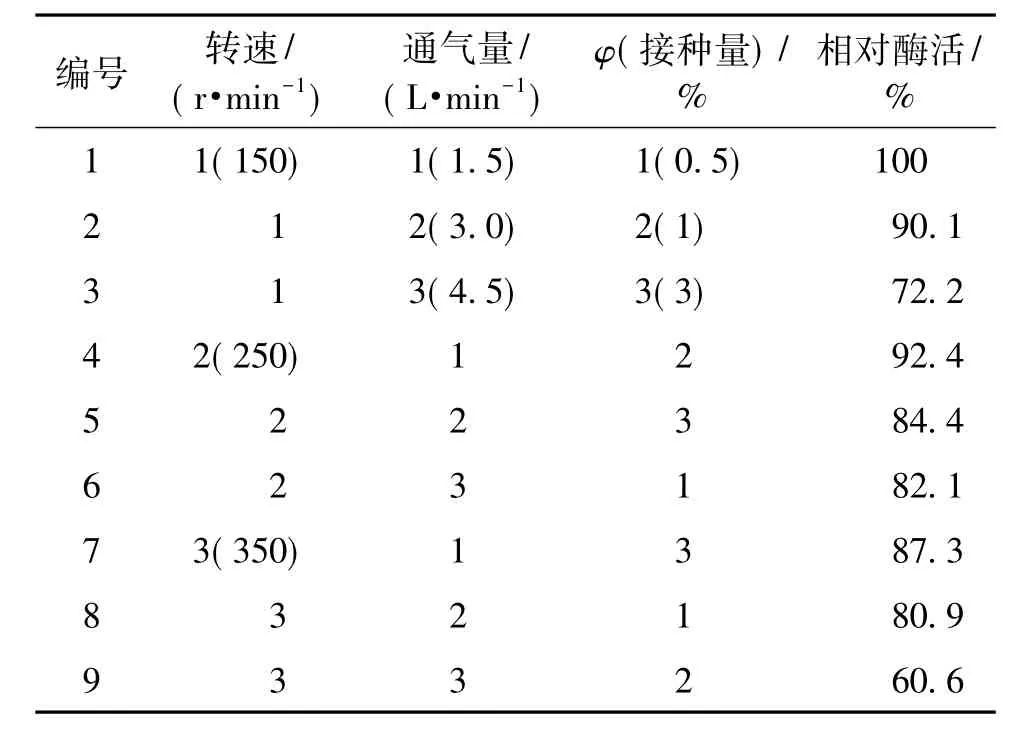
表5 培养条件的正交试验L9(34)设计及结果Table 5 Results and design of culture conditions orthogonal experiments

表6 培养条件优化的极差分析Table 6 Range analysis of culture conditions orthogonal experiments

表7 培养条件的方差分析Table 7 Analysis of culture conditions variance
由表5~7的结果分析可知:不同发酵条件对工程菌培养的影响显著性从大到小依次为通气量、转速、接种量。同时,笔者在纯化异构酶的过程中发现异构酶的活性衰退很大,分析异构酶的序列活性中心含有巯基,推测其抗氧化能力较差[18]。当发酵条件中的溶氧较高时影响异构酶的活性,导致双酶法中顺丁烯二酸异构酶活力较差,进而影响双酶法的对底物的转化能力。优化后的发酵条件为发酵罐转速150 r/min,通气量1.5 L/min,接种量0.5%。
由此得到优化的发酵培养基:蛋白胨20 g/L,酵母浸粉5 g/L,NaCl 5 g/L,富马酸10 g/L,NH4NO38 g/L,乳糖6 g/L,氨水调节pH至7.5。最佳发酵培养条件:发酵罐的转速150 r/min,通气量1.5 L/min,最佳的接种量0.5%。
2.4 优化后培养基发酵罐验证
摇瓶优化得到的培养基在上海傲中BMR-7A型发酵罐上进行了5 L规模的发酵,转速为200 r/min,培养温度与诱导温度37℃,溶氧控制在20%以上,pH控制在6.0~7.8。培养完成的工程菌,将发酵完成的发酵液1 L与顺丁烯二酸铵4 L (250 g/L,pH 8.2)投入到转化罐中,在42℃、200 r/min条件下进行转化实验,转化16 h完成转化实验,结果见表8。由表8可知:与未优化前的培养基相比,优化后相同培养体积的菌体转化的底物量提高了1倍,转化时间缩短8 h,L-天冬氨酸的质量收率提高了1%。

表8 培养基优化前后转化工程菌对底物转化能力比较Table 8 Comparison the conversion activity after optimization
2.5 产物鉴定
获得的产物通过核磁鉴定,结果见图4。1H NMR(400 MHz,D2O)δ3.96(q,J=2.4,4.4 Hz,1H),2.90(dd,J=4.0,8.0 Hz,2H)。由图4可见,通过发酵得到的产品是L-天冬氨酸。
3 结论
采用基因数据库中挖矿方法寻找合适的异构酶和天冬氨酸裂解酶基因,构建到同一株细菌中,并有效表达,使得该工程菌具有使顺丁烯二酸异构化为反丁烯二酸的能力和合成L-天冬氨酸的能力。表达完成的工程菌发酵液不做任何处理,直接加入到顺丁烯二酸铵的转化液中,同时对发酵培养基及发酵条件进行正交试验优化,优化后相同培养体积的菌体转化的底物量比较优化前提高了1倍。目前在实验室条件下,可稳定实现1 L发酵液转化1 kg顺丁烯二酸铵,L-天冬氨酸的质量收率达99%。后续将在工业生产条件下验证本实验的相关结果,期望本生产工艺后续将能够成功实现工业化应用,充分发挥其环保优势,为提升企业经济效应发挥重要作用。

图4 产物鉴定的核磁谱图Fig.4 Product identification by1H NMR
[1]张沙兵.L-天冬氨酸的生产应用及市场分析[J].硅谷,2010 (17):11-11.
[2]杨士林,黄君礼,张玉玲,等.聚天冬氨酸制造工艺研究进展[J].环境工程学报,2002,9(3):38-41.
[3]冯志彬,殷日彩,米阳,等.天冬氨酸生产工艺的研究进展[J].发酵科技通讯,2012,41(2):38-41.
[4]TOSA T,SATO T,MORI T,et al.Continuous production of L-aspartic acid by immobilized aspartase[J].Biotechnol Bioeng,1973,15:69-84.
[5]郝大伟,裘娟萍.生物催化富马酸加氨合成天门冬氨酸的研究进展[J].氨基酸和生物资源,2008,30(2):39-42.
[6]TOKUSHIGE M.Aspartate ammonia lyase[J].Methods Enzymol,1985,113:618-627.
[7]杭国中.综合利用苯酐洗涤水生产富马酸工艺改进的探讨[J].化学工程与装备,2009(5):74-77.
[8]ABDULLAH Y,DAUD A R,ALIAS N H,et al.Biodegradable polymeric bone cement formed from hydroxyapatite,poly (propylene fumerate),poly(vinyl pyrrolidone)and benzoyl peroxide[J].Mater Sci Technol,2004,20:1084-1086.
[9]WILLIAM S,WILLIAM B.Maleate isomerase[J].J Biol Chem,1969,244(7):1878-1882.
[10]朱敦明,吴洽庆,李正华,等.一种新的顺丁烯二酸异构酶及应用:102604922B[P].2013-08-28.
[11]HATAKEYAMA K,ASAI Y,UCHIDA Y,et al.Gene cloning and characterization of maleate cis-trans isomerase from Alcaligenes faecalis[J].Biochem Biophys Res Commun,1997,239:74-79.
[12]YASUO K,JINSAKU Y,YASUHISA A,et al.Maleate cis-trans isomerase from Arthrobacter sp.TPU 5446[J].J Ferment Bioeng,1995,80(6):610-612.
[13]HATAKEYAMA K,GOTO M,UCHIDA Y,et al.Molecular analysis of maleate cis-trans isomerase from thermophilic bacteria[J].Biosci Biotechnol Biochem,2000,64:569-576.
[14]HATAKEYMA K,GOTO M,KOBAYASHI M,et al.Analysis of oxidation sensitivity of maleate cis-trans isomerase from Serratia marcescens[J].Biosci Biotechnol Biochem,2000,64:1477-1485.
[15]LIU X T,ZHAO Q,REN J,et al.N-terminal truncation of a maleate cis-trans isomerase from Rhodococcus jostii RHA1 results in a highly active enzyme for the biocatalytic production of fumaric acid[J].J Mol Catal B,2013,93:44-50.
[16]SOSAKU I,TOMOKO I,SUKEKUNI M,et al.Improvement of production rate and yield offumaric acid from maleic acid by heat treatment of Pseudomonas alcaligenes strain XD-1[J].Biochem Eng J,2003,13:7-13.
[17]FISCH F,CARLOS M F,MARIE D,et al.A covalent succinylcysteine-like intermediate in the enzyme-catalyzed transformation of maleate to fumarate by maleate isomerase[J].J Am Chem Soc,2010,132:11455-11457.
[18]刘祥涛,赵青,任杰,等.顺丁烯二酸异构酶工程菌发酵条件优化[J].应用与环境生物学报,2011,17(4):558-562.
(责任编辑荀志金)
Optimizing of L-aspartic acid production by a"one-pot two-enzyme"process
LIU Xiangtao1,2,ZHANG Rui1,2,FENG Jinhui1,2,YI Hong1,2,WU Qiaqing1,2,ZHU Dunming1,2,MA Yanhe1,2
(1.National Engineering Laboratory for Industrial Enzymes,Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China;2.Tianjin Engineering Research Center Of Biocatalytic Technology,Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China)
L-aspartic acid has been widely used in medicine,food and chemical industries.It is currently produced by a chemoenzymatic process at industrial scale.We have developed a"one-pot two-enzyme" process for the production of L-aspartic acid,which involves a maleate cis-trans isomerase and an laspartic acid amino lyase that are highly co-expressed in Escherichia coli.The fermentation conditions were optimized by orthogonal experimental design to improve the enzyme production.The optimum medium composition was as follows(g/L):tryptone 20,yeast extract 5,NaCl 5,fumaric acid 10,NH4NO38,lactose 6,and pH 7.5.The optimum conditions were as follow:rotational speed 150 r/min,ventilation 1.5 L/min,inoculum concentration 0.5%.The enzyme activity was two times higher than that before optimization,thus enabling the scale-up of the process to ensure the production of l-aspartic acid at industrial scale by this"one-pot two-enzyme"process.
one-pot two-enzyme process;maleic acid;L-aspartic acid;fermentation optimization
TQ922
A
1672-3678(2017)04-0045-06
10.3969/j.issn.1672-3678.2017.04.008
2017-04-21
天津市科技计划(13ZCZDSY05200)
刘祥涛(1984—),男,山东临沂人,助理研究员,研究方向:生物催化与绿色化工;吴洽庆(联系人),研究员,E-mail:wu_qq@tib.cas.cn

