樟芝活性代谢产物的研究进展
邢宏博,胡永丹,吕俊,许赣荣,张薄博(1.江南大学工业与生物技术教育部重点实验室,江苏无锡214122; 2.江南大学生物工程学院,江苏无锡214122)
樟芝活性代谢产物的研究进展
邢宏博1,2,胡永丹1,2,吕俊1,2,许赣荣1,2,张薄博1,2
(1.江南大学工业与生物技术教育部重点实验室,江苏无锡214122; 2.江南大学生物工程学院,江苏无锡214122)
樟芝是我国台湾地区特有的一类十分稀有的药食两用真菌,具有显著的药理活性。本文中,笔者介绍了樟芝的分类与命名、生物学特性、樟芝的主要活性代谢产物及其药理活性;同时着重分析了樟芝现有的人工培养方式以及本课题组在相关方面取得的研究进展。
樟芝;活性成分;Antrodins;Antroquinonol
樟芝(Antrodia camphorata,Antrodia cinnamomea)又名牛樟芝、牛樟菇等,是台湾特有的一类十分珍稀的食药两用真菌,素有“神芝”、“森林中的红宝石”之称[1]。
1990年,臧穆等[2]首次将樟芝命名为Ganoderma comphoratum,但后期发现该研究的模式标本沾染了灵芝孢子。1995年,Chang等[3]对樟芝菌的担子形态、气味以及菌丝体和节孢子形态进行研究,发现樟芝与薄孔菌属(Antrodia)中其他种的子实体形态和培养特性均不相同,因此认为樟芝是一个新的种,并命名为Antrodia cinnamomea。1997年,Wu等[4]依据国际植物命名规则,将前两者的命名重新组合后,将樟芝命名为Antrodia camphorata。2004年,Chang等[5]建议将樟芝重新命名为Antrodia cinnamomea,而Wu等[6]通过鉴定樟芝核糖体脱氧核糖核酸的大亚基序列,提出将樟芝归属于多孔菌的新属——台芝属(Taiwanofungus),并将樟芝重新命名为Taiwanofungus camphorates。2007年,Chiu等[7]利用核糖体RNA基因的内转录序列进行分析后,重新将樟芝归入薄孔菌属。因此,樟芝属于真菌界(Fungi)、担子菌门(Basidiomycota)、担子菌亚门(Basidiomycotina)、同担子菌纲(Homobasidiomycetes)、无摺菌目(Aphyllophorales)、多孔菌科(Polyporaceae)、薄孔菌属(Antrodia)。目前学术界普遍认可的樟芝的命名为Antrodia camphorata和Antrodia cinnamomea。
樟芝主要生长于幽暗、潮湿且温度稍低且海拔在450~2 000 m的台湾东海岸山脉阔叶林地区。野生的樟芝子实体仅能寄生于台湾特有树种——牛樟树的腐朽内壁或者枯死倒伏树干的潮湿表面,在中性偏酸的环境中生长良好,每年的6~10月是其最适生长期。牛樟树是台湾山区常见的常绿阔叶林大乔木,但由于近些年盗采严重,成为濒危树种,更使得野生樟芝子实体市场供应严重失衡。因此,天然野生樟芝子实体的价格水涨船高,目前远高于灵芝、人参等传统药材,被誉为“森林中的红宝石”。
樟芝具有强烈的樟树香气、味辛苦,是多年生的药食两用真菌,其野生子实体形态多变,有钟形、板形、马蹄形或塔形等,无柄,紧贴于木材表面生长,表面多孔状结构。子实体初生时鲜红色,逐渐变为乳白色、淡褐色、淡红褐色或者淡黄褐色,成熟后颜色变为棕褐色至黑褐色[8]。樟芝的菌丝分为生殖菌丝和骨架菌丝两种,其中生殖菌丝具有锁状联合结构,直径2~3.5μm,骨架菌丝透明微黄,直径4.5μm。樟芝的有性繁殖结构为担子,呈棒状,(12~14)μm×(3~5)μm,担孢子圆柱状,透明无色,光滑,无淀粉质[3]。
1 樟芝菌的药理活性及代谢产物
自20世纪90年代樟芝被发现以来,樟芝越来越受到国内外学者的青睐。众多研究表明,樟芝具有解酒保肝、抗肿瘤、抗病毒、抗氧化、抗炎症和免疫调节等药理活性[9-14]。作为一种极具开发潜力和应用前景的药用真菌,其代谢产物及药理活性的研究近年来逐渐成为国内外研究和开发的热点。
1.1 樟芝的药理活性
樟芝在很久以前就被台湾土著居民用来医治因饮酒过量引起的各种身体不适。近年来的药理研究表明樟芝的子实体和菌丝体对乙醇诱发的急性肝损伤和CCl4诱导的慢性肝损伤具有良好的保护作用[9]。Lu等[15]通过樟芝液态发酵组分对急性酒精中毒小鼠的肝脏和抗氧化机制的影响进行研究,发现樟芝液态发酵菌丝体的酒精萃取物能够显著抑制肝酶标记物(如天冬氨酸转氨酶和谷丙转氨酶)的血清水平,改善乙醇诱导导致的肝脏谷胱甘肽氧化酶和还原酶活性的降低。Huang等[16]的研究同样发现樟芝的活性产物齿孔酸和去氢齿孔酸对CCl4诱导的肝损伤具有良好的保肝活性。
大量研究表明,樟芝的子实体和菌丝体的提取物以及多种生理活性成分均具有显著的抗肿瘤作用,可以抑制乳腺癌、胰腺癌、肺癌和结肠癌等肿瘤细胞[11-13,17]。Song等[18]利用发芽糙米进行樟芝菌的固态发酵,并对经过四周(28 d)培养的发酵产物进行处理,得到正己烷、乙醇、正丁醇和水4个萃取组分。通过细胞活性检测试剂盒(CCK-8)试验发现,乙醇萃取组分可以通过感应肿瘤抑制基因(p53)调节的细胞凋亡和增加黑色素原生成显著抑制B16F10黑色素细胞瘤细胞增殖。Yang等[19]利用裸鼠模型在试管中进行樟芝发酵液对人早幼粒细胞白血病(HL-60)细胞凋亡作用的研究,发现20~80μg/mL的处理量可以通过减少细胞周期蛋白和视网膜母细胞瘤蛋白的磷酸化作用来显著诱导HL-60细胞的G1细胞周期停滞,同时可以显著增加p21WAF1和p15NIK4B等细胞周期蛋白依赖性激酶(CDK)抑制因子的蛋白表达水平,诱导胞内活性氧自由基(ROS)的产生和线粒体功能障碍。试管研究和组织学分析均表明樟芝发酵液对白血病来说是良好的抗癌剂。
抗病毒是樟芝的又一大药理活性。研究发现马来酸和琥珀酸衍生物以及樟芝活性多糖等均具有抗乙肝病毒(HBV)的活性。Shen等[20]从樟芝发酵液中分离得到吡咯二酮并发现当在非细胞毒性浓度50μmol/L的处理条件下,吡咯二酮对乙肝表面抗原(HBsAg)和乙型肝炎E抗原(HBeAg)均有一定的抑制作用。同时,贺元川等[21]研究发现樟芝液态发酵菌丝体的水提物和醇提物对于单纯性疱疹病毒Ⅱ型具有显著的抑制作用。
樟芝的菌丝体萃取物、发酵液以及一些活性成分如多糖和酚类化合物等具有显著的抗氧化活性。Wu等[22]分别用·DPPH和超氧自由基(SOD)清除试验对樟芝发酵液的3种溶剂(正己烷、乙酸乙酯和正丁醇)萃取相的抗氧化活性进行研究,发现乙酸乙酯萃取相的抗氧化活性最好,并从中分离出了2种苯醌衍生物、3种苯环衍生物和1种马来酰亚胺衍生物,再进一步对这6种物质进行·DPPH、SOD和TEAC试验,发现苯环衍生物的抗氧化能力最好。同样,朝金龙等[23]对樟芝发酵液和菌丝体的甲醇、乙醇和异丙醇萃取相的抗氧化能力进行研究,发现乙醇萃取物的抗氧化能力总体最好。
Shen等[24]在樟芝液态发酵培养基中加入5种不同的樟树水提物,并对这些条件下发酵得到的菌丝体萃取物的抗炎活性进行研究,发现人外周血多形核白细胞(PMN)和单核细胞(MNC)中N-甲酰-甲硫氨酰-亮氨酰苯丙氨酸(fMLP)或豆蒄酰佛波醇乙酯(PMA)-诱导产生的ROS可以作为炎症介质和免疫反应信号,而樟芝菌丝体的萃取物可以减弱ROS的产生,且添加沉水樟、土肉桂和兰屿肉桂水提物的樟芝菌丝体的萃取物的抗炎活性更好。Tsai等[25]利用由于背部皮肤的皮瓣手术引起的皮肤缺血的小鼠模型对固态发酵和椴木栽培的樟芝菌丝体的抗炎活性进行研究,发现当利用樟芝菌丝体进行处理后,炎症相关的诱导型氧化氮合酶(iNOS)、白细胞介素(IL-6)、肿瘤坏死因子(TNF-α)和哺乳动物的转录因子(NF-κB)等基因的表达减少,皮瓣表皮和真皮细胞的坏死和炎症渗透显著减少。
除此之外,樟芝还具有免疫调节[26]、神经保护[27]、降血压[28]和抗菌[29]等多种药理活性。
1.2 樟芝菌的代谢产物
目前,研究者已经从樟芝中分离纯化出了近百种的生理活性化合物,主要包括活性多糖、萜类化合物、马来酸琥珀酸衍生物和泛醌类衍生物等[30]。
活性多糖是药食两用真菌中普遍存在的一种高分子量的生理活性物质,根据(1→3)、(1→4)和(1→6)等不同的糖苷键结合方式和α、β等不同构型形成多种多糖结构。在众多类型的多糖中,樟芝多糖大多是通过液态发酵获得,主要由半乳糖、葡萄糖、甘露糖、氨基葡萄糖和氨基半乳糖等单糖基组成,其中带有β-1,6-D-葡聚糖支链的β-1,3-D-葡聚糖是其主要的抗肿瘤活性成分[31]。
三萜类化合物是樟芝子实体的主要活性成分,也是樟芝苦味的来源。研究表明,樟芝子实体中的三萜类化合物主要以麦角甾烷和羊毛甾烷为骨架,且支链上均具有24(28)-en的结构。目前对于樟芝三萜类化合物的研究主要集中在新的三萜类化合物的发现及其药理活性方面[32]。Chen等[33]从樟芝子实体分离纯化出5种三萜类化合物,该5种三萜类化合物均具有很好的抗炎症效果,但作用机理几近相同。同样也有研究表明,三萜类化合物具有保护肝脏、抗肿瘤、抗氧化、抗炎症、调节免疫力和降血压等多种药理活性[14,33]。
马来酸和琥珀酸衍生物是樟芝的又一特征活性成分。2004年,Nakamura等[11]用CHCl3从樟芝的菌丝体中萃取得到了5种新的马来酸与琥珀酸衍生物,并在对其结构进行确定的情况下命名为Antrodin A~E,该研究发现Antrodin B和Antrodin C对于肺癌细胞(LLC)具有良好的抑制效果。Phuong等[14]研究发现Antrodins类化合物能够很好地抑制丙型肝炎病毒(HCV)的活性,具有良好的保肝活性。2008年,Wu等[34]从樟芝液态发酵的菌丝体中分离得到了4种马来酰亚胺和马来酸酐的衍生物Antrocinnamomin A~D,其中,Antrocinnamomin A能够显著抑制NO的产生。
泛醌类化合物是一类脂溶性的醌类化合物,由带有不同数目的异戊二烯侧链和苯环两部分组成,是呼吸链中的氢传递体。2007年,Lee等[35]用正己烷从樟芝固态发酵菌丝体中萃取并鉴定出了一个新的泛醌类衍生物——安卓奎诺尔(Antroquinonol),它也是樟芝子实体的特征代谢产物之一。研究表明安卓奎诺尔对乳腺癌、肝癌和前列腺癌等多种癌细胞和HBV病毒具有显著的抑制效果。2009年,Yang[36]等从樟芝的菌丝体中分离出了安卓奎诺尔B和4-乙酰安卓奎诺尔B,并对其抑制NO的效果进行了研究,结果表明安卓奎诺尔B和4-乙酰安卓奎诺尔B对NO有较强的抑制作用,其半抑制浓度值(IC50值)分别为16.2和14.7 μg/mL。2014年,Wang等[13]从樟芝固态发酵菌粉中分离得到了安卓奎诺尔D,并发现安卓奎诺尔D能够显著抑制DNA甲基转移酶的活性,同时可以激活肿瘤细胞中的肿瘤抑制基因,达到抗肿瘤的效果。2015年,Yen等[12]从樟芝固态发酵菌丝体中分离得到3种新的泛醌类衍生物,Antrocamol LT1、Antrocamol LT2和Antrocamol LT3,且当IC50值在0.01~1.79μmol/L时,这3种新的泛醌类衍生物对于5种人类癌细胞株(CT26、A549、HepG2、PC3和DU-145)均具有选择性的细胞毒性。因此,目前已知的从樟芝菌丝体中分离出来的泛醌类衍生物主要包括安卓奎诺尔、安卓奎诺尔B、安卓奎诺尔D、4-乙酰安卓奎诺尔、Antrocamol LT1、Antrocamol LT2和Antrocamol LT3等(图1),均具有显著的药理活性。
2 樟芝菌人工培养方式的研究现状
由于樟芝的唯一宿主牛樟树是台湾地区特有的珍稀树种,加上野生樟芝子实体生长极其缓慢,使得天然野生樟芝子实体昂贵难求,完全无法满足社会需求,因此利用现代技术进行樟芝的人工培养已经成为解决供需矛盾的有效方式。目前主要有3种人工培养方式——椴木栽培法、固态发酵法和液态发酵法。其中椴木栽培法获得子实体,固态和液态发酵法获得樟芝的菌丝体(图2)。
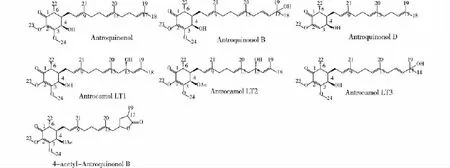
图1 樟芝菌菌丝体中的泛醌类衍生物Fig.1 Ubiquinone derivatives from the mycelia of Antrodia camphorata

图2 樟芝子实体、菌丝体及菌球Fig.2 The fruiting body,mycelia and ball of Antrodia camphorata
2.1 椴木栽培法
椴木栽培法是以木腐真菌的原有宿主或其他树种的椴木为生长载体,通过人为控制温度、湿度等培养条件,经1~3年的培养得到真菌子实体的一种培养方式。
樟芝由于其宿主特异性,只能利用牛樟树椴木作为其生长基质来进行子实体的培育。研究发现,在利用牛樟树椴木培养子实体的过程中,控制相对湿度为95%和CO2浓度为1%可以促进菌丝体分化形成子实体[37]。同样有研究认为,在利用牛樟树椴木进行樟芝子实体培养的过程中,高湿度环境可以促进子实体的生成,且子实体在椴木上的生成具有一定的方向性,只在椴木的侧面和下部能维持子实体的形态,其余部位的子实体会自然消退,该方法得到的子实体与野生子实体的甲醇萃取物的HPLC分析结果相似[38]。但是牛樟树是台湾特有树种,本身比较稀少,再加上遭受非法盗采,使得牛樟树椴木培养的成本非常高,且产量很低,培养时间很长,一般需要1~3年,难以实现工业化生产。
有学者尝试利用樟属的其他树种的椴木作为樟芝子实体培养的基质,并对其培养条件和影响因素进行研究[39],但是目前仍处于实验阶段,无法大量获得樟芝子实体。
2.2 固态发酵法
樟芝的固态发酵是利用太空包或者三角瓶进行菌丝体的培养,经过1~3个月的培养后得到与野生子实体成分相近的菌丝体与发酵基质的混合物。
樟芝固态发酵多是以谷物类(如胚芽米、薏仁和大米等)和木屑为发酵基质,对其最佳培养条件(如培养容器的种类和大小、培养时间、初始含水量、初始pH、接种量、培养温度和装料量等)进行研究,从而获得与子实体成分相近的培养物。有学者研究在樟芝固态发酵的培养基中添加不同种类的柑橘皮来促进三萜类化合物的合成和孢子的形成,发现当添加柚子皮时三萜类化合物的产量是不添加时5倍左右[40]。
由于被鉴定出来的樟芝固态发酵菌丝体中的活性种类有限,且多数活性物质的标准品制备及分析方法的研究都仍是空白,而樟芝最主要的活性物质为多糖和三萜类化合物,故目前关于樟芝固态发酵研究的目标产物主要集中在三萜类化合物和活性多糖方面[41-42]。为了使樟芝资源得到更好的利用,笔者所在课题组对樟芝固态发酵菌丝体中化合物的成分进行了深入分析,除三萜类化合物和活性多糖之外,本课题组采用乙酸乙酯进行萃取,通过硅胶层析及Sephadex-LH20柱层析分离纯化得到特征性的代谢产物,并通过GC-MS及质谱分析鉴定得到8种生理活性物质(Ergostatrien-3β-ol、Antrodin C、Antrodin B、Antrodin A、Antroquinonol、Antroquinonol B、4,7-Dimethoxy-5-methyl-1,3-benzodioxole和Ubiquinone-3),同时对不同培养方式得到的樟芝产物进行分析比较,建立了樟芝产品的HPLC特征图谱[43]。研究发现,樟芝液态发酵产物的主要活性成分为Antrodins类,而樟芝固态发酵产物的主要活性成分有Antrodins类和Antroquinonol类[43]。为了获得更高产量的樟芝固态发酵活性成分,本课题组通过对不同初始含水量、不同接种量、不同培养温度等条件进行优化,并通过Design-Expert软件对樟芝固态发酵合成Antrodin C的培养条件进行优化,最终得到的樟芝固态发酵产品中Antrodin C的含量高达6 617.36 mg/kg[44]。同时对樟芝固态发酵合成Antroquinonol的发酵条件进行响应面的优化,使得樟芝固态发酵产品中Antroquinonol的含量达到865.32 mg/kg,比优化前提高了232.09%[45]。
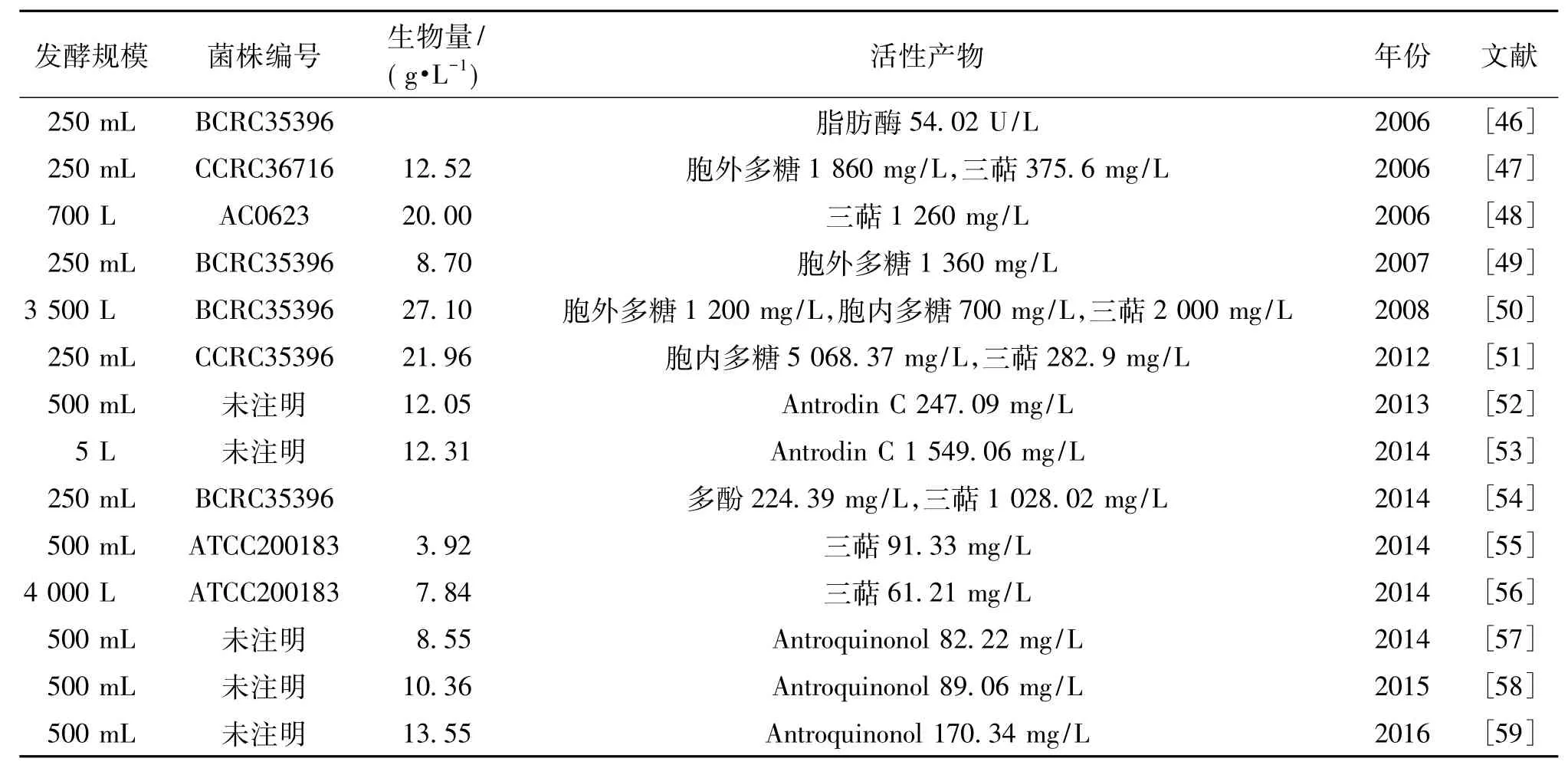
表1 樟芝液态发酵研究现状Table 1 Research status of Antrodia camphorata in submerged fermentation
2.3 液态发酵法
液态发酵是通过控制温度、溶氧、转速和pH等发酵条件,在短时间内获得大量的菌丝体或者代谢产物的一种发酵方式。樟芝液态发酵的周期一般为1~2周,培养时间短且易于放大培养,是一种有效的大规模生产方式。
目前,有许多学者对樟芝液态发酵的培养基和培养条件等进行了深入研究,并对其研究结果进行了相应的报道。表1列出了目前关于樟芝液态发酵研究的生物量和活性产物产量的一些相关报道。可以看出,目前樟芝液态发酵的研究主要处于实验室水平,且研究的发酵水平具有一定的差异。这可能与对樟芝的研究非常活跃的台湾学者和业界对其研究成果的保密,未将一些资料公开发表有一定的关系。
由表1可知,目前对于樟芝液态发酵合成活性产物的研究主要包括具有保护肝脏和抗癌活性的多糖、三萜、Antrodin C和Antroquinonol等。对樟芝液态发酵多糖的研究主要包括胞外多糖和胞内多糖,其中胞外多糖在2006年已经在摇瓶发酵水平达到1.86 g/L[47],而胞内多糖在2008年的研究中也达到了700 mg/L[50]。同样的,在2008年对樟芝液态发酵萃取物的保护肝脏活性的大规模发酵研究中,三萜的产量也达到了相对较高的水平[50]。
本课题组主要对樟芝液态发酵过程中的Antrodin C和Antroquinonol的合成情况进行了研究,使得Antrodin C和Antroquinonol的产量达到了相对较高的水平[52-53,56-58]。由于Antrodin C是樟芝液态发酵菌丝体的特征性代谢产物,本课题组分别通过在摇瓶发酵水平添加表面活性剂和原位萃取剂建立双液相发酵体系来提高Antrodin C的产量,同时在发酵罐水平通过pH调控和补糖分批发酵来提高Antrodin C的产量,最终使得樟芝液态发酵合成Antrodin C的产量高达1 549.06 mg/L[52-53],为后期发酵放大提供了一定理论基础。而Antroquinonol是樟芝子实体和固态发酵菌丝体的特征性代谢产物,研究发现,常规的液态发酵无法合成Antroquinonol。如何通过代谢调控,突破樟芝常规液态发酵过程无法合成Antroquinonol的瓶颈,成为了本课题组研究重点。通过对Antroquinonol分子式及结构的分析,表明它属于一种泛醌类物质,其结构与辅酶Q相似,因此,参照辅酶Q对Antroquinonol的代谢途径进行研究,分别通过添加其合成过程中可能的前体物质和效应物来促使樟芝液态发酵成功合成Antroquinonol[57-58],并在添加前体物质和效应物的基础上对樟芝液态发酵合成Antroquinonol的条件进行进一步优化,使得Antroquinonol的产量达到170.34 mg/L[59]。目前Antrodin C和Antroquinonol的产量都为国内外已有报道中的最高水平。
3 展望
自1990年开始,有关樟芝的相关报道已引起了众多研究者的重视。随着樟芝药用价值的发现,研究者对樟芝的研究已经从最初的菌种分离鉴定逐渐向其化学成分和药理活性的研究发展。然而野生樟芝子实体生长缓慢,野生牛樟芝的资源稀少,价格昂贵。因此,为了满足市场需求,通过人工培养方式获得樟芝发酵产物具有重要的意义。目前,固态和液态发酵是快速得到樟芝产品的有效培养方式。除了研究较多的樟芝多糖和三萜类化合物以外,Antrodins和Antroquinonol同样具有显著的药理活性,其中Antrodin C具有显著保肝活性,且其保肝活性超过1968年发现的水飞蓟素;而Antroquinonol具有显著抗癌活性,且目前已进入FDA二期临床实验。
虽然近年来对樟芝的研究取得了一系列的进展,但对樟芝的认识仍有一定的局限性,在樟芝的研究及其开发应用方面依旧存在不少问题。首先,研究者及产品开发者对樟芝人工培养菌丝体特征性代谢产物缺乏系统的鉴定,因而目前特征性代谢产物的分离、纯化、鉴定、标准品的制备、分析方法的建立仍是高质量樟芝产物开发的瓶颈之一。只有对其特征活性产物有较为全面的了解,才能制定出合理的质量评价标准,有效地选择优化的目标产物,从而提高樟芝产物的品质。其次,人工培养获得的樟芝菌丝体在活性成分和功效上与野生樟芝子实体之间存在着一定的差异,这主要是培养方式的不同会影响其特征活性产物的代谢途径,欲揭示其合成差异的原因,就必需阐明这些重要活性代谢产物的合成途径,然而迄今为止,相关的研究极为欠缺,已成为樟芝开发利用过程中的另一大瓶颈。因此,有必要利用现代科学技术手段来阐明樟芝中具有显著药效的特征活性产物的代谢途径,揭示其合成途径中关键酶的内在调控机理,缩小人工培养获得的樟芝菌丝体在成分和功效上与野生樟芝子实体之间存在的差异,为更合理、更有效地利用樟芝资源奠定理论基础。
[1]张东柱.台湾特有珍贵药用真菌牛樟芝[J].食用菌,2011,19: 33-34.
[2]臧穆,苏庆华.我国台湾产灵芝属一新种:樟芝[J].云南植物研究,1990,12(4):395-396.
[3]CHANG T T,CHOU W N.Antrodia cinnamomea sp.nov.on Cinnamomum kanehirai in Taiwan[J].Mycol Res,1995,99(6): 756-758.
[4]WU S H,RYVARDEN L,CHANG T T.Antrodia camphorata ("niu-chang-chih"),new combination of a medicinal fungus in Taiwan[J].Bot Bull Acad Sinica,1997,38:273-275.
[5]CHANG T T,CHOU W N.Antrodia cinnamomea reconsidered and A.salmonea sp.Nov.on Cunninghamia konishii in Taiwan[J].Bot Bull Acad Sinica,2004,45:347-352.
[6]WU S H,YU Z H,DAI Y C,etal.Taiwanofungus,a polypore new genus[J].Fung Sci,2004,19:109-116.
[7]CHIU H H.Phylogenetic analysis of Antrodia species and Antrodia camphorata infferred from internal transcribed spacer region[J].Anton Leeuw,2007,91:267-276.
[8]黄大斌,杨菁,黄进化,等.樟芝生物学特性研究[J].食用菌,2001,8(2):24-28.
[9]SONG T Y,YEN G C.Protective effects of fermented filtrate from Antrodia camphorata in submerged culture against CCl4-induced hepatic toxicity in rats[J].J Agric Food Chem,2003,51(6): 1571-1577.
[10]DENG J S,HUANG S S,LIN T H,et al.Analgesic and antiinflammatory bioactivities of eburicoic acid and dehydroeburicoic acid isolated from Antrodia camphorata on the inflammatory mediator expression in mice[J].J Agric Food Chem,2013,61 (21):5064-5071.
[11]NAKAMURA N,HIRAKAWA A,GAO J J.Five new maleic and succinic acid derivatives from the mycelium of Antrodia camphorata and their cytotoxic effects on LLC tumor cellline[J].J Nat Prod,2004,67:46-48.
[12]YEN I C,YAO C W,KUO M T,et al.Anti-cancer agents derived from solid-state fermented Antrodia camphorata mycelium[J].Fitoterapia,2015,102:115-119.
[13]WANG S C,LEE T H,HSU C H,et al.Antroquinonol D,isolated from Antrodia camphorata,with DNA demethylation and anticancer potential[J].J Agric Food Chem,2014,62(24): 5625-5635.
[14]PHUONG D T,MA C M,HATTORI M,et al.Inhibitory effects of antrodins A-E from Antrodia camphorata and their metabolites on hepatitis C virus protease[J].Phytother Res,2009,23(4): 582-584.
[15]LU Z M,TAO W Y,XU H Y,et al.Further studies on the hepatoprotective effect of Antrodia camphorata in submerged culture on ethanol-induced acute liver injury in rats[J].Nat Prod Res,2011,25(7):684-695.
[16]HUANG G J,DENG J S,HUANG S S,et al.Hepatoprotective effects of eburicoic acid and dehydroeburicoic acid from Antrodia camphorata in a mouse model of acute hepatic injury[J].Food Chem,2013,141:3020-3027.
[17]PARK D K,LIN Y H,PARK H J.Antrodia camphorata grown on germinated brown rice inhibits HT-29 human colon carcinoma proliferation through inducing G0/G1 phase arrest and apoptosis by targeting theβ-catenin signaling[J].J Med Food,2013,16 (8):681-691.
[18]SONG M,PARK D K,PARK H J.Antrodia camphorata grown on germinated brown rice suppresses melanoma cell proliferation by inducing apoptosis and cell differentiation and tumor growth[J].Evid-Based Compl Alt,2013,doi:10.1155/2013/321096.
[19]YANG H L,KUMAR K J,KUO Y T,et al.Antrodia camphorata induces G1 cell-cycle arrest in human premyelocytic leukemia (HL-60)cells and suppresses tumor growth in athymic nude mice[J].Food Funct,2014,5:2278-2288.
[20]SHEN C C,YANG H C,HUANG R L,et al.Anti-HBV principle from the culture broth of Antrodia camphorata(strain#CCRC-35396)[J].J Chin Med,2005,16(1):57-61.
[21]贺元川,鲁增辉,赵宗杰,等.樟芝提取物体外抗单纯疱疹病毒Ⅱ型的初步研究[J].天然产物研究与开发,2014,26: 2058-2061.
[22]WU M D,CHENG M J,WANG W Y,et al.Antioxidant activities of extracts and metabolites isolated from the fungus Antrodia cinnamomea[J].Nat Prod Res,2011,25(16):1488-1496.
[23]朝金龙,赵培城,毛建卫,等.樟芝发酵液和菌丝体提取物抗氧化性能研究[J].微生物学杂志,2014,34(5):49-54.
[24]SHEN Y C,CHOU C J,WANG Y H,et al.Anti-inflammatory activity of the extracts from mycelia of Antrodia camphorata cultured with water-soluble fractions from five different Cinnamomum species[J].FEMS Microbiol Lett,2004,231: 137-143.
[25]TSAI T C,TUNG Y T,KUO Y H,et al.Anti-inflammatory effects of Antrodia camphorata,a herbal medicine,in a mouse skin ischemia model[J].J Ethanopharmacol,2015,159:113-121.
[26]SONG A R,QIN D,ZHAO C,et al.Immunomodulatory effect of polysaccharides extracted from the medicinal mushroom Antrdia camphorata(higher basidiomycetes)in specific pathogen-free chickens[J].Int J Med Mushrooms,2014,16(1):95-103.
[27]LEE Y M,CHANG C Y,YEN T L,et al.Extract of Antrodia camphorata exerts neuroprotection against embolic stroken in rats without causing the risk of hemorrhagic incidence[J].Scientific World J,2014,2014:686109.
[28]LIU D Z,LIANG Y C,LIN S Y,et al.Antihypertensive activities of a solid-state culture of Taiwanofungus camphorates(changchih)in spontaneously hypertensive rats[J].Biosci Biotechol Biochem,2007,71(1):23-30.
[29]LIEN H M,TSENG C J,HUANG C L,et al.Antimicrobialactivity of Antrodia camphorata extracts against oral bacteria[J].PLoS One,2014,9(8):e105286.
[30]GEETHANGILI M,TZENG Y M.Review of pharmacological effects of Antrodia camphorata and its bioactive compounds[J].J Evidence-Based Complemen Altern Med,2009,2011:1-17.
[31]MENG L M,PAI M H,LIU J J,et al.Polysaccharides from extracts of Antrodia camphorata mycelia and fruiting bodies modulate inflammatory mediator expression in mice with polymicrobial sepsis[J].Nutrition,2012,28:942-949.
[32]贺元川,陈仕江,贺宗毅,等.樟芝三萜研究进展[J].重庆中草药研究,2012,66(2):19-25.
[33]CHEN Y C,LIU Y L,LI F Y,et al.Antcin A,a steroid-like compound from Antrodia camphorata,exerts anti-inflammatory effect viamimicking glucocorticoids[J].Acta Pharmacologica Sinica,2011,32(7):904-911.
[34]WU M D,CHENG M J,WANG B C,et al.Maleimide and maleic anhydride derivatives from the mycelia of Antrodia cinnamomea and their nitric oxide inhibitory activities in macrophages[J].JNat Prod,2008,71:1258-1261.
[35]LEE T H,LEE C K,TSOU W L.A new cytotoxic agentfrom solid state fermented mycelium of Antrodia camphorata[J].Planta Med,2007,73(13):1-3.
[36]YANG S S,WANG G J,WANG S Y,et al.New constituents with iNOS inhibitory activity from mycelium of Antrodia camphorata[J].Planta Med,2009,75(5):512-516.
[37]朱海文.牛樟芝椴木培养之研究探讨[D].台中:朝阳科技大学,2004.
[38]林志远.牛樟芝子实体形成之探讨[D].花莲:东华大学,2005.
[39]李名训.樟芝栽培之研究[D].嘉义:嘉义大学,2006.
[40]YANG F C,MA T W,LEE Y H.Reuse of citrus peel to enhance the formation of bioactive metabolite:triterpenoid in solid-state fermentation of A.cinnamomea[J].Biochem Eng J,2013,78: 59-66.
[41]张薄博,夏永军,许赣荣,樟芝发酵产品的研究进展[J].食品科技,2012,37(10):89-91.
[42]陈体强,方忠王.珍稀药用菌樟芝研究现状与进展[J].食用菌学报,2013,10(4):55-60.
[43]夏永军.樟芝菌发酵生产ANTRODINS等活性产物的研究[D].无锡:江南大学,2012.
[44]XIA Y J,WANG Y L,ZHANG B B.Effect of cultural conditions on antrodin C production by basidiomycete Antrodia camphorata in solid-state fermentation[J].Biotechnol Appl Biochem,2014,61(6):725-732.
[45]路瑞秋,胡永丹,张薄博,等.响应面法优化樟芝固态发酵产安卓奎诺尔[J].食品科学,2015,36(23):150-154.
[46]LIN E S,AND SUNG S C.Cultivating conditions influence lipase production by the edible Basidiomycete Antrodia cinnamomea in submerged culture[J].Int J Food Microbiol,2006,108(2): 182-187.
[47]SHIH I L,PAN K,HSIEH C Y.Influence of nutritional components and oxygen supply on the mycelial growth and bioactive metabolites production in submerged culture of Antrodia cinnamomea[J].Process Biochem,2006,41:1129-1135.
[48]CHANG C Y,LEE C L,PAN T M.Statistical optimization of medium components for the production of Antrodia cinnamomea AC0623 in submerged cultures[J].Appl Microbiol Biotechnol,2006,72:654-661.
[49]LIN E S,CHEN Y H.Factors affecting mycelial biomass and exopolysaccharide production in submerged cultivation of Antrodia cinnamomea using complex media[J].Bioresour Technol,2007,98:2511-2517.
[50]HO Y C,LIN M T,DUAN K J,et al.The hepatoprotective activity against ethanol-induced cytotoxicity by aqueous extract of Antrodia cinnamomea[J].J Chin Inst Chem Eng,2008,39: 441-447.
[51]HE Y C,HE K Z,PU Q,et al.Optimization of cultivating conditions for triterpenoids production from Antrodia cinnamomea[J].Ind J Microbiol,2012,52(4):648-653.
[52]ZHANG H,XIA Y J,WANG Y L,etal.Coupling use ofsurfactant and in situ extractant for enhanced production of Antrodin C by submerged fermentation of Antrodia camphorata[J].Biochem Eng J,2013,79:194-199.
[53]ZHANG H,HU Y D,LU R Q,et al.Intergrated strategy of pH-shift and glucose feeding for enhanced production of bioactive Antrodin C in submerged fermentation of Antrodia camphorata[J].J Ind Microbiol Biotechnol,2014,41:1305-1310.
[54]MA T W,LAI Y T,YANG F C.Enhanced production of triterpenoid in submerged cultures of Antrodia cinnamomea with the addition of citrus peel extract[J].Bioprocess Biosyst Eng,2014,37:2251-2261.
[55]LU Z M,GENG Y,LI H X,et al.Alpha-terponeol promotes triterpenoid production of Antrodia cinnamomea in submerged culture[J].FEMS Microbiol Lett,2014,358:36-43.
[56]LU Z M,HE Z,LI H X,et al.Modified arthroconidial inoculation method for the efficient fermentation of Antrodia camphorata ATCC 200183[J].Biochem Eng J,2014,87:41-49.
[57]HU Y D,ZHANGH,LU R Q,et al.Enabling the biosynthesis of Antroquinonol in submerged fermentation of Antrodia camphorata[J].Biochem Eng J,2014,91:157-162.
[58]HU Y D,LU R Q,LIAO X R,etal.Stimulating the biosynthesis of Antroquinonol by addition ofeffects and soybean oilin submerged fermentation of Antrodia camphorata[J].Biotechnol Appl Biochem,2015,63(3):398-406.
[59]胡永丹,路瑞秋,许赣荣,等.樟芝菌液态发酵合成安卓奎诺尔的发酵条件优化[J].食品与生物技术学报,2016,35(1): 28-34.
(责任编辑管珺)
Recent advances in metabolic products of Antrodia camphorata
XING Hongbo1,2,HU Yongdan1,2,LYU Jun1,2,XU Ganrong1,2,ZHANG Bobo1,2
(1.Key Laboratory of Industrial and Biotechnology of the Ministry of Education,Jiangnan University,Wuxi 214122,China; 2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Antrodia camphorata,with significant pharmacological activities,is an extremely expensive medicinal and edible mushroom in Taiwan.In this paper,we introduced the classification and nomenclature,biological characteristics,main bioactive metabolites and pharmacological activities of Antrodia camphorata.Meanwhile,the artificial cultivation conditions and the related research advance of Antrodia camphorata were introduced.
Antrodia camphorata;active ingredient;Antrodins;Antroquinonol
Q815
A
1672-3678(2017)04-0001-08
10.3969/j.issn.1672-3678.2017.04.001
2016-06-10
国家自然科学基金(21306065);江苏省自然科学基金(BK20130134);高等学校学科创新引智计划(111计划)(111-2-06)
邢宏博(1990—),男,河南周口人,研究方向:丝状真菌固、液态发酵;张薄博(联系人),副教授,E-mail:bobozhang@jiangnan.edu.cn

