昆虫蜕皮激素受体研究进展
王菁菁,胡琼波
昆虫蜕皮激素受体研究进展
王菁菁,胡琼波*
(华南农业大学农学院农药系,广州 510642)
昆虫的蜕皮激素(molting hormone,MH)是甾醇类激素,在昆虫体内的活性形式为20-羟基蜕皮酮(20-hydroxyecdysone,20E)。在昆虫的正常发育过程中,昆虫的蜕皮、变态和繁殖受到蜕皮激素的调控。昆虫蜕皮激素受体(ecdysone receptor,EcR)和超气门蛋白(ultraspiracle,USP)均属于核受体超家族成员,具有核受体的结构特征,包括A/B域(转录激活域transactivation domain)、C域(DNA结合域DNA-binding domain,DBD)、D域(铰链域hinge region)、E域(配体结合域ligand binding domain,LBD)和F域。蜕皮激素受体在昆虫蜕皮、变态和繁殖等重要的生命过程中的级联反应启动位置,对昆虫的生长发育和繁殖的正常完成有着非常重要的作用。蜕皮激素通过与蜕皮激素受体和超气门蛋白组成的复合体相互作用,然后启动一系列级联反应的过程。本文介绍了EcR和USP的结构和功能,以及它们与蜕皮激素相互作用的机理,并对EcR在农业害虫防治等方面的应用进行了介绍,并讨论了研究中遇到的问题以及对未来的研究进行展望。
蜕皮激素受体;超气门蛋白;核受体;20-羟基蜕皮酮(20E);异质二聚体
核受体(nuclear receptor,NRs)是一类扩散并能与特异性配体结合的细胞内信号蛋白,它们是配体依赖性转录因子,通过与配体结合而调控基因表达。NRs对机体的生长发育、新陈代谢等多种生理过程发挥重要功能。昆虫蜕皮激素受体(ecdysone receptor,EcR)和超气门蛋白(ultraspiracle,USP)均属于核受体超家族成员,在昆虫蜕皮、变态和繁殖等重要的生命过程中的级联反应启动位置,对昆虫的生长发育和繁殖的正常完成有着非常重要的作用。蜕皮激素是昆虫调控蜕皮及变态发育的重要激素,它的活性形式是,20-羟基蜕皮酮(20-hydroxyecdysone,20E),20E的最早靶基因是蜕皮激素的受体EcR/USP复合体,MH通过与EcR和USP的复合体结合,调控下游基因的表达,进而调控昆虫发育时期或组织对激素信号的特异生物学应答,称为20E信号途径。近年来,对EcR和USP的研究逐渐深入,在EcR和USP的基因的克隆测序、结构特征和功能确认的方面涉及了更广泛的昆虫,同时,EcR和USP与蜕皮激素的级联反应调控机理和分子的作用方式方面的研究也取得了很多进展。EcR在的农业害虫防治和人类医学方面的应用有着十分重要研究价值和研究前景。
1 蜕皮激素受体的结构
1.1 蜕皮激素受体的结构
自从对黑腹果蝇Drosophilamelanogaster的EcR和USP基因在上世纪的九十年代被克隆以来(Henrichetal., 1990),已经有国内外许多学者对鳞翅目、同翅目、直翅目、蜚蠊目、双翅目等的诸多昆虫的EcR和USP基因进行克隆测序以及相关的研究。这些昆虫的EcR均属于核受体超家族(Vanackeretal.,1998),它们有着核受体基因家族的成员具有的的共同的结构特征,一个典型的核受体分子从N端起,都是由A/B域(转录激活域transactivation domain)、C域(DNA结合域DNA-binding domain,DBD)、D域(铰链域hinge region)、E域(配体结合域ligand binding domain,LBD)和F域5个部分组成。
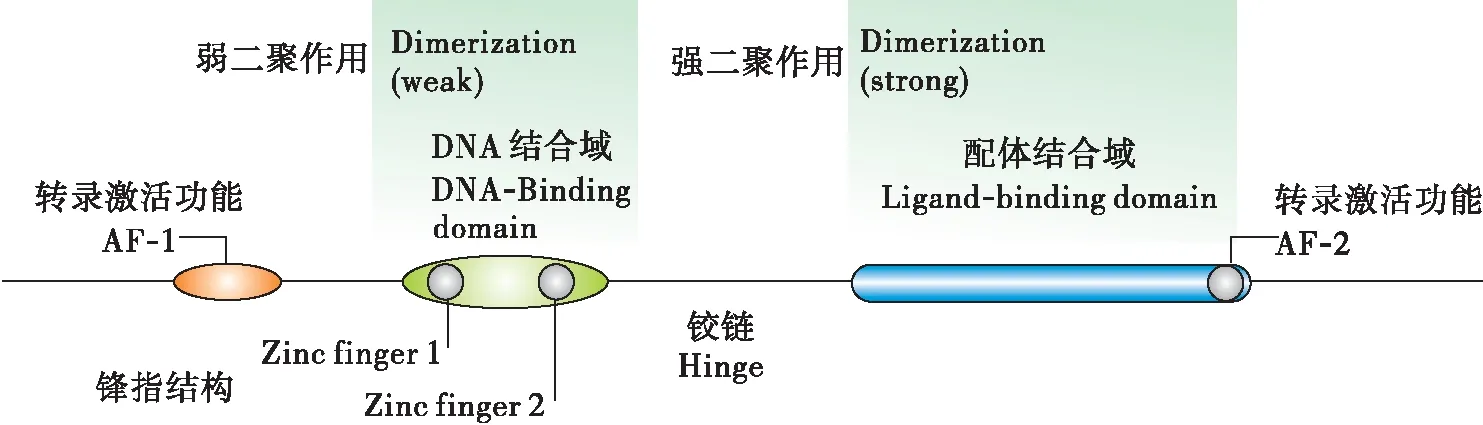
图1 核受体的结构示意图(Kingjones and Thummel, 2005)Fig.1 The stucture of nuclear receptor
A/B域:此结构中,氨基酸序列长度和同源性有着较大的变异,有着很大的可变性;其长度不一,由50至500多个氨基酸组成,特定位置的酪氨酸、丝氨酸和苏氨酸残基能受不同信号转导通路的相关激酶作用而磷酸化,继而影响受体和配体的亲和力和转录活性。目前已知的昆虫EcR有EcR-A、EcR-B1、EcR-B2 3种亚型,它们的主要区别就在于A/B结构域的不同,最大的不同表现在A/B结构域的N端部分,它们的C端基本相同;目前仅在黑腹果蝇中发现3个亚型同时存在,其他昆虫中仅发现EcR-A或EcR-B1型;这3种亚型在昆虫的变态发育中的发育阶段和组织特异性,有着不同的生物学功能(Jindraetal., 1996)。EcR-A主要存在于前胸和气管芽中,EcR-B1主要存在于如唾液腺或脂肪体等的幼虫组织中。例如,EcR-B2亚型对恢复黑腹果蝇胚胎发育阶段,幼虫能否正常发育有重要的作用。A/B结构域的缺失,会使得EcR失去正常的转录激活功能(Tranetal., 2001)。该域具有依赖于配体的转录激活功能(activation function 1,AF-1)。
C域:DNA结合域在EcR的5个功能区中具有最高的保守性,N端的66至68个氨基酸能形成专一识别DNA的α-螺旋,包含了特殊的高度保守的锌指结构,C-X2-C-X13-C-X2-C(锌指Ⅰ)和 C-XS-C-X9-C-X2-C(锌指Ⅱ),每个锌指结构由4个半胱氨酸和中心的一个锌离子螯合而成(Wickert and Selbig, 2002)。使得昆虫的蜕皮激素在EcR/USP形成复合体后,能特异性识别蜕皮激素受体反应元件(ecdysone respone elements,ECRE),进而引起下游的级联反应。ECRE具有高度兼并性的不完全回纹结构。C端还具有A-box和T-box的特殊结构。ECRE能够与A-box氨基酸残基结合,T-box能够使得A-box正确定位到ECRE的作用(Vögtlietal., 1998)。C结构域有很强的可塑性,对黑腹果蝇的α-螺旋等多个位点的氨基酸进行突变处理后,测定这些位点与hsp27的结合能力,实验结果得出黑腹果蝇的EcR与hsp27结合能力几乎不受影响,只有少量的位点突变后使得其与hsp的结合能力下降(Mareketal., 2004)。因为该域具有较高的保守性,所以DNA结合域可用作为核受体基因鉴定的典型结构序列。
D域:铰链域对EcR与USP能形成二聚体有着重要的作用。铰链域的保守程度比较高。其结构具有T-box和A-box,它们的作用分别是能够识别DNA和与DNA具有高度的亲和性(Bergmanetal., 2004)。
E域:配体结合域同样具有较高的保守性,但其程度仅次于DNA结合域,所以,配体结合域也如同DNA结合域一样,能够作为核受体基因鉴定的典型结构序列。其具有222至226个氨基酸组成,具有依赖配体的转录激活功能(activation function 2,AF2)。经过对昆虫EcR结合域晶体结构的分析,发现昆虫的LBD都是由12个α-螺旋反向排列形成“三明治”结构,有一个疏水袋装结构,使之能与配体结合,称为配体结合袋(Billasetal., 2003)。配体例如蜕皮激素的某些基团一旦与配体袋内的不同的氨基酸残基接触,就会使袋内构象发生改变,使得位于配体结合袋顶端的α-螺旋12封闭袋口,进而开始下游基因的转录。α-螺旋12的C端的AF2,其能够帮助EcR/USP复合体与共激活子(coactivators)的结合(Billa, 2003)。有研究还表明,配体结合域还能介导与热休克蛋白的相互作用(Niedziela-Majkaetal., 2000)。
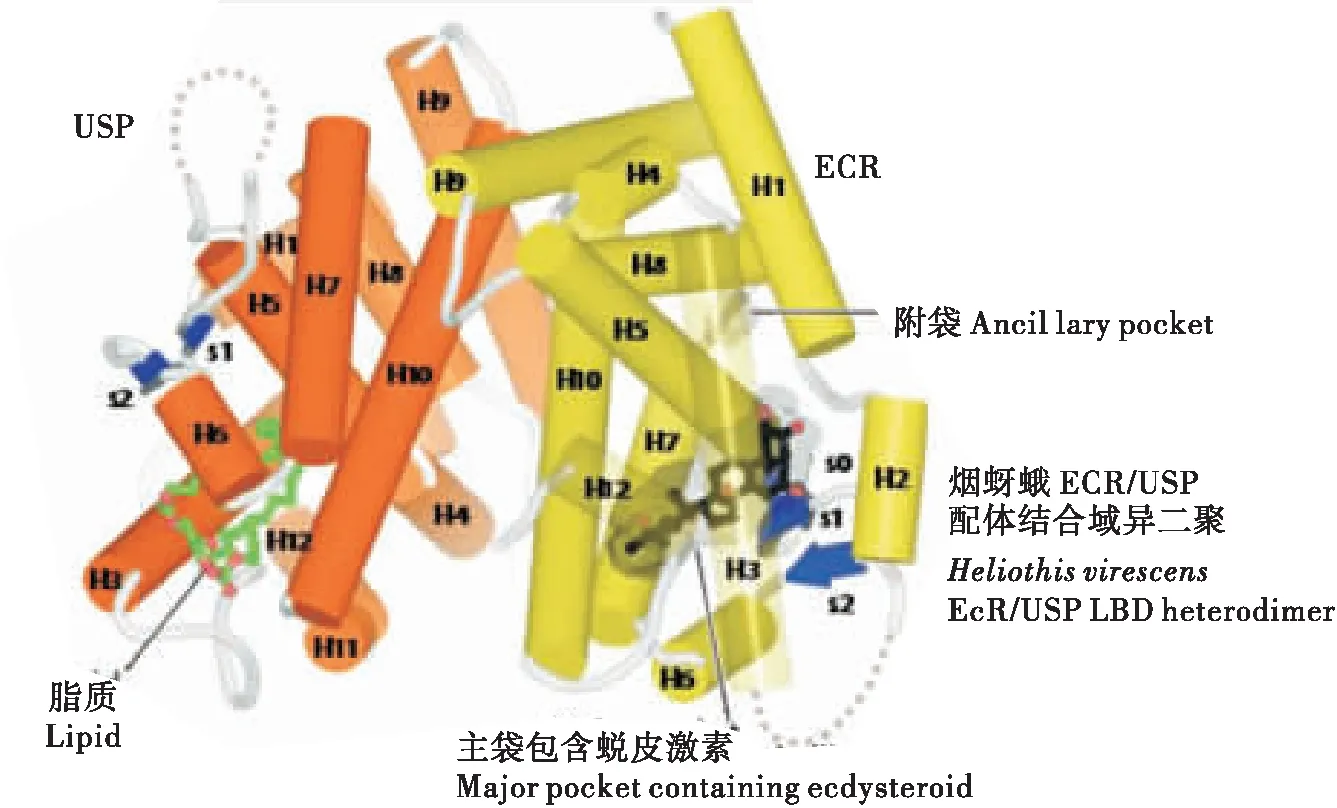
图2 二聚体配体结合域结构(Hill et al., 2012)Fig.2 The structure of ligand-binding domain of heterodimer
F域:在核受体超家族中,仅有少量的核受体具有F结构域;昆虫的EcR具有此结构域,存在于α-螺旋12的后方,为不保守的序列。在昆虫中,不同昆虫的F结构域长度有着明显的不一致。在黑腹果蝇中,保留F结构域的EcR与去掉F域EcR具有一样的转录激活能力,此结果表明F结构域不是EcR行使其转录功能的必须结构。昆虫的USP就不具有此结构(Huetal., 2003)。此结构域可能参与配基的精确识别和抑制因子的招募(Ruseetal., 2002)。

图3 EcR和USP的结构示意图(Hill et al., 2012)Fig.3 Structure of ecdysone receptor and ultraspiracle
仅当EcR单独存在时,不同的蜕皮激素是不能与其结合的,只有当USP与EcR形成复合体时,蜕皮激素才能与二者的复合体结合。USP与EcR的结构类似,在N末端具有高度可变区,具有转录激活作用;DNA结合区具有丰富的半胱氨酸和锌指结构,它能顺DNA螺旋旋转并与之结合;在C末端具有激素结合区,能够与配基结合、与热休克蛋白结合、使受体二聚化和转录激活的作用;具有铰链区,是短序列,或有与转录因子相作用和启动受体合体向核内移动的功能。最近的USP构象研究发现,其存在一个开放的、空闲的配体结合带袋(Renetal., 2014)。USP在昆虫体内有两种亚型,分别是USP1和USP2,果蝇中仅有1种亚型存在,在一些鳞翅目、直翅目、鞘翅目等昆虫中已经鉴定出来有两种USP亚型。
1.2 不同昆虫的EcR蛋白序列对比
昆虫的变态发育主要分为完全变态和不完全变态发育,大多数的昆虫都属于这两种类型的变态发育。在这两种变态类型中选取了不完全变态的东亚飞蝗Locustamigratoriamanilensis(Meyen)、白背飞虱Sogatellafurcifera和完全变态的小菜蛾Plutellaxylostella、黑腹果蝇Drosophilamelanogaster。在NCBI下载其EcR的蛋白序列,用DNAMAN进行蛋白序列对比,结果如图4所示。这四种昆虫的EcR蛋白序列有一定的相似性,在DNA结合域和配体结合域的序列高度相似,A/B域相似度不高的原因可能是因为所选取的EcR蛋白不是同一个亚型。到底是哪个区域决定了昆虫的两种变态发育类型目前还不清楚。
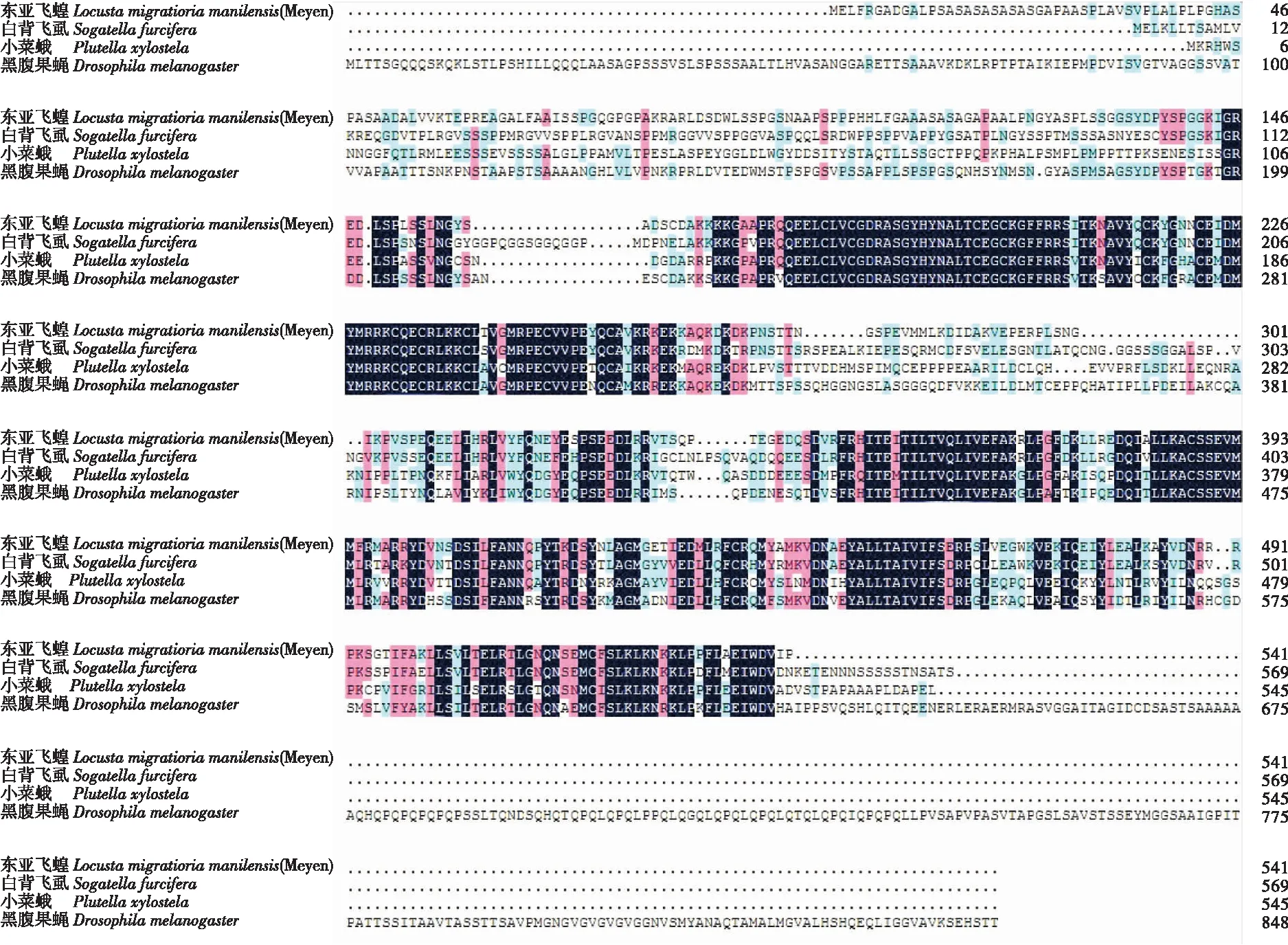
图4 4种昆虫EcR蛋白序列对比 Fig.4 EcR protein sequence alignment of four insects
将4种蛋白的序列进行同源性分析,结果如图5所示。东亚飞蝗和白背飞虱的同源性为65%,小菜蛾和黑腹果蝇的同源性为55%,两种类型变态的昆虫为51%,说明同种类型变态的昆虫的EcR蛋白结构在一定程度上具有较高的相似度。

图5 4种昆虫EcR蛋白序列同源性分析Fig.5 EcR protein sequence homology analysis of four insects
2 蜕皮激素受体的作用方式与功能
昆虫的EcR在调控昆虫的生长发育、变态和繁殖等生命过程处在关键的启动位置。在现有的节肢动物核受体的研究中,昆虫EcR是唯一已知配体的核受体,EcR的配体为蜕皮激素。昆虫的蜕皮激素是一类类固醇激素的总称,包括20E、百日青甾酮(PonA)、α-蜕皮酮以及β-蜕皮酮等,与EcR作用的天然蜕皮激素的活性形式为20E(赵小凡,2010)。
Yao等(1993)证明EcR与DNA及配体(如20E)有很高的亲和性,仅当EcR和USP结合形成异二聚体时,蜕皮激素才能结合到EcR上,形成20E-EcR/USP复合体。EcR/USP复合体与其他二型受体不同之处在于它们同激素的结合方式,单独EcR和USP是不能与激素结合的,只有两者的复合物才能与不同的蜕皮激素结合;该结合具有选择性和特异性,这些特性是由EcR决定的,并不是由二者的复合体决定的。不少研究都证明EcR的突变会影响特异性结合;USP的结合域的功能仅仅是促进激素的结合。
EcR、USP和蜕皮激素形成的复合体再与靶标基因启动子的蜕皮激素应答元件EcRE结合,并启动一系列级联反应。当20E存在时,其与EcR结合导致抑制蛋白被激活蛋白抑制,从而激活转录;当20E不存在时,EcR和USP形成的杂二聚体,虽然能结合到蜕皮酮反应基因的启动子区域,但是由于一组抑制蛋白存在,使得前后基因的转录没有激活。20E一旦进入EcR配体结合域的配体结合袋,其构象立即发生变化,与共阻遏子分离且与共激活子相作用,开始靶基因的转录(Kolchanovetal., 1999)。启动靶基因的转录反应后,EcR立即与蜕皮激素分离,下游基因开始表达,昆虫得以正常地完成整个蜕皮过程。
埃及伊蚊Aedesaegypti点突变的实验表明,EcR对蜕皮激素有专一性,埃及伊蚊EcR529位的苯丙氨酸是决定依赖于配体的DNA结合活性和配体专一性的关键点。同时,EcR的空间结构有很强的适应性和柔韧性,使得其能与USP结合后起着稳定LBD空间结构的作用(Renetal., 2014)。
昆虫蜕皮激素与EcR的作用方式非常的保守。对鳞翅目、鞘翅目和双翅目等的昆虫的异二聚体EcR/USP与天然的蜕皮激素如百日青甾酮结合形成的复合体的配体结合域的晶体结构时发现,EcR与百日青甾酮或蜕皮激素类类似物双酰肼类先导化合物结合的形状和配体的结合位点几乎一致,形成范德华力的氨基酸种类和顺序也几乎一致(Piotretal., 2006)。
由于EcR、USP和EcR/USP与20E相互作用时在亚细胞水平研究的较少,相关文献也鲜有报道,所以目前对它们在亚细胞水平的分布不是很了解。从这两年的在亚细胞水平的定位研究显示,EcR在经过20E的作用后就会大量的进入细胞核和部分的进入细胞质中,USP则主要在细胞核中起作用(Huangetal., 2015)。
EcR和USP在昆虫的生长发育、变态和繁殖方面有着重要作用。EcR在各个发育时期的脂肪体、卵巢、前胸腺和表皮等多个组织中有所表达。与大多数的基因一样,EcR与USP在昆虫的不同发育的时期或在不同的组织中具有不同的表达特征,说明其在这些时期或者组织中有着不同的功能(Heetal., 2015)。
20E最初的靶标是蜕皮激素受体基因EcR,DmEcR基因的表达产物与DmUSP表达的产物结合,从而介导20E的许多调节功能。DmEcR基因编码两个蛋白亚型,EcR-A、EcR-B1和EcR-B2,EcR-A和EcR-B是选择性启动造成的,EcR-B1和EcR-B2是选择性剪切造成的。在昆虫的变态发育中,DmEcR-A和DmEcR-B1会分别在不同的时期和在不同的组织中表达,这是因为20E作用的空间特异性。EcR蛋白在成虫体内组织中是广泛存在的,包括中枢神经系统、脂肪体、肠以及雄雌虫的生殖器官中。
对EcR不同亚型的研究发现,EcR-A只有很微弱的转录激活作用,而EcR-B是有效的配体调控的转录激活因子,蜕皮激素主要与EcR-B1受体结合,直接调控一小部分早期基因的转录。在果蝇的胚胎发育时期,EcR在胚带收缩和头部卷绕这两个过程中有着十分重要的作用。EcR-A的缺失或者突变会使得果蝇在蛹的中期发育停滞(Davisetal., 2005),表明EcR-A在体轴形成后且成体分化前是必须的结构。通过基因手段使得EcR-B1位点的突变,所有的试验果蝇幼虫不能正常的进入蛹期,但EcR-B1和EcR-B2两个位点同时突变,大部分果蝇的发育停滞在幼虫期,大部分果蝇的生长受阻,不能正常的进入蛹期(Maves and Schubiger, 1998),说明EcR-B1是昆虫完成正常变态发育所必须的结构(Sustar and Schubiger, 2005)。不同昆虫或不同时期的占主要表达的EcR同工体在不同的昆虫中表达是有很大差异的,例如,在鳞翅目昆虫如家蚕BombyxmoriLinnaeus和烟草天蛾Manducasexta的EcR-B1主要在幼虫中表达(Tan and Palli, 2008),果蝇的EcR-B1主要在幼虫组织中表达,EcR-A主要在成虫盘表达,在鞘翅目昆虫马铃薯甲虫中的EcR-A在幼虫中比EcR-B1表达的要多的多(Tanihara, 2009)。EcR-B2在果蝇的马氏管的形成和发育起着重要作用(Gautametal., 2015)。
EcR与不同的USP亚型结合形成不同的异二聚体,发挥着相同或不相同的功能。USP能与EcR-B1亚型形成异二聚体,USP在此复合体中不行使任何的转录激活功能,它的作用仅仅是对EcR产生异构效应,加强了EcR与DNA和20E结合的活性。在没有配体情况下,USP能够行使阻遏蛋白的功能(Ying and Dufau, 2004)。也有研究表明,在变态早期缺少USP的条件下,转录才能正常发生,说明在20E表态过程中,只有在去除阻遏因子,USP才能使得昆虫正常的完成变态发育。USP基因的突变或缺失会使得昆虫不能正常完成变态发育,例如成虫盘的分化和中肠的形成都不能正常完成。母系的USP基因缺失的胚胎会在胚胎发育后期出现胚胎绒毛膜缺陷而致死的现象,而合子的USP基因的缺失会导致大部分试验昆虫在幼虫时期就死亡,存活幼虫则会在二龄期会多长出一对尾部气门(Oroetal., 1992),表明一龄幼虫在的表皮在蜕皮时发生缺陷。
EcR和USP在昆虫的神经发育和神经调控方面发挥着重要的作用。在果蝇的神经发育中,在烟草天蛾和果蝇的研究中,发现在其变态发育中,神经元的重组需要EcR-B1的表达。在神经胶质和神经元中,特别是蕈形体轴突修剪阶段,EcR是必不可少的转录调节元件。蕈形体在果蝇的大脑中是非常重要的结构,控制果蝇的嗅觉和记忆。γ神经元是蕈形体重的一个重要结构,在重组阶段之前,EcR-B1能在γ 神经元中表达病控制其的修剪(Leeetal., 2000)。EcR或USP的基因缺失,会导致果蝇翅的感觉神经元过早的分化;果蝇眼部和神经元的发育会受到抑制(Schubiger and Truman, 2000)。
在昆虫的生长发育中,必然有着新组织的生长和衰老组织的程序性死亡,现已证实,一部分的核受体基因,包括昆虫的EcR,会参与调控细胞的程序性死亡。程序性死亡在腹侧神经元中已经被报道,并且受到EcR-A表达的调节(Robinowetal., 1993)。EcR-B1和EcR-B2能调控肽能神经元的程序性死亡,并且能诱导视神经叶的程序性死亡(Choietal., 2006)。在对昆虫EcR研究的深入,以及对核受体家族成员的深入研究,能够对人的核受体方面研究会有启示,EcR在神经方面的研究会使得人类在止疼药方面的研究有所进展。
3 EcR研究的问题与展望
3.1 EcR在害虫防治研究展望
昆虫不能正常的完成变态发育,不能完成蜕皮,幼虫就不能发育成健康的成虫,而是变成没有生命力的、取食量低的和不能繁殖的个体。因此,利用药物阻断昆虫的正常生命过程,如阻断其蜕皮过程,就能达到控制害虫种群的目的。通过测定新化合物与EcR/USP的亲和性来确定其杀虫活性的大小,能提供一种新的杀虫活性物质的筛选新方式,此方法不仅技术体系快速、准确、灵敏,而且可以高通量筛选和长期使用。将蜕皮激素接受子HHR3重组到苜蓿银纹夜蛾Autographacaliforica多角体病毒中,构建了绿色荧光蛋白标记和多角体蛋白包装的基因重组病毒,可将其通过消化道感染棉铃虫,导致棉铃虫的幼虫生长缓慢、不能正常蜕皮和种群数量下降(Shaoetal., 2007)。蜕皮激素类似物RH-2485可以促进棉铃虫致死性脱皮,能够在实验室和田间试验有良好的控制种群的效果(Zhaoetal., 2003)。
虽然对棉铃虫的EcR研究不是很透彻,但有研究者依旧在植物源的杀菌剂中寻找了一些柠檬苦素类似物,并与商业化的杀虫剂虫酰肼通过硅片法对比。结果表示试验中所用的6种植物源化合物都能够与棉铃虫的EcR配基结合与的活性位点结合。其结合能从-10.54~12.22 kcal/mol超过了昆虫生长调节剂和虫酰肼RH5992。在结合作用中有两个因子非常重要,一是残基Cys508和Asn504,在氢键作用很常见。二是疏水袋残基Asn504、Met507、Val416、Tyr408和Thr343。研究者还发现一个芳香环3-7附近的受体和1-3末端的疏水基有最低的药效特征。通过对EcR的天然类似物的研究能帮助我们在利用天然化合物在害虫的化学防治提供环境友好型的和对人类无毒、低毒的药物(Yadavetal., 2015),能够更好的控制农业害虫和人类疾病治疗相关药物的研发。
昆虫EcR启动转录的功能可以被用作研究转基因表达调控开关。EcR配体结合袋内不同位点氨基酸突变导致的对不同类型化合物的不同反应能够用来开发多基因调控系统。基于昆虫EcR建立的基因开关在转基因动物身上有着十分有价值的研究前景,受体和配体都是外源,可以安全、准确的调控基因表达,对哺乳动物无害。黑腹果蝇DmEcR和PonA建立的基因开关早已成功在哺乳动物细胞中利用(刘永杰等,2007)。
本课题组研究发现,生防菌绿僵菌的代谢产物绿僵菌素A与家蚕的EcR可能具有结合力。通过模拟对接等相关试验的分析,绿僵菌素A很可能与家蚕的EcR结合,但能否结合或具体的结合位点还需要进一步的研究和证明。此研究能够更进一步的阐明EcR的作用方式和绿僵菌素A在昆虫体内的靶标确认,且为EcR在生物农药的发展中提供新思路。
深入了解EcR的转录调节机制和探索一些能与EcR和USP结合的新化合物,使得EcR的研究在农业和医学上有潜在的价值。20E拮抗剂和类似物能与EcR/USP复合体相互作用,是有效的昆虫生长调节剂,并且此类物质对动物低毒且对环境具有安全性,使得它能在在农业害虫防治方面有应用;在桑叶中加入20E能够缩短上蔟时间,能在蚕丝生产上大大的缩短时间;并且在人类医学药物的研制方面也有应用,为新药的研发提供坚实的理论基础,并且EcR/USP的基因开关逐渐在临床上开始尝试(李康等,2011)。
也许在未来的发展中利用果蝇、家蚕等模式昆虫的功能基因组与遗传研究成果继续深入研究蜕皮激素EcR/USP的生物作用,并将基因组和转基因方法应用到其他昆虫EcR/USP的研究中。通过大量构建EcR和(或)USP模型进行活体和离体实验,以深入研究EcR/USP的功能和级联调控机理。相信在不久的将来昆虫EcR/USP的应用价值会以全新的面貌呈现在我们的面前。
3.2 目前EcR和USP研究的问题
近些年,由于EcR的研究价值不断升高,越来越多的学者选择其进行研究,研究的深度和广度都比以前扩大了。越来越多的昆虫的EcR基因的序列被克隆,结构功能被阐明的越来越透彻,从最初的模式昆虫双翅目的果蝇EcR的深入研究,到现在鳞翅目、鞘翅目、同翅目和直翅目的部分昆虫也在渐渐地被科学工作者研究。虽然人们对EcR和USP的研究逐渐增多,对EcR的调控机理逐渐清晰,但还是有大量问题需要解决。对EcR和USP的克隆测序和结构功能的研究主要集中在鳞翅目和双翅目,其他目的昆虫如。昆虫的EcR处在昆虫的发育、变态和繁殖等重要生命过程的级联调控的其实位置,具有种类或类群的特异性,今后还要更加全面的描述各种各类昆虫的EcR和USP的结构和功能特点,才能更加全面的深入了解。
对EcR和USP的分布还不是太了解,对EcR和USP在和20E相互作用时在细胞中的亚细胞水平的分布也还不是很了解,对各个亚型的分布还需要更深入研究;USP的定位至今还未被确定。各个亚型在不同昆虫或不同时期的作用还需要进行深入的探索,EcR-B2在昆虫变态发育中的作用了解的还不是很透彻,还需要更精确的基因手段来确定它们的作用。只有在明确USP的自然配体之后,才能清楚USP的真实作用。研究EcR和USP的表达控制不仅对于了解昆虫内分泌调控具有有重要的作用意义,还对了解蜕皮激素和保幼激素与其他生物过程的相互作用有意义。此外,细胞内蛋白和蜕皮激素滴度、代谢速率以及促进因子的亲和性等转录水平的影响也还不确定。这些问题对于转基因载体的构建,特别是转基因开关的利用是至关重要的。
References)
Bergman T, Henrich VU, Lezzi M.Ligand control of interactioninvivobetween ecdysteroid receptor and ultraspiracle ligand-binding domain [J].BiochemicalJournal, 2004, 378 (Pt 3): 779-784.
Billas IML, Thomas I, Jean-Marie G,etal.Structural adaptability in the ligand-binding pocket of the ecdysone hormone receptor [J].Nature, 2003, 426 (6962): 91-96.
Choi YJ, Lee G, Park JH.Programmed cell death mechanisms of identifiable peptidergic neurons inDrosophilamelanogaster[J].Development, 2006, 133 (11): 2223-2232.
Davis MB, Carney GE, Robertson AE,etal.Phenotypic analysis of EcR-A mutants suggests that EcR isoforms have unique functions duringDrosophiladevelopment [J].DevelopmentalBiology, 2005, 282 (2): 385-396.
Gautam NK, Verma P, Tapadia MG.Ecdysone regulates morphogenesis and function of malpighian tubules inDrosophilamelanogasterthrough EcR-B2 isoform [J].DevelopmentalBiology, 2014, 398 (2): 163-176.
He H, Xi G, Lu X.Molecular cloning, characterization, and expression analysis of an ecdysone receptor homolog inTeleogryllusemma(Orthoptera: Gryllidae) [J].JournalofInsectScience, 2015, 15 (1): 22.
Henrich VC, Sliter TJ, Lubahn DB,etal.A steroid/thyroid hormone receptor superfamily member inDrosophilamelanogasterthat shares extensive sequence similarity with a mammalian homologue [J].NucleicAcidsResearch, 1990, 18 (14): 4143-4148.
Hill RJ, Billas IML, Bonneton F,etal.Ecdysone receptors: From the Ashburner model to structural biology [J].AnnualReviewofEntomology, 2013, 58 (1): 846-852.
Hu X, Cherbas L, Cherbas P.Transcription activation by the ecdysone receptor (EcR/USP):Identification of activation functions [J].MolecularEndocrinology, 2003, 17 (4): 716-731.
Huang LX, Gong YG, Gu J,etal.Expression, subcellular localization and protein-protein interaction of four isoforms of EcR/USP in the common cutworm [J].InsectScience, 2015, 22 (1): 95-105.
Jindra M, Malone F, Hiruma K,etal.Developmental profiles and ecdysteroid regulation of the mRNAs for two ecdysone receptor isoforms in the epidermis and wings of the tobacco hornworm,Manducasexta[J].Developmentalbiology, 1996, 180 (1): 258-272.
King-Jones K, Thummel CS.Nuclear receptors-a perspective fromDrosophila[J].NatureReviewsGenetics, 2005, 6 (4): 311-323.
Kolchanov NA, Ananko EA, Podkolodnaya OA,etal.Transcription Regulatory Regions Database (TRRD): Its status in 1999 [J].HydrotechnicalConstruction, 1978, 12 (11): 1084-1087.
Lee T, Marticke S, Sung C,etal.Cell-autonomous requirement of the USP/EcR-B ecdysone receptor for mushroom body neuronal remodeling inDrosophila[J].Neuron, 2000, 28 (3): 807-818.
Li K, Li S, Cao Y.Transcriptional regulation by 20-hydroxyecydsone and its nuclear receptor EcR-USP [J].ActaEntomologicaSinica, 2011, 54 (8): 933-937.[李康, 李胜, 曹阳.蜕皮激素与其受体EcR-USP的转录调控机制[J].昆虫学报, 2011, 54 (8): 933-937]
Liu YJ, Xu PJ, Li YW,etal.Progress in ecdysone receptor (EcR) and insecticidal mechanisms of ecdysteroids [J].ActaEntomologicaSinica, 2007, 50 (1): 67-73.[刘永杰, 徐蓬军, 李艳伟, 等.昆虫蜕皮激素受体及其类似物的杀虫机制研究进展[J].昆虫学报, 2007, 50 (1): 67-73]
Marek O, Monika S, Agnieszka K,etal.Plasticity of the ecdysone receptor DNA binding domain [J].MolecularEndocrinology, 2004, 18 (9): 2166-2184.
Maves L, Schubiger G.A molecular basis for transdetermination inDrosophilaimaginal discs:Interactions between wingless and decapentaplegic signaling [J].Development, 1998, 125 (1): 115-124.
Niedziela-Majka A, Kochman M, Andrzej O.Polarity of the ecdysone receptor complex interaction with the palindromic response element from thehsp27 gene promoter [J].EuropeanJournalofBiochemistry, 2000, 267 (2): 507-519.
Oro AE, Mckeown M, Evans RM.The Drosophila retinoid X receptor homolog ultraspiracle functions in both female reproduction and eye morphogenesis [J].Development, 1992, 115 (2): 449-462.
Piotr D, Iwona G, Tomasz K,etal.The DNA-binding domain of the ultraspiracle drives deformation of the response element whereas the DNA-binding domain of the ecdysone receptor is responsible for a slight additional change of the preformed structure [J].Biochemistry, 2006, 45 (3): 668-675.
Ren B, Peat TS, Streltsov VA,etal.Unprecedented conformational flexibility revealed in the ligand-binding domains of theBovicolaovisecdysone receptor (EcR) and ultraspiracle (USP) subunits [J].ActaCrystallographica, 2014, 70 (7): 1954-1964.
Robinow S, Talbot WS, Hogness DS,etal.Programmed cell death in theDrosophilaCNS is ecdysone-regulated and coupled with a specific ecdysone receptor isoform [J].Development, 1994, 119 (4): 1251-1259.
Ruse MD, Privalsky ML, Sladek FM.Competitive cofactor recruitment by orphan receptor hepatocyte nuclear factor 4alpha1:Modulation by the F domain [J].Molecular&CellularBiology, 2002, 22 (6): 1626-1638.
Schubiger M, Truman J.The RXR ortholog USP suppresses early metamorphicprocesses inDrosophilain the absence of ecdysteroids [J].Development, 2000, 127 (6): 1151-1159.
Shao H, Dong DJ, Mang X,etal.Reconstruction of AcMNPV withHelicoverpahormone receptor 3 and its effect on theHelicoverpalarvae [J].BiocontrolScience&Technology, 2007, 17 (1): 95-104.
Sustar A, Schubiger G.A transient cell cycle shift inDrosophilaimaginal disc cells precedes multipotency [J].Cell, 2005, 120 (3): 383-93.
Tan A, Palli SR.Edysone receptor isoforms play distinct roles in controlling molting and metamorphosis in the red flour beetle,Triboliumcastaneum[J].Molecular&CellularEndocrinology, 2008, 291 (1-2): 42-49.
Tanihara O.Examination of the anti-monopoly law of the People’s Republic of China : Analysis from a viewpoint of the anti-monopoly laws of Japan & U.S.A [J].AoyamaLawReview, 2009, 50 (16): 4114-4128.
Tran HT, Askari HB, Shaaban S,etal.Reconstruction of ligand-dependent transactivation ofChoristoneurafumiferanaecdysone receptor in yeast [J].MolecularEndocrinology, 2001, 15 (7): 1140-1153.
Vanacker JM, Delmarre C, Guo X,etal.Activation of the osteopontin promoter by the orphan nuclear receptor estrogen receptor related alpha [J].CellGrowth&DifferentiationtheMolecularBiologyJournaloftheAmericanAssociationforCancerResearch, 1998, 9 (12): 1007-1014.
Vögtli M, Elke C, Imhof MO,etal.High level transactivation by the ecdysone receptor complex at the core recognition motif [J].NucleicAcidsResearch, 1998, 26 (10): 2407-2414.
Wickert L, Selbig J.Structural analysis of the DNA-binding domain of alternatively spliced steroid receptors[J].JournalofEndocrinology, 2002, 173 (3): 429-436.
Yadav RP, Ibrahim KS, Gurusubramanian G,etal.In silico docking studies of non-azadirachtin limonoids against ecdysone receptor ofHelicoverpaarmigera(Hübner) (Lepidoptera: Noctuidae) [J].MedicinalChemistryResearch, 2015, 24 (6): 1-11.
Yao TP, Forman BM, Jiang Z,etal.Functional ecdysone receptor is the product of EcR and Ultraspiracle genes [J].Nature, 1993, 366 (6454): 476-479.
Ying Z, Dufau ML.Genesilencing by nuclear orphan receptors [J].Vitamins&Hormones, 2004, 68 (6): 1-48.
Zhao XF, Li ZM, Wang JX,etal.Efficacy of RH-2485, a new non-steroidal ecdysone agonist, against the cotton boll worm;Helicoverpaarmigera(Lepidoptera: noctuidae) in the laboratory and field [J].CropProtection, 2003, 22 (7): 959-965.
Zhao XF.Progress in insect molting hormone signaling transduction pathways [J].ChineseBulletinofLifeSciences, 2010 (12): 1208-1214.[赵小凡.昆虫蜕皮激素信号转导途径研究进展[J].生命科学, 2010 (12): 1208-1214]
A review of ecdysone receptor
WANG Jing-Jing, HU Qiong-Bo*
(Department of Pesticide, College of Agriculture, South China Agricultural University, Guangzhou 510642, China)
Molting hormone is one of steroid hormone and its active form is 20-hydroxyecdysone.In the process of development of insect, ecdysis, metamorphosis and reproduction are regulated and controlled by molting hormone.Ecdysone and ultraspiracle belong to nuclear receptor and have the same structural characteristic which include transactivation domain, DNA-binding domain, hinge region, ligand binding domain and F region.EcR locate in promoter region in the cascade reaction of ecdysis, metamorphosis and reproduction of insect and play a significant role in these processes.Molting hormone interact with heterodimer composed of EcR and USP and start cascade reaction.This paper introduce the structure and function of EcR and USP, mechanism of interaction with molting hormone and application of EcR in agricultural pest control and so on.We discuss the problems that study in EcR and research prospect in future.
Ecdysone receptor (EcR); ultraspiracle protein (USP); nuclear receptor (NR); 20-hydroxyecdysone (20E); heterodimer
王菁菁,胡琼波.昆虫蜕皮激素受体研究进展[J].环境昆虫学报,2017,39(3):721-729.
公益性行业(林业)科研专项资金项目(201304408)
王菁菁,女,1993年生,硕士研究生,E-mail: wangjingjing968@126.com
*通讯作者Author for correspondence,E-mail: hqbscau@126.com
Received: 2016-04-08;接受日期Accepted: 2017-01-26
Q963;Q965
A
1674-0858(2017)03-0721-09

