取食不同食料的美国白蛾幼虫肠道细菌多样性及差异性研究
魏丹峰,王秀吉,杨 锦,耿涌鑫,陈 敏
取食不同食料的美国白蛾幼虫肠道细菌多样性及差异性研究
魏丹峰,王秀吉,杨 锦,耿涌鑫,陈 敏*
(北京林业大学林学院,北京100083)
为了解取食不同食料的美国白蛾HyphantriacuneaDrury幼虫肠道细菌多样性及差异性,本研究应用Illumina HiSeq二代测序技术检测16S rDNA基因序列的方法分析以人工饲料、桑树MorusalbaLinn和柳树SalixbabylonicaLinn为食的3种美国白蛾5龄幼虫肠道细菌类群结构、丰度差异和α多样性。共获得657 819对读数,聚成3 743个OTUs,注释到23个门,60个纲,90个目,143个科,196个属和58个种。科以上分类阶元,以两种植物为食的幼虫肠道的优势类群一致,但取食人工饲料的幼虫在各级分类水平与前者不同(门水平除外)。在属分类阶元,取食3种美国白蛾幼虫肠道菌群优势属各不相同,丰度最高分别为希瓦氏菌属Shewanella(12.81%)、葡萄球菌属Staphylococcus(7.86%)和芽孢杆菌属Bacillus(5.24%)。种水平上海藻希瓦氏菌Shewanellaalgae在3种食料的美国白蛾幼虫肠道中都有较高的丰度;松鼠葡萄球菌Staphylococcussciuri在以桑树和柳树为食料的美国白蛾幼虫肠道中比例较高,但在以人工饲料的幼虫中比例很低。3种食料的幼虫共有的OUTs为228个,特有的OUTs分别为人工饲料145个、桑树160个和柳树138个。以上结论表明取食不同食料的美国白蛾幼虫的肠道细菌类群结构和丰度存在一定差异。α多样性指数表明美国白蛾幼虫肠道细菌群落具有较高的丰富度和多样性。为进一步探明其肠道细菌的功能以及对寄主的适应机制等方面的研究奠定基础。
美国白蛾;肠道细菌;16S rDNA;多样性;差异性
美国白蛾HyphantriacuneaDrury属于鳞翅目Lepidoptera灯蛾科Arctiidae,是我国重要的外来入侵害虫。该害虫原分布于北美,1979年在我国辽宁省丹东市首次发现(于长义,1993),随后迅速在我国东北、华北地区不断扩散蔓延(李建州,2014),国家林业局发布2017年第2号、第3号公告,公布2017年全国美国白蛾疫区涉及11个省(区、市)的558个县级行政区。
昆虫肠道内栖息着大量的微生物,肠道微生物对昆虫的生长发育起着非常重要的作用(Dillon & Dillon, 2004; 黄胜威, 2009),如合成食物中缺少但昆虫必须的营养物质 (Morrisonetal., 2009; Gibson & Hunter, 2010; Fragoetal., 2012)、产生多种消化酶类(Watanabe & Tokuda, 2010)、解毒作用 (Nikohetal., 2011; Adamsetal., 2013; Masonetal., 2014)、提高防御能力(Dillonetal., 2005)、影响昆虫发育历期和繁殖(彩万志, 1990; Beharetal., 2008; 相辉和黄勇, 2008)、参与信息素合成(Dillonetal., 2002)等。因此,有学者认为肠道微生物可能是形成昆虫多样生活方式的关键因素,甚至被认为是整合到寄主生物系统的“细菌器官”(Moran, 2007; Engel & Moran, 2013)。而昆虫肠道微生物的群落结构和多样性与食性有很大关系,寄主植物或食料的不同,昆虫肠道微生物的结构和多样性也会产生一定差异(Dillonetal., 2002;Hayashietal., 2007)。昆虫肠道微生物包括原生动物、真菌、古生菌和细菌,大多数昆虫肠道微生物主要是细菌(周洪英等,2015)。
美国白蛾寄主范围非常广泛,世界范围内已知的寄主有636种,其中美国有120种,日本300种,欧洲234种(Firidinetal., 2008)。2015年7月据林业信息网公布,在我国美国白蛾寄主已经达到300多种,主要喜食树种有:桑、榆、臭椿、山楂、杏、法国梧桐、泡桐、白蜡树、苹果、杨树等。美国白蛾幼虫肠道微生物是否对幼虫生长发育及寄主适应性方面起着重要的作用,目前还没有相关报道。基于16S rDNA的第二代高通量测序,已成为肠道细菌研究的主要方法(Fadroshetal., 2014; Goodrichetal., 2014)。尤其对16S rDNA 的高变区V3-V4片段进行双端测序,时间短,费用相对较低,且能够得到足够多的序列以满足后续的生物信息学分析(李东萍等,2015)。本研究采用16S rDNA基因文库技术和Illumina HiSeq二代测序技术,分析取食不同寄主植物或食料的美国白蛾幼虫肠道细菌群落的多样性及差异性,为进一步探明其肠道细菌的功能以及对寄主的适应机制等方面的研究奠定基础。
1 材料与方法
1.1 供试昆虫
本研究试虫分别为取食人工饲料、桑树MorusalbaLinn和柳树SalixbabylonicaLinn 3种食料的美国白蛾5龄幼虫。寄主为柳树和桑树的美国白蛾幼虫于2015年8月采集北京林业大学校园内桑树和柳树上;取食人工饲料的试虫按照曹利军等(2014)的人工饲料配方和饲养方法在室内人工气候箱饲养美国白蛾至5龄幼虫作为实验材料。
1.2 美国白蛾幼虫的解剖
选取5龄幼虫20头于培养皿中,在超净工作台内进行解剖。首先将幼虫放入75%酒精中浸泡90 s进行虫体表面消毒,再用无菌水漂洗3次,然后将幼虫放于灭菌的培养皿(培养皿置于冰块上)中进行解剖,取出肠道放入2 mL离心管中。
1.3 DNA的提取
采用Tiangen粪便基因组DNA提取试剂盒TIANamp Stool DNA kit (天根生化科技(北京)有限公司)提取美国白蛾肠道细菌总DNA。实验步骤均按试剂盒说明书进行。提取细菌总DNA用超微量紫外分光光度计(Thermo,美国)对其浓度进行测定,然后进行1%的琼脂糖凝胶电泳检测。
1.4 肠道细菌16S rDNA基因V3-V4髙变区的PCR扩增
以提取的总DNA作为模板,使用带Barcode的特异引物扩增美国白蛾幼虫肠道细菌的16S rDNA的V3-V4 高变区(Floresetal., 2015)。引物序列为338F:5′-ACTCCTACGGGAGGCAGCA-3′和806R:5′-GGACTACHV GGGTWTCTAAT-3′(Dennisetal., 2013)。使用的酶和缓冲液为New England Biolabs 公司的Phusion® High-Fidelity PCR Master Mix with GC Buffer。PCR 反应体系为(30 μL):15 μL Phusion Master Mix(2×);3 μL引物(2 μM);10 μL gDNA(1 ng/μL)(5-10 ng);2 μL 去离子水。反应程序为:98℃预变性1 min;30 个循环包括98℃,10 s;50℃,30 s;72℃,30 s;72℃,5 min。PCR扩增产物经2.0%的琼脂糖凝胶电泳检测后,由北京诺禾致源生物信息科技有限公司利用Illumina HiSeq测序平台进行二代测序。
1.5 序列分析
首先应用对测序得到的原始数据截去Barcode序列和PCR扩增引物序列后,进行拼接得到原始Tags数据(Raw Tags)(Magoc & Salzberg, 2011),然后对原始 Tags进行截取、过滤和去嵌合体序列等处理,得到最终的有效数据(Effective Tags)(Haasetal., 2011)。
1.6 肠道细菌鉴定和多样性分析
利用UPARSE 软件(v7.0.1001)对所有样品的全部有效 Tags进行聚类,默认以97%的相似度将序列聚类成为OTUs(Operational Taxonomic Units)(Edgar, 2013),同时依据其算法原则,筛选频数最高的序列作为OTUs的代表序列。用RDP Classifier(V2.2)方法与GreenGene数据库(http://greengenes.lbl.gov/cgi-bin/nph-index.cgi)(Desantisetal., 2006)进行物种注释分析(设定阈值为0.8~1),并分别在各级分类水平统计样本的群落组成及物种的丰度分布情况(Wangetal., 2007)。利用QIIME (v1.80)软件计算Chao,ACE,Shannon,Simpson指数,使用R软件(Version 2.15.3)绘制稀释型曲线、Venn图,得到样品内物种丰富度和多样性信息、不同食料幼虫肠道细菌之间的共有和特有OTUs信息等。
2 结果与分析
2.1 序列拼接和组装
从美国白蛾幼虫肠道细菌的16S rDNA 基因序列文库共获得657819条reads,拼接后得到542611条 tags,拼接率为82.49%,tag平均长度为413±9 bp(带接头)。拼接的tags 经过优化得到461914条,在97%相似度下可将其聚类为用于物种分类的3743个OTUs。
2.2 3种食料的美国白蛾幼虫肠道细菌组成及其丰度
基于OTUs 的分类结果,总共注释到23个门,60个纲,90个目,143个科,196个属和58个种。
在门水平上,丰度前10位分别为变形菌门Proteobacteria,厚壁菌门Firmicutes、放线菌门Actinobacteria、拟杆菌门Bacteroidetes、TM7、WPS-2、芽单胞菌门Gemmatimonadetes、梭杆菌门Fusobacteria、蓝藻门Cyanobacteria、酸杆菌门Acidobacteria(如图1:A)。可以看出,取食3种食料的美国白蛾幼虫的肠道优势细菌都为变形菌门和厚壁菌门。在取食人工饲料、桑树和柳树的幼虫中变形菌门占的比率分别为63.23%、73.46%、63.82%;厚壁菌门分别占19.10%、15.49%、15.85%。
纲水平上,美国白蛾肠道细菌丰度前10位都为γ-变形菌纲Gamma-Proteobacteria、α-变形菌纲alphaProteobacteria、杆菌纲Bacilli、放线菌纲Actinobacteria、梭菌纲Clostridia、拟杆菌纲Bacteroidia、β-变形菌纲betaProteobacteria、TM7-3、ε-变形菌纲Epsilonproteobacteria、嗜热油菌纲Thermoleophilia (如图1:B)。以人工饲料为食料的美国白蛾肠道菌群中γ-变形菌纲比率最高,达到54.78%,其次为杆菌纲(14.87%)和放线菌纲(6.74%);而以桑树、柳树为食料的美国白蛾肠道菌群中α-变形菌纲比率最高,分别达到43.33%、31.43%,其次为γ-变形菌纲(分别占25.35%、22.59%)和杆菌纲(分别占12.77%、9.12%)。
目水平上,丰度前10位为立克次氏体目Rickettsiales、海洋螺菌目Oceanospirillales、乳杆菌目Lactobacillales、异单胞菌目Alteromonadales、芽孢杆菌目Bacillales、双歧杆菌目Bifidobacteriales、根瘤菌目Rhizobiales、梭菌目Clostridiales、放线菌目Actinomycetales、肠杆菌目Enterobacteriales (如图1:C)。以人工饲料为食料的美国白蛾肠道菌群中海洋螺菌目比率最高,达到37.10%,其次为乳杆菌目 (12.56%)和异单胞菌目 (12.82%);而以桑树、柳树为食料的美国白蛾幼虫肠道菌群中立克次氏体目比率最高,分别达到37.90%和23.34%,其次为海洋螺菌目 (分别为13.37%、17.57%) 和芽孢杆菌目(分别为10.39%、7.08%)。
科水平上,丰度前10位为Mitochondria科、盐单胞菌科Halomonadaceae、肠球菌科Enterococcaceae、希瓦氏菌科Shewanellaceae、葡萄球菌科Staphylococcaceae、双歧杆菌科Bifidobacteriaceae、芽胞杆菌科Bacillaceae、链球菌科Streptococcaceae、分支杆菌科Methylobacteriaceae、肠杆菌科Enterobacteriaceae (如图1:D)。以人工饲料为食料的美国白蛾肠道菌群中盐单胞菌科比率最高,达到37.10%;而在以桑树、柳树为食料的美国白蛾肠道菌群中Mitochondria科比率最高,分别为37.82%和23.33%。
属水平上,丰度前10位分别为肠球菌属Enterococcus、希瓦氏菌属Shewanella、葡萄球菌属Staphylococcus、双歧杆菌属Bifidobacterium、甲基杆菌属Methylobacterium、芽孢杆菌属Bacillus、链球菌属Streptococcus、巨型球菌属Macrococcus、沙雷氏菌属Serratia、鞘氨醇单胞菌属Sphingomonas(如图1:E)。取食3种食料的美国白蛾肠道菌群优势属各不相同,以人工饲料为食料的美国白蛾肠道菌群优势属为希瓦氏菌属,比率为12.81%,其次为肠球菌属 (7.73%)和双歧杆菌属 (3.80%),而这两个属在以两种寄主植物为食的幼虫样品中含量都较低(分别占1.04%、0.53%);以桑树为食料的幼虫肠道菌群优势属为葡萄球菌属,比率为7.86%,其次是希瓦氏菌属 (5.35%)和巨型球菌属(1.54%),而葡萄球菌属在其他两种食料的样品中含量仅0.68%和0.77%;以柳树为食料的幼虫肠道菌群优势属为芽孢杆菌属,比率为5.24%,其次是甲基杆菌属 (4.29%),希瓦氏菌属 (3.06%)居第三, 而在人工饲料和桑树的幼虫中芽孢杆菌属(0.35%,0.23%)和甲基杆菌属(0.02%,0.04%)含量很低。可见,不同食料饲养的幼虫肠道优势细菌在属水平差异较大,但希瓦氏菌属在所有样品中都占据较高的比例。
种水平上,丰度前10位分别海藻希瓦氏菌Shewanellaalgae、松鼠葡萄球菌Staphylococcussciuri、粘质沙雷菌Serratiamarcescens、Anoxybacilluskestanbolensis、申氏不动杆菌Acinetobacterschindleri、痤疮丙酸杆菌Propionibacteriumacnes、强固芽胞杆菌Bacillusfirmus、大肠杆菌Escherichiacoli、洛菲不动杆菌Acinetobacterlwoffii、鞘氨醇单胞菌Sphingomonasyabuuchiae(如图1:F)。以人工饲料为食料的美国白蛾肠道菌群中海藻希瓦氏菌比率最高,为12.78%,其次是粘质沙雷菌和Anoxybacilluskestanbolensis,分别达到1.54%和1.02%;以柳树为食料的美国白蛾肠道菌群中海藻希瓦氏菌比率也是最高,为9.00%,其次是松鼠葡萄球菌和粘质沙雷菌,分别达到3.59%和1.02%;而以桑树为食的美国白蛾肠道菌群中松鼠葡萄球菌比率最高,为7.15%,其次为海藻希瓦氏菌(5.22%)和鞘氨醇单胞菌 (0.87%)。海藻希瓦氏菌在三种食料美国白蛾幼虫肠道中占有较高的比例,而松鼠葡萄球菌在以桑树和柳树为食料的美国白蛾幼虫肠道中占有较高的比例,但在以人工饲料为食料的幼虫中含量很低(0.03%)。
2.3 取食不同食料的美国白蛾幼虫肠道细菌群落之间的差异性
根据OTUs聚类分析结果,对所有样品进行均一化处理后,分析不同食料的幼虫肠道之间共有、特有的OTUs,绘制成韦恩图(Venn Graph)(图2)。从图2可以看出,3种食料的幼虫共有的OUTs为228个,占各样品OUTs总数的35%-42.6%,人工饲料、桑树、柳树的幼虫特有的OUTs分别为145个、160个和 138个,分别占各样品OUTs总数的24.5%-25.8%,表明不同食料的美国白蛾幼虫肠道的细菌组成存在一定差异。
2.4 美国白蛾幼虫肠道细菌多样性
稀释性曲线(Rarefaction Curve)是采用对测序序列进行随机抽样的方法,以抽到的序列数与它们所能代表OTU的数目构建的曲线。当曲线趋于平坦时,说明测序数据量合理,更多的数据量对发现新OTU的边际贡献很小;反之则表明继续测序还可能产生较多新的OTU。稀释性曲线图(图3)说明测序量足够,已经基本覆盖到样本中所有的物种。
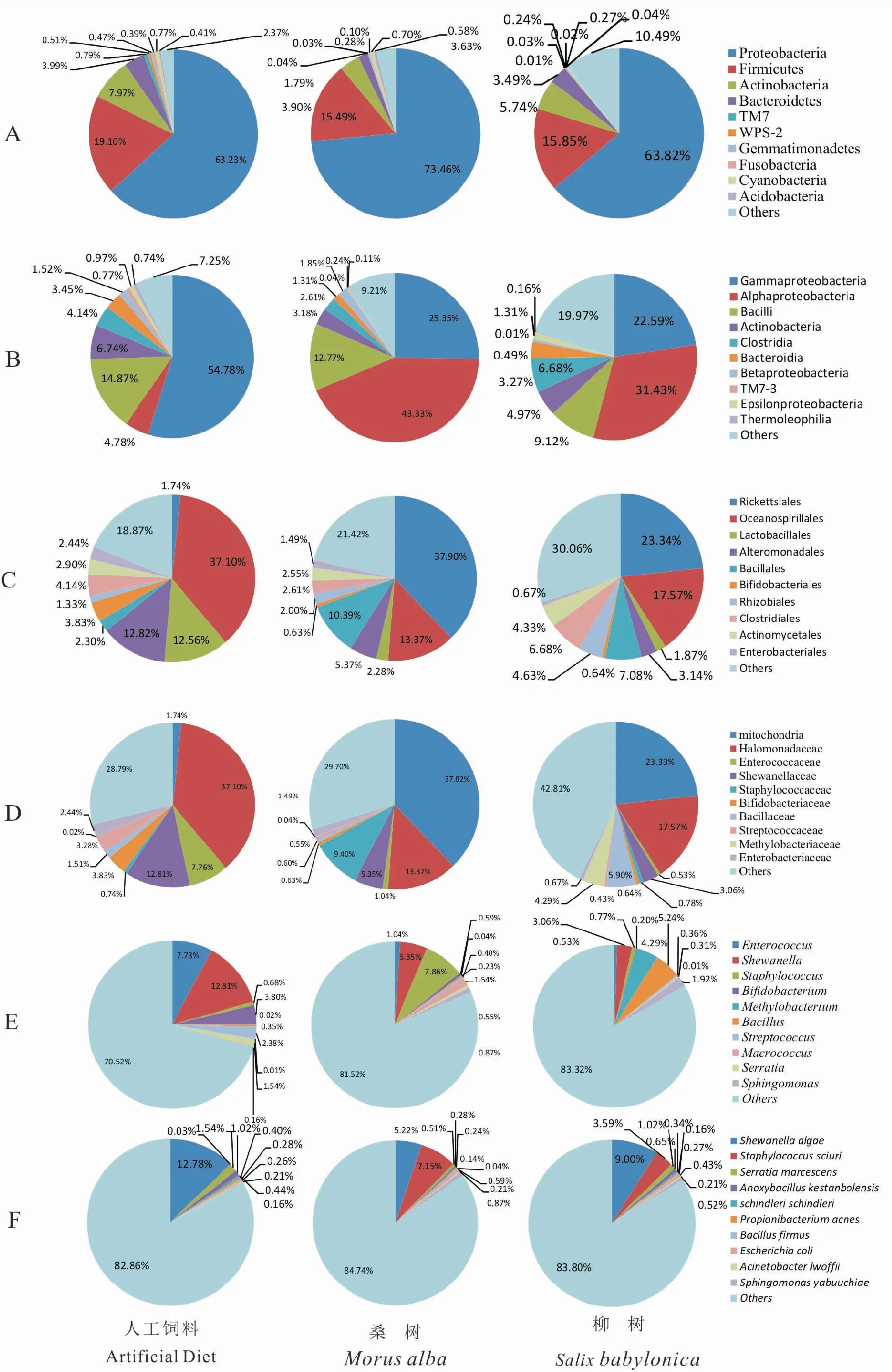
图1 3种食料的美国白蛾幼虫肠道细菌在不同分类等级上的物种比例Fig.1 The proportions of the bacteria species in the intestine of larval H.cunea fed on three diets at different classification levelsA:门分类水平中物种比例饼状图;B: 样品纲分类水平中物种比例饼状图;C: 样品目分类水平中物种比例饼状图;D: 样品科分类水平中物种比例饼状图;E: 样品属分类水平中物种比例饼状图;F: 样品种分类水平中物种比例饼状图。A: The taxonomic composition distribution in samples of phylum-level; B: The taxonomic composition distribution in samples of class-level; C: The taxonomic composition distribution in samples of order-level; D:The taxonomic composition distribution in samples of family-level; E: The taxonomic composition distribution in samples of genus-level; F: The taxonomic composition distribution in samples of species-level.

图2 3种食料的美国白蛾幼虫肠道细菌OTUs的维恩分析Fig.2 Venn analysis of OTUs of the intestinal bacterial of larval H.cunea fed on three diets注:AD, 人工饲料; MA, 桑树; SB, 柳树,下同。AD, Artificial Diet; MA , Morus alba ; SB, Salix babylonica.The same below.
取食3种食料的美国白蛾幼虫肠道细菌的Alpha多样性统计如表1。Chao指数和Ace 指数反映样品中群落的丰富度,数值越大,群落丰富度越高;Shannon 指数和Simpson 指数反映群落的多样性,数值越大,说明群落多样性越高。从表1可以看出,各样品的Chao 指数在387.611-523.768;Ace 指数在402.655-562.565;Shannon 指数为4.249-5.600;Simpson 指数为0.820-0.916,表明取食三种食料的美国白蛾幼虫肠道的细菌群落都有较高的丰富度和多样性。
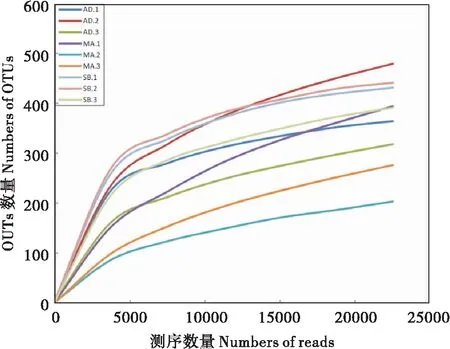
图3 测序样品稀释度曲线图Fig.3 Rarefaction curve of samples
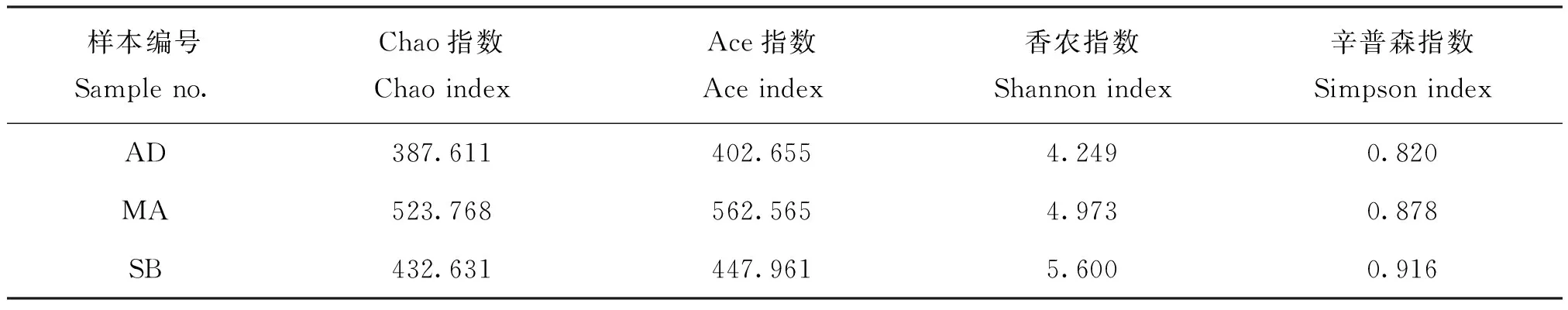
表1 美国白蛾幼虫肠道细菌的Alpha多样性指数Table 1 Alpha indices of the bacteria in the intestine of larval H.cunea
3 结论与讨论
本研究基于16S rDNA和Illumina二代测序技术首次对取食不同食料的美国白蛾幼虫肠道细菌菌落多样性及差异性进行了分析,总共注释到23个门,60个纲,90个目,143个科,196个属和58个种。3种不同食料饲养的美国白蛾幼虫肠道优势细菌均为变形菌门和厚壁菌门。该结果与多数昆虫肠道中的优势菌相同,如鳞翅目的舞毒蛾LymantriadisparLinnaeus、棉铃虫HelicoverpaarmigeraHübner、贡嘎蝠蛾HepjalusgonggaensisFu et Huang、小菜蛾PlutellaxylostellaLinnaeus、家蚕BombyxmoriLinnaeus、栎黄掌舟蛾PhaleraassimilisBremer et Grey以及膜翅目蜜蜂属Apis和鞘翅目暗黑鳃金龟HolotrichiaparallelaMotschulsky等(Brodericketal., 2004; Huangetal., 2006; 刘莉, 2008 ; 黄胜威, 2012;夏晓峰, 2014; 文竹等, 2015; 郭军,2015)。同样,Yun等(2014)对21个目的81种昆虫的肠道菌群的研究也得到相似的结果。但是,有些昆虫肠道中的优势菌相对简单,如茶尺蠖EctropisobliqueProut、扶桑绵粉蚧PhenacoccussolenopsisTinsley、泽兰实蝇ProcecidocharesutilisTephritidae (靳亮等,2013; 王震杰,2014; 张某等,2016)等肠道优势菌群仅为变形菌门。而另一些昆虫肠道的优势菌门却相对复杂,如白蚁肠道的优势细菌菌除了变形菌门和厚壁菌门,还有拟杆菌门和螺旋体门 (Shinzatoetal., 2007)。可见,昆虫肠道细菌的组成结构及群落结构与昆虫种类、食性及环境等息息相关。
在属水平上,3种食料的美国白蛾肠道菌群优势属差异明显。以人工饲料为食料的美国白蛾肠道菌群优势属为希瓦氏菌属,比率为12.81%。希瓦式菌属属于革兰氏阴性细菌,在鱼、虾等海产品中比较常见(商宝娣等,2015),但在昆虫肠道微生物中还未见报道。人工饲料饲养的美国白蛾幼虫肠道菌群次优势属为肠球菌属。肠球菌属属于厚壁菌门,为革兰氏阳性细菌,广泛分布于自然环境和昆虫肠道中(Martin & Mundt, 1972)。鳞翅目的小菜蛾、棉铃虫、稻纵卷叶螟、二化螟、家蚕等肠道中都有肠球菌属的存在(杨焊,2012; Xiaetal., 2013;许刚等,2015; 李振等,2016)。该属的细菌能够产生乙酸盐,导致肠道消化液的 pH 值的降低(Meadetal., 1988),可保护昆虫免受一些毒素的攻击。研究表明,肠球菌属能够抑制家蚕微孢子虫的孢子发芽,从而抑制致病微生物的感染(鲁兴萌和汪方炜,2002);舞毒蛾幼虫肠道内的肠球菌属能降低苏云金芽孢杆菌的杀虫活性(Brodericketal., 2004);烟草天蛾和小菜蛾的肠道内的肠球菌能够降低Cry1Ac的杀虫活性(Johnston & Crickmore, 2009)。夏晓峰(2014)发现肠球菌能显著提高小菜蛾对毒死蜱的抗性;经过Bt杀虫蛋白处理的二化螟幼虫肠道内肠球菌属比重会显著增加,可能该菌使昆虫更能够耐受有Bt杀虫蛋白的肠道环境(李振等,2016)。人工饲料饲养的美国白蛾幼虫肠道内的肠球菌属的丰度(7.73%)著高于取食两种寄主植物的幼虫(分别占1.04%、0.53%)。可能是幼虫受到人工饲料中的对羟基苯甲酸等防腐剂的诱导,以增强肠道的免疫性和抗药性。
以桑树为食料的美国白蛾肠道菌群优势属为葡萄球菌属,比率为7.86%。葡萄球菌属属于厚壁菌门,是自然界中广泛分布的一类细菌,在许多昆虫肠道中均有发现,并且在高等白蚁、桑粒肩天牛AprionagermariHope、家蚕、贡嘎蝠蛾等昆虫肠道内为优势菌群(Euticketal., 1978; 张伟等,2004; 胡霞,2014; 许刚等,2015)。葡萄球菌属能产蛋白酶,有助于昆虫对蛋白的消化吸收。Takatsuka等(2000)发现茶长卷叶蛾HomonamagnanimaDiakonoff的肠道中的葡萄球菌对入侵宿主体内的苏云金杆菌生长和繁殖有抑制作用。
以柳树为食料的美国白蛾肠道菌群优势属为芽孢杆菌属,比率为5.24%。芽孢杆菌属在家蚕、柞蚕AnthereapernyiGuerin-Meneville、贡嘎蝠蛾、华山松大小蠹DendroctonusarmandiTsai et Li等昆虫肠道内均有较高的比率(许刚等,2015; 邹昌瑞,2011;刘莉, 2008; 胡霞,2014)。芽孢杆菌属为主要的产酶菌,可以产纤维素酶、蛋白酶和脂肪酶,对昆虫消化吸收起到非常重要的作用。
本研究中取食不同食料的美国白蛾幼虫,其肠道细菌在属水平优势菌群各不相同,可能与不同食料的营养条件和昆虫对不同食物的消化吸收有关。Dillon 等(2002)研究表明,不同食料饲养的蝗虫Schistocercagregaria的肠道微生物的数量和种类有很大的变化。卓凤萍(2004)对野生贡嘎蝠蛾幼虫肠道进行分离,其优势细菌菌群是葡萄球菌属,而刘莉(2008)发现人工饲养的贡嘎蝠蛾幼虫肠道细菌优势菌群为肉食杆菌属Carnobacterium。Hayashi等(2007)报道,随着食物结构的改变,家白蚁CoptotermesformosanusShiraki肠道中的优势菌群也会随之发生改变。向芸庆(2010)用拓叶与桑叶饲养同一龄期的家蚕,其肠道中微生物优势菌群也出现较大变化。本研究初步分析了三种不同的食料对美国白蛾幼虫肠道细菌群落结构的影响,为进一步探明美国白蛾肠道微生物的功能及其与寄主植物的关系,下一步将继续增加寄主植物的种类并采取宏基因组技术,研究肠道细菌在美国白蛾消化吸收中的功能和作用,为研究美国白蛾的食性和对不同寄主植物的适应性提供有力依据。
References)
Adams AS,Aylward FO, Adams SM,etal.Mountain pine beetles colonizing historical and naïve host trees are associated with a bacterial community highly enriched in genes contributing to terpene metabolism[J].Appl.Environ.Microbiol., 2013, 79 (11): 3468-3475.
Behar A, Yuval B,Jurkevitch E.Gut bacterial communities in the Mediterranean fruit fly (Ceratitiscapitata) and their impact on host longevity [J].J.InsectPhysiol, 2008, 54 (9): 1377-1383.
Broderick NA,Raffa KF, Goodman RM,etal.Census of the bacterial community of the gypsy moth larval midgut by using culturing and culture-independent methods [J].Appl.Environ.Microbiol., 2004, 70 (1): 293-300.
Cai WZ.Insects common biological function and evolution [J].ChineseJournalofAppliedEntomology, 1990 , (1): 55-58.[彩万志.昆虫体内共生物的功能及进化[J].应用昆虫学报, 1990, (1): 55-58]
Cao LJ, Yang F, Tang SY,etal.Development of an artificial diet for three lepidopteran insects [J].ChineseJournalofAppliedEntomology, 2014, 51 (5):1376-1386.[曹利军,杨帆,唐思莹,等.适合三种鳞翅目昆虫的一种人工饲料配方[J].应用昆虫学报, 2014, 51 (5):1376-1386]
Desantis TZ, Hugenholtz P, Larsen N,etal.Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB [J].Appl.Environ.Microbiol., 2006, 72 (7): 5069-5072.
Dillon RJ,Charnley K.Mutualism between the desert locust Schistocerca gregaria and its gut microbiota [J].Res.Microbiol., 2002, 153 (8): 503-509.
Dillon RJ, Dillon VM.The gut bacteria of insects: nonpathogenic interactions [J].Annu.Rev.Entomol., 2004, 49 (1): 71-92.
Dillon RJ,Vennard CT, Charnley AK.Diversity of locust gut bacteria protects against pathogen invasion [J].Ecol.Lett., 2005, 8 (12): 1291-1298.
Dillon RJ,Vennard CT, Charnley AK.A Note: Gut bacteria produce components of a locust cohesion pheromone [J].J.Appl.Microbiol., 2002, 92 (4): 759-763.
Edgar RC.UPARSE: highly accurate OTU sequences from microbial amplicon reads [J].Nat.Methods, 2013, 10 (10): 996-998.
Engel P, Moran NA.The gut microbiota of insects-diversity in structure and function[J].FEMSMicrobiol.Rev., 2013,37(5): 699-735.
Eutick ML, O’Brien RW, Slaytor M.Bacteria from the gut of Australian termites[J].Appl.Environ.Microbiol., 1978, 35 (5): 823-828.
Fadrosh DW, Ma B, Gajer P,etal..An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform[J].Microbiome, 2014 , 2 (1): 1-7.
Firidin B, Bílgener BM, Yanar O,etal.The Effect of Nutritional Quality of Some Plant’s Leaf on the Feeding and Development ofHyphantriacunea(Drury) (Lepidoptera: Arctiidae) [J].Int.J.Nat.Eng.Sci., 2008, 2: 61-68.
Flores R, Shi J, Yu G,etal.Collection media and delayed freezing effects on microbial composition of human stool[J].Microbiome,2015,3 (1):1-11.
Frago E, Dicke M, Godfray HCJ.Insect symbionts as hidden players in insect-plant interactions[J].TrendsEcol.Evol., 2012, 27 (12):705-711.
Gibson CM, Hunter MS.Extraordinarily widespread and fantastically complex: Comparative biology of endosymbiotic bacterial and fungal mutualists of insects[J].Ecol.Lett., 2010, 13 (2):223-234.
Goodrich J,Dirienzi S, Poole A,etal.Conducting a microbiome study[J].Cell, 2014, 158 (2): 250-262.
Guo J.Diversity and Influencing Factors of Gut Microbiota in Honey bees[D].PhD Dissertation, Chinese Academy of Agricultural Sciences Dissertation, 2015 [郭军.蜜蜂肠道菌群多样性及其影响因素研究[D].中国农业科学院博士学位论文, 2015]
Haas BJ,Gevers D, Earl AM,etal.Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J].GenomeRes., 2011, 21 (3): 494-504.
Hayashi A, Aoyagi H, Yoshimura T,etal.Development of novel method for screening microorganisms using symbiotic association between insect (CoptotermesformosanusShiraki) and intestinal microorganisms[J].J.Biosci.Bioeng, 1978, 103 (4): 358-367.
Hu X.Gut associated microbiota diversity of the Chinese white pine beetle (Dendroctonusarmandi)and cellulolytic microbial community in its larval gut.PhD Dissertation[D], North West Agriculture and Forestry University , 2014[胡霞.华山松大小蠹肠道微生物群落多样性与幼虫肠道纤维素降解菌的研究[D].西北农林科技大学博士学位论文, 2014]
Huang SW.Molecular diversity ofbaeterial community in the gut ofHolotrichiaparallela(ColeoPtera: Scarabaeidae) [D].MSc Thesis.Hua Zhong Agricultural University, 2009.[黄胜威.暗黑鳃金龟肠道共生菌分子多态性研究[D].武汉:华中农业大学硕士学位论文, 2009]
Huang SW.Study on microbiota diversity and cellulolytic bacterial community in the hindgut ofHolotrichiaparallelalarvae (Coleoptera:Scarabaeidae) [D].PhD Dissertation,Huazhong Agricultural University, 2012.[黄胜威.暗黑鳃金龟幼虫肠道微生物分子多态性及纤维素降解菌多样性研究[D].武汉:华中农业大学博士学位论文, 2012]
Jin L, Wang JC, Wang HX,etal.Bacterial community in midguts ofEctropicobliquelarvae by PCR DGGE and 16S rRNA gene library analysis[J].JiangxiScience, 2013, 31( 6) : 759-763.[靳亮, 王金昌, 王洪秀, 等.16S rRNA 基因的PCR-DGGE 技术分析茶尺蠖幼虫肠道细菌种群结构及多样性[J].江西科学, 2013, 31( 6) : 759-763]
Johnston PR,Crickmore N.Gut bacteria are not required for the insecticidal activity of bacillus thuringiensis toward the tobacco Hornworm,Manducasexta[J].Appl.Environ.Microbiol., 2009, 75 (15): 5094-5099.
LiDp, Guo Mz, Xu Wt.Advances and applications on methodology of 16S rRNA sequencing in gut microbiota analysis[J].BiotechnologyBulletin, 2015, (2): 71-77.[李东萍, 郭明璋, 许文涛.16S rRNA测序技术在肠道微生物中的应用研究进展[J].生物技术通报, 2015, (2): 71-77]
Li JZ.Researchstatus ofHyphantriacunea(Drury)[J].ScientiaSilvaeSinicae, 2014, (14): 115-115.[李建州.美国白蛾的研究现状[J].林业科学, 2014, (14): 115-115]
Li Z, Han LZ, LiuYD,etal.Change in the diversity of bacterial community in larval midguts of the striped stem borer,Chilosuppressalis( Lepidoptera: Crambidae), after treatment withBacillusthuringiensisinsecticidal proteins[J].ActaEntomologicaSinica, 2016, 59(3): 292-300.[李振, 韩兰芝, 刘玉娣, 等.Bt杀虫蛋白处理后二化螟幼虫中肠细菌群落的变化[J].昆虫学报, 2016, 59(3): 292-300]
Liu L, Wang ZK, Yu HW,etal.Analysis of the bacterial diversity in intestines ofHepialusgonggaensis larvae[J].ActaMicrobiologicaSinica, 2008, 48(5): 616-622.[刘莉, 王中康, 俞和韦, 等.贡嘎蝠蛾幼虫肠道细菌多样性分析[J].微生物学报, 2008, 48(5) : 616-622]
Lu XM, Wang FW.Inhibition of silkwormEnterococcustoNosemabombycisoutside germination[J] .ScienceofSericulture, 2002, 28 (02): 126-128.[鲁兴萌, 汪方炜.家蚕肠球菌对微孢子虫体外发芽的抑制作用[J].蚕业科学, 2002, 28 (02): 126-128]
Magoc T, Salzberg SL.FLASH: Fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics, 2011, 27 (21): 2957-2963.
Martin JD,Mundt JO.Enterococci in insects[J].Appl.Microbiol., 1972, 24 (24): 575-580.
Mason CJ, Couture JJ,Raffa KF.Plant-associated bacteria degrade defense chemicals and reduce their adverse effects on an insect defoliator[J].Oecologia, 2014, 175 (3): 901-910.
Mead LJ,Khachatourians GG, Jones GA.Microbial ecology of the gut in laboratory stocks of the migratory grasshopper,Melanoplussanguinipes(Fab.) (Orthoptera: Acrididae) [J].Appl.Environ.Microbiol.,1988, 54 (5):1174-1181.
Moran NA.Symbiosis as an adaptive process and source of phenotypic complexity[J].Proc.Natl.Acad.Sci.USA, 2007, 1 (20): 8627-8633.
Morrison M, Pope PB, Denman SE,etal.Plant biomass degradation by gut microbiomes: more of the same or something new[J].Curr.Opin.Biotechnol., 2009, 20 (3): 358-363.
Nikoh N, Hosokawa T, Oshima K,etal.Reductive evolution of bacterial genome in insect gut environment [J].GenomeBiol.Evol., 2011, 3 (1): 702-714.
Segata N, Izard J, Waldron L,etal.Metagenomic biomarker discovery and explanation[J].GenomeBiol., 2011, 12 (6): 1-18.
Shang BX, Yang X, LiZY,etal.Research progress ofShewanella[J].FujianAgriculture, 2015, (7): 152-154[商宝娣, 杨星, 李正友, 等.希瓦氏菌的研究进展[J].福建农业, 2015, (7): 152-154]
Shinzato N, Muramatsu M, Matsui T,etal.Phylogenetic analysis of the gut bacterial microflora of the fungus-growing termiteOdontotermesformosanus[J].Biosci, 2007, 71 (4): 906-915.
Takatsuka J, Kunimi Y.Intestinal bacteria affect growth of Bacillus thuringiensis in larvae of the oriental tea tortrix,HomonamagnanimaDiakonoff (Lepidoptera: tortricidae) [J].J.Invertebr.Pathol.,2000, 76 (3): 222-226.
Wang Q,Garrity GM, Tiedje JM,etal.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Appl.Environ.Microbiol.,2007, 73 (16): 5261-5267.
Wang ZJ.Molecule Identification andAnalyse of the Symbiont Microorganism in Mealybug (PhenacoccussolenopsisTinsley) [D].MSc Thesis, Zhejiang Normal University, 2014.[王震杰.扶桑绵粉蚧共生微生物的分子鉴定及分析[D].浙江师范大学硕士学位论文, 2014]
Watanabe H,Tokuda G.Cellulolytic Systems in Insects[J].Annu.Rev.Entomol., 2010, 55 (1): 609-632.
Wen Z, Jiang YR, Huang L,etal.Analysis of aerobic bacterial population and screening of the celluloseproducing bacteria from larval intestine ofPhaleraassimilis[J].JournalofEnvironmentalEntomology, 2015, 37 (6): 1203-1212.[文竹, 姜义仁, 黄伶, 等.栎黄掌舟蛾幼虫肠道好氧菌群分析及产纤维素酶菌的筛选[J].环境昆虫学报, 2015, 37 (6): 1203-1212]
Xia XF.Organizational Diversity and Functional Characterization of Microbiota in the Midgut of Diamondback Moth,Plutellaxylostella( L.) [D] .PhD Dissertation, Fujian Agriculture and Forestry University, 2014.[夏晓峰.小菜蛾中肠微生物多样性及其功能研究[D].福建农林大学博士学位论文, 2014]
Xia XF, Zheng D,Zhong H,etal.DNA sequencing reveals the midgut microbiota of diamondback moth,Plutellaxylostella(L.) and a possible relationship with insecticide resistance[J].PLoSOne, 2013, 8 (7) : 1-8
Xiang H, Huang YP.Symbiosis between gut microbiota and insects[J].ChineseBulletinofEntomology, 2008, 45( 5) : 687-693.[相辉,黄勇平.肠道微生物与昆虫的共生关系[J].昆虫知识, 2008, 45( 5) : 687-693]
Xiang H, Wei GF,Jia SH ,etal.Microbial communities in the larval midgut of laboratory and field populations of cotton bollworm (Helicoverpaarmigera) [J].Can.J.Microbiol., 2006, 52 (11): 1085-1092.
Xiang YQ Comparative study of the composition and type of dominant intestinal microflora in silkworm reared with different forages[D].MSc Thesis, Southwest University, 2010.[向芸庆.不同饲料饲养家蚕其肠道微生态优势菌群的类型组成及差异性研究[D].西南大学硕士学位论文, 2010]
Xu G, Sun ZL, Hu XL,etal.Analysis on intestinal bacterial diversity in silkworm (Bombyxmori) based on 16S rRNA gene sequences [J].ScienceofSericulture, 2015, (4): 641-649.[许刚, 孙振丽, 胡小龙, 等.基于16S rRNA基因序列分析家蚕肠道细菌的多样性[J].蚕业科学, 2015, (4):641-649]
Yang H.Diversity of gut bacteria in larval of four lepidopteran insects[D].MSc Thesis, Nanjing Agricultural University, 2013.[杨焊.四种鳞翅目害虫肠道细菌多样性分析[D].南京农业大学硕士学位论文, 2012]
Yu CY.Fall webwormprevention and control strategies review[J].ForestPestandDiseaseSept,1993, (4): 35-37.[于长义.美国白蛾防治工作回顾及今后防治对策[J].中国森林病虫, 1993 (4): 35-37]
Yun JH,Roh SW, Whon TW,etal.Insect gut bacterial diversity determined by environmental habitat, diet, developmental stage, and phylogeny of host[J].Appl.Environ.Microbiol., 80 (17):5254-5264.
Zhang M, Yang P, Zhu JY,etal.Analysis of the bacterial diversity in the intestine of larvalProcecidocharesutilis( Diptera: Trypetidae) based on 16S rDNA gene sequence[J].ActaEntomologicaSinica, 2016, 59 (2):200-208.[张某, 杨璞, 朱家颖, 等.基于16S rDNA基因序列的泽兰实蝇幼虫肠道细菌多样性分析[J].昆虫学报, 2016, 59 (2): 200-208]
Zhang W, He ZB, Deng XP,etal.Variety and distribution of in testinal flora ofAprionagermari(Hope) larvae[J].JournalofSouthwestAgriculturalUniversity(NaturalScience), 2004, 26 (02): 169-172.[张伟, 何正波, 邓新平, 等.桑粒肩天牛幼虫肠道菌群的种类及分布[J].西南大学学报(自然科学版), 2004, 26 (2):169-172]
Zhou HB, Sun B, Wu HL ,etal.Research progress of insect gut microbial function and silkworm gut microbes[J].NorthSericulture, 2015, (4): 1-4.[周洪英, 孙波, 吴洪丽, 等.昆虫肠道微生物功能及家蚕肠道微生物研究进展[J].北方蚕业, 2015, (4): 1-4]
Zhuo XQ, Chen SQ, Yin YP,etal.Analysis of intestinal flora inHepialusgonggaensislarvae[J].ChongqingJournalofResearchonChineseDrugs, 2005, 27 (1): 26-29.[卓凤萍, 陈仕江, 殷幼平, 等.贡嘎蝠蛾幼虫肠道菌群的分析[J].重庆中草药研究, 2005, 27 (1): 26-29]
Zou CR, Wei GQ, Liu CL,etal.Analysis of bacterial community and the screening and identification of enzyme-producing bacteria in intestine ofAntheraeapernyi[J].ScientiaAgriculturaSinica, 2011, 44 (12): 2575-2581.[邹昌瑞, 魏国清, 刘朝良, 等.柞蚕肠道菌群分析及产酶菌的筛选与鉴定[J].中国农业科学, 2011, 44 (12): 2575-2581]
Analysis of the diversity and difference of intestinal bacteria in larvaeHyphantriacuneaDrury (Lepidoptera: Arctiidae) on different diets
WEI Dan-Feng,WANG Xiu-Ji, Yang Jin, Geng Yong-Xin,CHEN Min*
(College of Forestry, Beijing Forestry University,Beijing 100083,China)
To clarify the bacterial diversity and differences in the intestine of larvalHyphantriacuneaDrury (Lepidoptera: Arctiidae) fed on ifferent diets, the bacteria community structures, the predominant bacteria on each taxonomic level and the alpha diversity of the intestine bacteria of the fifth larvalHyphantriacuneaDrury (Lepidoptera: Arctiidae) fed on artificial diet,MorusalbaLinn andSalixbabylonicaLinn were analyzed based on 16S rDNA gene sequences which were obtained through Illumina HiSeq techniques .A total of 657 819 reads were obtained and clustered into 3 743 OTUs.These OTUs were annotated into 23 phyla, 60 classes, 90 orders, 143 families, 196 genera and 58 species.On and above Level of family except phyla, the dominant bacteria were same in samples fromMorusalbaandSalixbabylonicabut different from samples from artificial diet fed larvae.However, At genus level, the dominant genera of intestina bacteria inH.cunealarvae from artificial diet,MorusalbaandSalixbabylonicawereShewanella(12.81%),Staphylococcus(7.86%) andBacillus(5.24%), respectively.At species level,Shewanellaalgaehad high proportion in all samples, whileStaphylococcussciuriwas much higher in abundance in samples fromMorusalbaandSalixbabylonicathan in samples from artificial diet.228 OUTs was shared in all samples from different diets, while 145,160 and 138 OUTs were found unique in samples from artificial diet,MorusalbaandSalixbabylonica, respectively.The results indicate that the composition and proportion of intestinal bacteria communities were different inH.cunealarvae fed on various diets.The alpha diversity index showed that the bacterial community inH.cunealarvae had high richness and diversity.This study lays the foundation for further study on the function of intestinal bacteria and the adaptive mechanism of the host.
HyphantriacuneaDrury;intestinal bacteria;16S rDNA;diversity;difference
魏丹峰,王秀吉,杨 锦,等.取食不同食料的美国白蛾幼虫肠道细菌多样性及差异性研究[J].环境昆虫学报,2017,39(3):515-524.
国家自然科学基金项目(30970462);“十二五”农村领域国家科技计划“杨树分子育种与品种创制”(2011AA100201)
魏丹峰,男,1989年生,陕西渭南人,硕士研究生,研究方向为森林昆虫学,E-mail: 602855414@qq.com
*通讯作者Corresponding author, E-mail: minch@bjfu.edu.cn
Received: 2017-01-05;接受日期Accepted: 2017-04-05
Q968;S433
A
1674-0858(2017)03-0515-10

