粘质沙雷氏菌PS-1菌株对甜菜夜蛾幼虫中肠结构及消化酶活性的影响
赵晓峰,向亚林,凌 冰,许小霞,张茂新**
粘质沙雷氏菌PS-1菌株对甜菜夜蛾幼虫中肠结构及消化酶活性的影响
赵晓峰1,向亚林2*,凌 冰1,许小霞1,张茂新1**
(1.华南农业大学农学院,广州 510642;2.揭阳职业技术学院生物工程系,广东揭阳 522000)
粘质沙雷氏菌SerratiamarcescensPS-1菌株是从罹病黄曲条跳甲幼虫体内分离获得的病原菌,它对甜菜夜蛾Spodopteraexigua幼虫有显著的胃毒作用。为了明确PS-1菌株的杀虫机理,本文测定了甜菜夜蛾幼虫取食了含PS-1菌株的人工饲料后中肠蛋白酶和淀粉酶的活性,采用组织切片和透射电镜观察研究了甜菜夜蛾幼虫感染PS-1菌株后中肠肠壁细胞结构的变化。结果表明:甜菜夜蛾感染了PS-1菌株后,中肠蛋白酶和淀粉酶的比活力显著降低。对感染了PS-1菌株的甜菜夜蛾幼虫中肠的组织病理学研究发现,中肠整个围食膜被破坏消失;细胞明显伸长,变形;细胞间隙增大,细胞脱落。进一步的透射电镜观察发现中肠细胞的微绒毛脱落,内质网消失,细胞质空泡化。推测,粘质沙雷氏菌PS-1菌株对甜菜夜蛾幼虫的毒杀作用机制之一与消化酶活性抑制和中肠组织病变有关。
甜菜夜蛾;粘质沙雷氏菌PS-1菌株;胃毒作用;酶活性抑制;组织病变
甜菜夜蛾Spodopteraexigua(Lepidoptera:Noctuidae)是世界性的重要蔬菜害虫之一,长期以来使用化学杀虫剂对其进行防治,使其抗药性和耐药性逐渐增强(司升云等,2012),甚至对Bt制剂也产生了一定的抗性(苏宏华等,2012)。因此,迫切需要寻找新的生物源杀虫剂作为补充或替代药剂防治甜菜夜蛾。粘质沙雷氏菌Serratiamarcescens是常见的昆虫病原微生物,国内外的研究发现其对多种昆虫有杀虫活性(齐放军等,2004;徐红革和彭辉银,2004;尹鸿翔等,2004;金虹,2005;淘科,2006;Taoetal.,2006;Paranietal.,2011;Mohanetal.,2011;Ortegaestradaetal.,2012;杨琼等,2012;杨建云等,2015)。粘质沙雷氏菌由于其对甜菜夜蛾潜在的杀虫作用已经获得了一些关注。齐放军等(2004)和杨琼等(2012)分别报道了从罹病甜菜夜蛾虫体上分离到的粘质沙雷氏菌QL01、QL09和B30菌株对甜菜夜蛾的杀虫活性。粘质沙雷氏菌PS-1菌株是我们从罹病黄曲条跳甲幼虫体内分离获得的一种新的致病菌。研究表明,用含PS-1菌株的人工饲料饲喂甜菜夜蛾幼虫表现出较好的胃毒作用,部分存活试虫的生长发育也会受到明显抑制(杨建云等,2015)。但有关PS-1菌株的杀虫机理尚不清楚。本文报道了甜菜夜蛾幼虫取食了含PS-1菌株的人工饲料后,对其中肠蛋白酶和淀粉酶活性的影响,并采用组织切片和透射电镜观察法研究了甜菜夜蛾幼虫感染PS-1菌株后中肠肠壁细胞形态结构的变化。以探讨PS-1菌株对甜菜夜蛾的胃毒作用机理,为PS-1菌株的开发与利用提供科学依据。
1 材料与方法
1.1 试验材料
供试的粘质沙雷氏菌PS-1菌株来源于华南农业大学昆虫生态实验室。取该菌种于LB液体培养基中活化10 h后转接到新的LB液体培养基中培养20 h,离心后加无菌水制成菌悬液,使其在波长为600 nm时OD=1,此菌悬液浓度为1×109cfu/mL。用无菌水配制的浓度为1×109cfu/mL、1×107cfu/mL和1×105cfu/mL的菌悬液按人工饲料∶菌悬液为4∶1的比例配制浓度为2.5×108cfu/g、2.5×106cfu/g和 2.5×104cfu/g的含菌饲料。以人工饲料加无菌水(4∶1)作为对照组饲料。
供试甜菜夜蛾来自华南农业大学昆虫生态研究室,为人工饲料饲养7-8代的实验种群。饲养条件:温度为(25±2)℃、相对湿度为60%-65%和光照时间为14 L∶10 D。
1.2 试验方法
1.2.1 酶活测定
取饥饿24 h后的甜菜夜蛾4龄幼虫,用含PS-1菌株浓度为2.0×108cfu/g、2.0×106cfu/g和2.0×104cfu/g的人工饲料分别饲喂作为处理组;以饲喂正常人工饲料的幼虫作为对照组。每处理3次重复,每重复24头幼虫。取饲喂了3 d的处理组甜菜夜蛾活虫10头,在解剖镜下取中肠置于冰浴中的匀浆器内充分研磨,在1200 r/min、4℃条件下离心,取上清液在-20℃保存备用。处理组和对照组均重复3次。蛋白酶活性测定参照毕明娟等(2010)的酪蛋白水解比色法;淀粉酶活性测定参照潘科等(2010)的方法。经测定,蛋白质标准曲线为Y=0.0102 X+0.0050(R2=0.9912);酪氨酸标准曲线为Y=0.0381 X+0.0254(R2=0.9921);麦芽糖标准曲线为Y=2.3513 X-0.0175(R2=0.9984)。
1.2.2 石蜡切片
按照1.2.1的方法饲喂饥饿24 h后的甜菜夜蛾4龄幼虫。饲喂1 d、2 d和3 d后,分别取处理组和对照组活体幼虫的中肠各6条。用PBS(0.1 mol/l,PH=7.0)漂洗和卡诺氏(Carnoy)固定液固定18-24 h后,乙醇梯度脱水,二甲苯透明,石蜡包埋,切片(切片厚度4 μm),苏木精-伊红(H.E.)染色(郭郛和忻介六,1988;熊正燕等,2010)。切片完成后运用Nikon Eclipse Ti-SR型光学显微镜和Nikon DS-U3数码成像装置进行观察与摄片。
1.2.3 电镜观察
按1.2.1方法处理甜菜夜蛾幼虫3 d后,分别取处理组和对照组幼虫的中肠。用戊二醛固定,0.1 mol/L磷酸缓冲液(pH 7.0)漂洗,锇酸重固定,梯度乙醇脱水,Spurr树脂包埋,聚合;用Leica EMTRIM包埋修块机修成合适的大小和切面,再用Leica UCT超薄切片机进行修割切片,切片厚度为70-100 nm;用醋酸双氧铀溶液和柠檬酸铅溶液进行双重染色,晾干后放在FEI-Tecnai 12分析型透射电子显微镜下(加速电压为80 kv),观察并拍摄。
1.2.4 数据分析
实验数据的平均数据均以“平均数±标准误”表示,并用邓肯氏新复极差法(P<0.05)检验PS-1菌株不同浓度处理间的差异显著性(SAS 9.0)。
2 结果与分析
2.1 PS-1菌株对甜菜夜蛾幼虫肠道蛋白酶和淀粉酶活性的抑制作用
用含不同浓度PS-1菌株的人工饲料饲喂甜菜夜蛾4龄幼虫3 d后,甜菜夜蛾幼虫中肠的蛋白酶比活力明显降低(F=841.74,P<0.0001)(表1)。3个浓度(2.0×104cfu/g-2.0×108cfu/g)处理组的蛋白酶比活力比对照组降低了41.35%-44.42%。淀粉酶比活力也比对照组明显降低(F=254.62,P<0.0001),处理组的淀粉酶比活力比对照组降低了31.07%-31.59%。
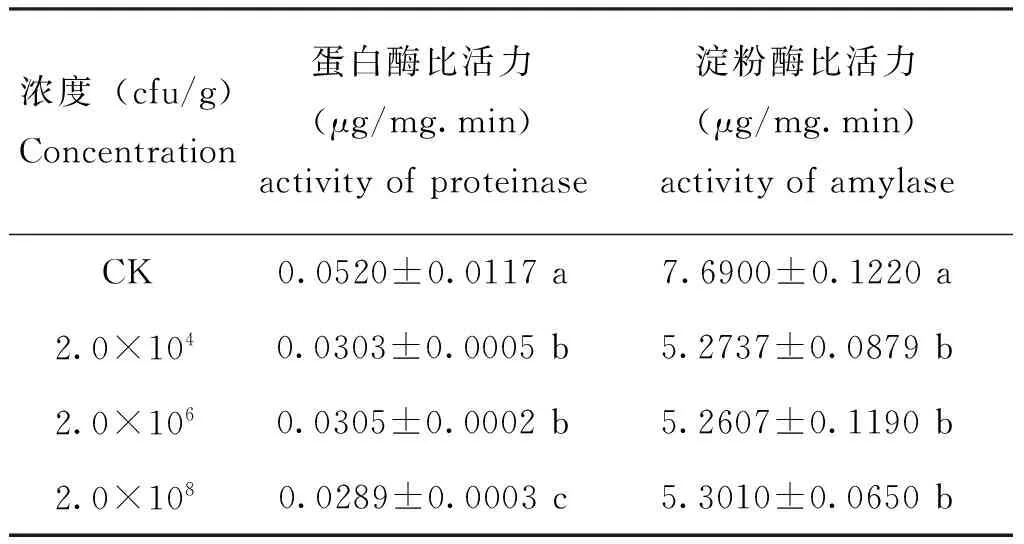
表1 PS-1菌株对甜菜夜蛾幼虫中肠消化酶活性的影响Table 1 Influences of Serratia marcescens PS-1 bacterial strain on the activity of midgut proteinase and amylase of Spodoptera exigua larvae
注:表中同列数据后字母不同者表示差异性显著(邓肯式新复极差法,P<0.05)。Note: Data in the table followed by different letters are significantly different (Duncan’s multiple range test,P<0.05).
2.2 PS-1菌株对甜菜夜蛾幼虫中肠组织形态学的影响
2.2.1 中肠组织切片观察结果
从对照组和处理组甜菜夜蛾4龄幼虫中肠组织切片图(图1)可以看出:对照组的甜菜夜蛾幼虫中肠肠壁细胞主要由柱状细胞和杯状细胞组成,细胞排列整齐紧密;围食膜清晰可见(图1:A)。取食PS-1菌株1 d的甜菜夜蛾幼虫中肠细胞排列较整齐,柱状细胞和杯状细胞均明显伸长,变形;柱状细胞顶端出现囊状突及其破裂后的分泌物,整个围食膜被破坏消失(图1:B);处理2 d,中肠肠壁细胞排列疏松混乱,很难辨别细胞形态,囊状突继续膨胀,有的破裂;部分细胞出现溶解,脱落;在肠壁细胞的基部出现大量的小型再生细胞,肠壁细胞开始加厚(图1:C)。处理3 d,肠壁细胞严重破坏,大量细胞脱落,连同细胞核和细胞质进入肠腔;肠壁再生细胞大量分裂,造成局部肠壁细胞向肠腔内外增生(图1:D)。
2.2.2 肠壁细胞超微结构的观察结果
通过观察比较对照和处理甜菜夜蛾幼虫中肠肠壁细胞的超微结构发现,对照组细胞核明显,细胞体完整;微绒毛排列紧密、整齐;线粒体、内质网和溶酶体清晰可见(图2:A-B)。甜菜夜蛾幼虫感染PS-1菌株3 d后,肠壁细胞的微绒毛稀疏,收缩变形,脱落,细胞间隙增大(图2:C-D);胞内出现大量空泡,溶酶体数量增多,内质网消失,线粒体膨胀变形(图2:D-F)。
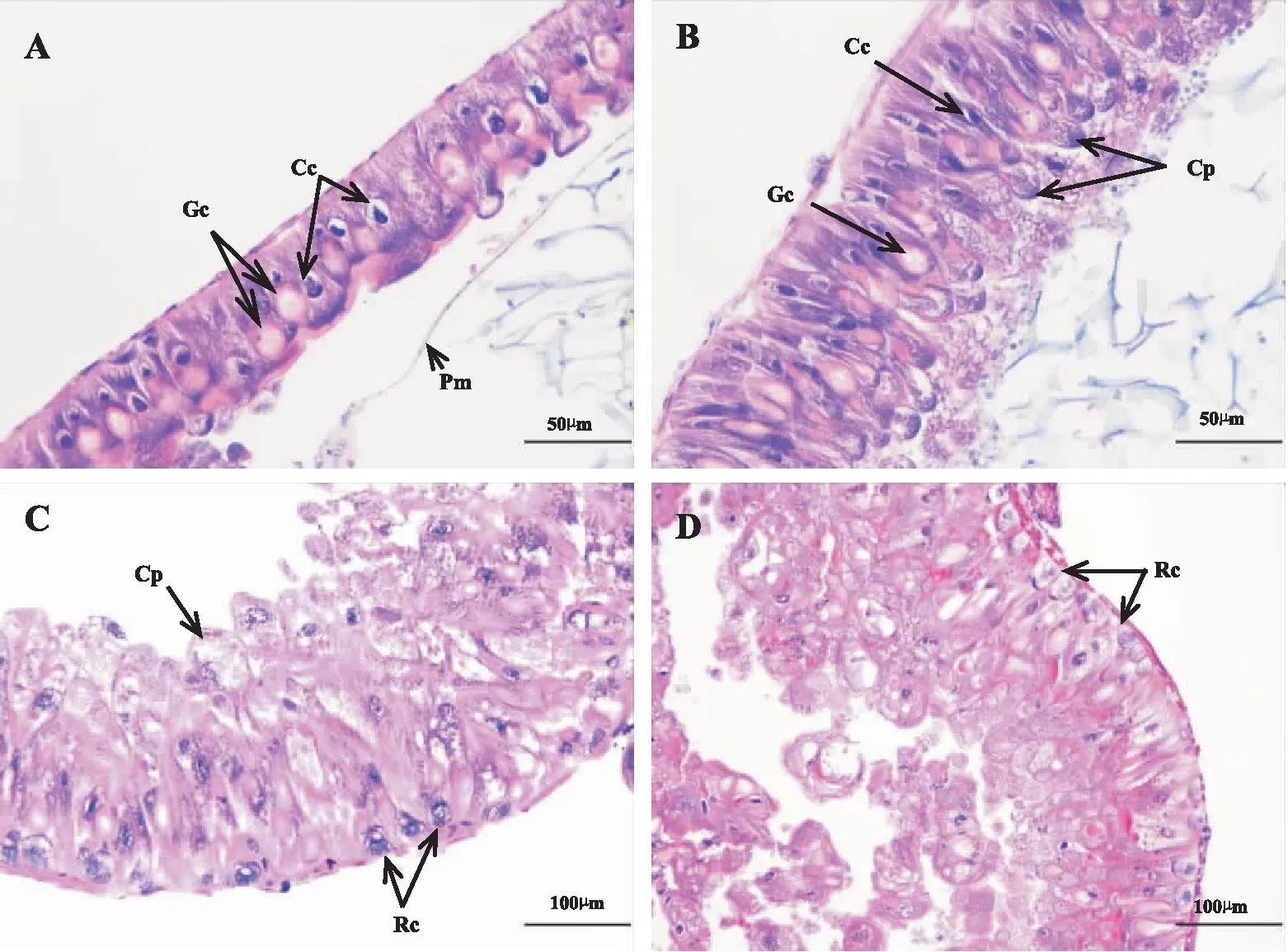
图1 感染粘质沙雷氏菌PS-1后甜菜夜蛾幼虫中肠肠壁细胞的变化(切片厚度4 μm)Fig.1 Changes in the midgut cells of Spodoptera exigua larvae after Serratia marcescens PS-1 bacterial strain infection (The section thickness was 4 μm)注:A-D,光学显微镜观察结果;A,对照中肠细胞;B,细胞混乱变形,囊状突破裂,围食膜消失;C,再生细胞生成;D,肠壁细胞脱落;Cc,柱状细胞;Gc,杯状细胞;Pm,围食膜;Cp,囊状突;Rc,再生细胞。Note: A-D, observed under light microscope; A, the control midgut cells; B, the cells elongated and deformed, cytoplasmic projections bursted, peritrophic membrane disappeared; C, the regenerative builded; D, midgut cell denuded; Cc, Columnar cell; Gc, Goblet cell; Pm, Peritrophic membrane; Cp, Cytoplasmic projections; Rc, Regenerative cell.
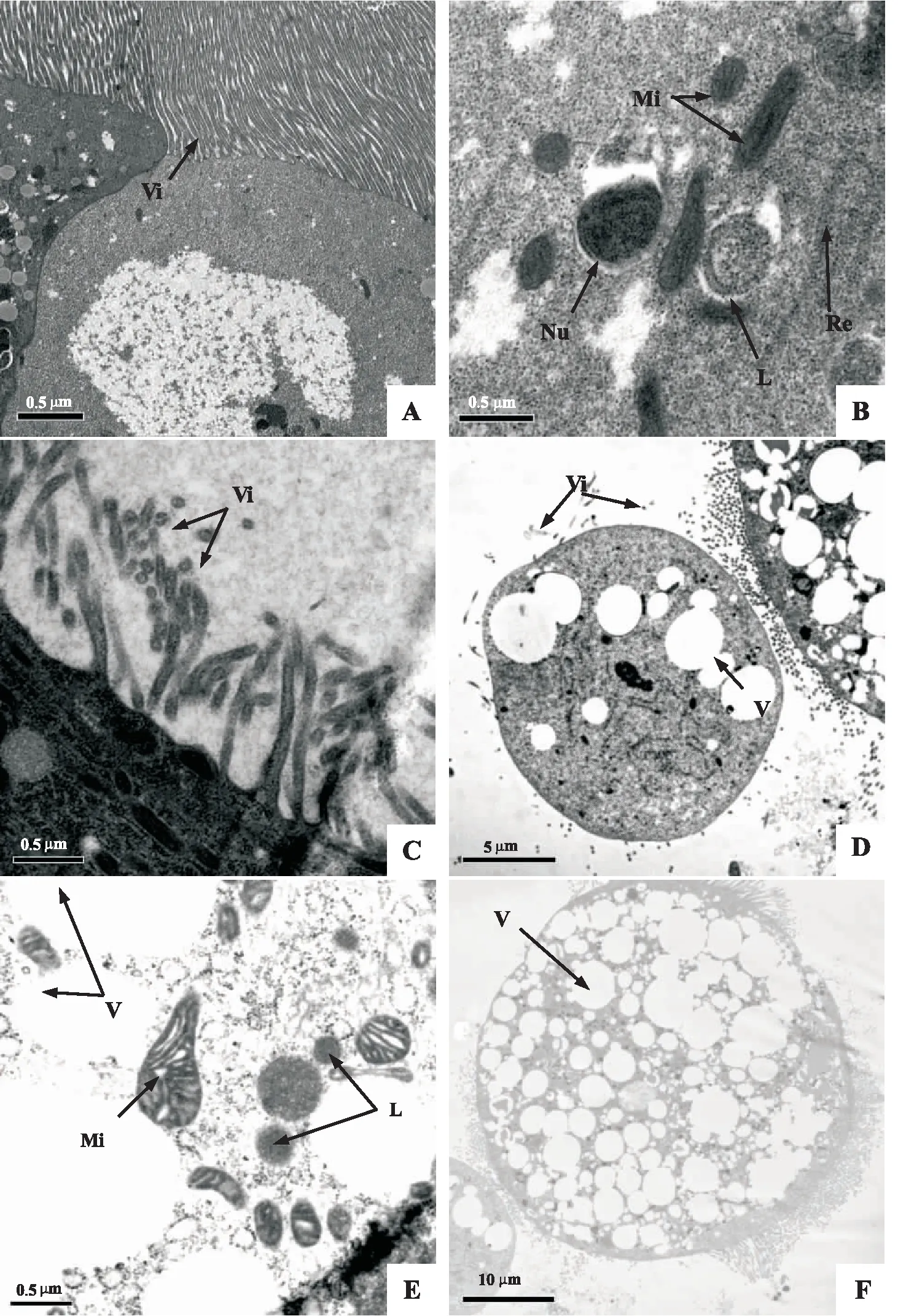
图2 感染PS-1菌株的甜菜夜蛾幼虫中肠细胞透射电镜图(切片厚度70-100 nm)Fig.2 TEM of midgut cells of Spodoptera exigua larvae after Serratia marcescens PS-1 bacterial strain infection (The section thickness was 70-100 nm)注:A-F,电子显微镜观察结果;A-B,对照细胞;C-F,PS-1菌株处理细胞;Vi,微绒毛;Nu,细胞核;Mi,线粒体;Re,内质网;L,溶酶体;V,空泡。Note: A-F, observed under electron microscope; A-B, the control cells; C-F, the treatment cells by PS-1; Vi, microvilli; Nu, nucleolus; Mi, mitochondria; Re, endoplasmic reticulum; L, lysosomes; V, vacuolation.
3 结论与讨论
昆虫中肠是分泌消化酶、消化食物和吸收养分的主要部位,消化酶活性的大小直接关系到昆虫对营养物质的消化吸收能力。本研究结果表明,感染PS-1菌株的甜菜夜蛾幼虫中肠蛋白酶和淀粉酶的比活力比对照明显降低。结果与Mohan等(2011)报道的棉铃虫幼虫取食了含有粘质沙雷氏菌SRM菌株的饲料后中肠蛋白酶活性显著降低相一致。金虹(2005)报道了粘质沙雷氏菌HR-3菌株处理蝗虫后,蝗虫肠道杯状细胞增多,细胞核浓缩,细胞层完全变性,细胞内空泡化严重,蝗虫肠道细胞严重破坏,最终导致细菌进入血腔增殖,患败血症死亡。PS-1菌株对甜菜夜蛾幼虫的病理学效应与以上报道相类似。同时,我们发现,感染了PS-1菌株1 d的甜菜夜蛾幼虫中肠的围食膜被破坏消失。围食膜作为中肠肠壁细胞与肠腔之间的一道有效屏障可以保护肠壁细胞免受粗糙食物颗粒磨损和微生物及其毒素的入侵(张严峻等,2000;彩万志等,2001;王荫长,2004;尹姣等,2009)。围食膜主要由蛋白质、糖和几丁质构成。其中,几丁质不仅含量较高,而且是围食膜骨架的主要成分,能强烈地亲和蛋白质而聚合成微纤维(Moskalyketal., 1995)。已有的研究证明粘质沙雷氏菌分泌的胞外蛋白质有几丁质酶、蛋白酶、核酸酶、磷脂酶、溶血素和脂肪酶等(Aucken and Pitt, 1998; Joetal., 2008; Kimetal., 2009)。几丁质酶能够破坏肠道围食膜的几丁质,从而破坏了围食膜的骨架结构,使得菌体容易进入昆虫体内,引起败血症而死亡(徐红革和彭辉银,2004;尹鸿翔等,2004)。Mohan等(2011)报道粘质沙雷氏菌SRM菌株具有克服昆虫宿主防御的能力和在整个肠道和血腔迅速增殖的能力。在感染了SRM菌株的棉铃虫4龄幼虫肠道和血淋巴中粘质沙雷氏菌是唯一存在的细菌,而且,在中肠中的数量明显高于前肠和后肠。Tao等(2006)从粘质沙雷氏菌菌株HR-3的培养液中分离纯化出一种新的杀虫蛋白—锌金属蛋白酶,其酶促活性测定的结果显示该杀虫蛋白拥有水解蛋白的活性。由此可以推断,甜菜夜蛾幼虫吞食了含有粘质沙雷氏菌PS-1菌株的饲料后,细菌在中肠内大量繁殖和分泌包括几丁质酶、金属蛋白酶等杀虫蛋白,使围食膜遭到破坏而消失;使作用于中肠肠壁细胞的细菌和毒素的数量增加、入侵机会增多,肠壁细胞伸长、变形,微绒毛脱落,细胞间隙增大,内质网消失,细胞质空泡化,最后导致大量细胞脱落。为了补偿消耗的细胞,肠壁基部的再生细胞提前快速分裂,打破了再生细胞固有的分裂周期,使局部细胞提前分裂而又缺乏分化,造成局部细胞层加厚(阎凤鸣等,1995)。遭到破坏的肠壁细胞不再具有分泌消化酶和吸收消化产物的功能,肠道内蛋白酶和淀粉酶的比活力降低,营养物质的利用率大大降低。从而引起甜菜夜蛾幼虫的死亡和抑制幼虫的生长发育。然而,是PS-1菌体直接作用于宿主中肠细胞,还是PS-1菌体的代谢产物引起的肠道细胞病变,还有待进一步研究。本研究进一步揭示了粘质沙雷氏菌PS-1菌株对甜菜夜蛾幼虫有显著的胃毒作用,初步探讨了PS-1菌株对甜菜夜蛾幼虫中肠组织病变是其引起甜菜夜蛾幼虫胃毒致死的作用机制之一。研究结果为甜菜夜蛾的生物防治提供了新思路和新途径,为粘质沙雷氏菌作为生物源杀虫剂的开发和利用提供了科学依据。
References)
Aucken HM, Pitt TL.Antibiotic resistance and putative virulence factors ofSerratiamarcescenswith respect to O and K serotypes [J].JournalofMedicalMicrobiology, 1998, 47 (12): 1105-1113.
Bi MJ, Xue M, Li QL,etal.Effects of feeding on tobacco plants preinfested byBemisiatabaci(Homoptera: Aleyrodidae) B-biotype on activities of protective enzymes and digestive enzymes inBemisiatabaciandMyzuspersicae(Homoptera: Aphididae) [J].ActaEntomologicaSinica, 2010, 53 (2): 139-146.[毕明娟, 薛明, 李庆亮,等.取食B型烟粉虱前侵染的烟草对B型烟粉虱和烟蚜体内保护酶和消化酶活性的影响[J].昆虫学报, 2010, 53 (2): 139-146]
Cai WZ, Pang XF, Hua BZ,etal.General Entomology [M].Beijing: China Agricultural University Press.2001, 108-109.[彩万志, 庞雄飞, 花保祯,等.普通昆虫学[M].北京: 中国农业大学出版社, 2001, 108-109]
Guo F, Xin JL.Experiment Technology of Entomology [M].Beijing: Science Press, 1988, 107-112.[郭郛, 忻介六.昆虫学实验技术[M].北京: 科学出版社, 1988, 107-112]
Jin H.Identification of A Pathogenic Strain of Locusts and Its Toxicity and Pathology [D].Chengdu: Sichuan University, 2005.[金虹.蝗虫病原菌的分离鉴定及其毒力病理研究[D].成都: 四川大学硕士论文, 2005]
Jo GH, Jung WJ, Kuk JH,etal.Screening of protease-producingSerratiamarcescensFS-3 and its application to deproteinization of crab shell waste for chitin extraction [J].CarbohydratePolymers, 2008, 74 (3): 504-508.
Kim Y, Kim K, Seo J,etal.Identification of an entomopathogenic bacterium,Serratiasp.ANU101, and its hemolytic activity [J].JournalofMicrobiologyandBiotechnology, 2009, 19 (3): 314-322.
Mohan M, Selvakumar G, Sushil SN,etal.Entomopathogenicity of endophyticSerratiamarcescensstrain SRM against larvae ofHelicoverpaarmigera(Noctuidae: Lepidoptera) [J].WorldJournalofMicrobiologyBiotechnology, 2011, 27 (11): 2545-2551.
Moskalyk LA, Jacobs LM.Comparative studies of the peritrophic matrix ofAnophekesgamblaeandAedesaegypti[J].JournalofCellularBiochemistry, 1995, S21A: 210.
Ortegaestrada MDJ, Rincóncastro MCD, Basurtoríos R,etal.Phoresis betweenSerratiamarcescensandSteinernemacarpocapase(Rhabditida: Steinernernematidae) during infection ofgalleriamellonella(Lepidoptera: Pyralidae) larvae [J].FloridaEntomologist, 2012, 95 (1): 120-127.
Pan K, Huang BQ, Hou XW,etal.The effect ofAlocasiamacrorrhizalectinon the amylase and protease of soybean aphidAphiscraccivora[J].GuangdongAgriculturalSciences, 2010, 37 (10): 103-105.[潘科, 黄炳球, 候学文.海芋凝集素对豆芽淀粉酶、蛋白酶活性的影响[J].广州农业科学, 2010, 37 (10): 103-105]
Parani K, Shetty GP, Saha BK.Isolation ofSerratiamarcescensSR1 as a source of chitinase having potentiality of using as a biocontrol agent [J].IndianJournalofMicrobiology, 2011, 51 (3): 247-250.
Qi FJ, Liu Y, Ji ZY.Isolation and identification of a new pathogenic bacterium strain forSpodopteraexiguaHünber [J].ActaPhytophylacicaSinica, 2004, 31 (2): 223-224.[齐放军, 刘缨, 季志英.一种新的甜菜夜蛾致病菌的分离和鉴定[J].植物保护学报, 2004, 31 (2): 223-224]
Si SY, Zhou LL, Wang SL,etal.Progress in research on prevention and control of beet armyworm,Spodopteraexiguain China [J].ChineseJournalofAppliedEntomology, 2012, 49 (6): 1432-1438.[司升云, 周利琳, 王少丽, 等.甜菜夜蛾防控技术研究与示范[J].应用昆虫学报, 2012, 49 (6): 1432-1438]
Su HH, Song B, Li L,etal.Resistance ofSpodopteraexiguato insecticides and mechanisms of resistance [J].ChineseJournalofAppliedEntomology, 2012, 49 (6): 1659-1663.[苏宏华, 宋彬, 李丽, 等.甜菜夜蛾的抗性及抗性机理研究进展[J].应用昆虫学报, 2012, 49 (6): 1659-1663]
Tao K.Studies onPurification, Gene Cloning and Expression of Insecticidal Protein [D].Chengdu: Sichuan University, 2006.[陶科.粘质沙雷氏菌杀虫蛋白的分离纯化及其基因的克隆与表达研究[D].成都: 四川大学博士论文, 2006]
Tao K, Long ZF, Liu K,etal.Purification and properties of a novel insecticidal protein from the locust pathogenSerratiamarcescensHR-3 [J].CurrentMicrobiology, 2006, 52 (1): 45-49.
Wang YC.Insect Physiology [M].Beijing: China Agriculture Press.2004, 52-53.[王荫长.昆虫生理学[M].北京: 中国农业出版社, 2004, 52-53]
Xiong ZY, Zhou Q, Yu DC.Technique of Paraffin Slices of Insect Intestine [A].In: Wen LZ, ed.Insect Research in Central China (Vol.VI) [M].Changsha: Central South University Press, 2010, 95-98.[熊正燕, 周琼, 余定椿.昆虫肠组织石蜡切片的制作[A].见: 文礼章主编, 华中昆虫研究 (第6卷) [M].长沙: 中南大学出版社, 2010, 95-98 ]
Xu HG, Peng HY.Delayed effects of chitinase ofSerratiamarcescensisolate S3 onHelicoverpaarmigerain different instar [J].ActaMicrobiologicaSinica, 2004, 44 (1): 88-92.[徐红革, 彭辉银.沙雷氏杆菌S3菌株产几丁质酶对棉铃虫不同虫龄幼虫的后致死作用[J].微生物学报, 2004, 44 (1): 88-92]
Yan FM, Xu CR, Li SG,etal.Effects of DIMBOA on the midgut of Asian corn borer,Ostriniafurnacalis(Guenée) [J].ActaEntomologicaSinica, 1995, 38 (3): 380-382.[阎凤鸣, 许崇任, 李松岗,等.丁布对亚洲玉米螟幼虫中肠组织的影响效果[J].昆虫学报, 1995, 38 (3): 380-382]
Yang JY, Cao X, Ji CY,etal.Inhibitory effects ofSerratiamarcescensisolate PS-1 on the increase of experimental population ofSpodopteraexigua[J].ChineseJournalofBiologicalControl, 2015, 31 (4): 501-507.[杨建云, 曹溪, 纪春艳, 等.粘质沙雷氏菌菌株PS-1对甜菜夜蛾实验种群增长的抑制作用[J].中国生物防治学报, 2015, 31 (4): 501-507]
Yang Q, Zhou Y, Han GJ,etal.Isolation, identification and active ingredient analysis of two pathogenic bacterial strains isolated fromSpodopteraexigua[J].JiangsuJournalofAgriculturalSciences, 2012, 28 (6): 1267-1271.[杨琼, 周宇, 韩光杰, 等.两种甜菜夜蛾致病菌的分离、鉴定及杀虫成分初步分析[J].江苏农业学报, 2012, 28 (6): 1267-1271]
Yin HX, Zhang J, Hou RT,etal.Isolation and identification of a chitinase-producing bacterium and its synergistic effect on locust biocontrol [J].Plantprotection, 2004, 30 (2): 37-41.[尹鸿翔, 张杰, 侯若彤, 等.一株几丁质酶产生菌的分离鉴定及其灭蝗增效作用[J].植物保护, 2004, 30 (2): 37-41]
Yin J, Guo W, Li KB,etal.Effect of fluorescent brightener 28 (M2R) on peritrophic membrane ofLoxostegesticticalis(Lepidoptera: Pyralidae) and its synergistic effect on Bt virulence [J].ActaEntomologicaSinica, 2009, 52 (7): 763-768.[尹姣, 郭巍, 李克斌, 等.光增白剂M2R对草地螟中肠围食膜的影响及对Bt毒力的增效作用[J].昆虫学报, 2009, 52 (7): 763-768]
Zhang YJ, Tan J, Lin YQ.The effects on peritrophic membrane ofHelicoverpaarmigeratreated by low temperature and chitinase [J].ChineseJournalofBiologicalControl, 2000, 16 (4): 152-155.[张严峻, 谭军, 林玉清.低温和几丁质酶处理对棉铃虫围食膜的影响[J].中国生物防治学报, 2000, 16 (4): 152-155]
Effects ofSerratiamarcescensPS-1 bacterial strain on structure of the midgut and digestive enzyme activities ofSpodopteraexigua(Hünber) larvae
ZHAO Xiao-Feng1, XIANG Ya-Lin2*, LING Bing1, XU Xiao-Xia1, ZHANG Mao-Xin1**
(1.College of Agriculture, South China Agricultural University, Guangzhou 510642, China; 2.Department of Bioengineering, Jieyang Vocational & Technical College, Jieyang 522000, Guangdong Province, China)
SerratiamarcescensPS-1 bacterial strain with high infectivity was isolated from the natural death larvae ofPhyllotretastriolata.It has high effect of stomach toxicity against theSpodopteraexigua(Hünber) larvae.In order to define the insecticidal mechanism, we measured the effects ofS.marcescensoral infection on the activity of proteinase and amylase, and the ultrastructure of the midgut ofS.exigua.The results showed that the activities of midgut proteinase and amylase were significantly decreased after PS-1 infection.According to the histopathologic data, we found that the peritrophic membrane structure of infected larvae was seriously damaged.Intestinal epithelial cells were massively dead and compensatory proliferation.Furthermore, the infected midgut epithelial cell displays translucent vacuoles evocative of cellular stress.The results indicate thatS.marcescenskill the larvae ofS.exiguaby inhibition of digestive enzyme and the destruction of the midgut.
Spodopteraexigua;SerratiamarcescensPS-1; stomach toxicity; inhibition on enzyme activity; pathological changes
赵晓峰,向亚林,凌冰,等.粘质沙雷氏菌PS-1菌株对甜菜夜蛾幼虫中肠结构及消化酶活性的影响[J].环境昆虫学报,2017,39(3):533-538.
广东省科技计划项目(2013B090700009-03,2014A020208106)
赵晓峰,男,硕士研究生,研究方向为昆虫生态学,E-mail:xiaofengzhao_ok@163.com;*共同第一作者, E-mail: alinclimb@163.com
**通信作者Author for correspondence, E-mail: mxzhang@scau.edu.cn
Received: 2016-12-29; 接受日期Accepted: 2017-05-10
S433.5;Q935
A
1674-0858(2017)03-0533-06

