自发性糖尿病小鼠肾小球细胞Nampt和骨形态发生蛋白7的表达及烟酰胺单核苷酸在高糖条件下对大鼠肾小球系膜HBZY-1细胞纤维化的影响
陈叶,蔡聪捷,韦日明,乔伟,胡婷婷,王平,冯乐平
(桂林医学院1.公共卫生学院,2.生物技术学院,3.药学院,广西桂林541004)
自发性糖尿病小鼠肾小球细胞Nampt和骨形态发生蛋白7的表达及烟酰胺单核苷酸在高糖条件下对大鼠肾小球系膜HBZY-1细胞纤维化的影响
陈叶1,蔡聪捷1,韦日明2,乔伟3,胡婷婷2,王平1,冯乐平1
(桂林医学院1.公共卫生学院,2.生物技术学院,3.药学院,广西桂林541004)
目的 探讨糖尿病肾小球细胞烟酰胺磷酸核糖转移酶(Nampt)与骨形态发生蛋白7(BMP7)表达的关系及烟酰胺单核苷酸(NMN)缓解糖尿病肾小球细胞炎症纤维化的作用机制。方法①动物实验:C57/ BL6自发性糖尿病小鼠和C57/BL6野生型小鼠,均采取普通饲料喂养,当自发性糖尿病小鼠血糖>(34.2± 1.9)mmol·L-1并出现明显肾组织损伤时,取肾组织进行病理切片,免疫共聚焦法检测肾小球细胞Nampt、核转录因子κB p65(NF-κB p65)、沉默调节蛋白1(SIRT1)和BMP7的表达。②细胞实验:葡萄糖200 mmol·L-1培养大鼠肾小球系膜HBZY-1细胞,在不同时间(24,48和72 h)以及不同浓度NMN(50,100和200 μmol·L-1)处理24 h时后,免疫印迹法检测Nampt和BMP7的表达;葡萄糖200 mmol·L-1处理HBZY-1细胞96 h,免疫荧光法检测NF-κB p65和α-平滑肌肌动蛋白(α-SMA)的表达;应用NMN 100 μmol·L-1和Nampt特异抑制剂FK866 10 μmol·L-1作用HBZY-1细胞24 h后,免疫印迹法检测HBZY-1细胞Nampt,BMP7和NF-κB p65表达。结果 ①动物实验:自发性糖尿病小鼠肾小球明显萎缩,肾小球细胞Nampt和NF-κB p65的荧光强度比野生型小鼠明显升高(P<0.05),而BMP7和SIRT1的荧光强度显著降低(P<0.01)。②细胞实验:Western蛋白印迹检测显示,葡萄糖200 mmol·L-1培养48和72 h,HBZY-1细胞Nampt表达增加(P<0.01),BMP7表达下降(P<0.01,P<0.05)。葡萄糖200 mmol·L-1条件下加NMN 50,100和200 μmol·L-1作用24 h,各组BMP7表达均增加(P<0.01);免疫荧光结果 显示,与细胞对照组比较,葡萄糖200 mmol·L-1处理HBZY-1细胞,NF-κB p65和α-SMA的荧光强度升高(P<0.01);NMN干预后,与葡萄糖200 mmol·L-1处理组比,Nampt和NF-κB p65表达降低(P<0.01),BMP7表达增加(P<0.01);加FK866后,Nampt表达降低(P<0.01),NF-κB p65表达下降,BMP7表达虽然有上升趋势,但其表达增高没有NMN组明显。结论严重糖尿病状态下,通过抑制内源性Nampt过表达能够上调BMP7,从而缓解肾小球细胞炎症纤维化作用,NMN可能通过干预Nampt影响细胞BMP7表达。
糖尿病性肾病;肾小球纤维化;烟酰胺磷酸核糖转移酶;p65;沉默调节蛋白1;骨形态发生蛋白7
DOl:10.3867/j.issn.1000-3002.2017.06.009
烟酰胺磷酸核糖转移酶(nicotinamide phosphoribosyl transferases,Nampt)又称内脂素(visfatin),是一种前B细胞克隆增强因子,在机体多种组织细胞内,Nampt能够同时作用于依赖NAD+的组蛋白去乙酰化酶(sirtuin type 1,SIRT1)和核因子κB(nuclear factor-kappa B,NF-κB)两种信号通路[1-3]。然而,在糖尿病肾病肾小球细胞内,Nampt过度表达可以激活多种促炎症纤维化因子,但机制尚未阐明。骨形态发生蛋白7(bone morphogenetic protein 7,BMP7)是转化生长因子β(transforming growth factor-β,TGF-β)超家族中成员之一,在成年动物肾组织高表达,参与不同细胞的生长、分化、趋化和凋亡[4]。研究表明,BMP7具有抗肾组织纤维化作用,作为纤维化负性调节因子,BMP7能够与TGF-β1相互拮抗。增加BMP7表达能够促进细胞外基质(extracellular matrix,ECM)降解,减少多种促炎症因子,对肾纤维化具有预防和治疗作用[5-6]。糖尿病肾病发病早期主要累及肾小球[7-8]。我们前期研究发现,在糖尿病小鼠肾小球细胞内源性Nampt过度表达时,BMP7表达明显减少。由此推测,在肾小球细胞内,Nampt可能与BMP7的表达存在某种内在联系。本研究应用免疫共聚焦、免疫荧光和Western蛋白印迹技术分别对严重糖尿病小鼠肾小球细胞和高糖氧化应激状态下离体细胞探讨Nampt和BMP7表达的相互关系,同时对烟酰胺单核苷酸(nicotinamide mononucleotide,NMN)在DN纤维化中的作用进行探讨。
1 材料与方法
1.1 试剂和主要仪器
含葡萄糖0.56 mmol·L-1的MEM培养液(美国Gibco公司);10%胎牛血清(美国Gemini公司);胰蛋白酶(工作液浓度0.25%)及青霉素和链霉素(终浓度分别为100 kU·L-1和100 kg·L-1)(中国Solarbio公司);NMN(美国Sigma公司);FK866(中国APExBIO公司);4′,6-二脒基-2-苯基吲哚(DAPI)(中国捷世康公司);兔抗小鼠Nampt和BMP7单抗(美国Bioword公司);SIRT1和NF-κB p65单抗(英国Abcam公司);兔抗大鼠Nampt和α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单抗(美国Santa公司);抗大鼠BMP7单抗(美国Bioword公司)和NF-κB p65单抗(英国Abcam公司);FITC标记的羊抗兔多抗和Cy3标记的羊抗兔多抗(美国LIFE公司)。GT-1640血糖检测仪(日本ARKRAY Inc公司);Cobas111全自动生化分析仪(美国Roche公司);LSM700激光共聚焦扫描显微镜(德国Zeiss公司);Mini-PROTEAN 3 CELL 165-3301电泳系统和小型垂直电泳转印系统(美国Bio-Rad公司)。
1.2 动物、细胞和分组
1.2.1 实验动物
C57/LB6胰岛素基因突变型糖尿病模型小鼠[9](美国密歇根大学糖尿病实验中心提供),雄性,体质量25~30 g,该小鼠作为自发糖尿病实验组,以野生型C57/LB6小鼠为对照组。全部动物实验程序符合密歇根大学糖尿病实验中心的伦理委员会标准。两组小鼠均采取普通饲料喂养,经血糖测定和全自动生化分析仪分析,确定实验组小鼠血糖≥(34.2±1.9)mmol·L-1和出现明显血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,Scr)异常时,乙醚麻醉小鼠,脊椎脱臼处死,取肾组织进行病理分析。
1.2.2 细胞处理和分组
用含葡萄糖5.6 mmol·L-1的DMEM培养基培养大鼠肾小球系膜HBZY-1细胞(购自中国医学科学院基础医学研究所),将细胞置于含5%CO2,37℃培养箱中适应性培养至对数生长期,用0.25%胰蛋白酶进行消化,收集细胞,按每孔1×106细胞移至35 cm培养皿中,分组如下:①葡萄糖200 mmol·L-1培养HBZY-1细胞,在不同时间(0,24,48和72 h)以及不同浓度NMN(0,50,100和200 μmol·L-1)处理24 h时后,免疫印迹法检测Nampt和BMP7的表达;②葡萄糖200 mmol·L-1处理HBZY-1细胞96 h,免疫荧光法检测NF-κB p65和α-SMA的表达;③正常对照组(含葡萄糖5.6 mmol·L-1的DMEM培养基)、Nampt特异性抑制剂(FK866)10 μmol·L-1组、NMN 100 μmol·L-1组、葡萄糖200 mmol·L-1组、葡萄糖200 mmol·L-1+FK866组、葡萄糖200 mmol·L-1+ NMN组和葡萄糖200 mmol·L-1+FK866+NMN组;于直径35 cm培养皿中,每组5复孔。细胞干预至第5天,分别加入FK866(终浓度10 μmol·L-1)和NMN(终浓度100 μmol·L-1)继续培养24 h,收集细胞,蛋白免疫印迹法分别检测FK866和NMN对细胞Nampt,NF-κB p65和BMP7表达的影响。
1.3 全自动生化分析仪检测小鼠血糖、尿素氮和血清肌酐水平
定期小鼠尾静脉采血,应用血糖检测仪测定血糖;应用全自动生化分析仪检测BUN和Scr水平。
1.4 HE染色检测小鼠肾小球组织病理变化
结合1.3结果 ,待出现明显肾损伤后,取肾组织进行石蜡包埋切片,HE染色,普通光镜下观察肾组织病理变化。
1.5 免疫共聚焦检测肾小球细胞Nampt,BMP7,NF-κB p65和SlRT1表达
4%多聚甲醛固定肾组织,脱水后石蜡包埋并切片,组织切片经脱蜡和乙醇梯度脱水,枸橼酸微波修复后,加待检蛋白一抗:抗Nampt(1∶500),BMP7(1∶1000),NF-κB p65(1∶1000)和SIRT1(1∶400)单抗进行孵育,4℃冰箱静置过夜,加入相应荧光标记二抗(1∶1000),37℃避光孵育1 h;用PBS冲洗3次,DAPI避光染色5 min,N-丙基没食子酸盐(N-propyl gallate,NPG)(抗荧光淬灭剂)处理后树脂胶封片,共聚焦显微镜技术检测肾小球细胞质和细胞核内待测蛋白的表达。绿色荧光显示肾小球细胞内Nampt表达,红色荧光分别显示肾小球细胞内BMP7,NF-κB p65和SIRT1的表达,用Image J2×软件计算10个视野单位面积平均荧光强度表示蛋白表达水平。
1.6 Western蛋白印迹法检测HBZY-1细胞Nampt,NF-κ B p65和BMP7蛋白表达
将1×106细胞移至直径35 cm培养皿中,葡萄糖200 mmol·L-1培养HBZY-1细胞24,48和72 h后,Western蛋白印迹法检测细胞Nampt和BMP7表达;每孔1×106细胞移至35 cm培养皿中,葡萄糖200 mmol·L-1培养HBZY-1细胞72 h后,为鉴别Nampt是否对BMP7表达发挥作用,在葡萄糖200 mmol·L-1培养的细胞中加入NMN 0,50,100和200 μmol·L-1,继续培养细胞24 h后,Western蛋白印迹法检测NMN对细胞BMP7表达的影响。
为确定Nampt对BMP7的调控作用,应用Nampt特异性抑制剂FK866 10 μmol·L-1作用后检测BMP7的表达。于直径35 cm培养皿中1 mL的1×106细胞,每组5复孔。细胞应用葡萄糖200 mmol·L-1连续干预,每天换液,至第5天时,分别加入FK866 10 μmol·L-1,NMN 100 μmol·L-1和FK866 10 μmol·L-1+NMN 100 μmol·L-1,继续培养24 h收集细胞,Western蛋白印迹法检测FK866和NMN对Nampt,NF-κB p65和BMP7表达的影响。取出培养细胞加入细胞裂解液于Eppendorf离心管中,超声波粉碎仪裂解蛋白,经4℃低温12 000×g,15 min离心取上清液;蛋白定量后进行SDS-PAGE电泳,电压120 V电泳,PVDF半干式转膜(电压150V,60 min),封闭,加入待检蛋白一抗〔Nampt(1∶500),NF-κB p65(1∶200)和BMP7(1∶1000)〕,4℃孵育过夜,次日加入相应二抗(1∶2000)后孵育1 h,将PVDF膜置于凝胶成像系统中获取相应蛋白条带的积分吸光度(integrated absorbance,IA)值,蛋白相对表达水平用IA目标蛋白/IAβ肌动蛋白比值表示。
1.7 免疫荧光检测HBZY-1细胞NF-κ B p65和α-SMA蛋白的表达
按每孔1 mL含1×106细胞接种于置盖玻片的6孔细胞培养板中培养96 h。取出盖玻片,加待检蛋白一抗〔NF-κB p65(1∶500)和α-SMA(1∶400)〕4℃冰箱孵育过夜,加入相应荧光标记二抗(1∶1000),于37℃避光孵育1 h,DAPI复染5 min。NF-κB p65和α-SMA分别使用488 nm和558 nm激发光检测,用Image J2×软件计算10个视野单位面积平均荧光强度表示蛋白表达水平。
1.8 统计学分析
实验结果 数据均采用x±s表示,应用SPSS17.0软件进行统计分析,采用t检验进行两组间均数比较,多组均数比较采用方差分析,P<0.05认为差异有统计学意义。
2 结果
2.1自发性糖尿病C57/BL6小鼠发病后血糖、BUN和Scr水平变化
与野生型C57/BL6小鼠比较,12周后自发性糖尿病C57/BL6小鼠的血糖浓度达(34.2±1.9)mmol·L-1,血中非蛋白氮的代表型产物BUN和Scr明显升高(P<0.01)(表1)。提示该组小鼠肾组织出现了明显的病理改变。

Tab.1Concentration of blood glucose,blood urea nitrogen(BUN)and serum creatinin(SCR)in C57/BL6 spontaneous diabetic mice
2.2 自发性糖尿病C57/BL6小鼠肾小球组织病理改变
当自发性糖尿病小鼠血糖达(34.2±1.9)mmol·L-1时,取肾组织观察病理变化。HE染色结果 显示,与野生型C57/BL6小鼠比较,自发性糖尿病C57/BL6小鼠肾小球萎缩,肾小管腔变狭窄,细胞出现纤维性变趋势(图1)。提示糖尿病小鼠已出现肾实质病变。
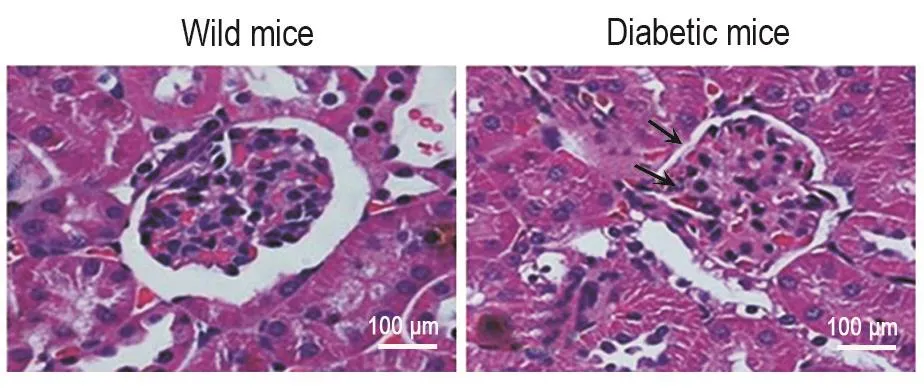
Fig.1 Pathologyical changes of glomeruli in spontaneous diabetic mice detected by HE stainning.The arrows indicate inflammatory cells infiltration and cell arrangement disorder.
2.3 自发性糖尿病小鼠肾小球细胞Nampt和BMP7的表达
免疫共聚焦检测结果 (图2)显示,与野生型小鼠相比,自发性糖尿病小鼠肾小球内细胞致密,体积变小,肾实质细胞的细胞质内Nampt荧光强度增加(P<0.05),BMP7表达减少(P<0.01),提示细胞内Nampt过度表达。
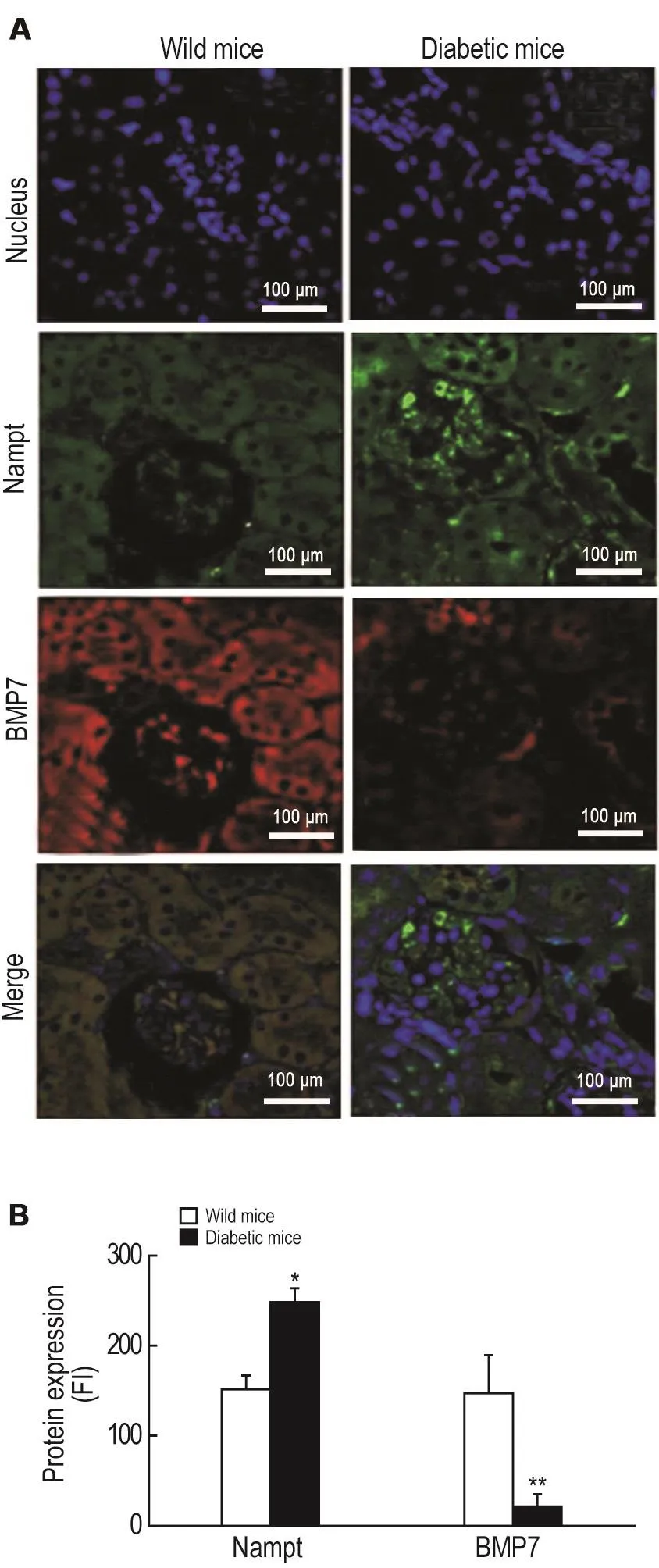
Fig.2Expression of nicotinamide phosphoribosyl transferases(Nampt)and bone morphogenetic protein 7(BMP7)in renal parenchyma cells of diabetic C57/LB6 mouse by immunefocused fluorescence.Green:Nampt;Red:BMP7;Blue:Nuclei.FI:fluorescence intensity.B was the semi-quantitative result of A.x±s,n=3.*P<0.05,**P<0.01, compared with wild mice group.
2.4 自发性糖尿病小鼠肾小球细胞Nampt和NF-κ B p65的表达
免疫共聚焦结果 (图3)显示,与野生型小鼠比较,自发性糖尿病小鼠肾小球内源性Nampt(绿色)和NF-κB p65的荧光(红色)强度明显增加(P<0.05)。
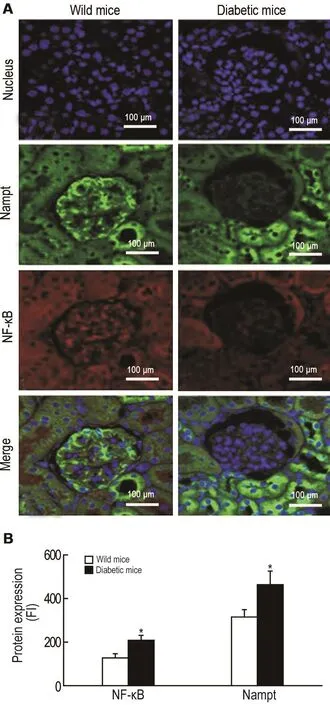
Fig.3 Expression of Nampt and NF-κ B p65 in renal parenchyma cells of diabetic C57/BL6 mice by immunefocused fluorescence detection.A:the expression and location of Nampt(green fluorescence),NF-κB p65(red fluorescence)and nuclei(blue fluorescence)in glomerular cells;B was the semi-quantitative result of A.x±s.n=3.*P<0.05,compared with wild mice group.
2.5 自发性糖尿病小鼠肾小球细胞Nampt和SlRT1表达
免疫共聚焦结果 显示,与野生型小鼠相比,自发性糖尿病小鼠肾小球细胞Nampt的荧光强度增加(P<0.05),SIRT1的荧光(红色)强度减弱(P<0.01)(图4)。提示自发性糖尿病小鼠肾小球细胞质内Nampt过度表达。
2.6 葡萄糖200 mmol·L-1对HBZY-1细胞Nampt和BMP7表达的影响
Western蛋白印迹检测结果 (图5)显示,葡萄糖200 mmol·L-1对HBZY-1细胞进行氧化应激48和72 h时,细胞内源性Nampt表达较对照组均明显增加(P<0.01);BMP7明显下降(P<0.05,P<0.01)。
2.7 NMN对高糖致氧化应激HBZY-1细胞BMP7表达的影响
Western蛋白印迹检测结果 (图6)显示,葡萄糖200 mmol·L-1处理72 h后,加NMN 50,100和200 μmol·L-1处理24 h,与对照组(NMN 0 μmol·L-1)比较,各处理组BMP7表达明显增加(P<0.01)。
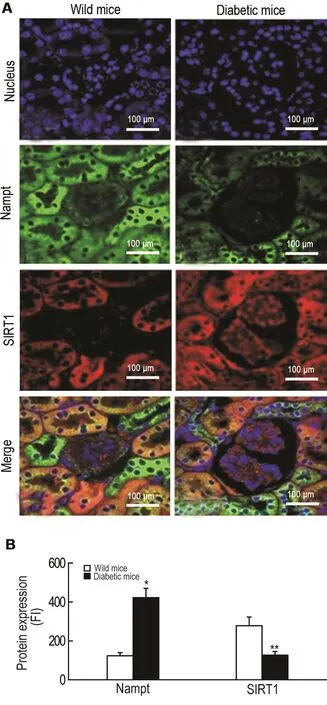
Fig.4 Expression of Nampt and sirtuin type1(SlRT1)in renal parenchyma cells of diabetic C57/BL6 mice by immunofocused fluorescence detection.A:the expression and location of Nampt(green fluorescence),SIRT1(red fluorescence)and nuclei(blue fluorescence)in glomerular cells FI;B was the semi-quantitative result of A.x±s.n=3.*P<0.05,**P<0.01 compared with wild mice group.
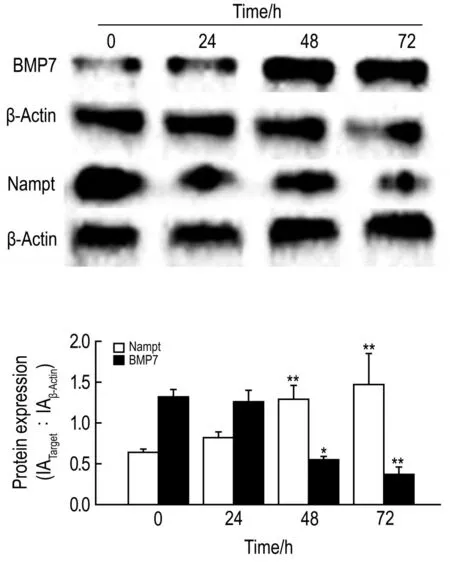
Fig.5 Effect of incubation time on expression of Nampt and BMP7 in glucose 200 mmol·L-1oxidative stressed HBZY-1 cells.IA:integrated absorbance.x±s,n=3.*P<0.05,**P<0.01,compared with control(0)group.
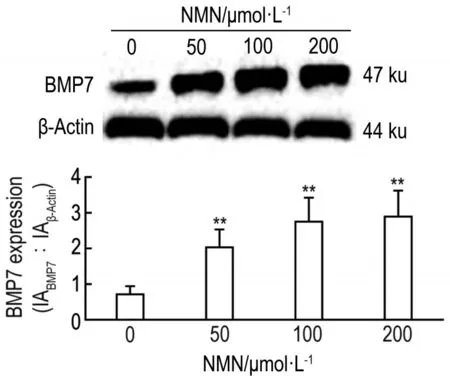
Fig.6 Concentration-effect of nicotinamide mononucleotide(NMN)on expression of BMP7 in HBZY-1 cells treated with glucose 200 mmol·L-1.HBZY-1 and cells were cultured in glucose 200 mmol·L-1medium for 72 h and then treated with NMN 50,100 and 200 μmol·L-1for 24 h.x±s,n=3.**P<0.01,compared with control(0)group.
2.8 葡萄糖200 mmol·L-1对HBZY-1细胞内NF-κ B p65和α-SAM表达的影响
免疫荧光结果 (图7)显示,葡萄糖200 mmol·L-1培养HBZY-1细胞96 h时,NF-κB p65和α-SMA蛋白表明显增加(P<0.01),提示高浓度葡萄糖氧致化应激的HBZY-1细胞已经有炎症因子和前纤维化因子的表达。
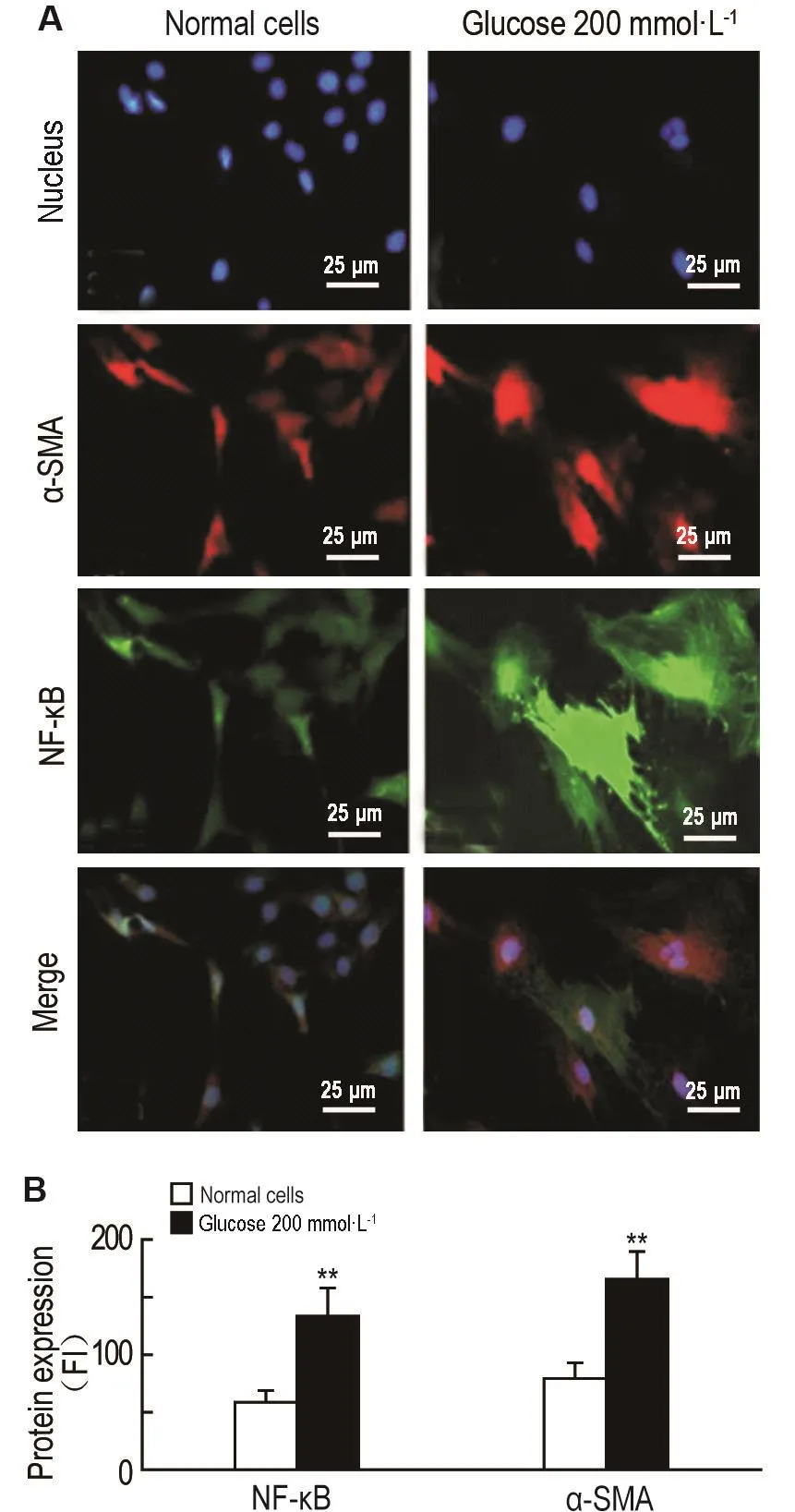
Fig.7 Effect of glucose 200 mmol·L-1on expression of NF-κ B p65 and α-smooth muscle actin(α-SMA)in HBZY-1 cells by immunofluorescence.A:FI represents expression and location of the proteins in HBZY-1 cells,corresponding to the nuclei(blue fluorescence),α-SMA(green fluorescence)and NF-κBp65(red fluorescence).B was the semiquantitative result of A.x±s.n=3.**P<0.01 compared with normal cell group.
2.9 NMN对高糖致氧化应激HBZY-1细胞Nampt,NF-κ B p65和BMP7表达的变化
Western蛋白印迹结果 (图8)显示,NMN对正常浓度葡萄糖(5.6 mmol·L-1)培养细胞内源性BMP7表达有抑制作用,Nampt和NF-κB p65表达未见明显变化。但在高浓度葡萄糖培养的细胞中,与葡萄糖200 mmol·L-1组比较,NMN干预后细胞Nampt和NF-κB p65表达减少(P<0.01),BMP7表达明显增加(P<0.01)。与葡萄糖200 mmol·L-1+ NMN组比较,葡萄糖200 mmol·L-1+FK866+NMN组Nampt,NF-κB p65和BMP7表达未见明显差异。

Fig.8 Effect of NMN on expression of Nampt,NF-κ B p65 and BMP7 in HBZY-1 cells.1:glucose 5.6 mmol·L-1;2:glucose 5.6 mmol·L-1+KF866;3:glucose 5.6 mmol·L-1+NMN;4:glucose 200 mmol·L-1;5:glucose 200 mmol·L-1+FK866;6:glucose 200 mmol·L-1+NMN 100 μmol·L-1;7:glucose 200 mmol·L-1+ FK866 10 μmol·L-1+NMN 100 μmol·L-1.In all glucose 200 mmol·L-1groups,glucose 200 mmol·L-1intervened cells for 5 d,then add FK866 10 μmol·L-1(final concentration),NMN 100 μmol·L-1(final concentration)alone or combination,respectively.All cells were collected after 24 h culture.x±s.n=5.*P<0.05,**P<0.01,compared with glucose 200 mmol·L-1group.
3 讨论
本研究发现,严重糖尿病小鼠肾小球细胞中内源性Nampt和NF-κB p65表达显著增加,此时SIRT1和BMP7表达则明显下降。以往研究表明,Nampt过度表达能够激活多种炎症因子和前纤维化因子,从而促进炎症反应[2]。有文献报道,在一定条件下,BMP7能够在肾组织细胞中表达,并通过多种途径对肾组织的炎症纤维化发挥拮抗作用[10]。同时也有文献报道,当肾损伤(包括糖尿病肾病)时,BMP7表达减少和活性下降,但机制仍不清楚[6,11-12]。
体外实验发现,应用高浓度葡萄糖(200 mmol·L-1)处理HBZY-1细胞发现,随着培养时间的延长,Nampt表达不断增加,而BMP7表达则呈现明显的下降趋势。说明两者在蛋白表达方面出现负增长效应。相同糖浓度条件下,应用NMN干预发现,BMP7的表达与NMN的浓度有关,由此进一步说明了Nampt和BMP7在细胞内可能存在某种内在的联系。在高浓度葡萄糖作用下,NF-κB p65和α-SMA表达增加,说明葡萄糖在200 mmol·L-1时能够明显诱导细胞炎症和纤维化因子表达增加。
为进一步验证Nampt和BMP7之间的内在关系,应用Nampt的特异性抑制FK866作用于葡萄糖200 mmol·L-1培养的细胞,观察细胞内源性Nampt和BMP7表达的变化。结果 显示,在FK866,NMN和FK866+NMN各组细胞中,内源性Nampt和NF-κB p65表达均显著减少,而BMP7表达明显增加。说明在NMN干预细胞内源性Nampt表达时,BMP7表达明显增加。上述研究表明,在机体糖尿病的氧化应激条件下,肾小球细胞内源性Nampt过度表达,可能会直接或间接影响BMP7表达。有文献报道,在肾纤维化过程中,结缔组织生长因子和TGF-β1等[10,13]也可以通过BMP7/Smads/TGF-β1等信号转导通路控制BMP7的表达和活性[10,13]。在这个过程中,还有相关因子均与Nampt的过度表达密切相关[14]。由此可见,Nampt在糖尿病肾病发病过程中发挥着不容忽视的作用,可能作为一个控制糖尿病肾病的新靶点。Nampt是细胞合成DNA的关键酶,应用FK866能够有效地抑制Nampt表达,但同时影响了细胞活性和功能[15]。研究显示,NMN既是NAD+的前体物质,又是Nampt合成的底物。在葡萄糖200 mmol·L-1氧化应激条件下,其能够通过负反馈抑制内源性Nampt表达,同时也可以通过NAD+促进SIRT1和BMP7表达增加。本研究结果 提示,细胞内源性Nampt与BMP7在表达方面可能存在某种关联,NMN及其类似物可能在预防和治疗糖尿病肾病肾小球纤维化中发挥作用。
[1]Song HK,Lee MH,Kim BK,Park YG,Ko GJ,Kang YS,et al.Visfatin:a new player in mesangial cell physiology and diabetic nephropathy[J]. Am J Physiol Renal Physiol,2008,295(5):F1485-F1494.
[2]Kitada M,Kume S,Koya D.Role of sirtuins in kidney disease[J].Curr Opin Nephrol Hypertens,2014,23(1):75-79.
[3]Salminen A,Huuskonen J,Ojala J,Kauppinen A,Kaarniranta K,Suuronen T.Activation of innate immunity system during aging:NF-kB signaling is the molecular culprit of inflamm-aging[J].Ageing Res Rev,2008,7(2):83-105.
[4]Tsujimura T,Idei M,Yoshikawa M,Takase O,Hishikawa K.Roles and regulation of bone morphogenetic protein-7 in kidney development and diseases[J].World J Stem Cells,2016,8(9):288-296.
[5]Yuan A,Lee Y,Choi U,Moeckel G,Karihaloo A. Chemokine receptor Cxcr4 contributes to kidney fibrosis via multiple effectors[J].Am J Physiol Renal Physiol,2015,308(5):F459-F472.
[6]Wang SL,Yang CQ,Qi XL,Yuan M,Chang YZ,Yang L,et al.Inhibitory effect of bone morphogenetic protein-7 on hepatic fibrosis in rats[J].Int J Clin Exp Pathol,2013,6(5):897-903.
[7]Anil Kumar P,Welsh GI,Saleem MA,Menon RK. Molecular and cellular events mediating glomerular podocyte dysfunction and depletion in diabetes mellitus[J].Front Endocrinol(Lausanne),2014,5:151.
[8]Coward R,Fornoni A.Insulin signaling:implications for podocyte biology in diabetic kidney disease[J]. Curr Opin Nephrol Hypertens,2015,24(1):104-110.
[9]Støy J,Edghill EL,Flanagan SE,Ye H,Paz VP,Pluzhnikov A,et al.Insulin gene mutations as a cause of permanent neonatal diabetes[J].Proc Natl Acad Sci USA,2007,104(38):15040-15044.
[10]Li RX,Yiu WH,Tang SC.Role of bone morphogenetiprotein-7 in renal fibrosis[J].Front Physiol,2015,6:114.
[11]Lee SY,Kim SI,Choi ME.Therapeutic targets for treating fibrotic kidney diseases[J].Transl Res,2015,165(4):512-530.
[12]Yeh CH,Chang CK,Cheng MF,Lin HJ,Cheng JT. The antioxidative effect of bone morphogenetic protein-7 against high glucose-induced oxidative stress in mesangial cells[J].Biochem Biophys Res Commun,2009,382(2):292-297.
[13]Abreu JG,Ketpura NI,Reversade B,De Robertis EM. Connective-tissue growth factor(CTGF)modulates cell signalling by BMP and TGF-beta[J].Nat Cell Biol,2002,4(8):599-604.
[14]Gallí M,Van Gool F,Rongvaux A,Andris F,Leo O. The nicotinamide phosphoribosyltransferase:a molecular link between metabolism,inflammation,and cancer[J].Cancer Res,2010,70(1):8-11.
[15]Hasmann M,Schemainda I.F K866,a highly specific noncompetitive inhibitor of nicotinamide phosphoribosyltransferase,represents a novel mechanism for induction of tumor cell apoptosis[J].Cancer Res,2003,63(21):7436-7442.
Expression of Nampt and bone morphogenetic protein 7 in spontaneous diabetic mice and effect of nicotinamide mononucleotide on fibrosis of rats′glomerular cells HBZY-1 in high glucose culture
CHEN Ye1,CAI Cong-jie1,WEI Ri-ming2,QIAO Wei3,HU Ting-ting2,WANG Ping1,FENG Le-ping1
(1.Public Health School,2.Biotechnology School,3.Pharmacy School,Guilin Medical University, Guilin 541004,China)
OBJECTlVETo investigate the mechanism of nicotinamide mononucleotide(NMN)on inflammation and fibrosis between endogenous nicotinamide phosphoribosyltransferase(NAMPT)and bone morphogenetic protein 7(BMP-7)in diabetic glomerular cells.METHODS①In vivo,spontaneous diabetic C57/BL6 mice and wild C57/BL6 mice were divided into two groups.When blood glucose was above(34.2±1.9)mmol·L-1,renal histology of diabetic mice became obvious.The protein expressions of Nampt and nuclear transcription factors-kappa B p65(NF-κB p65),silent mating type information regulation 2 homolog 1(SIRT1)and BMP7 were analyzed by lengths of immunofluorescence.②In vitro,rats′glomerular cells HBZY-1 were incubated with glucose 200 mmol·L-1for different lengths of time(0,24, 48 and 72 h)and at different concentrations of NMN(0,50,100 and 200 μmol·L-1).The protein levels of Nampt and BMP7 were detected by Western blotting and the protein expressions of NF-κB p65 and α-SMA were measured by immunofluorescence assay.The protein levels of Nampt,BMP7 and NF-κB p65 were detected by Western blotting after HBZY-1 cells were treated with NMN 100 μmol·L-1and FK866 10 μmol·L-1for 24 h.RESULTS①In vivo,the glomeruli of diabetic C57/BL6 mice showed obvious atrophy.Fluorescence intensity of Nampt was increased(P<0.05),but that of BMP7 and SIRT1 in renal glomeruli cells was decreased compared with the wild type(P<0.01).②In vitro,HBZY-1 cells were cultured in glucose 200 mmol·L-1for 48 and 72 h.The protein expression of NAMPT was increased,but that of BMP7 was decreased(P<0.05,P<0.01).Expressions of NF-κB p65 and α-SMA were increased (P<0.01)by immunofluorescence.The expression of BMP7 was increased after treatment with glucose 200 mmol·L-1,followed by NMN 50,100 and 200 μmol·L-1for 24 h(P<0.01).The expressions of NAMPT and NF-κB p65 were decreased(P<0.01).The expressions of Nampt and NF-κB p65 in glucose 5.6 mmol·L-1+FK866 and glucose 5.6 mmol·L-1+NMN groups were increased(P<0.01),but the expression of BMP7 did not change.CONCLUSlONUpregulation of endogenous Nampt obviously intervenes in BMP7 expression in the process of glomerular inflammatory fibrosis in severe diabetes. NMN can affect the protein expression of BMP7 via a special Nampt signaling pathway.
diabetic nephropathy;glomerular fibrosis;nicotinamide phosphoribosyltransferase; p65;silent mating type information regulation 2 homolog 1;bone morphogenetic protein 7
The project supported by National Natural Science Foundation of China(31060161);National Natural Science Foundation of China(81460164);and Natural Science Foundation of Guangxi Zhuang Autonomous Region of China(2015GXNSF)
FENG Le-ping,E-mail:lpfeng1226@163.com,Tel:(0773)5835125
R966
A
1000-3002-(2017)06-0553-08
2016-07-27接受日期:2017-03-20)
(本文编辑:贺云霞)
国家自然科学基金(31060161);国家自然科学基金(81460164);广西壮族自治区自然科学基金(2015GXNSF)
陈叶,硕士研究生,主要从事糖尿病及其并发症的发病机制研究;冯乐平,研究生导师,主要从事糖尿病及其并发症的发病机制研究。
冯乐平,E-mail:lpfeng1226@163.com,Tel:(0773)5835125

