pH依赖型植物基微胶囊的制备和体外释药研究
李荣荣,王素珍,岳 雪,董惠钧
(聊城大学药学院,山东聊城 252000)
pH依赖型植物基微胶囊的制备和体外释药研究
李荣荣,王素珍,岳 雪,董惠钧*
(聊城大学药学院,山东聊城 252000)
为研究新型肠溶植物基微胶囊,实现消化道定位给药,以植物多糖变性淀粉、果胶和卡拉胶为基质,制备了微胶囊并考察了其性质、体外释药行为和安全性。选用果胶、木薯醋酸酯淀粉与卡拉胶为材料,制备了pH依赖型微胶囊。考察了微胶囊的红外吸收特征、溶解性能、显微结构和细胞毒性,并进一步研究了微胶囊的释药行为。结果表明:当微胶囊中不含果胶时,其在不同pH条件下均不溶解且没有药物释放;当基质中果胶含量为1%,pH在中性偏酸性时微胶囊的释药量最大,随着果胶浓度的增大微胶囊的释药量降低,3%果胶含量微胶囊几乎没有释药。细胞毒性结果表明微胶囊是安全无毒的。果胶是pH依赖型微胶囊的关键成分,通过调节果胶含量可以实现微胶囊在pH中性环境下的有效释药,实现药物在肠道的定位释放,提高药物的生物利用度。
木薯醋酸酯淀粉,果胶,卡拉胶,微胶囊,pH依赖
植物多糖多由单糖或低聚糖聚合而成,是一种大分子聚合物,具有稳定性高、生物相容性好、体内可降解且对人体安全无毒等优点,在食品和药品工业领域应用广泛,如淀粉及其衍生物、果胶、壳聚糖、魔芋多糖、海藻酸盐等[1-3]。果胶是一种水溶性多糖,在药学领域里,可以作为亲水性乳化剂、胶凝剂和增稠剂使用,已有研究表明果胶耐低pH,具有pH敏感性[4]。木薯醋酸酯淀粉是木薯原淀粉与醋酸或醋酸酐反应生成的一种变性淀粉[5],具有糊化温度低、粘度高、凝胶化和透明度好等特点[6]。卡拉胶是从海洋红藻细胞壁中提取的多糖[7],是优良的成胶剂。微胶囊是一种用成膜材料把固体或液体材料包覆形成微小粒子[8],其形状一般是球形,还可形成椭圆形或谷粒形等。目前以壳聚糖与其它成分复配制备的微胶囊较为常见。窦圣博等人以pH敏感的海藻酸钠和温度敏感的N-异丙基丙烯酰胺为壁材,合成了pH/温度双重敏感微胶囊[9]。pH敏感型药物载体在口服给药系统和肿瘤靶向系统中已取得一定成果[10]。本文以木薯醋酸酯变性淀粉、果胶与卡拉胶为囊材,制备pH依赖型微胶囊,考察了微胶囊的红外吸收特征、溶解性能、显微结构和细胞毒性,并进一步研究了其释药行为。本研究选用植物来源的高分子多糖作为基质来制备pH依赖型载药微囊,以保障胶囊的安全性和良好的生物相容性。
1 材料和方法
1.1 材料与仪器
木薯醋酸酯淀粉 顶新国际集团;卡拉胶 广州市健鸥食品添加剂有限公司;果胶 河南千志商贸有限公司;氨苄青霉素钠盐 Solarbio公司;MCF-7 cells 中科院上海细胞库;在本研究中使用的所有其他化学品和溶剂均为分析纯试剂。
NEXUS 670型傅里叶变换红外光谱仪 美国Nicolet;S-3000N型扫描电子显微镜 日本日立公司;Guava 8-HT型流式细胞仪 默克密理博;HH-4型数显恒温水浴锅 金坛市科析仪器有限公司;UPR-I-10T型优普系列超纯水器 成都超纯科技有限公司。
1.2 实验方法
1.2.1 复合膜的制备 分别制备木薯醋酸酯淀粉、果胶、卡拉胶单组份膜以及三者的复合膜,具体配制方法如下:分别配制浓度均为5%的木薯醋酸酯淀粉、果胶和卡拉胶悬液,在70~80 ℃条件下加热制备胶液,然后50 ℃的水浴锅中保温1 h,除去胶液中的气泡,然后将溶液倒入表面皿中,真空干燥24 h。根据预实验的结果确定复合膜的比例为木薯醋酸酯淀粉1%、卡拉胶3%和果胶1%。
1.2.2 复合微胶囊的制备 按照上述制胶过程制成胶液后,在45 ℃保温条件下与定量氨苄青霉素混合,搅拌均匀后采用滴注法滴入食用油中,形成均匀的微胶囊,低温真空干燥24 h,测定微胶囊粒径为(1±0.3) mm。根据微胶囊成型工艺和pH敏感预实验,果胶含量是关键变量,木薯醋酸酯淀粉和卡拉胶的比例不变。复合胶囊的组分比例果胶∶木薯醋酸酯淀粉∶卡拉胶分别为1∶1∶3,2∶1∶3和3∶1∶3,包裹氨苄青霉素的浓度为2.5%,载药后测定载药率为70%。
1.2.3 傅里叶变换红外光谱分析 将制备的复合微胶囊干燥研碎后与KBr混合压制测试片。用傅里叶变换红外光谱仪进行测试[11],扫描范围为4000~400 cm-1。
1.2.4 扫描电镜分析 采用S-3000 N型扫描电子显微镜对所制备的膜进行表面形态观察[12]。测试时加速电压为10.0 kV,放大倍数为50000倍。
1.2.5 微胶囊溶解率的测定 定量称取制备的空白复合微胶囊,分别放在不同pH溶液中,其中pH1为盐酸溶液,pH3、pH5和pH7为磷酸盐缓冲液,每隔10 min取样称重剩余的微胶囊,测定微胶囊的溶解率[13]。每种微胶囊样品测定三个平行样。微胶囊溶解率(DR)的计算:

式(1)
1.2.6 细胞毒性实验 对醋酸酯淀粉、果胶、卡拉胶及复合微胶囊四种样品进行细胞毒性实验[14]。每种样品的加入量分别为2.5、5、7.5、10 mg,每个梯度做三个平行。首先待乳腺癌细胞MCF-7在含有1640培养基的培养瓶中培养至5.0×104cfu/mL时,将细胞转移到24孔板中,体积为500 μL,在培养箱中孵育24 h(37 ℃,5% CO2)。随后,用含有定量样品的新鲜1640培养基置换原培养液,再温育48 h。再用500 μL新鲜无血清1640培养基置换含有样品的1640培养基,将50 μL MTT溶液(5 mg/mL)添加到培养液中继续孵育4 h后,加入500 μL新鲜1640培养混合均匀,取出200 μL的混合溶液依次加入到96孔板中。用流式细胞仪在570 nm处测定吸光值(OD),计算出细胞的存活率。

式(2)
1.2.7 药物释放 用高效液相色谱仪测定载药微胶囊的释放量[15]。将不同组成比例的载药微胶囊分别放入四种不同pH溶液中,其中pH1为盐酸溶液,pH3、pH5和pH7为磷酸盐缓冲液,每隔10 min分别取样测定氨苄青霉素的释放量,考察微胶囊中药物随时间的释放度。色谱条件为色谱柱为C18,流动相为0.05 mol/L的磷酸盐缓冲液(pH6.5)-乙腈(6∶1),检测波长为225 nm,柱温为35 ℃,流速为0.7 mL/min,进样量10 μL。
1.2.8 数据处理 样品各项指标检测均进行3次重复,结果进行定性和定量分析。采用Excel 2007进行数据的整理、分析和作图。
2 结果和讨论
2.1 傅里叶变换红外光谱分析
图1为制备的四种不同组分膜的红外光谱扫描结果。由图1可知,卡拉胶在1240、930、850 cm-1处均有吸收,在805 cm-1处没有吸收,卡拉胶为一类线性、含硫酸酯基团的高分子多糖,1240 cm-1处便是卡拉胶中硫酸基的结合位置,930 cm-1和850 cm-1处的吸收峰分别是β-D半乳糖中C6和半乳糖中C4-O-S拉伸所致[16]。

图1 膜材红外光谱图Fig.1 The infrared spectra of membrane materials注:A卡拉胶膜;B醋酸酯淀粉膜;C果胶膜;D复合膜。
木薯醋酸酯淀粉在3000~3700 cm-1处为羟基伸缩振动和羟基氢键缔合后的特征吸收峰,木薯醋酸酯淀粉在1375 cm-1和1240 cm-1附近均出现了酯基的特征吸收峰,这是由于木薯醋酸酯淀粉中含有醋酸酯基团。
在果胶膜的红外光谱图中,2930 cm-1附近的吸收峰由C-H(CH,CH2和CH3)伸缩振动引起,这个峰常被O-H伸缩振动引起的宽峰所掩盖。1638 cm-1处吸收峰为羧酸盐的不对称伸缩振动。由于833 cm-1处有一弱的吸收峰,923 cm-1附近没有吸收峰,说明果胶中含有一定量的α-糖苷键而不含β-糖苷键。由羧基形成的酯键在1737 cm-1处有特异吸收,表明该果胶为酸性多糖。
红外光谱图对比发现,复合膜的吸收峰比单一组分膜的吸收峰少很多,只在1637 cm-1和3467 cm-1有两处明显吸收峰。其中,1637 cm-1处吸收峰为糖水化合物吸收峰。在3600~2400 cm-1处的宽峰比其他三种样品的峰都窄,说明复合膜的分子内或分子间O-H伸缩振动减弱,而且酸性基团如硫酸基、羧基的吸收峰减弱或消失。
2.2 扫描电镜分析

图2 膜材扫描电镜图(50000×)Fig. 2 Images of the capsule material by scanning electron microscope(50000×)
为了揭示植物基微胶囊微观结构与释药机制的关系,采用SEM扫描电镜对膜材的表面结构进行了初步分析(图2)。图2显示木薯醋酸酯淀粉膜材表面致密,没有孔洞分布;果胶膜材呈现熔融状立体结构,表面多分布有孔洞(黑色部分);卡拉胶膜材呈现层状页岩式结构,表面致密,零星分布有孔洞;复合膜表面有成簇棒状结构,且多为垂直分布,表面分布有穴状结构。通过对比分析四种不同膜材的微观结构可以看出,果胶和卡拉胶可以形成多孔状结构,对微胶囊的释药起到关键作用,通过加入变性淀粉可以调节孔状结构的形状和大小。从复合膜的显微结构看出,表面的簇状结构能够形成许多微小的流通通道,可以均匀有效的实现药物的释放。
2.3 微胶囊溶解率的测定
在预实验中分别以木薯醋酸酯淀粉和卡拉胶为单一基质制备微胶囊,结果显示微胶囊在4种不同的pH溶液中均不溶,当基质中加入果胶后微胶囊可以溶解。图3为考察添加不同比例果胶对复合微胶囊溶解性的影响。由图3可知,随着果胶浓度的增加,微胶囊在四种pH溶液中的溶解度也逐渐增加,含3%果胶的复合微胶囊在pH7条件下1 h内可以溶解85%以上,而含1%果胶的复合微胶囊同样条件下溶解率只有50%。表明果胶的加入能够显著促进微胶囊的溶解,促进内容物释放。这一结果可以从扫描电镜结果得到验证,单一果胶膜有许多孔洞和裂痕,有助于微胶囊外溶剂的进入,复合微胶囊扫描照片显示表面成簇状棒状结构,成纵深排列,且表面有孔洞。另外,pH对复合微胶囊溶解性也有显著影响。在pH1条件下,1%和2%果胶含量的复合微胶囊在1 h内溶解度均低于30%,3%果胶含量的微胶囊溶解率在1 h内也只有40%左右。在pH3~7条件下,微胶囊的溶解率显著增加,果胶浓度1%,微胶囊在1 h内溶解率为60%左右,而2%和3%果胶含量的微胶囊溶解率可以达到80%以上。这些结果表明通过调节果胶含量,可以有效调节微胶囊在不同pH环境下的溶解率。
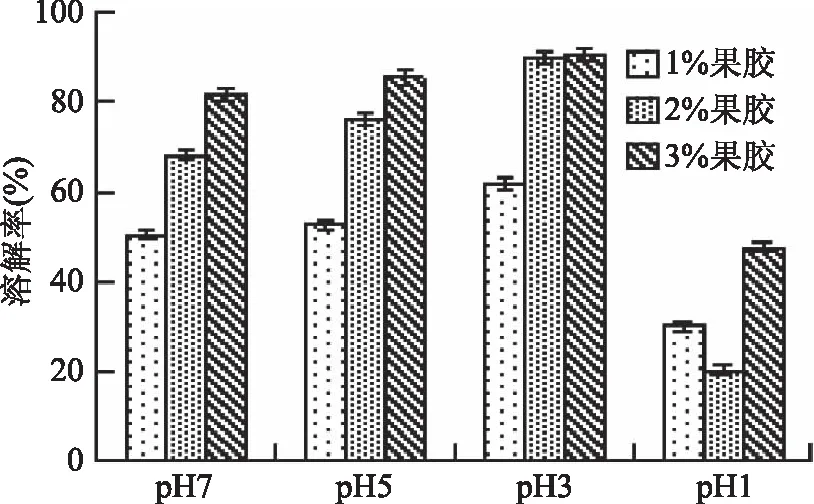
图3 不同果胶含量微胶囊在不同pH条件下的溶解率Fig.3 The dissolution rates of microcapsules with different pectin contents under different pH conditions
2.4 细胞毒性研究
本实验采用MTT法考察了所用三种植物高分子物质及其复合物对细胞的影响。图4为各组分和复合组分的细胞毒性研究,结果表明:木薯醋酸酯淀粉在高浓度7.5 mg/mL时有一定细胞毒性,细胞相对增殖率为37.60%,这可能与木薯醋酸酯淀粉的化学生产工艺有关,有化学物质和有机溶剂的残留。果胶在添加量为2.5 mg/mL及5 mg/mL时,细胞相对增殖率均达到80%以上,基本无生物毒性。当果胶浓度增加到7.5 mg/mL时,细胞相对增殖率为53.21%,这可能是由于果胶呈酸性会破坏细胞增殖的微环境,抑制细胞的生长。相比于木薯醋酸酯淀粉和果胶,卡拉胶不但未呈现细胞毒性,反而细胞相对增殖率超过100%,可以促进细胞增殖。三种高分子物质制成的复合微胶囊显示的细胞相对增殖作用显著大于果胶和醋酸酯淀粉,说明卡拉胶的加入可减小细胞毒性,细胞相对增殖率均达到90%以上,根据细胞毒性分级的判断标准[17],复合微胶囊细胞毒性分级为0-1,可认为无细胞毒性。由此可见复合微胶囊可以安全应用。
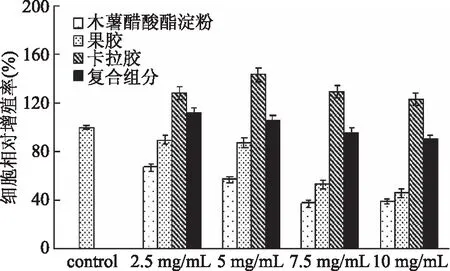
图4 各组分和复合组分的细胞毒性Fig.4 Cytotoxicity of components and composite components
2.5 载药微胶囊的释药行为
为考察复合微胶囊在不同pH条件下的释药行为,制备了包裹了氨苄青霉素的复合微胶囊,图5为不同果胶含量载药微胶囊在不同pH条件下的释药。由图5可看出,随着果胶浓度的增加,微胶囊释放氨苄青霉素的能力减弱,3%果胶含量的载药微胶囊在pH7溶液中60 min释药量只有约0.05 mg/mL,在pH1条件下几乎没有释药,同样条件下1%果胶含量的载药微胶囊释药分别达到0.8 mg/mL和0.4 mg/mL,但未加果胶的载药微胶囊在不同pH条件下并没有药物释放(数据未列出),表明果胶在药物释放中起到关键作用,但较高的含量也会阻碍药物的释放(图5)。不同果胶浓度的释药能力与溶解性正好相反,但其中的原因和机制有待于进一步研究。相同果胶含量的载药微胶囊在不同pH下释药也不同,在pH1条件下微胶囊的释药能力最弱,pH3、pH5和pH7条件下的释药能力相近。对于复合微胶囊的pH依赖性释药行为,可能的机制是由于果胶、变性淀粉和卡拉胶等植物多糖的酸性基团,在低pH环境下解离受到抑制,羧基、硫酸基等酸性基团转变为不带电荷的分子,使分子间空间排阻降低,分子水合作用也降低,有利于分子间的结合和三维网络结构的形成,不易溶解和释放药物,随着pH增加,酸性基团解离程度增加,相应的分子排斥力和水合作用增强,更易于溶解和释放药物。
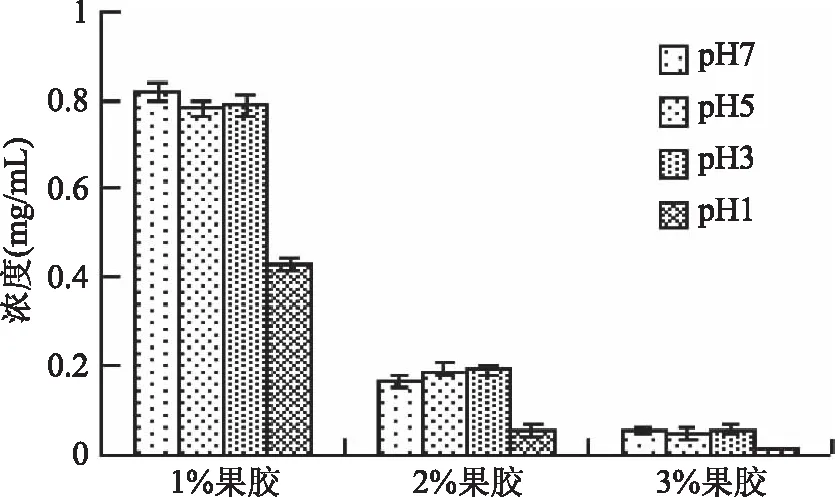
图5 不同果胶含量载药微胶囊在不同pH条件下的释药量Fig.5 The release dose of drug-loaded microcapsules with different pectin content under different pH conditions
3 结论
本文研究表明使用木薯醋酸酯淀粉、卡拉胶与果胶可以制备具有pH敏感性的载药微胶囊。果胶在微胶囊释药中起着关键作用,微胶囊释药性研究结果显示,1%果胶含量的微胶囊释药效果最好。不同pH条件下,微胶囊主要是在强酸环境下释药能力最弱,可以保护在强酸环境易变性的药物。通过细胞毒性实验结果可知,复合微胶囊基本无生物毒性,可以安全应用。
在传统的口服给药方式中,药物首先到达消化道的胃部(pH1~2),然后再到肠部(pH7),这使很多药物在到达肠道之前被胃中酶所破坏。载药微胶囊在强酸环境几乎不溶,离开胃部微胶囊开始溶解,释药量增加,故可以将这种药物缓释微胶囊应用于肠道靶向给药,具有很好的应用前景。
[1]江涛,李卫平,雷健,等. 天然多糖作为结肠定位给药系统材料的研究进展[J]. 中国药房,2013,24(23):2199-2201.
[2]Liu J,Zhang LK,Hu WJ,et al. Preparation of konjac glucomannan-based pulsatile capsule for colonic drug delivery system and its evaluationinvitroandinvivo[J]. Carbohydrate Polymers,2012,87(1):377-382.
[3]Silva I,Gurruchaga M,Goi I. Physical blends of starch graft copolymers as matrices for colon targeting drug delivery systems[J]. Carbohyd Polym,2009,76(4):593-601.
[4]曹亮,张钧寿,刘玉峰,等. 果胶钙胶囊结肠定位释放介质的确定[J]. 中国药科大学学报,2002,33(3):203-207.
[5]刘文娟,梁琪,方东平,等. 木薯醋酸酯淀粉的制备及性能研究[J]. 中国食品添加剂,2012,6:142-146.
[6]于泓鹏,朱婉怡,高群玉,等. 食用醋酸酯淀粉制备和性质的研究[J]. 食品科学,2003,7:70-74.
[7]杜伏玲,郑敦胜,阮继良,等. 卡拉胶/淀粉共混膜的制备与性能研究[J]. 包装工程,2008,8:19-20.
[8]苏峻峰,任丽,王立,等. 微胶囊技术及其最新研究进展[J]. 材料导报,2003,17:141-144.
[9]窦圣博,安朴英,巴信武. pH/温度敏感性微胶囊的制备及其药物释放性能研究[J]. 功能高分子材料,2014,3:860-862.
[10]杨燕,周亮,舒婷. pH敏感型药物载体材料的研究进展[J]. 化学工程师,2015,10:37-39.
[11]T Woggum,P Sirivongpaisal,T Wittaya. Properties and characteristics of dual-modified rice starch based biodegradable films[J]. International journal of biological macromolecules,2014,67(6):490-502.
[12]M Chiumarelli,M D Hubinger. Evaluation of edible films and coatings formulated with cassava starch,glycerol,carnauba wax and stearic acid[J]. Food Hydrocolloids,2014,38(4):20-27.
[13]Y Shang,F Ding,L Xiao,et al,Chitin-based fast responsive pH sensitive microspheres for controlled drug release[J]. Carbohydrate polymers,2014,102:413-418.
[14]L Ma,M Liu,H Liu,et al.Invitrocytotoxicity and drug release properties of pH-and temperature-sensitive core-shellhydrogel microspheres[J]. International journal of pharmaceutics,2010,385(1-2):86-91.
[15]古丽曼·木哈买提拜. 高效液相色谱法测定生鲜乳中氨苄青霉素的残留量[J]. 新疆畜牧业,2015,(12):30-31.
[16]刘安军,刘彩红,马宏原,等. κ-卡拉胶-大豆肽可食膜配方优化与结构表征[J]. 食品科技,2015,40(1):26-35.
[17]徐小川,陈大福,石锐,等. 增塑淀粉的细胞毒性实验[J]. 口腔颌面修复学杂志,2007,8(1):38-40.
Study on the preparation and drug release ofpH-dependent plant microcapsulesinvitro
LI Rong-rong,WANG Su-zhen,YUE Xue,DONG Hui-jun*
(School of Pharmacy of Liaocheng University,Liaocheng 252000,China)
In order to study the new plant based enteric-coated microcapsules and realize the digestive tract drug delivery,the microcapsules were prepared by acetate starch,pectin and carrageenan and performed to investigate their characteristics and drug release process and safety. A kind of pH-dependent plant microcapsules was prepared by pectin,acetate starch and carrageenan. The microcapsules were characterized by Fourier transform infrared spectroscopy,dissolution property,scanning electron microscopy and cytotoxicity test,and the drug release behavior of microcapsules was further studied. The results showed that there was no dissolution or drug release in different pH conditions when the microcapsules contain no pectin. The microcapsule containing one percent of pectin had the strongest release capacity under neutral partial acidity conditions. The drug release rate of microcapsules decreased with the increase of pectin concentration. There almost no drug release when the microcapsules contained three percent of pectin. The results of cytotoxicity showed that the microcapsules were safe and nontoxic. Pectin is a key component of pH-dependent microcapsules,which can be used for the effective release of microcapsules in pH neutral environment by regulating the pectin content,to achieve drug release in the intestinal tract and improve the bioavailability of drugs.
Acetylated cassava starch;pectin;carrageenan;microcapsules;pH-dependent
2016-12-23
李荣荣(1989-),女,硕士研究生,研究方向:植物淀粉胶囊,E-mail:lirongrong2016@163.com。
*通讯作者:董惠钧(1977-),男,博士,副教授,研究方向:生物制药,E-mail:donghuijun_747@163.com。
TS201.1
A
1002-0306(2017)13-0074-05
10.13386/j.issn1002-0306.2017.13.014

