含氮中孔碳材料的制备及其双氧水分解活性
杨 阳, 杨 洋, 陈洪林, 张小明
(1. 中国科学院 成都有机化学研究所,四川 成都 610041; 2. 中国科学院大学,北京 100049)
·快递论文·
含氮中孔碳材料的制备及其双氧水分解活性
杨 阳1,2, 杨 洋1,2, 陈洪林1*, 张小明1
(1. 中国科学院 成都有机化学研究所,四川 成都 610041; 2. 中国科学院大学,北京 100049)
以三聚氰胺和甲醛作为碳源和氮源,合成三聚氰胺甲醛树脂前驱体(2);采用模板法,以CaCl2为模板剂,2经高温碳化处理制备孔结构发达的含氮中孔碳材料(NMC),其结构经N2吸附/脱附、扫描电镜(SEM), X-射线衍射(XRD)和X-射线光电子能谱(XPS)表征。不同炭化温度(700 ℃, 800 ℃, 900 ℃)下所合成的NMC表面氮含量为3.85~10.80at%,比表面积为570~870 m2·g-1,中孔孔径为4 nm和10 nm。以H2O2分解反应作为探针反应,考察了NMC的催化活性。结果表明:NMC的催化活性随着碳化温度的升高而增大,碳化温度为900 ℃的NMC分解H2O2的升温速率为6.92 ℃·min-1,循环套用5次后,活性基本维持不变。
三聚氰胺; 甲醛; 中孔; 含氮碳材料; CaCl2模板法; 制备; 双氧水分解; 催化
中孔碳材料因具有发达的比表面积和孔道结构,良好的分子扩散速率,易于调控表面性质,耐酸碱性等优越性质,在电极材料、燃料电池、超级电容器、储能、吸附剂以及多相催化等领域得到广

Scheme 1
泛关注[1]。据报道,碳材料掺杂氮后可以改变碳表面局部电子结构,形成局部富电子区域;同时形成的含氮碱性官能团可以调节表面酸碱性质,这些都共同提高碳材料在吸附剂、催化剂/催化剂载体、电极材料、电容器等领域的相应性能[2-3]。如Zhou等[4]研究发现,碳材料经过氮改性处理后,可以有效增强载体与负载Pt纳米颗粒之间的强相互作用力,改善Pt纳米颗粒的成核与生长,提高Pt纳米颗粒的分散度与稳定性。Bagreev等[5]研究发现,氮掺杂改性处理碳材料可以有效提高其吸附SO2的性能。Besson等[6]研究表明,氮改性处理碳材料后,可以有效的改变碳材料表面的酸碱性质,从而提高了碳材料在催化氧化时的催化活性。因此制备含氮量高的功能化多孔碳材料具有重要的研究前景。
目前制备氮掺杂多孔碳材料的方法可以概括为两类:(1)直接合成法,也叫原位合成法,即采用“自下而上”的方式,在合成碳材料的过程中直接进行氮掺杂;(2)后处理法,即利用含氮前驱体(NH3、三聚氰胺、尿素等)对多孔碳材料进行后处理,在碳材料表面形成含氮官能团。后处理法虽然操作简单易于实现,但是制备的碳材料含氮量低,含氮官能团可控性差,制备重复性低。通常采用直接合成法得到高含氮量的多孔碳材料[7]。常用的直接合成法包括:模板法、化学气相沉积法(CVD法)及含氮高聚物直接高温热解碳化法[8]。模板法相对于其他直接制备方法而言,原料来源易得,可以通过选用合适模板剂来可控制备孔结构均匀的含氮碳材料,是直接制备高含氮多孔碳材料的主要方法。在模板法研究中,常见的含氮前驱体(三聚氰胺、苯二胺、二乙胺、乙腈等)在SBA-15、MCM-48、CMK-3、13X,Y型沸石等硬模板剂的作用下,通过化学合成的方法可以制备高比表面积(1 000 m2·g-1)和高含氮量(>30%)的多孔碳材料[9-11]。但是硬模板法存在模板无法回收,制备工艺流程复杂和孔结构不稳定等问题,制约硬模板法应用。近年来研究表明,当采用金属盐(ZnCl2, CaCl2和KCl等)作为模板,以可溶性或可水解的碳水化合物为碳源时,可以制备高比表面积的中孔碳材料,且整个过程中模板剂成本低且可回收利用,工艺简单,可以有效克服硬模板存在的问题[12-14]。
因此,本文以三聚氰胺和甲醛作为碳源和氮源,合成三聚氰胺甲醛树脂前驱体(2, Scheme 1);采用模板法,以CaCl2为模板剂,2经高温碳化处理制备孔结构发达的含氮中孔碳材料(NMC),其结构经N2吸附/脱附、扫描电镜(SEM), X-射线衍射(XRD)和X-射线光电子能谱(XPS)表征。以H2O2分解反应作为探针反应,考察含氮中孔碳材料的催化活性。
1 实验部分
1.1 仪器与试剂
Vario MICRO select型元素分析仪;SSA 4200型吸附仪(200 ℃真空处理1 h,于-196 ℃测量,氮气为吸附质,介孔体积用BJH方程计算);DX-2500型X-射线衍射仪[Cu Kα辐射,石墨单色器,Ni滤波片,扫描范围2θ=(10~70°)]; XSAM 800型多功能表面分析电子能谱仪[Al Kα射线,污染碳C1s(284.6 eV)校正荷电效应];JEOL JSM 6380-LV型显微镜;Tecnai G2F20型高分辨200 KV场发射透射电子显微镜。
三聚氰胺,AR, 98.5%;甲醛溶液,AR, 37%;双氧水,AR, 30%;其余所用试剂均为分析纯,广东光华化学厂有限公司。
1.2 合成
(1) 2的合成
在反应瓶中加入三聚氰胺 3.00 g(23.4 mmol)和甲醛12.0 mL(3.9 mmol),搅拌下升温至50 ℃,用2.00 mol·L-1NaOH溶液调至pH 8.0~9.0,反应约1 h。体系变澄清后加入CaCl2粉末至溶液开始浑浊;用2.00 mol·L-1盐酸调至pH 4.3~4.8,升温至70 ℃,反应1.5 h。将反应液置于烘箱于180 ℃固化5 h得橙黄色硬块状固体7.33 g,产率93.5%,所得固体研碎备用。
(2) NMC的合成
将固化后研细的产物2置于管式炉中(N2气氛:80 mL·min-1)经高温碳化处理(700, 800, 900 ℃)2 h得黑色固体。冷却至室温,用1 mol·L-1盐酸搅拌酸洗12 h去除其中CaCO3成分,再用去离子水洗涤多次直至溶液呈中性,于100 ℃干燥8 h得3种黑色固体NMC 2.00~3.00 g,产率约27.4%~41.1%,分别标记为NMC-700, NMC-800, NMC-900,其中700, 800, 900指碳化处理温度,置于干燥器中备用。
1.3 催化性能评价
H2O2是湿式催化氧化体系中的常用氧化剂,H2O2分解产生自由基的快慢是决定催化氧化活性高低的重要因素[15-17]。因此本文利用H2O2反应考察含氮中孔碳材料的催化性能。
H2O2分解实验在绝热反应器中进行。在室温下,称取NMC 0.25 g、去离子水100 mL和缓冲溶液(0.50 mol·L-1KH2PO4和0.50 mL·L-1K2HPO4)50 mL放入绝热反应器中,在300 r·min-1下,加入H2O250 mL,记录反应体系的温度随时间的变化。由于H2O2分解释放热量,分解越快,则温度升高越快,通过测定升温速率判断材料的分解活性。
2 结果和讨论
2.1 结构分析
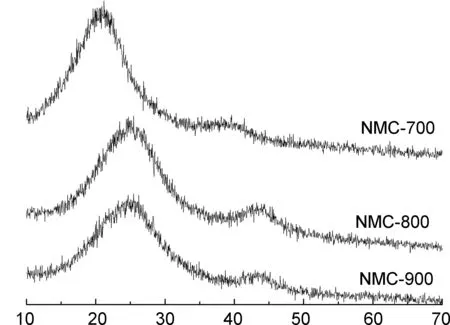
图1(a~c)为三种含氮中孔碳材料NMC-700, NMC-800和NMC-900的SEM图。由图1可以看出,三种碳化温度下制备的含氮中孔碳材料都具有三维无序的孔道结构。NMC-800表面结构比NMC-700光滑且有片层结构出现,且NMC-800孔结构分布更均匀。NMC-900的表面与NMC-800相比,粗糙程度增大,且中孔分布更加宽泛,说明在更高温度下,存在孔道的坍塌。通过NMC-800的TEM图[图1(d)]可知,形成了石墨片层结构和中孔结构。这从其XRD谱图(图2)中得到证实。三种含氮中孔碳材料在2θ为25°和44°附近均出现明显的衍射峰,对应为石墨碳的(002)晶面和(101)晶面,具有无序多层碳材料的特点。随着碳化温度的增大,衍射峰位置向高角度偏移,说明碳材料的石墨化程度随碳化温度的升高而增大[18]。

图1 含氮中孔碳材料的SEM图: (a) NMC-700,(b) NMC-800,(c) NMC-900)和NMC-800的TEM图(d)
2θ/(°)
2.2 孔性质分析
三种含氮多孔碳材料NMC-700, NMC-800和NMC-900的N2吸附/脱附等温线和中孔孔径分布曲线如图3和图4所示。由图3可知,NMC-700, NMC-800和NMC-900的吸附/脱附等温线呈IV型变化,且在相对压力为0.4~1.0时,出现明显的脱附回滞环,符合中孔材料N2吸附/脱附曲线的特征。因此说明NMCs是中孔为主的碳材料。图4的中孔粒径分布图也进步证实了三种含氮多孔碳材料以中孔为主,中孔主要集中在4.0 nm和10.0 nm左右。从孔性质数据(表1)可知,三种含氮多孔碳材料的中孔所占比例(Vmeso/Vtot)都在50%以上。当碳化温度从700 ℃升至800 ℃时,比表面积的变化差别不大,主要是中孔比表面积(Smeso)和中孔体积(Vmeso)出现明显增大。这主要由于在这个过程中模板剂的扩孔作用还是起主要作用,使得有更多的微孔向中孔发展;而当温度由800 ℃升至900 ℃时,比表面积、孔体积和中孔体积都出现下降,这主要是由于在这个过程中,过高的温度导致孔结构出现坍塌。

Relative pressure/(P/P0)图3 含氮多孔碳材料的N2吸附/脱附等温线Figure 3 N2 adsorption/desorption isotherms for nitrogen-containing porous carbon materials

Pore diameter/nm

SampleSBETaSmesobVtotcVmicrodVmesoeVmesofNMC-7008731870.6790.3370.34250.4NMC-8008744410.9870.2120.77578.5NMC-9005772140.6110.1830.42870.0
a/m2·g-1;b/m2·g-1;c/cm3·g-1;d/cm3·g-1;e/cm3·g-1;f/Vtot。
2.3 表面和体相元素组成分析
除了结构和孔性质外,对含氮碳材料性质影响较大的是其元素组成,特别是表面元素组成。采用XPS和元素分析分别测定了不同碳化温度得到的三种含氮中孔碳材料,结果如表2所示。采用三聚氰胺甲醛树脂为碳源和氮源是可以得到高含氮的中孔碳材料。如碳化温度为900 ℃时,体相和表面氮含量分别为3.67wt%和3.85at%,高于采用高温氨气处理的碳材料。随着碳化温度的增大,材料石墨化程度增加,使得含氮官能团脱落,氮含量出现大幅度降低,氧含量则变化较小。而由于XPS是三种元素的加和量(C+O+N=100at%),元素分析是元素所占总质量的百分比,所以分析结果存在较大差别。

表2 含氮多孔碳材料的元素分析和XPS分析
aElemental content from analysis;bfor XPS(C+O+N=100at.%)。
对三种含氮中孔碳材料的O 1s和N 1s能谱进行分峰处理(图5),其中N1s分为四个峰,分别是吡啶类氮(N-6, 394.85 eV)、吡咯类氮(N-5, 400.4 eV)、石墨类氮(N-Q, 401.2 eV)和吡啶氧类氮(N-O, 403.5 eV); O1s也分为四个峰,分别代表醌类氧(O-1,531.2 eV)、苯酚类氧(O-2, 532.2 eV)、羧酸类氧(O-3, 533.2 eV)和吸附水或氧(O-4, 536.2 eV)。通过计算得到每种官能团的相对含量如表3所示。分析含氧官能团的变化可知,随着碳化温度的升高,酸性含氧官能团O-3的相对含量出现下降,而碱性含氧官能团O-1的相对含量却出现增大,这主要是由于一方面在高温下O-3不稳定容易发生裂解,另一方面由于在高温下O-2和O-3类含氧官能团向O-1转化导致[19];分析含氮官能团的变化可知,随着碳化温度的升高,N-6与N-5的相对含量随之减小,而N-Q和N-O却随之增大,这主要是一方面N-Q, N-O比N-6, N-5更耐高温,不容易热解,另一方面高温下N-6, N-5会向N-Q和N-O转化[2,20]。

表3 在XPS能谱中含氮和含氧官能团的种类及相对含量

BE/eV BE/eV
2.4 催化活性
以H2O2分解反应作为探针反应,考察含氮中孔碳材料的催化活性,探讨碳化温度对H2O2分解速率的影响。三种含氮中孔碳材料NMC-700, NMC-800和NMC-900催化H2O2分解实验的温度和时间关系图见图6所示。H2O2分解释放热量,分解越快,则温度升高越快。随着H2O2含量的减少,温度达到最高,然后开始下降。对温度升高线性段进行线性拟合,得到H2O2分解的升温速率,NMC-700, NMC-800和NMC-900分别为1.51、 4.75和6.92 ℃·min-1。碳化温度越高,其催化分解H2O2能力增强,而材料的氮含量降低,石墨化程度的提高。一般认为,碱性官能团越多,会将多余的电子传递给材料中吸附的过氧化氢分子,产生HO·和HOO·等中间体自由基或MC-OH和MC-OOH等过氧化自由基,从而加速H2O2的分解,使得材料的催化活性增强[16]。因此尽管800 ℃相比于900 ℃的比表面积和介孔体积更高,但催化能力反而降低。对于本文中合成的NMC来说,碳化温度高石墨化程度高,提高了电子的传递能力,从而提高了H2O2分解活性。
对催化分解双氧水能力较好的两种含氮多孔碳材料NMC-800和NMC-900进行套用,结果见图7所示。循环使用5次后,材料催化分解H2O2的速率基本不变,说明NMC-800和NMC-900稳定性良好。

Time/min

Repeating times
以三聚氰胺甲醛树脂和CaCl2模板剂制备了含氮中孔碳材料,其中孔部分孔体积达到50%以上,表面氮含量达到3.85at%以上,孔径分布主要集中在4 nm和10 nm,该含氮中孔碳材料具有良好的催化分解双氧水活性以及稳定性。随着碳化温度的提高,氮含量降低、石墨化程度提高各种含氮官能团的分布也发生了变化;双氧水的分解活性也随着碳化温度的增加和增大。因此该材料的催化分解双氧水活性与石墨化程度关系更大。
[1] Shen W Z, Fan W B. Nitrogen-containing porous carbons:Synthesis and application[J].Journal of Materials Chemistry A,2013,1(4):999-1013.
[2] Arrigo R, Hävecker M, Wrabetz S,etal. Tuning the Acid/Base Properties of Nanocarbons by FunctionalizationviaAmination[J].Journal of the American Chemical Society,2010,132(28):9616-9630.
[3] Ziff L. Mechanisms of oxygen reduction reaction on nitrogen-doped graphene for fuel cells[J].Journal of Physical Chemistry C,2011,115(22):11170-11176.
[4] Zhou Y, Zou B, Xiao L,etal. Enhancement of Pt and Pt-alloy fuel cell catalyst activity and durability via nitrogen-modified carbon supports[J]. Energy & Environmental Science, 2010,3(10):1437-1446.
[5] Bagreev A, Bashkova S, Bandosz T J,etal. Adsorption of SO2on activated carbons:The effect of nitrogen functionality and pore sizes[J].Langmuir,2002,18(4):1257-1264.
[6] Besson M, Gallezot P, Perrard A,etal. Active carbons as catalysts for liquid phase reactions[J].Catalysis Today, 2005,102:160-165.
[7] Wang H, Maiyalagan T, Wang X,etal. Review on recent progress in nitrogen-doped graphene:Synthesis,characterization,and its potential applications[J].ACS Catalysis, 2012,2(5):781-794.
[8] Shen W, Fan W. Nitrogen-containing porous carbons:Synthesis and application[J].Journal of Materials Chemistry A,2013,1(4):999-1013.
[9] Hulicova D, Yamashita J, Soneda Y,etal. Supercapacitors prepared from melamine-based carbon[J].Chemistry of Materials,2005,17(5):1241-1247.
[10] Drage T C, Arenillas A, Smith K M,etal. Preparation of carbon dioxide adsorbents from the chemical activation of urea-formaldehyde and melamine-formaldehyde resins[J].Fuel,2007,86(1-2):22-31.
[11] Liu N N, Yin L, Wang C,etal. Adjusting the texture and nitrogen content of ordered mesoporous nitrogen-doped carbon materials prepared using SBA-15 silica as a template[J].Carbon,2010,48(12):3579-3591.
[12] Yang W, Chen S, Lin W,etal. Oxygen reduction on non-noble metal electrocatalysts supported onN-doped carbon aerogel composites[J].International Journal of Hydrogen Energy,2012,37(1):942-945.
[13] Huang Y, Yang F, Xu Z,etal. Nitrogen-containing mesoporous carbons prepared from melamine formaldehyde resins with CaCl2as a template[J].Journal of Colloid and Interface Science,2011,363(1):193-198.
[14] Huang Y, Hu S, Xu Z,etal. Mesoporous carbon materials prepared from carbohydrates with a metal chloride template[J].Journal of Materials Chemistry,2009,19(41):7759-7764.
[15] Rey A, Faraldos M, Bahamonde A,etal. Role of the activated carbon surface on catalytic wet peroxide oxidation[J].Industrial & Engineering Chemistry Research,2008,47(21):8166-8174.
[16] 王宜望. 活性炭碱性的来源、增强及其催化双氧水分解的研究[D].南京:南京林业大学,2015.
[17] Dhaouadi A, Adhoum N. Heterogeneous catalytic wet peroxide oxidation of paraquat in the presence of modified activated carbon[J].Applied Catalysis B-Environmental,2010,97(1-2):227-235.
[18] Datta K K, Balasubramanian V V, Ariga K,etal. Highly crystalline and conductive nitrogen-doped mesoporous carbon with graphitic walls and its electrochemical performance[J].Chemistry-a European Journal,2011,17(12):3390-3397.
[19] Figueiredo J L, Pereira M F R, Freitas M M A,etal. Modification of the surface chemistry of activated carbons[J].Carbon,1999,37(9):1379-1389.
[20] Kundu S, Xia W, Busser W,etal. The formation of nitrogen-containing functional groups on carbon nanotube surfaces:A quantitative XPS and TPD study[J].Physical Chemistry Chemical Physics,2010,12(17):4351-4359.
Preparation of Nitrogen-Containing Mesoporous Carbon and Its Activity of Hydrogen Peroxide Decomposition
YANG Yang1,2, YANG Yang1,2, CHEN Hong-lin1*, ZHANG Xiao-ming1
(1. Chengdu Institute of Organic Chemistry, Chinese Academy of Sciences, Chengdu 610041, China;2. University of Chinese Academy of Science, Beijing 100049, China)
Melamine formaldehyde resin precursors(2) was synthesized from melamine formaldehyde as carbon and nitrogen sources. The nitrogen-containing mesoporous carbon(NMC) was prepared by high temperature carbonization of 2 using CaCl2as template. The structures were characterized by N2adsorption/desorption, SEM, XRD and XPS. The NMCs prepared under carbonization temperatures(700 ℃, 800 ℃ and 900 ℃) exhibit 3.85~10.80at% of surface nitrogen, 570~870 m2·g-1of specific surface area and 4 nm and 10 nm of mesoporous size. The catalytic activity of NMC was tested by decomposition of H2O2, and the results show that the activity increases with increasing of carbonization temperature. The heating rate of decomposition of H2O2by NMC prepared under 900 ℃ was 6.92 ℃·min-1, and remains stable after cycle of five times.
melamine; formaldehyde; mesopore; nitrogen-containing carbon material; CaCl2template method; preparation; hydrogen peroxide decomposition; catalysis
2017-03-27
四川省科技支撑计划(2015GZ0169)
杨阳(1990-),男,汉族,河南焦作人,硕士研究生,主要从事含氮多孔碳材料合成的研究。 E-mail: 583990875@qq.com
陈洪林,博士,研究员,博士生导师, Tel.028-85226215, E-mail: hlchen@cioc.ac.cn
O613.7; O643.36
A
10.15952/j.cnki.cjsc.1005-1511.2017.07.17069

