掺Fe3+A-TiO2的合成及其对酸性红B的光催化降解性能
张一兵, 韩军燕, 王园美, 刘 霞, 徐濛濛
(1. 上饶师范学院 化学与环境科学学院,江西 上饶 334001;2. 江西省塑料制备成型重点实验室,江西 上饶 334001)
·研究简报·
掺Fe3+A-TiO2的合成及其对酸性红B的光催化降解性能
张一兵1,2*, 韩军燕1, 王园美1, 刘 霞1, 徐濛濛1
(1. 上饶师范学院 化学与环境科学学院,江西 上饶 334001;2. 江西省塑料制备成型重点实验室,江西 上饶 334001)
以硫酸氧钛和FeCl3·6H2O为主要原料,采用水热法合成了掺Fe3+的纯锐钛矿型A-TiO2催化剂,其结构经FT-IR和X-射线衍射表征。以波长365 nm紫外灯为光源,酸性红B为降解对象,研究了其光催化降解性能。实验结果表明:掺Fe3+有利于提高TiO2的催化性能,当掺Fe3+量为0.2 mol%时,A-TiO2的光催化性能最强;当掺Fe3+A-TiO2投放量为400 mg·L-1,于20 ℃降解时间40 min,对10 mg·L-1酸性红B溶液(pH=5)的降解率最大(95.11%)。
硫酸氧钛; 掺Fe3+A-TiO2; 水热法; 合成; 酸性红B; 紫外光; 光催化降解
印染废水污染严重,污染物种类众多,色度高,含有许多有毒有害物质,对河流及湖泊有严重污染,特别是进入人体后会产生致癌作用[1]。酸性红B就是其中一种有色染料,具有高芳香性及低生物降解性等特点。这些有机废水严重破坏自然环境和人类健康,妥善处理印染废水迫在眉睫。目前,国内外处理染料废水的方法主要有光催化法、化学氧化法、吸附法及电解法,这些方法单独使用或联合处理[2]。光催化氧化法是近年发展起来的处理染料废水的先进技术,它能够有效破坏许多结构稳定的难降解污染物,和传统降解方法不一样的是,该方法降解污染物较彻底,已受到研究人员的广泛关注[1-14]。该方法最常用的氧化剂是TiO2,因为TiO2具有化学性质稳定、光催化性能好及无毒等特点,因此在催化降解中应用广泛。TiO2晶体有锐钛矿型、板钛矿型和金红石型。板钛矿型TiO2是天然存在的物质,合成条件苛刻;稳定而最常见的金红石晶型TiO2的合成较为容易;而介稳态的锐钛矿型TiO2的合成则相对较难[3],锐钛矿型TiO2即A-TiO2拥有最好的催化性能[4]。TiO2的禁带宽度较大(3.2 eV),只能吸收波长小于387 nm的光量子,而到达地球表面的紫外光辐射只占整个太阳光谱的4%左右,所以TiO2利用太阳光催化反应受到很大限制[2]。掺杂少量金属离子可以提高TiO2的催化性能,研究结果发现掺Fe3+时效果最佳[5]。
本文拟通过掺杂金属离子Fe3+以提高A-TiO2的光催化活性。以硫酸氧钛和FeCl3·6H2O为主要原料,采用水热法合成了掺Fe3+的锐钛矿型A-TiO2(P),其结构经IR和X-射线衍射表征。并研究了酸性红B初始浓度C0、掺Fe3+量、催化剂投放量m及酸性红B溶液的初始pH值等因素对Fe3+A-TiO2紫外光催化降解酸性红B的影响,优化光催化降解过程的条件。
1 实验
1.1 仪器与试剂
722型紫外可见分光光度计;Nicolet FT-IR 6700型红外光谱仪(KBr压片);Dmax/2500PC型X-射线衍射仪。
酸性红B,分析纯,萨恩化学技术(上海)有限公司;硫酸氧钛,化学纯,国药集团上海化学试剂有限公司;尿素,分析纯,广东中山化工厂;FeCl3·6H2O,分析纯,上海市试剂厂综合经营公司;实验用水为二次去离子水。
1.2 P的制备
仅改变FeCl3·6H2O用量,用类似方法制得不同Fe3+掺量的Fe3+A-TiO2粉末P0, P0.1, P0.2, P0.4和P0.6, Fe3+掺量分别为0, 0.1 mol%, 0.2 mol%, 0.4 mol%和0.6 mol%。
1.3 酸性红B的光催化降解
将酸性红B固体粉末用蒸馏水溶解配制成一定浓度溶液(pH=5),用蒸馏水作参比溶液,测定其初始吸光度A0。移取25 mL酸性红B溶液倒入干燥的200 mL烧杯中,加入一定量掺Fe3+A-TiO2粉末,密闭后置于暗箱中,搅拌下于20 ℃用紫外光(λ=365 nm)照射,适时取适量降解溶液,离心两次(除去溶液里的A-TiO2固体)后取上清液测量不同时间降解后酸性红B溶液的吸光度At。由于吸光度A与酸性红的浓度C在同一温度成正比,因此可按下式计算催化降解率D:
D/%=[(A0-At)/A0]×100%
2 结果与讨论
2.1 酸性红B的最大吸收波长
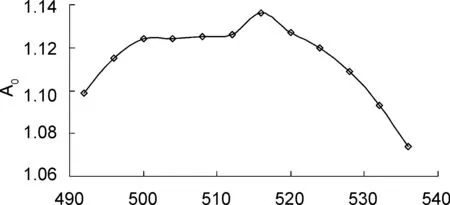
在可见分光光度计上对酸性红B溶液进行490~540 nm波段扫描,测定溶液吸光度A0,以测试数据绘制图1。由图1可以得出,酸性红B的最大吸收波长为516 nm,对应的吸光度A0为1.136。在后续实验中,均在波长516 nm下测定溶液的吸光度。
2.2 表征
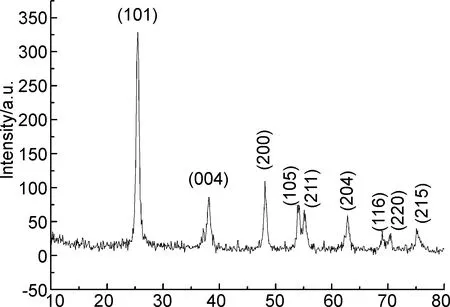
图2为P0.2的XRD图。由图2可见,超强的特征衍射峰出现在2θ25.41°处,对应于锐钛相(101)晶面,说明产物为结晶度高、晶型完整的A-TiO2;次强的衍射峰2θ48.01°,对应晶面(200);稍弱的特征峰2θ38.01°对应于(004)晶面;其它3个较小特征衍射峰的2θ分别为54.71°、 55.16°和63.11°,各对应于(105)、(211)和(204)晶面;余下的3个衍射峰强度均很小。图2中所有的衍射峰均与A-TiO2的标准图峰(对照卡片PDF No 02-0406)吻合,即样品晶体为纯锐钛矿相(A-TiO2),具有较高的光催化性能[4]。图2没有展现Fe3+氧化物FexOy产生的衍射峰原因可能为:(1)Fe3+均匀地分布于TiO2晶格中,(2)若有多余Fe3+(其量极少,因为掺Fe3+量仅为0.2%)则因高度分散,即使氧化物生成其量也微乎其微,难以检出[6]。
λ/nm
2θ/(°)
图3为P0和P0.2的FT-IR谱图。其中Ti—O—Ti键的对称伸缩振动峰位于400~700 cm-1处,Ti—O—C的弯曲振动峰出现在1 061 cm-1[7]。催化剂所吸附的H2O导致了两个主要吸收峰的存在,分别是H—O—H键的弯曲振动对应的1 637 cm-1处吸收峰、H2O和O—H键的伸缩振动和弯曲振动对应的3 000~3 500 cm-1的吸收峰[8],以上结果说明所制得的Fe3+A-TiO2中存在大量OH基团,一方面,OH有益于吸附溶液中的染料分子酸性红B;另一方面,OH促进产生活性自由基,从而有利于提高Fe3+A-TiO2的光催化活性[9]。
对比分析P0和P0.2的FT-IR谱图可知,Fe3+掺杂造成了A-TiO2的吸收波带发生了红移现象,说明催化剂对光谱响应范围扩大了,提高了其对光的吸收效能。产生红移现象的原因为[10]:掺Fe3+后造成了TiO2粒子尺寸的增大,使其量子尺寸效应相对减弱,同时掺Fe3+后造成半导体的带隙宽度的收窄。
为什么这么说呢?因为醋与海鲜长时间同烧,会使海鲜肉质变粗、变柴。同时因为醋的祛腥威力过强,久烹还会将海鲜的鲜味全部去净。

ν/cm-1
2.3 光催化降解的条件优化
(1) 酸性红B的初始浓度C0
配取初始浓度C0分别为75, 50, 30, 20, 10和5 mg·L-1的酸性红B溶液(pH=5,下同),分别加入P0.2使其投放量为400 mg·L-1,紫外光(λ=365 nm,下同)照射40 min,所得光催化降解曲线见图4。
由图4可以看出,当酸性红B的初始浓度C0位于0~10 mg·L-1时,酸性红B的降解率D随着C0的增大陡然增大,且当C0等于10 mg·L-1时降解率最大,继续增大C0酸性红B降解率D则出现先猛然下降(C0增加至30 mg·L-1时)再缓慢下降的过程。当溶液浓度较低时,掺Fe3+能在A-TiO2半导体晶格中引入了缺陷位置或改变了半导体的结晶度,从而抑制了电子-空穴对的复合[11],有助于提高降解率D。初始浓度C0较高时,会减小入射光的透光率,体系对紫外光的吸收率下降,造成光照射所激发的游离电子及空穴数量的减少,溶液中产生能破坏酸性红B分子结构的自由基相应减少,导致降解率D随之降低。因此酸性红B溶液浓度为10 mg·L-1时效果最好。

Time/min
(2) 掺Fe3+量
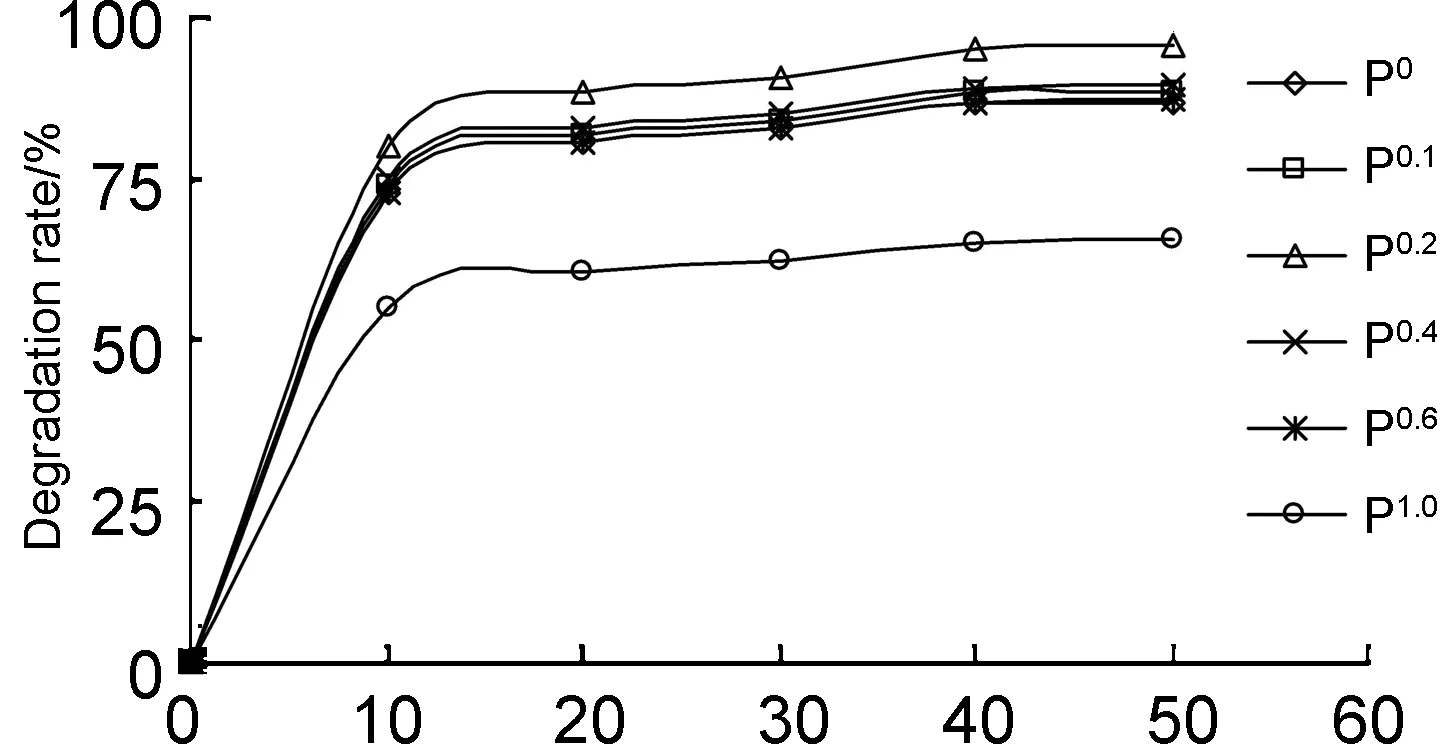
在10 mg·L-1的酸性红B溶液中,分别加入投放量m均为400 mg·L-1的P0, P0.1, P0.2, P0.4, P0.6, P1.0,紫外光照射40 min,所得光催化降解曲线见图5。
Time/min
由图5可以看出,掺Fe3+量低于0.2%时,A-TiO2的催化活性随着掺Fe3+量的增加而快速增大,当掺Fe3+量等于0.2%时,降解率D达到95.11%,此后,随着掺Fe3+量的增加催化剂活性迅速下降。这是因为随着掺Fe3+量的增大,Fe3+特殊的电子结构有利于半导体光生电子的浅度捕获,即有利于光生电子-空穴对的快速移动并有效分离,从而提高A-TiO2的光量子效率和催化活性[12]。当掺Fe3+量超过最佳值时,过多的Fe3+或以氧化物FexOy的形式在A-TiO2晶体表面上堆积,或Fe3+自身会成为光生空穴与电子的复合中心,降低量子效率,光催化作用也就大自然降低。因此,A-TiO2掺Fe3+量以0.2%最佳。
(3) 催化剂用量
取初始浓度C0=10 mg·L-1的酸性红B溶液,加入掺Fe3+量均为0.2%的A-TiO2粉末P0.2,催化剂投放量m分别为200, 240, 320, 400, 480和560 mg·L-1,紫外光照射40 min,所得光催化降解曲线见图6。

Time/min
由图6可以看出,当催化剂投放量m低于400 mg·L-1时,随着m的增大,酸性红B降解率D逐渐升高,当m=400 mg·L-1时D达到最大值(95.11%),继续增加催化剂投放量,降解率D缓慢下降。由于TiO2投放量的增加会导致催化剂转化有效光子的化学能增加,加快了反应速度,降解率D增加。当催化剂投放量超过最佳量时,在提高光子转化化学能几率的同时也会形成严重的光散射效应[7],使光吸收效率下降,光催化反应速率减小,降解率D随之下降[13]。因此,催化剂投放量为400 mg·L-1最优。
(4) 酸性红B初始溶液pH
移取初始浓度C0为10 mg·L-1的酸性红B溶液5份,分别加入投放量为400 mg·L-1、掺Fe3+量为0.2%的A-TiO2催化剂,以强酸或强碱调节溶液pH分别为1, 3, 5, 7和9,紫外光照射40 min,所得光催化降解曲线见图7。
由图7可以看出,在pH值低于5时,随着酸性红B溶液pH值的增加,其降解率D逐渐上升;pH=5时,降解率D达到最大值(95.11%);当pH值高于5时,降解率D迅速下降。可能的原因是:酸性红B溶液的pH值在很大程度上会影响胶体粒子的大小、催化剂表面电荷以及TiO2能带位置[14],催化剂的能带位置都强烈地受到pH值的影响[1],由于它在水中的等电点大约是pH=5,当pH值较低时,催化剂颗粒表面为正电荷,相反则为负电荷。对酸性红B而言,酸性条件下更有利于催化剂吸附酸性红B分子,表现出较高的降解率D,这是由于表面电荷之间的作用性能起了重要的作用。故pH=5最佳。

Time/min
采用水热法合成了掺Fe3+的纯锐钛矿相TiO2。掺Fe3+有利于提高TiO2催化性能,当掺Fe3+量为0.2%(摩尔分数)时,A-TiO2的光催化性能最强。优化了光催化降解条件:在室温下,当掺Fe3+A-TiO2投放量为400 mg·L-1、降解时间为40 min时,对浓度为10 mg·L-1的酸性红B溶液(pH=5)的降解率达到最高(95.11%)。
[1] 徐清艳,黄雅丽. Fe3+掺杂TiO2可见光催化降解酸性红的研究[J].闽江学院学报,2011,32(5):98-102.
[2] 张志强,马琦,张宝柱,等. 影响TiO2催化降解有机物废水效率的主要因素[J].钛工业进展,2006,23(1):45-49.
[3] 于向阳,梁文,程继健. 提高二氧化钛光催化性能的途径[J].硅酸盐通报,2000,19(1):53-57.
[4] 韩承辉,李智渝,沈俭一. 纳米TiO2-Cu2O可见光下光催化降解活性艳红及其机理研究[J].材料导报:研究篇,2014,28(7):4-8.
[5] Choi W, Termin A, Hoffmann M R. The role of metal ion dopants in quantum-sized TiO2:Correlation between photoreactivity and charge carried recombination dynamics[J].Phys Chem,1994,98(5):13669-13679.
[6] 张立德,牟季美. 纳米材料和纳米结构[M].北京:科学出版社,2001:59-88.
[7] Hou Y D, Wang X C.N-doped SiO2/TiO2mesoporous nanoparticles with enhanced photocatalytic activity under visible-light irradiation[J].Chemoshpere,2008,72(3):414-421.
[8] 肖信,张敬环,南俊民,等. 铁离子掺杂磁载TiO2光催化剂的制备及光催化性能[J].硅酸盐学报,2008,36(11):1548-1551.
[9] Wang H, Xu Q, Zheng X,etal. Synthesis mechanism,enhanced visible-light-photocatalytic properties,and photogenerated hydroxyl radicals of PS@CdS core-shell nanohybrids[J].Journal of Nanoparticle Research,2014,16(12):1-15.
[10] Chen X B, Burda C. The electronic origin of the visible-light absorption properties ofC-,N- andS-doped TiO2nanomaterials[J].Journal of the American Chemical Society,2008,130(15):5018-5019.
[11] Ashokkumar M, Maruthamuthu P. Preparation and characterization of doped WO3photocatalyst powders[J].Journal of Materials Science,1989,24(6):2135-2139.
[12] 赵德明,金宁人. 过渡金属Fe3+离子掺杂改性TiO2的光催化性能研究进展[J].浙江工业大学学报,2005,44(2):165-169.
[13] 田琳琳,姚兰芳,许瑞清,等. 铋铁共掺纳米TiO2复合薄膜的制备及光催化性能[J].人工晶体学报,2011,40(3):710-715.
[14] 周武艺,唐绍裘,万隆,等. 纳米TiO2光催化降解有机物的机理及其影响因素的研究[J].中国陶瓷工业,2003,10(5):26-29.
Synthesis of Fe3+-doping A-TiO2and Its Photo-catalytic Degradation Performance for Acid Red B
ZHANG Yi-bing1,2*, HAN Jun-yan1, WANG Yuan-mei1, LIU Xia1, XU Meng-meng1
(1. School of Chemistry and Environmental Science, Shangrao Normal University, Shangrao 334001, China;2. Jiangxi Province Key Laboratory of Polymer Preparation and Processing, Shangrao 334001, China)
Fe3+-doping A-TiO2photo-catalyst was preparedviahydrothermal process using titanyl sulfate and FeCl3·6H2O as raw materials. The structure was characterized by FT-IR and XRD. The photo-catalytic performance was studied using ultraviolet lamp(λ=365 nm) as illumination device and acid red B as stimulant pollutant. The results indicated that Fe3+doping into A-TiO2improved the photo-catalytic performance of TiO2, and when the amount Fe3+-doping was 0.2 mol%, the photo-catalytic activity of A-TiO2was the best. The best degradation rate of acid red B was achieved 95.11% under the following optimal conditions: acid red B’s initial concentration was 10 mg·L-1(pH=5), amount of Fe3+-doping was 0.2 mol%, and catalyst dosage was 400 mg·L-1, irradiation by UV-light at 20 ℃ for 40 min.
titanyl sulfate; Fe3+-doping A-TiO2; hydrothermal process; synthesis; acid red B; UV-light; photo-catalytic degradation
2016-12-26;
2017-05-22
教育部第四批高等学校特色专业建设点资助项目(TS11524); 江西省精品课程(赣教高字[2011]74号)资助项目; 江西省精品资源共享课(赣教高字[2015]79号)资助项目
张一兵(1963-),男,汉族,江西上饶人,硕士,教授,主要从事无机化学与无机材料的研究。 E-mail: srxbzyb@163.com
X703.1; O643
A
10.15952/j.cnki.cjsc.1005-1511.2017.07.16327

