一种新型可降解蓝光固化医用粘合剂的合成及其性能研究
王 敏, 龚文辉, 黄 鹏, 李 森, 叶晓峰*, 游正伟*
(1. 东华大学 材料科学与工程学院 纤维材料改性国家重点实验室,上海 201620;2. 上海交通大学 医学院附属瑞金医院 心脏外科, 上海 200025)
·快递论文·
一种新型可降解蓝光固化医用粘合剂的合成及其性能研究
王 敏1, 龚文辉2, 黄 鹏1, 李 森2, 叶晓峰2*, 游正伟1*
(1. 东华大学 材料科学与工程学院 纤维材料改性国家重点实验室,上海 201620;2. 上海交通大学 医学院附属瑞金医院 心脏外科, 上海 200025)
临床外科手术缝合费时费力,且容易留下疤痕,医用粘合剂为解决这些问题提供了一种有效手段。本文基于在生物材料领域广泛应用的可降解材料聚癸二酸甘油酯(PGS),研制了一种新型的可降解蓝光固化医用粘合剂。以PGS为基体与甲基丙烯酸(2-异氰基乙基)酯反应制得聚癸二酸甘油酯接枝甲基丙烯酸(2-异氰基乙基)酯(PGS-IM)粘结剂,其结构和性能经1H NMR, ATR-FTIR, TGA和DSC表征。并测试了其蓝光固化后的粘结性能,考察了其生物相容性。结果显示:PGS-IM的玻璃化转变温度为-30.6 ℃;玻璃和PET板的粘结强度分别为0.84±0.12 MPa和0.39±0.07 MPa。 RAECs培养实验显示其具有良好的生物相容性。
聚癸二酸甘油酯; 甲基丙烯酸(2-异氰基乙基)酯; 接枝; 医用粘合剂; 合成; 蓝光固化; 生物相容性
缝合技术是外科手术成功的关键,具有相当的技术难度,且耗时较长,技术均一性差。对于外科手术缝合而言,如果缝合不严密,可能会引起局部组织出血、感染甚至不愈合。医用粘合剂作为一种新的闭合技术,简便易用、操作快捷,同时具有止血等作用,受到人们日益广泛的关注。目前,临床上可用的粘合剂主要包括医用级氰基丙烯酸酯(CA)和纤维蛋白封闭剂,前者在体内使用有一定的毒性,后者粘结性弱易被冲洗掉,因而这两类粘合剂的应用均受到限制[1-2]。近年来,新型医用粘合剂的研究越来越多,已开发出如改性聚(乙烯醇)粘合剂[3]、多糖类生物粘合剂[4]和胶原类粘合剂[5-6]等。这些粘合剂通常是通过化学反应实现粘结组织的,往往存在涂上后固化快、不便于实现细微的调整或固化慢、粘结作用较弱等问题。光固化医用粘合剂由于其施胶方便、固化速度快、粘结强度高,受到研究人员的日益青睐[7-12]。然而,这些粘合剂多是亲水性的,在体内易吸水膨胀或被冲水快速冲走[13]。
聚(癸二酸甘油酯)[poly(glycerol sebacate), PGS][14-15]是一种生物相容性良好、可生物降解的疏水性聚合物。众所周知,PGS是由生物相容性良好的癸二酸和甘油制备的,具有较好的生物相容性、可调控的力学性能和降解性能,因此PGS广泛应用于组织工程、生物胶以及药物缓释中。研究表明,以PGS为基体结合丙烯酰氯制备的丙烯酸化聚癸二酸甘油酯(PGSA),将其涂覆在组织病患处,在紫外光照条件下可以使组织粘结在一起,时间短、粘结强度高[16]。然而在制备PGSA的过程中,具有挥发性和腐蚀性的丙烯酰氯和三乙胺,以及制备过程中产生的有毒气体氯化氢对人体均有一定的损伤,实验不易控制,操作较为复杂。另外,当前光固化医用粘合剂的研究多集中于紫外光固化方面,由于紫外光对组织和细胞有一定损伤,因此使其应用受到限制。
为了克服上述问题,本文以PGS为基体结合甲基丙烯酸(2-异氰基乙基)于80 ℃(油浴)反应20 min,制备一种新的酯接枝PGS(PGS-IM)粘结剂(Scheme 1),其结构经1H NMR和ATR-FTIR表征。通过热重分析(TGA)和差示扫描量热分析(DSC)考察了其热学性能,测试了其蓝光固化后的粘结性能,并在其上培养SD大鼠的胸主动脉内皮细胞(RAECs),考察了其生物相容性。
该研究中PGS-IM的制备方法较为简单,并且不会产生有毒气体副产物;PGS-IM的侧链较PGSA的长,容易在光照条件下发生交联固化,并证实其是一种可蓝光固化的医用粘合剂。PGS已被证实具有良好的生物可降解性[17],可以预见这种基于PGS的生物胶也具有较好的生物降解性。
1 实验部分
1.1 仪器与试剂
Bruke AM-400(400 MHz)型核磁共振仪(acetone-d6为溶剂,TMS为内标);Nicolet 6700型红外光谱仪;Discovery型热重分析仪(TGA); 204 F1 Phoenix型差示扫描量热仪(DSC);蓝光光固化机(波长:430~485 nm, 1500 Mw·cm-2); 20KN/WDW3020型微控电子万能试验机(配备200 N传感器);OLYMPUS IX71型倒置相差显微镜。

Scheme 1
癸二酸(≥99%)、无水N,N-二甲基甲酰胺(DMF, 99.8%)和甲基丙烯酸(2-异氰基乙基)酯(98%),百灵威科技有限公司;甘油(≥99.5%),西格玛奥德里奇中国公司;THF(≥99.9%),国药集团化学试剂有限公司;樟脑醌(98%)和2.4-二甲氨基-苯甲酸乙酯(98%),百灵威;DMEM(11965-092)培养基,美国Gibco公司。
1.2 制备
(1) PGS的制备[18]
将重结晶纯化后的癸二酸20.257 4 g(0.1 mol)和甘油9.203 7 g(0.1 mol)加入三口烧瓶中,于135 ℃熔融,通N2反应24 h;于135 ℃抽真空(4 Mbar)48 h。冷却至室温得淡黄色蜡状固体PGS。
(2) PGS-IM的制备
PGS-IM的合成中加料在手套箱中(水含量≤0.1 mg·L-1,氧含量≤0.1 mg·L-1)进行。在反应瓶中依次加入PGS 1.21 g(4.69 mmol)和无水DMF 1.6 mL,氮气保护下于80 ℃(浴温)搅拌使PGS完全溶解;加入甲基丙烯酸(2-异氰基乙基)酯359.5 mg(2.35 mmol),于80 ℃(浴温)反应20 min。用去离子水沉淀除去DMF,用四氢呋喃溶解,重复操作三次,得白色黏稠半固体PGS-IM 1.038 g,产率70%。
1.3 PGS-IM的热学性能表征
PGS-IM的热学性能通过TGA和DSC测试所得。TGA测试在氮气氛围中,以10 ℃·min-1升温速率从40 ℃升至500 ℃。 DSC测试在氮气氛围中,以10 ℃·min-1的速率从室温升温至150 ℃消除热历史,然后降温至-70 ℃,再从-70 ℃升温至150 ℃,进行测试。玻璃化转变温度(Tg)按玻璃化转变过程中的中点温度确定,由仪器自带的分析软件得出。
1.4 PGS-IM粘结性能实验
PGS-IM的粘结实验由透光性较好的玻璃板和可作心脏补片的材料聚(对苯二甲酸乙二醇酯)(PET)板材完成,光源为一台蓝光光固化机,参考国标(GB/T 7124-2008)中胶黏剂的测试方法。将蓝光光固化催化剂樟脑醌和2.4-二甲氨基-苯甲酸乙酯按1 ∶4(m∶m)混合后,按1%(w/w)当量加入PGS-IM中,混合均匀,避光存放。一端带孔(便于力学测试)的玻璃板(100 mm×35 mm×5 mm)另一端均匀涂上20 mg混有催化剂的PGS-IM,涂胶面积35 mm×12 mm,将另一块玻璃板压紧固定,用蓝光光固化机照射60 s。用铁丝穿过玻璃板的孔,将铁丝固定在万能试验机夹具上,以5 mm·min-1拉伸速度进行拉伸测试。PET板测试采用8 mm厚的PET板,将其裁剪成100 mm×20 mm的长条,每两片PET板间均匀涂上10 mg混有催化剂的PGS-IM,涂胶面积20 mm×10 mm,固定后,蓝光光固化机照射60 s。将PET板样条直接夹在万能试验机夹具上以5 mm·min-1速度进行拉伸测试。玻璃和PET板均测试5个样品,剪切强度取平均值。
1.5 PGS-IM的生物相容性测试
将混有催化剂的PGS-IM配制成1 g·L-1的四氢呋喃(THF)溶液,取100 μL均匀涂在细胞爬片(φ18 mm)上,待溶剂挥发后,蓝光光固化机照射30 s,固化后用蒸馏水水冲洗掉残余溶剂。将含有新合成的生物胶涂层的玻璃片和对照的纯玻璃片各三块,放在含有DMEM的6孔平底板中,然后,将按参考文献中[19-20]描述的方法培养的RAECs重新悬浮在上述6孔细胞培养板中培养24 h。用倒置相差显微镜观察细胞生长情况。
2 结果与讨论
2.1 PGS-IM的合成
首先由癸二酸和甘油在真空加热条件下发生缩聚反应制得PGS,然后将具有甲基丙烯酸结构的甲基丙烯酸(2-异氰基乙基)酯通过异氰酸酯基和羟基的反应接枝到PGS上,合成可光固化的PGS-IM。 PGS-IM具有一个高度不对称的双键结构,活性较高,可通过蓝光诱导交联。另外,其侧链具有氨基甲酸结构,可与组织形成氢键,提高其与组织间的粘结力。
2.2 表征
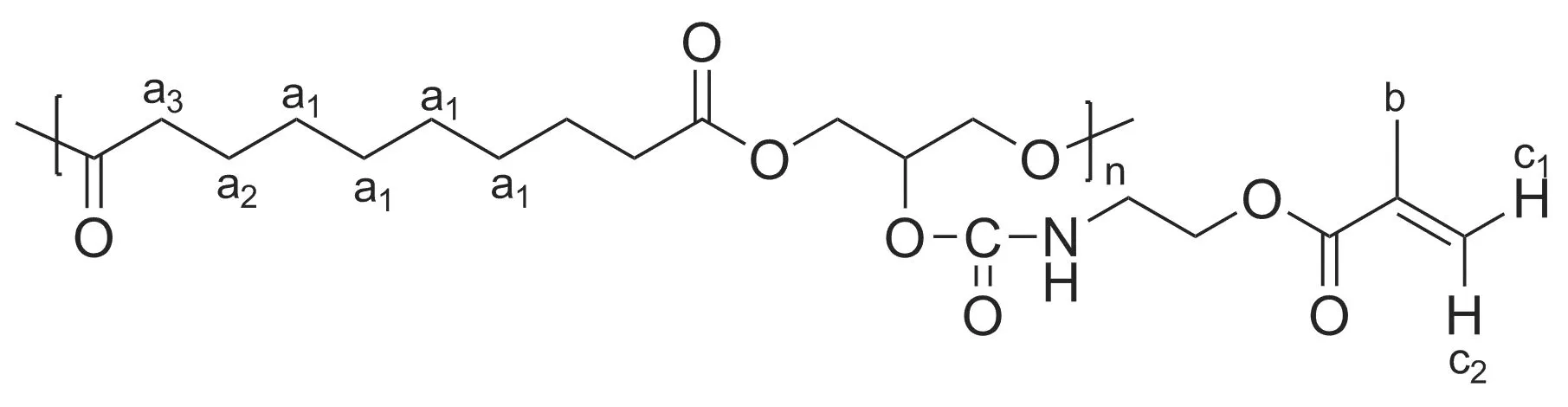
从PGS-IM的1H NMR谱图(图1)可以观察到PGS的癸二酸部分的质子信号分别标为a1, a2, a3(δ1.35, 1.62和2.35),积分比为2 ∶1 ∶1,验证了癸二酸部分的结构。标记为b(δ1.93)的信号峰是甲基丙烯酸(2-异氰基乙基)酯中甲基的质子信号,标记为c1(δ5.61)和c2(δ6.12)的信号峰归属甲基丙烯酸(2-异氰基乙基)酯双键中氢质子,三者积分比为3 ∶1 ∶1,与结构完全符合,从而证实了甲基丙烯酸(2-异氰基乙基)酯的成功接枝。根据接枝侧基的特征峰c1(1个烯氢质子)和主链的特征峰a2(癸二酸结构中的4个亚甲基氢质子)的积分比为0.08 ∶1,计算得接枝率为32%。

δ
图2为PGS-IM的FT-IR谱图。由图2可以看出,3 400 cm-1处的宽峰对应PGS-IM上剩余的未接枝的羟基吸收峰,2 928 cm-1和2 855 cm-1处吸收峰为甲基、亚甲基和次甲基中的C—H吸收峰,1 738 cm-1处尖而强的吸收峰对应羰基的双键伸缩振动峰,1 642 cm-1处吸收峰对应PGS-IM结构中的双键(CH=CH2)吸收峰,1 540 cm-1是酰亚胺基(CONH)的吸收峰,进一步证实了PGS-IM的结构。

ν/cm-1
2.3 PGS-IM的热学性能
PGS-IM的热学性能通过TGA(图3)和DSC(图4)曲线表征。从图3可以看出PGS-IM在200 ℃内无重量减少,说明它具有比较广的温度使用范围。从图4可以得出PGS-IM的玻璃化转变温度(Tg)为-30.6 ℃。在测试温度范围(-70~150 ℃)内没有观察到其熔融和结晶峰,说明在其使用的体温附近,PGS-IM为玻璃化温度之上的无定型状态,具有一定的流动性,便于其涂覆在待粘接底物的表面。

Temperature/℃

Temperature/℃
2.4 PGS-IM的粘结性能
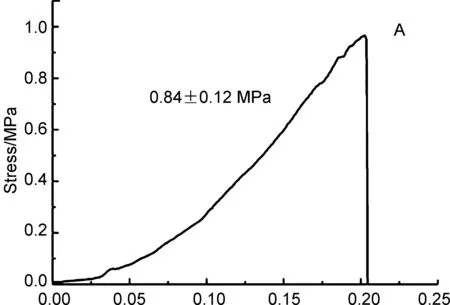
选用玻璃板和PET板(常用的心脏补片材料)作为被粘接材料对PGS-IM的粘结性能进行了测试。首先用PGS-IM将两块测试的板材初步粘接到一起,然后用对组织基本无损伤的蓝光对其进行原位即时固化。固化30 s后即达到较好的粘接性,两块被粘接的板材作为整体可以任意移动,不发生相对移位,而后对其抗剪切拉伸情况进行量化的测试,结果见图5,其中图5A和5B分别为粘接玻璃和PET板的测试结果。结果显示蓝光固化的PGS-IM粘合剂对二者均有较好的粘接性,对玻璃和PET板的粘结强度分别达到0.84±0.12 MPa和0.39±0.07 MPa。
Strain/%

Strain/%
2.5 PGS-IM的生物相容性测试
分别在普通玻片和含有蓝光固化PGS-IM涂层的细胞爬片上培养RAECs。培养两天后,用倒置相差显微镜观察两组细胞的生长情况(图6)。从图中可以看出大鼠主动脉内皮细胞在蓝光固化的PGS-IM胶层上生长良好,在涂层及其放置的细胞培养皿上看不出明显的差异(图6B)。总体生长情况和无涂层的对照组(图6A)相当。说明PGS-IM具有良好的细胞相容性。

图6 大鼠胸主动脉内皮细胞(RAECs)培养2 d后的倒置相差显微镜图像:(A)普通玻片细胞爬片的对照组,(B)涂有蓝光固化PGS-IM涂层的细胞爬片*
设计并合成了一种新型的可降解蓝光固化医用粘接剂聚癸二酸甘油酯接枝甲基丙烯酸(2-异氰基乙基)酯(PGS-IM)。PGS-IM常温下为粘稠的半固体,施胶方便,可蓝光固化,对组织无损伤,固化迅速,固化后粘结性能良好。RAECs培养实验证实其具有良好的生物相容性。综上我们预期PGS-IM有望发展成为有效的医用粘结剂。
[1] Mizrahi B, Stefanescu C F, Yang C,etal. Elasticity and safety of alkoxyethyl cyanoacrylate tissue adhesives[J].Acta Biomater,2011,7(8):3150-3157.
[2] Duarte A P, Coelho J F, Bordado J C,etal. Surgical adhesives:Systematic review of the main types and development forecast[J].Prog Polym Sci,2012,37(8):1031-1050.
[3] Strehin I, Nahas Z, Arora K,etal. A versatile pH sensitive chondroitin sulfate-PEG tissue adhesive and hydrogel[J].Biomaterials,2010,31(10):2788-2797.
[4] Lih E, Lee J S, Park K M,etal. Rapidly curable chitosan-PEG hydrogels as tissue adhesives for hemostasis and wound healing[J].Acta Biomater,2012,8(9):3261-3269.
[5] Jeong J H, Hong S W, Hong S,etal. Surface camouflage of pancreatic islets using 6-arm-PEG-catechol in combined therapy with tacrolimus and anti-CD154 monoclonal antibody for xenotransplantation[J].Biomaterials,2011,32(31):7961-7970.
[6] Rafat M, Li F F, Fagerholm P,etal. PEG-stabilized carbodiimide crosslinked collagen-chitosan hydrogels for corneal tissue engineering[J].Biomaterials,2008,29(29):3960-3972.
[7] Nakayama Y, Okuda K, Takamizawa K,etal. Preparation of well-defined poly(ether-ester) macromers:Photogelation and biodegradability[J].Acta Biomater,2011,7(4):1496-1503.
[8] Matteini P, Ratto F, Rossi F,etal. Emerging concepts of laser-activated nanoparticles for tissue bonding[J].J Biomed Opt,2012,17(1):010701-1-010701-9.
[9] Lauto A, Foster L J R, Ferris L,etal. Albumin-genipin solder for laser tissue repair[J].Laser Surg Med,2004,35(2):140-145.
[10] O’neill A C, Winograd J M, Zeballos J L,etal. Microvascular anastomosis using a photochemical tissue bonding technique[J].Laser Surg Med,2007,39(9):716-722.
[11] Hoogeboom J E, Ranger W R, Leibold W C. Pneumostasis of experimental air leaks with a new photopolymerized synthetic tissue sealant-Discussion[J].Am Surgeon,1997,63(9):795-795.
[12] Elvin C M, Brownlee A G, Huson M G,etal. The development of photochemically crosslinked native fibrinogen as a rapidly formed and mechanically strong surgical tissue sealant[J].Biomaterials,2009,30(11):2059-2065.
[13] Spencer H T, Hsu J T, Mcdonald D R,etal. Intraoperative anaphylaxis to gelatin in topical hemostatic agents during anterior spinal fusion:A case report[J].Spine J,2012,12(8):E1-E6.
[14] Wang Y D, Ameer G A, Sheppard B J,etal. A tough biodegradable elastomer[J].Nat Biotechnol,2002,20(6):602-606.
[15] Rai R, Tallawi M, Grigore A,etal. Synthesis,properties and biomedical applications of poly(glycerol sebacate)(PGS):A review[J].Prog Polym Sci,2012,37(8):1051-1078.
[16] Lang N, Pereira M J, Lee Y,etal. A blood-resistant surgical glue for minimally invasive repair of vessels and heart defects[J].Sci Transl Med,2014,6(218):218-216.
[17] Pomerantseva I, Krebs N, Hart A,etal. Degradation behavior of poly(glycerol sebacate)[J].Journal of Biomedical Materials Research Part A,2009,91A(4):1038-1047.
[18] Gao J, Crapo P M, Wang Y D. Macroporous elastomeric scaffolds with extensive micropores for soft tissue engineering[J].Tissue Eng,2006,12(4):917-925.
[19] Wu X H, Li L. Rosiglitazone suppresses lipopolysaccharide-induced matrix metalloproteinase-2 activity in rat aortic endothelial cellsviaRas-MEK1/2 signaling[J].Int J Cardiol,2012,158(1):54-58.
[20] Mcguire P G, Orkin R W. Isolation of rat aortic endothelial-cells by primary explant techniques and their phenotypic modulation by defined substrata[J].Lab Invest,1987,57(1):94-105.
Synthesis and Properties Research of A Novel Biodegradable Blue Light-crosslinkable Medical Adhesive
WANG Min1, GONG Wen-hui2, HUANG Peng1,LI Sen2, YE Xiao-feng2*, YOU Zheng-wei1*
(1. State Key Laboratory for Modification of Chemical Fibers and Polymer Materials, College of Materials Science and Engineering, Donghua University, Shanghai 201620, China; 2. Department of Cardiac Surgery,Ruijin Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200025, China)
Suturing is an important tissue closure technique. However it is time-cosuming, induces additional damage and scars on the tissue. Medical adhesive can overcome these disadvantages and have emerged as a promising alternative to suture. Here, we designed a new biodegradable medical adhesive. Poly(sebacic glycerides) grafted 2-isocyanateoethyl methacrylate(PGS-IM) based on PGS and 2-isocyanateoethyl methacrylate was synthesized by polyaddition. The structure and properties were characterized by1H NMR, ATR-FTIR, TGA, and DSC. Its adhesive properties on glass and poly(ethylene terephthalate) plates after blue light induced crosslinking were tested. Furthermore, its cytocompatiblity was evaluated by the culture of rat aortic endothelial cells. The results revealed that the glass-transition temperature(Tg) of PGS-IM was -30.6 ℃. The adhesive strength were 0.84±0.12 MPa(glass pane) and 0.39±0.07 MPa(PET pane), respectively, and PGS-IM was a biocompatible material.
poly(sebacic glycerides); 2-isocyanateoethyl methacrylate; graft; medical adhesive; synthesis; photo-crosslinking; blue light; biocompatibility
2016-12-22;
2017-05-24
国家自然科学基金资助项目(21574019, 81571826); 中央高校基本科研业务费专项资金资助项目(2232014A3-01);“东华大学"励志计划"(B201303); 上海交通大学医学院临床潜力学科(瑞金心脏外科)基金资助项目
王敏(1993-),女,汉族,河南鹿邑人,硕士研究生,主要从事医用高分子材料的合成研究。 E-mail: 735248450@qq.com
游正伟,教授,博士生导师, E-mail: zyou@dhu.edu.cn; 叶晓峰,副主任医师,硕士生导师, E-mail: xiaofengye@hotmail.com
O63
A
10.15952/j.cnki.cjsc.1005-1511.2017.07.16320

