金线莲α-葡萄糖苷酶抑制剂提取工艺优化研究
陈哲,张进,钟振声*
(华南理工大学化学与化工学院,广东广州510640)
金线莲α-葡萄糖苷酶抑制剂提取工艺优化研究
陈哲,张进,钟振声*
(华南理工大学化学与化工学院,广东广州510640)
以金线莲为原材料,采用超声辅助提取法提取金线莲α-葡萄糖苷酶抑制剂,考察提取温度、提取时间、固液比、提取次数对α-葡萄糖苷酶抑制率的影响。在单因素试验结果的基础上,采用正交试验对提取工艺条件进行优化。确定最佳提取工艺条件为提取温度60℃,提取时间90 min,固液比1∶15(g∶mL),提取次数为1次。在此工艺条件下,所得的金线莲提取液对α-葡萄糖苷酶的抑制率为31.98%。关键词:金线莲;超声辅助提取;α-葡萄糖苷酶抑制剂;工艺优化
糖尿病是一种因胰岛素分泌不足或胰岛素作用障碍而引起的代谢疾病,它的最主要特征是碳水化合物、脂肪和蛋白质代谢紊乱而导致体内长期处于高血糖状态[1-2]。近几年,全世界的糖尿病发病率呈现持续上升的趋势,已成为世界第三大严重威胁人类健康的非传染病[3-4]。糖尿病分为I型糖尿病和II型糖尿病,II型糖尿病占糖尿病患者90%以上。对于II型糖尿病患者,餐后高血糖的危害远远超过空腹高血糖,通过使用α-葡萄糖苷酶抑制剂来降低餐后血糖是治疗II型糖尿病的重要手段。因此,研究开发α-葡萄糖苷酶抑制剂已成为近年来药物研究的热点[5-7]。
目前,常用的商品化α-葡萄糖苷酶抑制剂有阿卡波糖、伏格列波糖、米格列醇等,它们能够显著降低餐后血糖,增加胰岛素的敏感性,在治疗糖尿病方面有着良好的效果[8]。但是其副作用也很明显,主要集中在肠胀气、肠胃不适等[9],由于糖尿病需要漫长的治疗期,患者需要长期服用相关药物,因此目前α-葡萄糖苷酶抑制剂的副作用问题急需得到解决。相应地,天然来源的α-葡萄糖苷酶抑制剂因不良反应小、控制血糖效果好等优点而成为糖尿病的治疗及保健的重要药物,越来越受到众多学者的青睐[10-12]。
金线莲(Anoectochilus roxburghi)又名金线兰、金丝草等,是兰科(Orchidaceae)开唇兰属(Anoectochilus)的多年生草本植物。我国广西、广东、云南、福建、海南、贵州、四川和台湾等省份均有分布,主要集中在亚热带及热带地区[13-15]。金线莲是我国民间珍稀药材,具有清热凉血、强心利尿等功效,有较强的抗氧化作用,主治糖尿病、肾炎、肺炎等症,素有“药王”、“金草”等美称,几百年来作为民间常用草药使用[16-19]。随着研究的深入,金线莲的药用价值日益突显,其广阔的开发利用前景得到越来越多的关注。本研究采用超声辅助提取法,从金线莲中提取葡萄糖苷酶抑制剂,分析提取工艺参数对金线莲提取物酶抑制率的影响,通过正交试验得出最优提取工艺,以期为金线莲的开发、资源深度利用和提高附加值提供的理论依据。
1 材料与方法
1.1 材料与试剂
金线莲全草干品:广东雁归来公司,经鉴定为福建品种金线莲;α-葡萄糖苷酶(0.1 U/mL)、4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl-alpha-D-glucopyranoside,pNPG):美国Sigma公司;磷酸氢二钾、磷酸二氢钾、氢氧化钠、碳酸钠等(均为分析纯):广州试剂厂。
1.2 仪器与设备
岛津UV-2450紫外可见分光光度计:日本岛津公司;PHS-3CpH计:上海仪电科学仪器股份有限公司;FA2004型电子天平:上海良平仪器仪表有限公司;KQ-300DE型数控超声波提取器:昆山市超声仪器有限公司;DF-101S集热式恒温加热磁力搅器:巩义市予华仪器有限责任公司;FW100高速万能粉碎机:天津市泰斯特仪器有限公司。
1.3 实验方法
1.3.1 金线莲提取液的制备
准确称取4.0 g金线莲粉末至于圆底烧瓶中,加入一定量的蒸馏水,在一定的提取温度下,使用超声辅助(功率为300 W)提取一定时间后,过滤,取滤液用蒸馏水定容至100 mL,即得金线莲提取液,于4℃下保存备用。
1.3.2 对α-葡萄糖苷酶抑制作用的实验方法
参照ANASTASIA W I等[20-21]方法并作改进,在比色管中加入0.1 U/mL的α-葡萄糖苷酶0.4 mL和提取液1.0 mL,37℃水浴20 min后,加入2 mmol/L的pNPG 0.1 mL以启动反应,37℃反应15 min后,加入0.5 mol/L Na2CO3溶液1 mL终止反应,用蒸馏水稀释定容到10 mL,于波长405 nm处测定吸光度值。用等量的蒸馏水代替金线莲提取液作为空白组,等量蒸馏水代替α-葡萄糖苷酶作为背景组。试验重复进行3次,每次使用3根复管,计算抑制率。α-葡萄糖苷酶抑制率计算公式如下:
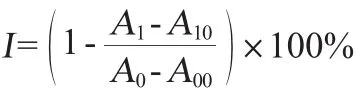
式中:I为α-葡萄糖苷酶抑制率,%;A0、A00、A1、A10分别为空白
管、空白对照管、实验管和实验背景管的的吸光度值。
1.3.3 单因素试验
分别以提取温度(20℃、40℃、60℃、70℃、80℃)、提取时间(15 min、30 min、60 min、90 min、120 min、150 min)、固液比(1∶5、1∶10、1∶15、1∶20、1∶25(g∶mL))、提取次数(1次、2次、3次、4次)为影响因素,α-葡萄糖苷酶抑制率为评价指标,考察各因素对金线莲中α-葡萄糖苷酶抑制物质提取效果的影响。
1.3.4 正交试验设计
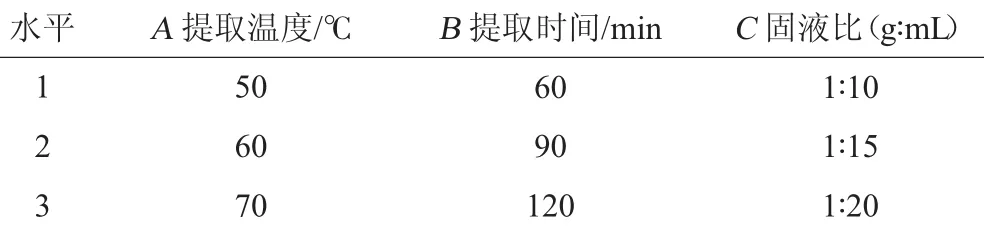
表1 金线莲α-葡萄糖苷酶抑制剂提取工艺优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for extraction technology optimization of α-glucosidase inhibitor in A.roxburghi
在单因素试验结果的基础上,以α-葡萄糖苷酶抑制率为评价指标,选择提取温度(A)、提取时间(B)、固液比(C)为影响因素,每个因素设置3个水平,按照L9(33)正交表进行金线莲α-葡萄糖苷酶抑制剂提取工艺条件优化正交试验,试验因素与水平见表1。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 提取温度对金线莲中α-葡萄糖苷酶抑制物质提取的
影响
考察提取温度对α-葡萄糖苷酶抑制率的影响,结果见图1。
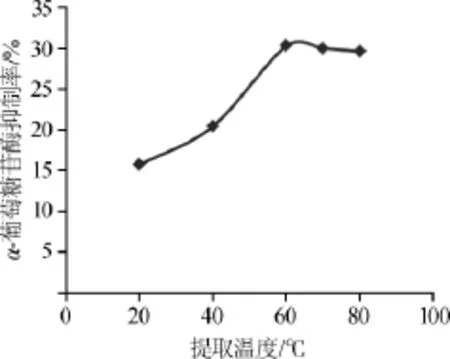
图1 提取温度对α-葡萄糖苷酶抑制率的影响Fig.1 Effect of extraction temperature on inhibition rate of α-glucosidase
由图1可知,随着提取温度的提升,金线莲提取物对α-葡萄糖苷酶的抑制率呈现先升高后略微下降的趋势,当提取温度从20℃升高至60℃时,金线莲提取物对α-葡萄糖苷酶的抑制率逐步上升,说明金线莲中α-葡萄糖苷酶抑制物质需要一定的温度才可溶出,温度提升有利于活性物的释放;当提取温度为60℃时,α-葡萄糖苷酶抑制率达到最大值,表明此时金线莲中α-葡萄糖苷酶抑制物质的溶出达到最大;继续升高提取温度,酶抑制率保持平稳且有略微下降的趋势,表明此时温度的提升对增加金线莲中α-葡萄糖苷酶抑制物质的溶出无太大影响,且温度过高有可能对活性物的结构产生破坏作用。因此,选择提取温度60℃为宜。
2.1.2 提取时间对金线莲中α-葡萄糖苷酶抑制物质提取的影响
考察提取时间对α-葡萄糖苷酶抑制率的影响,结果见图2。
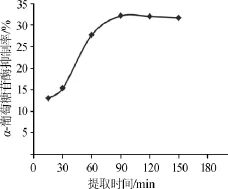
图2 提取时间对α-葡萄糖苷酶抑制率的影响Fig.2 Effect of extraction time on inhibition rate of α-glucosidase
由图2可知,随着提取时间的增加,金线莲提取物对α-葡萄糖苷酶的抑制率呈现先升高后保持平稳的趋势。提取时间在15~90min时,金线莲提取物对α-葡萄糖苷酶的抑制率逐步上升,表明在金线莲中α-葡萄糖苷酶抑制物质的溶出量较高,当提取时间达到90min后,金线莲提取物对α-葡萄糖苷酶的抑制率保持平稳,表明金线莲中的α-葡萄糖苷酶抑制物质基本完全浸出。因此,选择提取时间90min为宜。
2.1.3 固液比对金线莲中α-葡萄糖苷酶抑制物质提取的影响
考察固液比对α-葡萄糖苷酶抑制率的影响,结果见图3。
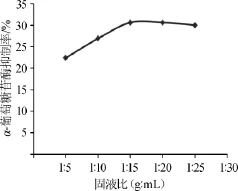
图3 固液比对α-葡萄糖苷酶抑制率的影响Fig.3 Effects of solid-liquid ratio on inhibition rate of α-glucosidase
由图3可知,随着固液比的增加,金线莲提取物对α-葡萄糖苷酶的抑制率呈现先升高后保持平稳的趋势。当固液比从1∶5(g∶mL)增加到1∶15(g∶mL)时,金线莲提取物对α-葡萄糖苷酶的抑制率逐步上升;当固液比达到1∶15(g∶mL)后,金线莲提取物对α-葡萄糖苷酶的抑制率保持平稳,继续增大固液比,可能会造成其他杂质的引入,且对后续的浓缩及分离带来更多能源上的损耗和麻烦。因此,选择固液比1∶15(g∶mL)为宜。
2.1.4 提取次数对金线莲中α-葡萄糖苷酶抑制物质提取的
影响
考察提取次数对α-葡萄糖苷酶抑制率的影响,结果见图4。
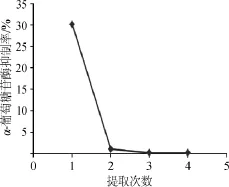
图4 提取次数对α-葡萄糖苷酶抑制率的影响Fig.4 Effects of extraction times on inhibition rate of α-glucosidase
由图4可知,随着浸提次数的增加,金线莲提取物对α-葡萄糖苷酶的抑制率呈现迅速下降的趋势。与第一次提取物对α-葡萄糖苷酶的抑制率相比,第二次提取物对α-葡萄糖苷酶的抑制率已大为下降;第三次和第四次的金线莲提取物对α-葡萄糖苷酶的抑制率已接近于零。这说明金线莲中α-葡萄糖苷酶抑制物质在第一次提取时就已经几乎完全浸出,因此增加提取次数对提取已无太大的帮助。综合考虑,选择提取次数1次为宜。
2.2 正交试验结果分析
根据单因素试验结果,选择提取温度(A)、提取时间(B)、固液比(C)3个因素,以α-葡萄糖苷酶抑制率为评价指标,采用正交试验对金线莲α-葡萄糖苷酶抑制剂提取工艺条件进行优化,正交试验结果与分析见表2,方差分析结果见表3。
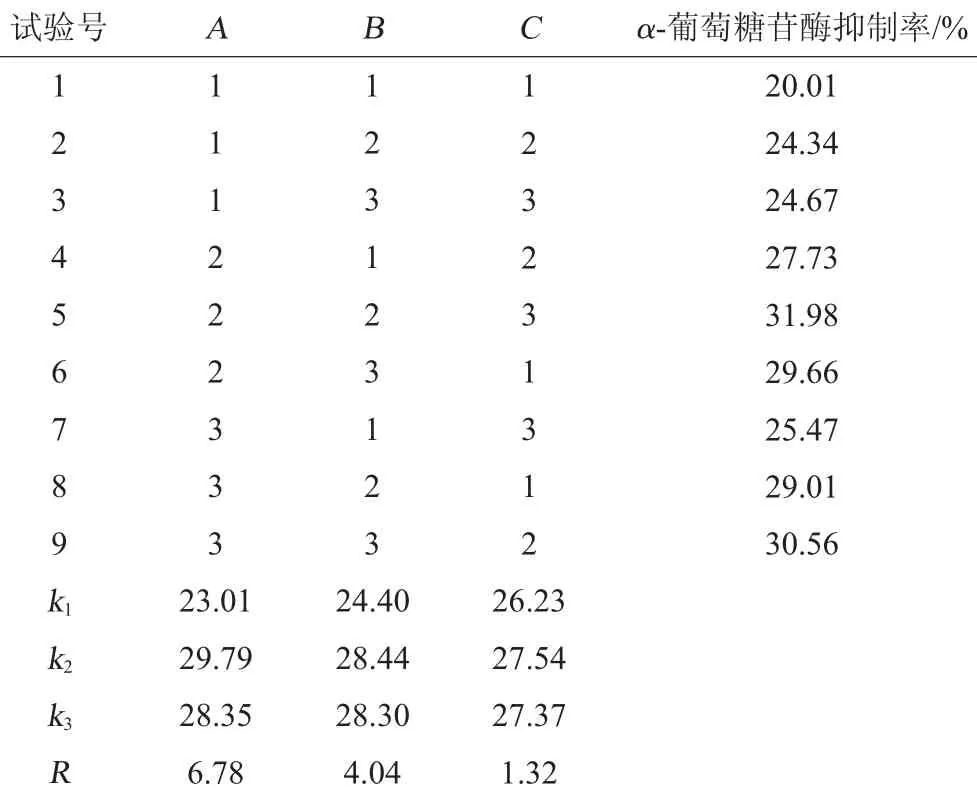
表2 提取工艺优化正交试验结果表Table 2 Results and analysis of orthogonal experiments for extraction technology optimization
由表2中极差R值大小的分析可知,对α-葡萄糖苷酶抑制率结果影响的因素顺序为:提取温度>提取时间>固液比。最佳的提取条件组合为A2B2C2,即提取温度60℃,提取时间90 min,固液比1∶15(g∶mL)。在此最优提取条件下进行3次验证试验,所得的金线莲提取液对α-葡萄糖苷酶的抑制率为31.98%。

表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results
由表3的方差分析可知,在各个因素中,提取温度和提取时间对α-葡萄糖苷酶抑制率的影响比较显著(P<0.05),而提取料液比对α-葡萄糖苷酶抑制率的影响不显著(P>0.05)。
3 结论
本研究以金线莲药材为原材料,以α-葡萄糖苷酶的抑制率为评价指标,考察提取温度、提取时间、固液比、提取次数对酶抑制率的影响。在单因素试验结果的基础上,采用正交试验优化超声辅助提取法提取金线莲α-葡萄糖苷酶抑制剂。结果表明,金线莲α-葡萄糖苷酶抑制剂的最佳提取工艺条件为提取温度60℃,提取时间90 min,固液比1∶15(g∶mL),提取次数1次,在此工艺条件下,所得的金线莲提取液对α-葡萄糖苷酶的抑制率为31.98%。为提升金线莲的附加价值、充分实现金线莲资源的全面利用无疑具有重要的作用。
[1]曹艳,张娜,史亦丽.国内糖尿病治疗药物利用评价[J].中国医院用药评价与分析,2006,6(5):264-267.
[2]李立明.流行病学[M].北京:人民卫生出版社,2003:419.
[3]黄琼刁,邓万溪,黄钦展,等.糖尿病主要并发症年龄与体质之相关性研究[J].世界中医药,2013,8(3):288-290.
[4]傅樱花,张富春.降血糖功能性食品的研究现状[J].食品研究与开发,2011,32(11):165-168.
[5]陈海敏,严小军,林伟.α-葡萄糖苷酶抑制剂类药物的研究进展[J].海洋科学,2005,29(11):73-76.
[6]郭舜民,郭尧惠.天然药降血糖成分的研究进展[J].海峡药业,2000,12(1):1-5.
[7]杜伟奇,施秀芳,邱明艳,等.治疗糖尿病药物的研究进展[J].中国医院药学杂志,2005,25(1):67-69.
[8]张瑞霞,杨凤英,卓文海,等.阿卡波糖的研究进展[J].齐鲁药事,2012, 31(6):360-361.
[9]张丽萍,李舸.伏格列波糖片治2型糖尿病的临床疗效及不良反应[J].中国医药指南,2013,11(2):32-33.
[10]李玉萍,白冰,叶军.α-葡萄糖苷酶抑制剂的制备和活性研究进展[J].食品科学,2008,29(9):617-620.
[11]马庆一,陈春涛,时国庆,等.天然α-葡萄糖苷酶抑制作用的研究[J].食品工业科技,2005,26(8):51-53.
[12]岳振峰,陈小霞,彭志英.α-葡萄糖苷酶研究现状及进展[J].食品与发酵工业,2000,26(3):63-67.
[13]马志杰,胡宏友.民间药材金线莲研究动态[J].亚热带植物科学,2002,31(增刊):27-31.
[14]张以忠,邓琳琼.金线莲研究的现状与展望[J].贵州科学,2007,25(2):81-84.
[15]刘贤旺,赖学文,黄慧莲,等.江西金线莲资源调查简报[J].中国野生植物资源,19(2):25-26.
[16]林宗铿.名贵药材“金线莲”[J].福建热作科技,2003,28(2):45-46.
[17]赖万玉,赖万年.金线莲在海南岛的种植发展前景[J].上海农业学报,2005,21(1):92-94.
[18]杨秀伟,韩美华,靳彦平.金线莲化学成分的研究[J].中药材,2007,3(7):43-46.
[19]陈卓,黄自强.金线莲及其提取物降血糖实验研究[J].福建医科大学学报,2000,34(4):350-353.
[20]ANASTASIA W I,SANRO T,RIZNA T D,et al.Antioxidant and a-glucosidase inhibitor activities of natural compounds isolated from Quercus gilvaBlume leaves[J].Asian Pac J Trop Biomed,2015,5(9): 748-755.
[21]APOSTOLIDIS E,KWON Y I,SHETTY K.Inhibitory potential of herb,fruit,and fungal-enriched cheese against key enzymes linked to type 2 diabetes and hypertension[J].Innov Food Sci Emer Technol, 2007,8:46-54.
Optimization of extraction technology of α-glucosidase inhibitor fromAnoectochilus roxburghii
CHEN Zhe,ZHANG Jin,ZHONG Zhensheng*
(School of Chemistry and Chemical Engineering,South China University of Technology,Guangzhou 510640,China)
UsingAnoectochilus roxburghiias raw material,α-glucosidase inhibitor was extracted fromA.roxburghiiby ultrasonic-assisted extraction method.The effects of extraction temperature,time,solid-liquid ratio and extraction times on the inhibition rate of α-glucosidase were investigated. On the basis of single factor experiments results,the extraction process conditions were optimized by orthogonal experiments.The optimum extraction conditions were determined as:extraction temperature 60℃,time 90 min,solid-liquid ratio 1∶15(g∶ml)and extraction time 1.Under the conditions, the inhibition rate ofA.roxburghiiextracting solution on α-glucosidase was 31.98%.
Anoectochilus roxburghi;ultrasonic-assisted extraction;α-glucosidase inhibitor;technology optimization
TS201.2
0254-5071(2017)07-0135-04
10.11882/j.issn.0254-5071.2017.07.029
2017-03-21
粤港招标项目(201298A13)
陈哲(1991-),男,硕士研究生,研究方向为精细化学品的合成提取和分析。
*通讯作者:钟振声(1955-),男,教授,本科,研究方向为有机精细化学品的合成提取和分析。

