一株植物乳杆菌的分离鉴定及应用
刘宗敏,周红丽,谭兴和*,李清明,王锋,郭红英,刘楚岑,姚荷,王栏树,严钦武
(1.湖南农业大学食品科技学院,湖南长沙410128;2.食品科学与生物技术湖南省重点实验室,湖南长沙410128;3.湖南佳宴食品有限公司,湖南长沙410123;4.湖南插旗菜业有限公司,湖南岳阳414207)
一株植物乳杆菌的分离鉴定及应用
刘宗敏1,2,周红丽1,2,谭兴和1,2*,李清明1,2,王锋1,2,郭红英1,2,刘楚岑1,2,姚荷1,2,王栏树3,严钦武4
(1.湖南农业大学食品科技学院,湖南长沙410128;2.食品科学与生物技术湖南省重点实验室,湖南长沙410128;3.湖南佳宴食品有限公司,湖南长沙410123;4.湖南插旗菜业有限公司,湖南岳阳414207)
从湖南自然发酵的酸豇豆中分离出一株疑似乳酸菌菌株L4,提取其16S rDNA,并经测序、同源性分析和系统发育树构建等,对其属种进行鉴定。结果表明,菌株L4为植物乳杆菌(Lactobacillus plantarum)。通过耐盐、耐酸和降解亚硝酸盐实验发现,菌株L4可在10%食盐含量条件下生长,耐受pH 2.5,对亚硝酸盐的降解率高达99%。接种菌株L4发酵萝卜干,以自然发酵萝卜干为对照,对发酵萝卜干进行感官评定初步探究该菌株发酵萝卜干的特性。结果表明,菌株L4可以缩短萝卜干发酵周期,提高发酵萝卜干感官评分。关键词:酸豇豆;分离鉴定;植物乳杆菌;发酵
酸菜是一种腌制方法比较简单的蔬菜腌制品,全国各地都产酸菜。乳酸菌是酸菜制作中重要的微生物,不同乳酸菌在其发酵过程中起到不同的作用[1-2]。蔬菜经过乳酸菌的发酵作用会呈现出特殊的风味,因地域不同特色各异。我国幅员辽阔,具有地方特色的传统发酵蔬菜众多,这些发酵蔬菜可以作为优良乳酸菌菌株的分离源[3-6]。传统酸菜一般是蔬菜经过自然发酵而成,其口味纯正[7],但往往发酵周期长,工业化生产较困难。乳酸菌在食品发酵业上有重要的应用[8],从自然发酵酸菜中分离出相关乳酸菌并对其进行研究成为一种趋势[9]。目前鉴定乳酸菌较为普遍的方法有传统的表型、生理生化方法和分子鉴定方法,传统鉴定方法中影响操作的因素较多,易造成鉴定结果不够准确。随着分子生物学的发展,分子鉴定的方法被越来越多的采用[10]。16S rDNA序列分析是一种分子水平上鉴定乳酸菌的常用方法,因16S rDNA序列具有高度保守性,这种方法用于菌种鉴定的结果较准确[11-12]。
本研究从湖南自然发酵酸豇豆中分离乳酸菌,并对其进行16S rDNA序列分析。测定乳酸菌的耐盐、耐酸和降解亚硝酸盐特性,并将其接种发酵萝卜干,以期为乳酸菌的应用提供一定理论依据。
1 材料与方法
1.1 材料与试剂
酸豇豆样品:采集自湖南省凤凰县吉信镇,样品采集后,放入无菌取样瓶,并置于冰箱低温(0~4℃)储存,用于实验室菌种分离鉴定工作;MRS琼脂培养基、MRS肉汤培养基:广东环凯微生物科技有限公司;Ezup柱式细菌基因组DNA抽提试剂盒、DNA Ladder Mix maker:生工生物工程(上海)股份有限公司;A038亚硝酸盐测试盒:南京建成生物工程研究所;萝卜干:湖南佳宴食品有限公司;道道全纯正菜籽油:道道全粮油股份有限公司;海藻碘盐(食品级):湖南省湘澧盐化有限责任公司。
1.2 仪器与设备
YXQ-SG46-280S高温灭菌锅:上海博讯医疗设备厂;UV-1750紫外-可见分光光度计:上海元析仪器有限公司;DYCP-31DN DNA电泳槽、DYY-5稳压电泳仪:北京六一仪器厂;FR980凝胶成像仪:上海复日科技仪器有限公司;SS-450离心机:湘潭离心机配件厂;SW-CJ-1FD型单人单面净化工作台:苏州净化设备有限公司。
1.3 方法
1.3.1 乳酸菌的分离纯化
取酸豇豆卤水进行10倍梯度法稀释,选取10-2、10-3、10-4和10-54个稀释度,向平板中加入1 mL稀释液,再倾入冷却至55℃左右的含有2%碳酸钙的MRS琼脂培养基混匀[13],在30℃倒置培养36~48 h后,挑取有较大溶钙圈的单菌落,进行10倍梯度稀释法纯化培养3~4次,挑选乳白色的单个菌落进行革兰氏染色镜检、触酶实验,选取实验结果为革兰氏阳性、触酶阴性的菌株进行4℃斜面保藏和液体保藏。
1.3.2 16S rDNA序列分析
(1)菌株DNA的提取:将供试菌株接种于MRS肉汤培养基中,在30℃培养18~24 h后,离心(4 000 r/min,10 min)收集菌种,并用灭菌生理盐水洗涤,传代培养2~3次后,利用Ezup柱式细菌基因组DNA抽提试剂盒提取菌体DNA。
(2)16S rDNA基因序列聚合酶链式反应(polymerase chain reaction,PCR):PCR扩增采用细菌通用引物。正向引物为27F:5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物为1492R:5′-CTACCAGGGTATCTA ATCC-3′。PCR扩增体系(50.0μL):1.5μL正向27F引物,1.5μL反向1492R引物,1.0 μL基因组DNA,5.0 μL 10×Buffer,1.0 μLTaq聚合酶(5U/μL),1.0μL脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(10mmol/L),39.0μL双蒸H2O。PCR扩增反应程序:94℃预变性4 min,94℃变性45 s,55℃退火45 s,72℃延伸1 min,72℃终延伸10 min,共进行30个循环。PCR扩增产物经1%的琼脂糖凝胶电泳检测后,送往生工生物工程(上海)股份有限公司进行序列测定。
(3)同源性分析与系统发育分析:登陆NCBI(www.ncbi. nlm.gov/blast/)网站,对菌株进行同源性分析。采用MEGA 5.0软件将测得序列与GenBank中的模式菌株16SrDNA序列进行分析,构建系统发育树,得到目的菌株的系统发育地位。
1.3.3 乳酸菌耐盐试验
乳酸菌活化后,按3%接种量(以试管中10 mL MRS肉汤培养基为基准,下同)分别接种于食盐含量为0、2%、4%、6%、8%和10%的MRS肉汤培养基中[14],在30℃培养18 h(通过测定该乳酸菌的生长曲线发现,该乳酸菌在培养18 h时进入衰亡期;培养0 h时OD值为0.26),测定培养液在波长600nm处的吸光度值,观察其生长情况。每组两个平行。
1.3.4 乳酸菌耐酸试验
乳酸菌活化后,按3%接种量分别接种于用6 mol/LHCl调节pH值为2.0、2.5、3.0、3.5和4.0的MRS肉汤培养基中,在30℃培养18 h(培养0 h时OD600nm值为0.26),测定培养液在波长600 nm下的吸光度值,观察其生长情况。每组两个平行。
1.3.5 乳酸菌降亚硝酸盐试验
乳酸菌活化后,按3%接种量分别接种于亚硝酸钠质量浓度为50 mg/L、100 mg/L、150 mg/L、200 mg/L和250 mg/L的MRS肉汤培养基中,在30℃培养18 h(培养0 h时OD600nm值为0.26),测定培养液在波长600 nm下的吸光度值,观察菌株生长情况,并使用亚硝酸盐测试盒测定培养液中残留亚硝酸盐浓度[15]。每组两个平行。亚硝酸盐计算公式如下:

式中:X1为试样中亚硝酸盐的含量,mg/kg;m2为测定用样液中亚硝酸钠的质量,μg;m3为试样质量,g;V1为测定用样液体积,mL;V0为试样处理液总体积,mL。
1.3.6 乳酸菌发酵萝卜干试验
将萝卜干漂洗切分后,加入一定量水分(包括接种菌液)和食盐,按5%接种量(以每坛发酵萝卜干总质量为基准)接种乳酸菌,以不接种自然发酵作为对照,使萝卜干最终含水量为65%,食盐含量为5%,拌匀并装坛,坛沿使用道道全纯正菜籽油密封,发酵温度28℃,每组两个平行。
1.3.7 感官品质评定
邀请10名有经验的感官评定员,按照表1标准对发酵萝卜干进行感官评分[16]。发酵0~50 d期间,每隔10 d取样进行感官评定,满分为100分。

表1 发酵萝卜干感官评分标准Table 1 Sensory evaluation standard of fermented dried turnip
2 结果与分析
2.1 菌落及菌体特征
从酸豇豆中分离得到菌株L4,其菌落形态如图l所示。由图l可知,通过观察菌株L4在MRS琼脂培养基平板上的生长情况,发现其生长状态良好。菌株L4菌落呈乳白色,边缘规则,表面湿润且光滑,菌落直径在1.0~2.0 mm之间。

图1 菌株L4的菌落形态Fig.1 Colony morphology of strain L4
通过革兰氏染色和触酶实验,在10×100倍光学显微镜下,观察菌株L4的革兰氏染色结果如图2所示。由图2可知,菌株L4为短杆菌,且其菌体的排列方式有单个和链状排列,菌株L4为革兰氏阳性、触酶阴性菌株。

图2 菌株L4的革兰氏染色结果Fig.2 Gram staining results of strain L4
2.2 16S rDNA基因序列PCR扩增
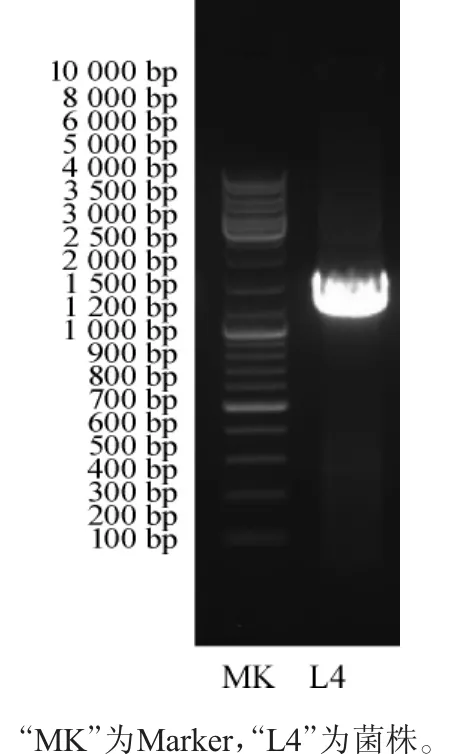
图3 菌株L4的16S rDNA扩增产物电泳图Fig.3 Electrophoresis of 16S rDNA amplification products of strain L4
将菌株L4的基因组DNA进行16S rDNA基因序列PCR扩增,扩增产物通过1%琼脂糖凝胶电泳检测,结果如图3所示。由图3可知,菌株L4的PCR产物条带单一,在1 500 bp处有特异性亮带,亮带无拖尾,说明无明显非特异性扩增,满足测序要求。
2.3 16S rDNA序列分析与系统发育树的构建
2.3.1 16S rDNA性同源对比
登录NCBI网站,将所测定的菌株L4的16S rDNA序列与该网站数据库进行BLAST(https://blast.ncbi.nlm.nih. gov/Blast.cgi)同源性比对,寻找与目的基因序列同源性较高的已知分类地位的菌种。将菌株L4的16S rDNA序列与Genbank中的已知基因序列对比可知,菌株L4与植物乳杆菌(Lactobacillus plantarum)同源性最高,且菌株的同源性达到99%以上。
2.3.2 构建系统发育树
用MEGA5.0软件构建系统发育树,进行聚类性分析[17],得到系统发育树如图4所示。由系统发育树可知,送检菌株L4与已报道的Lactobacillus plantarumAB362768.1模式植物乳杆菌亲缘关系最为接近,在NCBI上比对其相似度100%。菌株L4菌落和菌体特征符合植物乳杆菌的基本特征,结合分子生物学鉴定结果,可以将菌株L4确定为植物乳杆菌(Lactobacillus plantarum)。
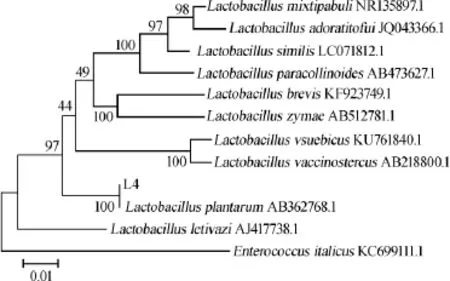
图4 菌株L4的16S rDNA序列系统发育树Fig.4 Phylogenic tree of strain L4 based on 16S rDNA sequence
2.4 菌株L4耐盐性测定
食盐含量是影响乳酸菌活性的重要因素,当食盐含量较低时(<2%),乳酸菌生长较快,当食盐含量较高时(>3%),乳酸菌的生长会受到抑制[18]。根据乳酸菌对不同盐含量的适应能力拓展其应用范围,可满足不同地区对发酵不同食盐用量的需求。由图5可知,培养18h后,菌株L4的培养液的OD600nm值随着食盐含量的增加而明显减小(P<0.05),说明食盐含量对菌株L4的生长有较大的影响。当食盐含量为0时,菌株L4培养液的的OD600nm值可达7.59±0.02;当食盐含量为2%时,菌株L4的OD600nm值为6.57±0.18,两者差异显著(P<0.05),说明2%食盐含量在一定程度上抑制了菌株L4的生长。曲线在食盐含量4%~8%变化趋势比0~4%变化明显,说明高浓度食盐能明显抑制菌株L4的生长。但当食盐含量为10%时,菌株L4的OD600nm值可达0.72±0.05,明显大于培养0 h时的OD600nm值0.26±0.00(P<0.05),说明菌株L4可以在食盐含量10%条件下进行一定程度的增殖,这可能和用于分离的酸豇豆含盐量较高有关,同时也表明菌株L4可以用于发酵食盐含量较高的蔬菜。有研究发现,植物乳杆菌可耐受较高的食盐含量,但当食盐含量在5%~10%时,其活性有利于产品的发酵及保藏[19]。
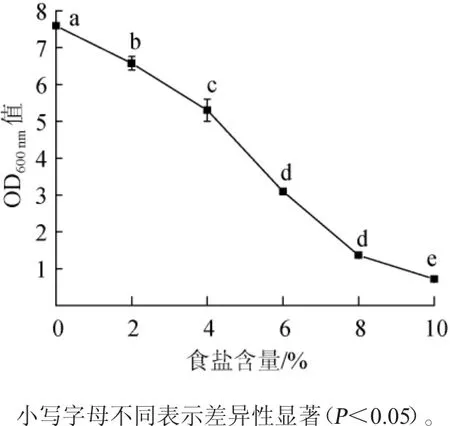
图5 不同食盐含量对菌株L4生长的影响Fig.5 Effect of different NaCl concentrations on the growth of strain L4
2.5 菌株L4耐酸性测定
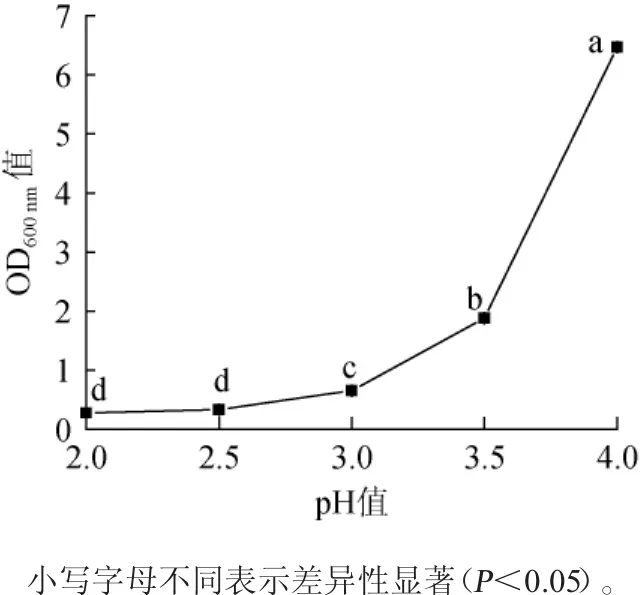
图6 不同pH对菌株L4生长的影响Fig.6 Effect of different pH on the growth of strain L4
将菌株L4分别接种于pH值为2.0、2.5、3.0、3.5和4.0的MRS肉汤培养基中培养,观察其生长情况,初步判定菌株L4是否具有耐酸性。由图6可知,MRS肉汤培养基的pH越高,菌株L4经培养18 h时的OD600nm值越大。当菌株L4在pH值为2.5的MRS液体培养基中培养18 h时,其OD600nm值为0.34±0.15,略大于pH值为2.0时的OD600nm值0.28±0.01(P>0.05),但明显大于培养0 h的OD600nm值0.26±0.00(P<0.05)。说明菌株L4在pH值为2.5时仍能进行一定程度的增殖,具有潜在的益生特性[20]。MRS肉汤培养基pH值在2.5~4.0之间时,菌株L4经培养18h时的OD600nm值随pH值的增大而显著增加(P<0.05);当pH值为4.0时,其OD600nm值增至6.47±0.06。故菌株L4可以耐受pH 2.5的酸性环境。
2.6 菌株L4降解亚硝酸盐性能测定
亚硝酸盐质量浓度对菌株L4生长的影响如图7所示。由图7可知,随着MRS肉汤培养基中亚硝酸盐质量浓度的增加,菌株L4经培养18h时的OD600nm值明显下降(P<0.05),说明菌株L4的数量随着亚硝酸盐质量浓度的增加而减少。培养液中亚硝酸盐质量浓度越大,对菌株L4生长的抑制作用越明显。但当亚硝酸盐质量浓度为250 mg/L时,菌株L4的OD600nm值为5.51±0.04,明显大于培养0 h的OD600nm值0.26±0.00(P<0.05),说明菌株L4在亚硝酸盐质量浓度为250 mg/kg时仍生长较好。

图7 不同亚硝酸盐质量浓度对菌株L4生长及对其降解亚硝酸盐的影响Fig.7 Effect of different nitrite concentrations on the growth of strain L4 and nitrite degradation
MRS肉汤培养基中亚硝酸盐质量浓度不同,菌株L4降解亚硝酸盐的程度不同。随着亚硝酸盐质量浓度的增加,菌株L4对亚硝酸盐的降解率逐渐下降,可能由于培养液中菌株L4的数量随亚硝酸盐质量浓度的增加而减少有关。但随着亚硝酸盐质量浓度的增加,菌株L4降解亚硝酸盐率下降幅度较小,都在99%左右。当亚硝酸盐质量浓度为50 mg/L时,MRS肉汤培养基中亚硝酸盐降解率高达(99.14±0.15)%,可能原因有以下几种:菌株L4产酸能力较强,在培养18 h时各组培养液的pH值降低到3.72左右,相差不显著(P>0.05),大量的H+会促进亚硝酸盐的酸降解;菌株L4在生长代谢过程中会产生一定数量的胞外酶,促进亚硝酸盐的酶降解;菌株L4在生长代谢时,会摄入培养液中的亚硝酸盐并将其代谢掉。但菌株L4降低培养液中亚硝酸盐含量的具体原理尚不清楚,有待进一步研究。
2.7 发酵萝卜干感官评定
食品感官品质是影响消费者购买食品的重要因素。食品感官分析实用性强,可以解决一些理化分析不能解决的问题[21]。接种发酵和自然发酵萝卜干感官评分见图8。由图8可知,接种发酵和自然发酵萝卜干感官评分随发酵时间的延长呈上升趋势,且发酵0~50 d期间,接种发酵萝卜干评分一直大于自然发酵的;发酵1~20d期间,萝卜干土腥味较重,软黏、涩口、偏咸;发酵30d时,萝卜干土腥味基本消失,接种发酵和自然发酵萝卜干感官评分分别为(84.7±1.2)分和(74.5±1.0)分,两者差异显著(P<0.05),说明接种发酵能加速萝卜干的发酵速度;发酵30~50 d期间,随着盐分继续渗透到萝卜干内部和微生物的发酵作用[22-23],萝卜干逐渐变脆,且咸度适口,发酵萝卜香味明显。发酵40d时,接种发酵的萝卜干感官评分最高,为(90.2±1.2)分;发酵50 d时,接种发酵萝卜干感官评分下降为(87.2±1.0)分,但还是显著(P<0.05)高于自然发酵萝卜干感官评分(84.6±1.1)分。说明菌株L4发酵虽能加快萝卜干的发酵速度,但发酵时间过长,萝卜干的感官品质反而会下降。

图8 发酵萝卜干感官评分结果Fig.8 Results of sensory evaluation of fermented dried turnip
3 结论
本实验从湖南自然发酵的酸豇豆中分离出一株乳酸菌L4,采用16S rDNA序列分析法鉴定其为植物乳杆菌(Lactobacillus plantarum)。菌株L4能耐受10%的食盐含量和pH 2.5的酸度,且对亚硝酸盐的降解率高达99%。将菌株L4接种到萝卜干中进行发酵,发现其可以加快萝卜干的发酵速度,提高发酵萝卜干的感官评分。本研究结果为植物乳杆菌L4的后期应用提供了一定的理论依据,但对其代谢产物及其对发酵蔬菜风味的影响等还有待进一步的研究。
[1]SANG H J,JI Y J,LEE S H,et al.Microbial succession and metabolite changes during fermentation of Dongchimi,traditional korean watery Kimchi[J].Int J Food Microbiol,2013,164(1):46-53.
[2]KIM H,BONG Y,JEONG J,et al.Heterofermentative lactic acid bacteria dominate in korean commercial Kimchi[J].Food Sci Biotechnol,2016, 25(2):541-545.
[3]敖晓琳,张小平,史令,等.四川泡菜中两株优良乳酸菌的鉴定及不同发酵条件对其发酵泡菜品质的影响[J].食品科学,2011,32(11):152-156.
[4]吕秀红,陈凯飞,朱祺,等.降胆固醇乳酸菌的筛选与鉴定[J].中国食品学报,2016,16(3):198-204.
[5]张蓓蓓,王柱,王宪斌,等.四川地区泡菜微生物的多样性分析[J].食品与发酵科技,2016,52(1):1-5.
[6]朱军莉,赵进,朱雅霏.自然发酵蔬菜制品中降解亚硝酸盐乳酸菌的分离与鉴定[J].中国酿造,2015,34(6):39-42.
[7]张良,向文良,曾泽生,等.四川泡菜乳酸发酵菌剂的研究[J].食品科学,2013,34(19):200-206.
[8]叶巍.乳酸菌DNA序列分析与功能基因研究现状[J].江苏农业科学,2014,42(10):40-41.
[9]陆利霞,王晓飞,熊晓辉,等.植物乳杆菌B2纯种发酵萝卜泡菜的研究[J].食品工业科技,2005,26(7):59-60.
[10]庞会利,谈重芳,蔡义民,等.乳酸菌分类鉴定方法的研究进展[J].中国酿造,2009,28(6):1-5.
[11]CHEN Y S,WU H C,PAN S F,et al.Isolation and characterization of lactic acid bacteria from Yan-taozih(pickled peaches)in Taiwan[J]. Ann Microbiol,2013,63(2):607-614.
[12]李欣,武俊瑞,田甜,等.大庆自然发酵酸菜中乳酸菌的分离鉴定及耐酸菌株初步筛选[J].食品科学,2014,35(1):150-154.
[13]JI Y J,LEE S H,JIN H M,et al.Metatranscriptomic analysis of lactic acidbacterialgeneexpression duringkimchi fermentation[J].Int J Food Microbiol,2013,163(2):171-179.
[14]杜庆.仔姜乳酸发酵工艺研究[D].重庆:西南大学,2009.
[15]YAN P M,XUE W T,TAN S S,et al.Effect of inoculating lactic acid bacteria starter cultures on the nitrite concentration of fermenting Chinese paocai[J].Food Control,2008,19(1):50-55.
[16]牛广财,魏文毅,朱丹,等.低盐麻辣风味萝卜干的研制[J].包装与食品机械,2013,31(1):62-65.
[17]汪立平,汪欣,艾连中,等.纯种植物乳杆菌发酵低盐萝卜泡菜的研究[J].食品科学,2013,34(17):182-186.
[18]JI Y J,LEE S H,CHE O J.Kimchi microflora:history,current status, and perspectives for industrial kimchi production[J].Appl Microbiol Biot,2014,98(6):2385-2393.
[19]PALOMINO J M,ÁRBOL J T D,BENOMAR N,et al.Application of Lactobacillus plantarumLb9 as starter culture in caper berry fermentation[J].LWT-Food Sci Technol,2014,60(2):788-794.
[20]WOUTERS D,BERNAERT N,CONJAERTS W,et al.Species diversity,community dynamics,and metabolite kinetics of spontaneous leek fermentations[J].Food Microbiol,2013,33(2):185.
[21]刘登勇,董丽,谭阳,等.食品感官分析技术应用及方法学研究进展[J].食品科学,2016,37(5):254-258.
[22]汪立平,汪欣,艾连中,等.纯种植物乳杆菌发酵低盐萝卜泡菜的研究[J].食品科学,2013,34(17):182-186.
[23]侯晓艳,陈安均,罗惟,等.不同乳酸菌纯种发酵萝卜过程中品质的动态变化[J].食品工业科技,2015,36(2):181-185.
Isolation,identification and application of aLactobacillus plantarumstrain
LIU Zongmin1,2,ZHOU Hongli1,2,TAN Xinghe1,2*,LI Qingming1,2,WANG Feng1,2,GUO Hongying1,2,LIU Chucen1,2, YAO He1,2,WANG Lanshu3,YAN Qinwu4
(1.College of Food Science and Technology,Hunan Agricultural University,Changsha 410128,China;2.Hunan Provincial Key Laboratory of Food Science and Biotechnology,Changsha 410128,China;3.Hunan Jiayan Food Company Limited,Changsha 410123,China; 4.Hunan Cha Qi Vegetables Industry Company Limited,Yueyang 414207,China)
One strain of suspected lactic acid bacteria L4 was isolated from natural fermented acid cowpea in Hunan province.The 16S rDNA was extracted from strain L4 and the strain was identified by DNA sequencing,homology analysis and phylogenetic tree.The results indicated that strain L4 belonged toLactobacillus plantarum.After salt resistance,acid resistance and nitrite degradation experiments,results showed that strain L4 could grow under 10%NaCl concentration,tolerate pH 2.5 and the degradation rate of nitrite reached up to 99%.Using natural fermented dried turnip as control,dried turnip inoculated with strain L4 as experimental sample,the characteristics of fermented dried turnip was investigated by sensory evaluation.The results showed that strain L4 could shorten the fermentation period and improve the sensory evaluation score of fermented dried turnip.
acid cowpea;isolation and identification;Lactobacillus plantarum;fermentation
TS255.53
0254-5071(2017)07-0095-05
10.11882/j.issn.0254-5071.2017.07.021
2017-03-09
湖南省重点研发计划(2016NK2113)
刘宗敏(1992-),女,硕士研究生,研究方向为蔬菜加工。
*通讯作者:谭兴和(1959-),男,教授,博士,研究方向为农产品加工及贮藏。

