猪血清淀粉样蛋白3分子SYBR GreenⅠ实时荧光定量PCR检测方法的建立及初步应用
郇贝丽,刘 珂,马改妮,魏建超,邵东华,李蓓蓓,邱亚峰,石元元,马志永
(中国农业科学院上海兽医研究所,上海200241)
·研究论文·
猪血清淀粉样蛋白3分子SYBR GreenⅠ实时荧光定量PCR检测方法的建立及初步应用
郇贝丽,刘 珂,马改妮,魏建超,邵东华,李蓓蓓,邱亚峰,石元元,马志永
(中国农业科学院上海兽医研究所,上海200241)
分别根据猪血清淀粉样蛋白3(serum amyloid A3,SAA3)基因序列以及猪三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因全长序列设计特异性扩增引物,进行PCR扩增,并将PCR扩增片段连接至相应载体上构建重组质粒。两个重组质粒经测序鉴定和纯化后,倍比稀释作为标准曲线样品,用于实时荧光定量PCR中SAA3、GAPDH标准曲线的制备,并进行反应的灵敏性、特异性和重复性检测。结果显示,标准曲线线性关系 R2均在0.98以上;特异性检测显示该引物可以特异性检测到猪 SAA3、GAPDH扩增曲线;组内和组间变异系数均小于5%,说明本研究成功建立猪SAA3的荧光定量PCR检测方法。运用建立的荧光定量RT-PCR对正常以及感染猪繁殖与呼吸综合征病毒的肺泡巨噬细胞和猪组织进行检测,可检测到猪SAA3的表达,正常组与接毒组之间显示出明显的表达差异。本研究初步建立了检测猪SAA3基因的SYBR Green荧光定量RT-PCR的方法,为后续对猪传染性疾病与猪 SAA3之间相互关系的研究提供了一种特异、灵敏的检测方法。
猪血清淀粉样蛋白3;SYBR GreenⅠ;实时荧光定量PCR
血清淀粉样蛋白3(serum amyloid A3,SAA3)是血清淀粉样蛋白(serum amyloid A,SAA)家族的一员。SAA是一类多基因编码的多形态蛋白家族,属于急性时相反应蛋白, 在医学上是炎性反应的重要指标。SAA基因含有4个外显子和3个内含子,包括SAA1、SAA2、SAA3、SAA4四个基因,猪的SAA基因位于2号染色体上,基因长度大约为60 kb。SAA3基因位于第4个外显子处。SAA3是一种分泌蛋白,由130个氨基酸组成,其中1~18位氨基酸为信号肽。目前研究表明,SAA3是猪血液循环中主要的SAA蛋白。
本实验室前期研究发现SAA3可能是一种与PRRSV复制密切相关的因子,但是其与病毒相互作用的具体机制却没有相关报道。为进一步研究SAA3与病毒相互作用机制及其与PRRSV临床发病的关系,建立一种能高效检测SAA3的方法非常必要。本研究针对猪SAA3基因保守区设计1对引物,拟建立一种能够稳定精确检测猪SAA3基因表达的荧光定量RT-PCR方法,为针对SAA3分子的进一步研究奠定基础。
1 材料与方法
1.1 猪组织样品 所有猪组织样品均由上海奉贤区某猪场提供。
1.2 主要试剂 Trizol 试剂、反转录酶MLV、RNA酶抑制剂、ExTaq DNA 聚合酶、pMD 18T载体、SYBR Green Ex Taq II及快速反转录试剂盒均购自大连TaKaRa公司;胶回收试剂盒、质粒提取试剂盒购自康宁Axygen公司;动物组织RNA试剂盒、大肠杆菌DH5α购自TIANGEN公司。
1.3 引物 根据GenBank数据库中的猪三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、SAA3基因序列,利用Beacon Designer 7针对其保守区设计特异性引物。Sus scrofa GAPDH 1r:TCTGGCAAAG TGGACATT,Sus scrofa GAPDH 2r:GGTGGAATC ATACTGGAACA;Sus scrofa SAA3 1r:ATGGGC ATCATTCCTCAA,SAA3 2r:TTTGTAATTGG CTTCTCTCAT。利用Primer Premier 5.0引物设计软件设计猪GAPDH、SAA3扩增引物,Sus scrofa GAPDH 1R:TATAAATTCCGGCTGCAGCCTTCCC CTGCGCTCTCTGCTCCT,Sus scrofa GAPDH 2R:GGGTACAGTGTACTTTATTGATGGTACATGAC GAGGCAGGTCTCCCT,扩增全长为1304 bp。Sus scrofa SAA3 1R:GCGTCGACATGAAGCTTTCCA CGGGCATCATTTTCTGCTTCCT,Sus scrofa SAA3 2R:CGGGATCCGTACTTGTCAGGCAGGCCACG AGGTCTGAAGTGGT,扩增全长为393 bp。引物均由上海Invitrogen公司合成。
1.4 标准品的制备
1.4.1 细胞RNA的提取及反转录 细胞样品按照Trizol法说明书提取总RNA,以2μL总RNA为模板进行反转录,体系为20μL,包含1μL Random Primer随机引物、4μL 5×反转录Buffer、2μL DTT,1μL dNTP mix(10 mmol/L)、1μL反转录酶(200 U/ μL)、1μL RNA RNase Inhibiton(20 U/μL),混匀后于37℃水浴作用1.5 h,用于猪SAA3、GAPDH扩增实验。
1.4.2 标准品目的片段PCR及重组质粒的构建 猪GAPDH基因扩增体系:cDNA模板2 μL、上下游引物各0.25 μL(50 pmol/μL)、dNTP Mixture(2.5mmol/μL)4 μL、Ex Taq酶0.5 μL,10×PCR Buffer 2.5 μL,加水至25 μL。反应程序:98℃预变性5 min;98℃变性1 min,56℃退火30 s,72℃延伸2 min,共35个循环;72℃延伸10 min。反应结束后,取50 μL PCR 产物在1%琼脂糖凝胶上电泳检测扩增结果。回收纯化目的片段,与pMD 18 T载体连接,转化至DH5α大肠杆菌,提取质粒进行PCR鉴定和序列测定,挑选结果正确的质粒并测定其浓度。
猪SAA3基因扩增体系:cDNA模板2 μL、上下游引物各0.25 μL(50 pmol/μL)、dNTP Mixture(10 mmol/μL)0.5 μL、Q5高保真酶0.5 μL、10×PCR Buffer 2.5μL,加水至25 μL。反应程序:98℃预变性5 min;98℃变性1 min,56℃退火30 s,72℃延伸30 s,共35个循环;72℃延伸10 min。反应结束后,取50 μL PCR产物在1%琼脂糖凝胶上电泳检测扩增结果。回收纯化目的片段,与pFlag7.1载体连接,转化至DH5α大肠杆菌,提取质粒进行PCR鉴定和序列测定,挑选结果正确的质粒并测定其浓度。
1.5 实验样品的制备 将PAM细胞铺于24孔板,贴壁后,实验组接种0.1MOI的猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV),对照组接种等量的PBS,每组3个重复。24 h后,按照Trizol法说明书提取总RNA。然后按照上述标准品的反转录体系进行反转录,反应产物用于实时荧光定量实验。
选取30日龄健康小猪,实验组颈部肌肉注射1 mLPRRSV(病毒滴度107),鼻腔灌注1 mL PRRSV,对照组接种等量的PBS。接毒后2周,分别采集猪各种组织,按照Trizol法说明书提取总RNA,然后按照上述反转录体系进行反转录。
1.6 SYBR GreenⅠ实时荧光定量PCR检测方法的建立
1.6.1 SYBR GreenⅠ荧光定量PCR 反应体系的建立及优化 以质粒标准品为模板,反应体系为20μL,分别对引物、模板、SYBR GreenⅠmix的最佳使用量,以及反应条件进行优化并绘制熔解曲线。
1.6.2 标准曲线的建立 将猪的SAA3、GAPDH标准质粒按 10倍梯度稀释,分别取5个连续稀释度:SAA3标准品质粒为1.9×107~1.9×103copies/μL, GAPDH标准品质粒为9.4×107~9.4×103copies/μL。分别将这些稀释度的标准品质粒作为模板进行荧光定量PCR,每个稀释度设3个重复。标准曲线由ABi7500荧光定量PCR仪自动生成,横坐标代表拷贝数,纵坐标代表Ct值。
1.7 敏感性试验 分别选取1.9 ×107~1.9 ×103copies/ μL SAA重组质粒,以及9.4×107~9.4×103copies/ μL GAPDH重组质粒进行敏感性试验,同时将荧光定量PCR产物进行琼脂糖凝胶电泳检测。
1.8 重复性试验 对3份不同批次的阳性标准品进行批内重复试验和批间重复试验。
2 结果
2.1 猪SAA3,GAPDH基因克隆结果 将反转录、PCR扩增获得的猪GAPDH、SAA3基因分别与pMD 18 T载体和pFlag7.1载体连接,对构建的重组载体进行PCR鉴定,分别获得大小为393 bp的SAA3基因片段,以及1304 bp的GAPDH的基因片段,测序结果与GenBank数据库中猪SAA3、GAPDH基因相符,表明重组质粒构建成功。

图1 猪SAA3、GAPDH的PCR扩增结果Fig.1 PCR-amplif ed result of porcine SAA3,GAPDHM: DNA分子量标准(DL2000); 1:SAA3基因; 2: GAPDH基因M: DNA Marker(DL2000); 1: PCR products of SAA3 gene; 2: PCR products of GAPDH
2.2 质粒标准品的制备 鉴定正确的重组质粒经核酸浓度检测仪检测,SAA3重组质粒的质量浓度为419 ng/μL,换算成拷贝数为1.94×1010,按1:10梯度稀释成1.94×107~1.94×103copies/μL的质粒标准品,作为标准曲线制作的模板。GAPDH重组质粒的质量浓度9.44×1010,按1:10梯度稀释成9.44×107~9.44×103copies/μL的质粒标准品,作为标准曲线制作的模板。
2.3 反应体系中各组分的优化和条件的优化
2.3.1 反应体系中各组分的优化 向Real-time PCR 检测体系中分别逐次加入不同终浓度的引物和模板,分析检测结果的重复性和扩增效率,最终筛选出最佳反应体系(20 μL):2×SYBR Green Premix Ex Taq II 10 μL、上下游引物各0.4 μL(25 pmol/L)、模板(质粒或cDNA)1μL、ROX Reference Dye(50×)0.4 μL、DEPC水7.8 μL。
2.3.2 反应体系中反应条件的优化 分别选取SAA3重组质粒模板1.94×105copies/μL、GAPDH重组质粒9.44×105copies/μL,进行Real-time PCR 检测,改变退火延伸温度,每种温度分别重复4次,最终筛选出最佳循环参数:95℃预变性5 min;95℃变性5 s,60℃退火及延伸34 s,扩增40个循环,用此参数进行扩增重复性较好且扩增效率较高。
2.4 SYBR Green I 实时荧光定量PCR标准曲线的建立 对SAA3阳性重组质粒进行10倍稀释,获得1.9 ×107、1.9 ×106、1.9 ×105、1.9 ×104、1.9 ×103copies/μL五个浓度梯度,同时对GAPDH阳性重组质粒进行10倍梯度稀释,获得9.4×107、9.4×106、9.4×105、9.4×104、9.4×103copies/μL五个浓度梯度,作为标准品进行实时荧光定量PCR反应。扩增曲线见图2A(横坐标为循环数,纵坐标为荧光值),根据扩增结果分别绘制了SAA3和GAPDH的标准曲线(图2B),(横坐标为拷贝数,纵坐标为Ct值)。由SAA3标准曲线可知:斜率为-3.418,相关系数为0.985,扩增效率为96.145%。由GAPDH标准曲线可知:斜率为-3.442,相关系数为0.984,扩增效率为95.23%。
2.5 SYBR Green I实时荧光定量PCR的熔解曲线 根据参数95℃ 15 s、60℃ 1 min、95℃ 10 s绘制熔解曲线。结果显示,标准样品均出现了窄且尖的单峰,无杂峰出现(图3),表明该SYBR GreenⅠ实时荧光定量PCR反应为特异性扩增。
2.6 敏感性试验结果 实时荧光定量PCR检测梯度稀释的标准样品,在35个循环内的Ct 值> 0,且相邻稀释梯度拷贝数呈10倍关系。将稀释5个梯度的标准样品用普通PCR进行检测,并进行琼脂糖凝胶电泳(图4),结果与实时荧光定量PCR结果相符。
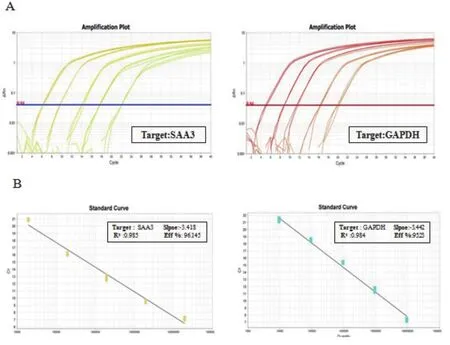
图2 SYBR Green I实时荧光定量RT-PCR检测猪SAA3和GAPDH的扩增曲线和(A)标准曲线(B)Fig. 2 Amplif cation plots (A ) and standard curve (B) of SYBR Green I Real-time f uorescent quantitative RT-PCR

图3 SYBR Green Ⅰ实时荧光定量RT-PCR检测猪GAPDH和SAA3标准品的熔解曲线Fig. 3 The melting curve of SYBR Green I Real-time f uorescence quantitative RT-PCR for detection of porcine GAPDH and SAA3 standard
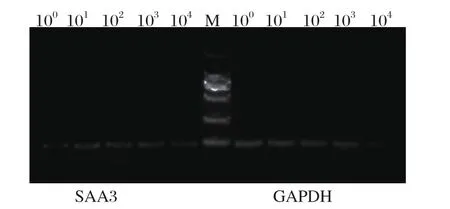
图4 猪GAPDH和SAA3标准品PCR检测结果Fig. 4 Result of Real-time PCR for detection of porcine GAPDH and SAA3 standardM: DNA分子量标准(DL2000); 100、101、102、103、104为GAPDH和SAA3标准品的稀释倍数M:DNA Marker(DL2000); 100, 101, 102, 103, 104were the dilution multiple of GAPDH and SAA3 standard
2.7 SYBR GreenⅠ实时荧光定量PCR的重复性 SAA重复性实验(表1)和GAPDH重复性实验(表2)结果显示,建立的实时荧光定量PCR重复性良好,变异系数均在5%以下,进一步证实该方法检测猪GAPDH、SAA3基因高效、可信。
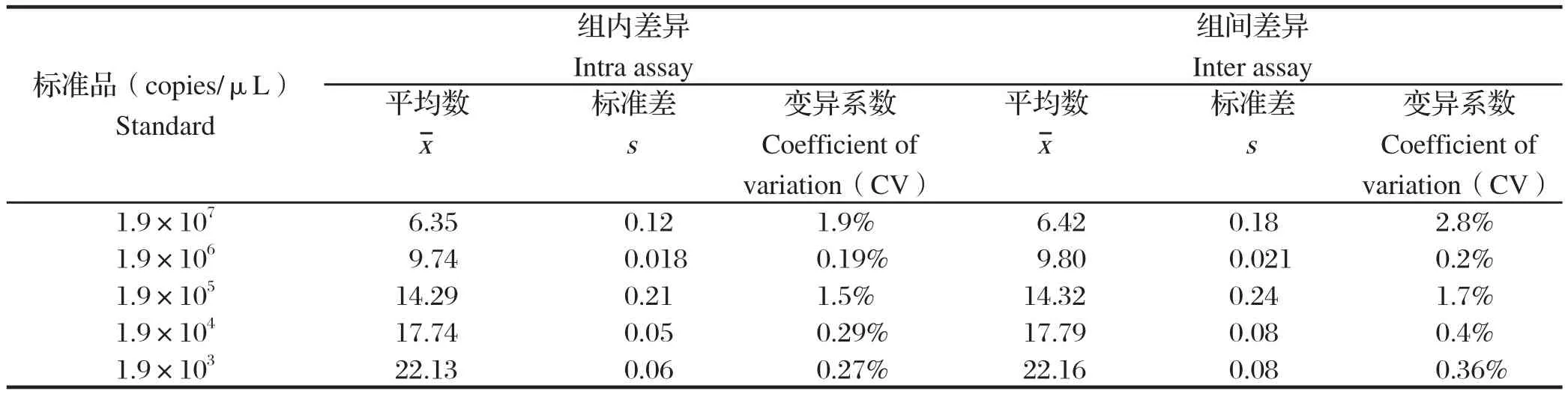
表1 猪SAA3实时荧光定量PCR重复性检测结果(n=3)Table 1 Reproducibility assay of Real-time f uorescent quantitative RT-PCR for porcine SAA3

表2 猪GAPDH的实时荧光定量PCR重复性检测结果(n=3)Table 2 Reproducibility assay of Real-time f uorescent quantitative RT-PCR for porcine GAPDH
2.8 SYBR Green I实时荧光定量PCR对细胞样品和组织样品的检测结果 采用建立的荧光定量PCR方法对细胞样品中SAA3、GAPDH的绝对量进行检测,然后用SAA3的绝对量与GAPDH的绝对量比值代表SAA3最终的相对含量。结果显示,接毒的PAM细胞中SAA3的含量是正常PAM细胞中的7倍左右(图5A)。这一结果为进一步研究PRRRSV感染和SAA3之间的关系奠定了基础 。
采用建立的荧光定量PCR方法对组织样品中SAA3、GAPDH的绝对量进行检测,结果显示,感染PRRSV之后,各个组织中的SAA3含量都有一定量的增加,但是在肺脏中增加最明显,增加了大约200倍。在肝脏、脾脏以及淋巴结中也有不同程度的增加(图5B)。
3 讨论
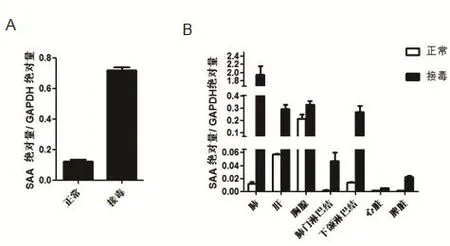
图5 细胞和组织样品中SAA3、GAPDH的SYBR Green I实时荧光定量PCR检测Fig. 5 Detection results of SAA3、GAPDH in cells and tissues by SYBR Green I Real-time f uorescent quantitative RT-PCR
血清淀粉样蛋白A(SAA)是一类多基因编码的多形态蛋白家族,组织淀粉样蛋白A的前体物质,属于急性应答蛋白。炎症或感染急性期其在48~72 h内即迅速升高现象,并且在疾病的恢复期迅速下降。目前细菌、病毒感染、动脉粥样硬化、冠心病、急性移植排斥反应、肿瘤等疾病中均检测到血清SAA升高。某些疾病,如病毒感染、移植排斥反应、冠心病等,SAA的敏感性高于CRP,可为临床提供更好的参考价值。在人类SAA家族中,SAA1、SAA2属于急性期蛋白,SAA4属于组成型表达蛋白,SAA3属于假基因。但是研究报道,猪SAA3蛋白是血液循环中主要的SAA蛋白,所以建立一种准确检测猪SAA3的方法就尤为重要。
SAA蛋白具有多种功能,它不仅是一种急性反应蛋白、载脂蛋白,也有相关文献报道显示,SAA具有抗病毒作用。本实验室研究发现,猪SAA3显示出抗PRRSV的作用,所以建立准确、稳定的猪SAA3分子检测方法是进一步研究SAA3在体内与病毒相互作用机制的重要基础。本研究建立的实时荧光定量RT-PCR检测方法灵敏度高,特异性强,重复性好,对3份不同批次的标准品分别进行3个批内重复和批间重复, 变异系数均小于5%。用建立的RT-PCR方法对正常细胞以及感染PRRSV病毒的细胞样品、正常组织以及感染病毒的组织样品进行检测,都显现出明显的差异。
综上所述,本研究建立的SYBR Green I 荧光定量PCR 检测方法可以定性和定量检测猪SAA3的表达,实时分析样品中SAA3基因的表达含量,为深入研究猪SAA3的功能和机制打下基础。
[1] Skovgaard K, Mortensen S, Boye M, et al. Rapid and widely disseminated acute phase protein response after experimental bacterial infection of pigs[J]. Vet Res, 2009, 40(3): 23.
[2] Skovgaard K, Mortensen S, Boye M, et al. Hepatic gene expression changes in pigs experimentally infected with the lung pathogen Actinobacillus pleuropneumoniae as analysed with an innate immunity focused microarray[J]. Innate Immun, 2010, 16(6): 343-353.
[3] Sørensen N S, Tegtmeier C, Andresen L O, et al. The porcine acute phase protein response to acute clinical and subclinical experimental infection with Streptococcus suis[J]. Vet Immunol Immunopathol, 2006, 113(1-2): 157-168.
[4] Heegaard P M, Stockmarr A, Pin~eiro M, et al. Optimal combinations of acute phase proteins for detecting infectious disease in pigs[J]. Vet Res, 2011, 42:50.
[5] 孟春春, 段云兵. 基因Ⅶ型新城疫病毒SYBR Green I实时荧光定量PCR检测方法的建立[J]. 中国动物传染病学报, 2011, 19(5): 8-14.
[6] 侯军委, 周艳君. 猪源TTV Taqman实时荧光定量PCR检测方法的建立和应用[J]. 中国动物传染病学报, 2011,19(2): 13-19.
[7] 王蓉蓉, 孙卫东. 猪链球菌2 型主要毒力因子三重荧光定量PCR 检测方法的建立[J]. 中国动物传染病学报, 2014,22(6): 25-31.
[8] 史子学, 徐兴然, 涂长春. 用荧光定量 RT-PCR 方法检测猪瘟病毒[J]. 中国预防兽医学报, 2007, 29(6): 467-470.
[9] 王云龙, 刘建营, 韩 洁, 等. 猪瘟病毒荧光定量 PCR 检测方法的建立 [J] . 动物医学进展, 2009, 30( 5) : 36-40.
[10] 陆永干, 戴贤君, 姚建红, 等. 猪瘟病毒荧光定量 PCR 标准阳性模板的构建 [J]. 浙江农业学报, 2009, 21(1): 35-38.
[11] Steel D M, Whitehead A S. The major acute phase reactants: C-reactive protein, serum amyloid P component and serum amyloid A protein[J]. Immunol Today, 1994, 15(2): 81-88.
[12] Upragarin N, Landman W J, Gaastra W, et al. Extrahepatic production of acute phase serum amyloid A[J]. Histol Histopathol, 2005, 20(4): 1295-1307.
[13] Meek R L, Benditt E P. Amyloid A gene family expression in different mouse tissues[J]. J Exp Med, 1986, 164(6): 2006-2017.
[14] Sjo¨holm K, Palming J, Olofsson L E, et al. A microarray search for genes predominantly expressed in human omental adipocytes: adipose tissue as a major production site of serum amyloid A[J]. J Clin Endocrinol Metab, 2005, 90(4): 2233-2239.
[15] Steel D M, Donoghue F C, O’Neill R M, et al. Expression and regulation of constitutive and acute phase serum amyloid A mRNAs in hepatic and non-hepatic cell lines[J]. Scand J Immunol, 1996, 44(5): 493-500.
[16] Yamada T, Kluve-Beckerman B, Kuster W M, et al. Measurement of serum amyloid A4 (SAA4): its constitutive presence in serum[J]. AMYLOID Amyloid, 2009, 1(2): 114-118.
[17] Yamada T, Wada A, Yamaguchi T, et al. Automated measurement of a constitutive isotype of serum amyloid A/SAA4 and comparison with other apolipoproteins[J]. J Clin Lab Anal, 1997, 11(6): 363-368.
[18] Husby G, Marhaug G, Dowton B, et al. Serum amyloid A (SAA): biochemistry, genetics and the pathogenesis of AA amyloidosis[J]. AMYLOID,2009,1(2):119-137.
[19] Jacobsen S, Niewold T A, Halling-Thomsen M, et al. Serum amyloid A isoforms in serum and synovial fluid in horses with lipopolysaccharide-induced arthritis[J]. Vet Immunol Immunopathol, 2006, 110(3-4): 325-330
DEVELOPMENT AND PRELIMINARY APPLICATION OF SYBR GREEN I REAL-TIME PCR ASSAY FOR DETECTION AND QUANTITATION OF PORCINE SERUM AMYLOID PROTEIN 3 (SAA3)
HUAN Bei-li, LIU Ke, MA Gai-ni, WEI Jian-chao, SHAO Dong-hua, LI Bei-bei, QIU Ya-feng, SHI Yuan-yuan, MA Zhi-yong
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
The objective of the present study was to develop a SYBR GreenⅠ Real-time PCR assay for detecting and quantifying porcine serum amyloid protein 3 (SAA3). According to the SAA3 (NM_001044552.1) and GAPDH (AF017079.1) gene sequences, specific primes were designed to their amplif cation. The resulting fragments were cloned into the vector to construct the recombinant plasmids. Using the recombinant plasmids as standard products, a Real-time quantitative RT-PCR was performed to construct the standard curves of porcine SAA and GAPDH and detect the sensitivity, specif city and repeatability. The results showed a precise linear relationship with a correlation coeff cient of R2> 0.98. The amplif cation curves showing a single peak was detected for porcine SAA3 and GAPDH. Thecoeff cient of variation was less than 0.5% within and between the assays. The SYBR GreenⅠ Real time PCR assay was used to detect porcine tissues and PAMs treated with PRRSV(Porcine reproductive and respiratory syndrome virus). Porcine SAA3 was found in these samples and there was signif cant difference in SAA3 content between infection group and control group. The SYBR GreenⅠ Real-time PCR assay developed here was highly specif c, sensitive, and reproducible and might be a tool for monitoring the relationship between pig infectious diseases and porcine SAA3.
Serum amyloid A3(SAA3); SYBR GreenⅠ; Real-time quantitative RT-PCR
S852.42
A
1674-6422(2017)03-0080-07
2016-08-20
973计划(2014CB542702)
郇贝丽,女,硕士研究生,预防兽医学专业
马志永,E-mail:zhiyongma@shori.ac.an

