H3N2亚型犬流感病毒反向遗传操作系统的建立
段旭彤,荣广玉,田巧珍,申伟霞,李雪松,陈鸿军,刘芹防,杨健美,滕巧泱,赵 凯,李泽君
(1.黑龙江大学,哈尔滨 150080;2.中国农业科学院上海兽医研究所,上海 200241)
·研究论文·
H3N2亚型犬流感病毒反向遗传操作系统的建立
段旭彤1,2,荣广玉1,2,田巧珍2,申伟霞2,李雪松2,陈鸿军2,刘芹防2,杨健美2,滕巧泱2,赵 凯1,李泽君2
(1.黑龙江大学,哈尔滨 150080;2.中国农业科学院上海兽医研究所,上海 200241)
H3N2亚型犬流感病毒(Canine influenza virus,CIV)可以在犬中迅速的传播,甚至引起犬的死亡,也可感染其他哺乳动物。目前该病毒致病的分子机制尚不清楚。为此,本研究采用RT-PCR技术扩增犬流感病毒A/Canine/Zhejiang /01/2010(H3N2)(简称ZJ2010)的PB2、PB1、PA、HA、NP、NA、M和NS 8个基因片段,并分别克隆至双向表达载体pBD上。采用8质粒系统共转染293T细胞,转染48 h后加入TPCK胰酶作用2 h,将上清和细胞一同接种9~11日龄SPF鸡胚,并检测血凝效价。结果显示,本研究成功拯救获得了病毒株rZJ2010。rZJ2010株的8个基因片段的序列均与亲本ZJ2010株的序列相同。rZJ2010株与ZJ2010株在鼠的肺和鼻中复制水平接近。这些结果证实,本研究已成功建立H3N2亚型犬流感病毒反向株遗传操作系统,为该病毒的致病机理、传播机制以及跨宿主传播机制研究等奠定了技术平台。
犬流感病毒;H3N2亚型;反向遗传操作系统
犬流感病毒(Canine influenza virus,CIV),属于正粘病毒科,A型流感病毒属。犬流感病毒直径大小为80~120 nm,形态呈现多样性,具有脂质双层囊膜,膜表面具有致密的纤突结构。CIV属于单股负链RNA病毒,其核酸不具有感染能力,可分为8个相对分子质量不同的节段[1,2]。近几年,越来越多的流感病毒可以引起犬的感染,可以分为H3N8亚型、H3N2亚型、H5N1亚型、H1N1亚型以及H5N2亚型[3,4]。
目前在犬中流行的两种主要流感病毒为2004年在美国分离到的H3N8亚型CIV以及2007年在韩国分离的禽源H3N2亚型CIV[5]。目前,我国主要流行的是H3N2 亚型CIV,该病毒可以在犬中迅速的传播,能引起咳嗽、流涕、发热、呼吸困难等呼吸系统疾病临床症状,且偶尔会出现继发性并发症,如重症肺炎[6-8]。进一步研究发现,该H3N2亚型CIV可通过空气传播方式感染犬,且引起其他的哺乳动物,如鼠和豚鼠的感染[9]。鉴于犬与人的亲密伴侣关系,H3N2亚型犬流感可能极大地威胁着人类健康。目前,H3N2亚型CIV致病的分子机制尚不清楚。为此,本研究建立了1株H3N2亚型犬流感病毒[A/ Canine/Zhejiang/01/2010(H3N2)(简称ZJ2010)]的反向遗传操作系统,为研究犬流感病毒的致病机理及其传播机制等奠定了技术平台。
1 材料和方法
1.1 病毒、细胞、SPF鸡胚以及实验动物 H3N2亚型犬流感病毒ZJ0110由本实验室分离和保存;293T细胞使用含10%FBS的opti-MEM培养液并放在37℃、5% CO2的培养箱中培养;双向表达载体pBD由本实验室提供;SPF鸡胚购自北京梅里亚维通试验动物技术有限公司,并由本实验室自行孵化;BALB/c实验小鼠购自北京维通利华实验动物技术有限公司。
1.2 主要试剂 病毒RNA提取试剂盒和转染用的质粒提取试剂盒购自QIAGEN公司;鼠源反转录酶(M-MLV)试剂盒购自TaKaRa公司;Pfx高保真DNA聚合酶购自Invitrogen公司;小量质粒提取试剂盒、胶回收试剂盒均购自AXYGEN公司;Klenow大片段酶、BspQI 酶、T4 DNA聚合酶、T4 DNA连接酶均购自NEB公司;感受态大肠杆菌DH5α购自北京全式金公司;OPTI-MEM培养液购自Thermo公司;转染试剂Mirus购于MIRUS公司;引物由苏州金维智生物公司合成。
1.3 引物设计 根据CIV 8个基因序列,设计A型流感病毒通用性扩增引物及流感病毒反转录通用引物12 bp(表1),由苏州金维智生物公司合成。

表1 H3N2亚型犬流感病毒扩增引物Table 1 The primers of H3N2 CIV in this paper
1.4 病毒RNA的提取及RT-PCR扩增 根据RNeasy Mini Kit(QIAGEN公司)说明书,从SPF鸡尿囊液中提取病毒总RNA,利用流感病毒通用的12 bp引物反转录得到病毒cDNA,并以cDNA为模板,用Pfx高保真DNA聚合酶扩增病毒的 PB2、PB1、PA、HA、NP、NA、M和NS 八个基因片段。
1.5 质粒的构建、鉴定及纯化 8个基因的PCR产物经过1%凝胶电泳后,切下目标条带,并按照Gel Extraction Kit(Axygen,USA)说明书进行产物回收纯化。其中PB2、PB1、PA和HA基因用T4 DNA连接酶处理。体系如下:PCR纯化产物20 μL、10×T4 Polymerase buffer 5μL、dCTP 5μL、dTTP 5μL、100×BSA 0.5 μL、T4 聚合酶 1μL,灭菌ddH2O补至50 μL;反应条件:12℃作用30 min、75℃作用20 min。pBD 载体经 BspQ Ⅰ酶切回收后,在含有2 μL dATP 和2 μL dGTP存在的条件下,用Klenow大片段分别于25℃作用25 min、75℃作用20 min。基因片段与 pBD 载体在 T4 DNA连接酶的作用下16℃连接过夜。NP、NA、M和NS基因的PCR纯化产物经 BspQ Ⅰ酶切后,与同样酶切的PBD载体链接。
将连接产物转化到DH5α大肠杆菌感受态细胞中,具体步骤如下:冰浴20 min,42℃热激45 s,纯化回收以上并置于冰上冰浴2 min;随后将转化产物放入无氨苄青霉素LB的培养液中,摇菌45~60 min;取100 μL 菌液涂布于含有氨苄青霉素(50 μg/mL)LB 平板上。37℃培养12 h,挑取白色孤立菌落,接种于2 mL含有氨苄青霉素(50μg/mL)液体LB培养基,37℃培养8 h。通过菌液PCR确定阳性克隆,并将菌液送美吉测序公司进行序列鉴定。序列正确的菌液,使用Hispeed Midi Plasmid kit(QIAGEN)抽提质粒。
1.6 拯救病毒 293T细胞传代培养在直径3.5 cm的平板上。待细胞长至70%~80%时,进行转染,具体步骤如下:将250 μL不含有FBS的opti-MEM培养液分别加入两个无菌的EP管中,构建的8个质粒分别按照每个质粒均1.0 μ g加入EP管中,混匀。将24 μL Mirus转染试剂加入到另一管250 μL的opti-MEM中,混合并作用5 min后,将两个溶液混合,静止30 min;将混合液轻轻加入到用PBS清洗2次的293T细胞上并补加溶液至2 mL;培养48 h后,加入2 μL的TPCK胰酶,作用2 h后将细胞上清及细胞混合液接种到9~11日龄的SPF鸡胚,0.5 mL/枚,37℃继续孵化48 h后,进行血凝(Hemagglutination,HA)试验;收集血凝效价为阳性的尿囊液,分装并放置于-80℃保存,拯救病毒命名为rZJ2010。
1.7 获救病毒的全基因测序 使用RNeasy Mini Kit试剂盒,提取获救病毒尿囊液RNA,并反转录成cDNA。使用PCRmix(TaKaRa,中国)以及流感特异性扩增引物(表1)扩增出病毒的8个基因片段。具体体系以及PCR程序如下:2×PCRmix 12.5 μL、上游引物1 μL、下游引物1 μL、cDNA 2μL,灭菌ddH2O补至25 μL;94℃预变性30 min后,94℃变性30 s,53℃退火30 s,72℃延伸2.5 min,循环30次,72℃ 延伸10 min。胶回收纯化PCR产物,并送美土测序公司进行测序。使用DNAStar的Seqman软件对获救病毒rZJ2010株与亲本病毒ZJ2010株的序列进行比对分析。
1.8 小鼠致病性试验 为了研究亲本病毒ZJ2010株与拯救病毒H3N2亚型CIV对哺乳动物致病力是否存在差异,开展了这两株病毒的小鼠致病性试验。将4周龄BALB/c小鼠随机分成3组,即ZJ2010组、rZJ2010组以及空白对照组,每组各3只小鼠。使用干冰麻醉小鼠后,经鼻腔接种50 μL含 106半数鸡胚感染剂量(50% egg infective dose,EID50)的病毒。攻毒后4 d,每组剖杀3只,取鼻甲和肺用于病毒滴定,并进行无害化处理。
1.9 病毒滴定 将小鼠组织中加入1 mL含有1000 U双抗PBS,并使用样品组织研磨机70HZ研磨90 s。研磨后,以4℃、10 800×g的条件下离心15 min。取上清,并用无菌PBS进行10倍系列稀释,将不同稀释度的组织研磨液分别经尿囊腔接种3枚9~11日龄SPF鸡胚,每个鸡胚接种100 μL,37℃孵化48 h后测定血凝效价,利用 Reed-Muench 法计算EID50。
2 结果
2.1 亲本毒各基因片段扩增 RT-PCR扩增了H3N2亚型CIV ZJ0110株的8个基因片段。经1%的琼脂糖电泳鉴定,得到的产物大小与相应的基因大小一致(见图1)。PB2、PB1、PA、HA、NP、NA、M、NS基因大小分别为2341、2341、2233、1765、1565、1473、1027、890 bp。
2.2 重组质粒的构建及病毒拯救 pBD载体通过BspQ Ⅰ酶切并电泳割胶回收后,浓度为68 ng/μL,随后将其用Klenow处理,割胶回收后浓度为57 ng/ μL。扩增的目的基因片段用T4 DNA polymerase分别与pBD载体过夜连接,并转化至大肠杆菌DH5α。通过挑取菌落进行菌液PCR后,获得阳性质粒,经测序鉴定正确后,扩大培养。得到序列正确的8个质粒。测序结果表明这8个质粒所插入的目的片段序列完全正确。将这8个重组质粒转染293T细胞后,成功获得了拯救病毒rZJ0110。其血凝效价为27,见图2。
图1 H3N2 CIV ZJ0110 株 8 个基因片段的 RT-PCR 扩增Fig.1 Amplif cation of eight gene segments from H3N2 CIV ZJ011 strain by RT-PCRM: DNA分子量标准(DL2000); 1: PB1基因; 2: PB2基因; 3: PA基因; 4: HA基因; 5: NP基因; 6: NA基因; 7: M基因; 8: NS基因M: DNA Marker(DL2000); 1: PB1 gene; 2: PB2 gene; 3: PA gene; 4: HA gene; 5: NP gene; 6: NA gene; 7: M gene; 8: NS gene

图2 CIV亲本毒株ZJ0110以及拯救病毒rZJ0110株血凝效价对比Fig.2 The comparision of hemagglutination titers between CIV ZJ0110 strain and the rescued virus rZJ0110 strain
2.3 拯救病毒rZJ0110株序列的鉴定 提取获救病毒的鸡胚尿囊液中的RNA,以流感病毒通用的12 bp引物反转录得到cDNA,并用H3N2亚型犬流感病毒扩增引物(表1)进行各基因的RT-PCR扩增,并进行序列测定。通过比对,获救毒株与亲本毒ZJ0110的各基因片段序列完全一致。
2.4 小鼠组织病毒分离滴定 亲本病毒ZJ0110株和拯救的病毒rZJ0110株分别感染小鼠,感染d 4时,采集鼠的肺脏组织和鼻甲骨进行病毒滴定。结果显示,在肺脏和鼻甲骨中均能分离到ZJ0110株和rZJ0110株病毒,通过方差分析得出病毒ZJ0110株和rZJ0110株EID50差异不具备统计学意义(P>0.05)(图3)。
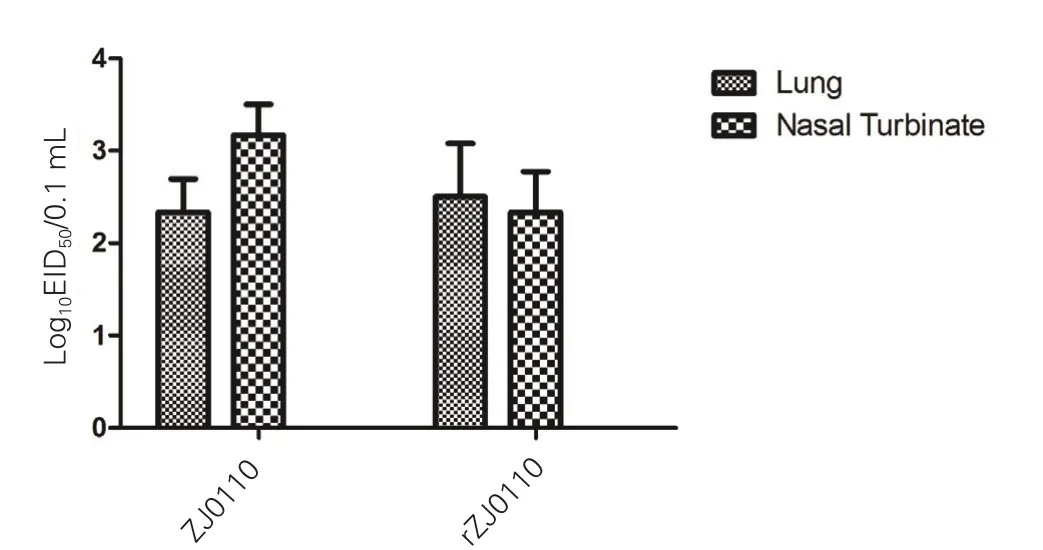
图3 感染亲本病毒ZJ0110株和拯救病毒rZJ0110株后小鼠肺脏和鼻甲骨中病毒滴度Fig.3 The virus titer in lungs and nasal turbinates of mice infected with ZJ0110 strain and rZJ0110 strain
3 讨论
2007年,在韩国犬群中暴发了严重的呼吸道疾病,并从其中3只犬的鼻腔分泌物中分离到了H3N2亚型犬流感病毒,并已经证明H3N2亚型流感病毒可以在犬之间传播[10,11]。在我国也发现了H3N2亚型流感病毒在犬中传播,通过系统发育树分析表明,与韩国2007年分离的H3N2亚型犬流感病毒8个基因亲缘关系接近,同时各基因与禽流感的核苷酸同源性高达94.7%~98.3%,说明禽源犬流感已经进入中国。研究表明H3N2亚型犬流感病毒在中国、韩国和泰国等亚洲地区的犬群中广泛流行[12]。2015年,美国芝加哥约5000只犬感染H3N2亚型犬流感病毒,进一步证明犬流感由亚洲流行区域已经逐渐扩大到北美洲,并在犬类中感染与传播[3]。2010年,韩国报道称,在猫的身上分离到的病毒8个基因片段(PB2、PB1、PA、HA、NP、NA、M、NS)与H3N2亚型犬流感病毒基因几乎相同。这说明H3N2亚型犬流感病毒已经可以跨宿主传播[13-15]。2009~2012年,在中国大陆陆续分离到了犬流感病毒,通过感染实验发现这些犬流感病毒可以使犬发病,但很少导致犬类死亡,同时分离自犬的流感病毒不仅能感染犬,还能感染小鼠和猪,但不能感染鸡和鸭[16]。表明H3N2犬流感病毒已经完全适应了哺乳动物,成功地实现了跨宿主传播,同时存在新的哺乳动物之间跨宿主传播的风险。目前已经发现的H3N2亚型犬流感病毒与人流感病毒pandemic influenza H1N1可以进行重配,如2012年,在韩国分离到1株新型的H3N1犬流感病毒,通过系统发育树分析后发现该病毒HA基因与H3N2亚型犬流感病毒HA基因相似度可以达到99.6%,而其他的7个基因片段与2009年甲型H1N1流感病毒的相似程度可以达到99.1%~99.9%[17]。而2014年发现的1株病毒则由2009年甲型H1N1流感病毒M基因和H3N2其他7个基因组成的重配犬流感病毒[18]。上述发现表明H3N2亚型犬流感病毒与甲型H1N1流感病毒的重配,有可能导致人际间流感大流行。
犬类作为与人类生活息息相关的动物,由于密切接触,很可能导致人类感染H3N2亚型流感病毒,因此,进一步对该病毒的流行状况、致病机制进行深入的研究显得尤为重要。同时如何更好的防控犬流感病毒流行,对公共安全具有重要的意义。本研究成功构建了H3N2亚型犬流感病毒毒株的8质粒反向遗传操作系统,从293T细胞中成功拯救了重组病毒。rZJ0110株经鉴定各基因片段的序列与原始病毒相应序列完全一致,且对鼠的致病性也是相似的。这些结果皆表明,本研究所建立的H3N2亚型犬流感反向遗传操作系统为进一步研究病毒复制装配机制、病毒变异机制、致病力、种间传播分子机制奠定了基础,同时也为犬流感新型疫苗的研制开辟了新的途径。
[1] 夏冰, 刘红彦, 胡国良, 等. 犬流感的研究进展及其公共卫生安全影响[J]. 中国动物检疫, 2014, 31(10): 33-37.
[2] Wit E D, Fouchier R A. Emerging influenza[J]. J Clin Virol, 2008, 41(1): 1-6.
[3] 于志君, 张醒海, 张坤, 等. 犬流感研究新进展[J]. 中国病原生物学杂志, 2015, 10(8): 768-771.
[4] Feng H X, Liu Y Y, Song Q Q, et al. Interspecies transmission of canine influenza virus H5N2 to cats and chickens by close contact with experimentally infected dogs[J]. Vet Microbiol, 2014, 170(3-4): 414-417.
[5] Lyoo K S, Kim J K, Kang B, et al. Comparative analysis of virulence of a novel, avian-origin H3N2 canine influenza virus in various host species[J]. Virus Res, 2015, 195(2): 135-140.
[6] Lee E, Kim E J, Kim B H, et al. Multiplex RT-PCR detection of H3N2 influenza A virus in dogs[J]. Mol Cell Probe, 2016, 30(1): 50-60.
[7] Song D, Kang B, Lee C, et al. Transmission of avian influenza virus (H3N2) to dogs[J]. Emerg Infect Dis, 2008, 14(5): 741-746.
[8] Ozawa M, Kawaok Y. Cross Talk Between Animal and Human Influenza Viruses[J]. Anim Biosci, 2013, 1(1): 21-42.
[9] Teng Q Y, Zhang X, Xu D W, et al. Characterization of an H3N2 canine influenza virus isolated from Tibetan mastiffs in China[J]. Vet Microbiol, 2013, 162(2-4): 345-352.
[10] Payungporn S, Crawford P C, Kouo T S, et al. Influenza A Virus (H3N8) in Dogs with Respiratory Disease, Florida[J]. Emerg Infect Dis, 2008, 14(6): 902-908.
[11] Li S J, Shi J H, Jiao P R, et al. Avian-origin H3N2 canine influenza A viruses in Southern China[J]. Infect Genet Evol, 2010, 10(8): 1286-1288.
[12] Kim Y K, Lim S I, Cho Y Y, et al. Detection of H3N2 canine influenza virus using a Quartz Crystal Microbalance[J]. J Virol, 2014, 208: 16-20.
[13] Song D S, An D J, Moon H J, et al. Interspecies transmission of the canine influenza H3N2 virus to domestic cats in South Korea, 2010[J]. J Gen Virol, 2011, 92(10): 2350-2355.
[14] Pecoraro H L, Bennett S, Spindel M E, et al. Evolution of the hemagglutinin gene of H3N8 canine influenza virus in dogs[J]. Virus Genes, 2014, 49(3): 393-399.
[15] Jeoung H Y, Lim H I, Shin B H, et al. A novel canine influenza H3N2 virus isolated from cats in an animal shelter[J]. Vet Microbiol, 2013, 165(3-4): 281-186.
[16] 师志海, 王文佳, 李万利, 等. 犬流感流行病学与跨宿主传播机制的研究进展[J]. 河南农业科学, 2013, 42(5): 17-19.
[17] Song D, Moon H J, An D J, et al. A novel reassortant canine H3N1 influenza virus between pandemic H1N1 and canine H3N2 influenza viruses in Korea[J]. J Gen Virol, 2012, 93(3): 551-554.
[18] Moon H, Hong M, Kim G P, et al. H3N2 canine influenza virus with the matrix gene from the pandemic A/ H1N1 virus: Infection dynamics in dogs and ferrets[J]. Epidemiol Infect, 2014, 143(4): 1-9.
ESTABLISHMENT OF REVERSE GENETICS SYSTEM FOR H3N2 SUBTYPE CANINE INFLUENZA VIRUS
DUAN Xu-tong1,2, RONG Guang-yu1,2, TIAN Qiao-zhen2, SHEN Wei-xia2, LI Xue-song2, CHEN Hong-jun2, LIU Qin-fang2, YANG Jian-mei2, TENG Qiao-yang2, ZHAO Kai1, LI Ze-jun2
(1.Heilongjiang University, Harbin 150080, China; 2.Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
H3N2 Canine influenza virus (CIV) can spread quickly among dogs and even causes death. Moreover, CIV infects other mammals. At present, the molecular mechanism of CIV is not clear. In the present study, RT-PCR technique was used to amplify 8 genes (PB2,PB1,PA,HA,NP,NA,M and NS) of A/Canine/Zhejiang /01/2010(H3N2) (ZJ0110), and the resulting products were then cloned into the two-way expression vector pBD. These 8 recombinant plasmids were co-transfected into 293T cells that were treated with TPCK trypsin at 48 h post-transfection. The supernatant and transfected 293T cells were inoculated into 9-day-old specif c pathogen free (SPF) chicken embryonated eggs. The rescued viruses were identif ed in hemagglutination assay (HA). The virus strain (rZJ2010) was sequenced for the above 8 genes and found they were identical to those of its parent virus ZJ2010. The replication of rZJ2010 in the lungs and nasal turbinates of mice were similar to that of ZJ2010. These results indicated that the reverse genetics system of H3N2 subtype Canine inf uenza virus was established as a technological platform for further research on the molecular mechanism, pathogenicity and interspecies transmission of Canine inf uenza viruses.
Canine inf uenza virus; H3N2 subtype; reverse genetics system
S852.659.5
A
1674-6422(2017)03-0007-05
2016-11-09
国家自然科学基金项目(31302115,31472206); 国家重点研发计划(2016YFD0500204);上海市科技兴农重点攻关项目(沪农科攻字( 2015字)第1-11字号)
段旭彤,女,硕士研究生,微生物学专业;荣广玉,男,硕士研究生,微生物学专业
李泽君,E-mail:lizejun@shvri.ac.cn;赵凯,E-mail:zybin395@126.com;滕巧泱,E-mail:tengqy@shvri.ac.cn

