猪流行性腹泻病毒S1基因在昆虫细胞中的表达与鉴定
杨德强,李慧春,陈鹏飞,王 康,李先斌,张文超,虞凌雪,姜一峰,高 飞,黄勤峰,于 海,童光志,2,周艳君,2
(1.中国农业科学院上海兽医研究所,上海 200241;2. 江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
·研究论文·
猪流行性腹泻病毒S1基因在昆虫细胞中的表达与鉴定
杨德强1,李慧春1,陈鹏飞1,王 康1,李先斌1,张文超1,虞凌雪1,姜一峰1,高 飞1,黄勤峰1,于 海1,童光志1,2,周艳君1,2
(1.中国农业科学院上海兽医研究所,上海 200241;2. 江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
本文以猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)流行毒株FJzz1/2011株的S1蛋白的切割位点设计合成特异性引物,通过RT-PCR扩增获得S1基因,将其克隆至转移载体pFastBacHTA中,获得了重组质粒pFastBacHTA-S1,将该重组质粒转化E.coli DH10Bac感受态细胞,得到重组穿梭质粒rBacmid-S1,再将重组穿梭质粒rBacmid-S1转染Sf9细胞,48 h后即可观察到明显的细胞病变。将收获的rBac-S1-P1代病毒在Sf9细胞上连续传3代后,收获细胞培养物,分别用间接免疫荧光鉴定(indirect immunofluorescence assay,IFA)、SDS-PAGE电泳和Western blot分析。结果显示,P3代重组病毒rBac-S1感染的细胞均呈现亮绿色荧光,证实表达产物可以被PEDV阳性血清和抗S1蛋白的单抗特异性识别;SDS-PAGE电泳结果显示在大约120 kDa左右可观察到特异性条带;Western blot结果证实该蛋白可以被抗S1蛋白的特异性单抗识别。综上研究结果,证明利用杆状病毒表达系统在Sf9细胞中成功表达了PEDV的S1蛋白,为进一步研究PEDV S蛋白的抗原性奠定了基础。
猪流行性腹泻病毒;S1蛋白;杆状病毒;Sf9细胞
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种可感染各年龄段猪的急性、高度接触性传染病,哺乳仔猪感染后典型临床表现为急性水样腹泻、呕吐和脱水等,在新生仔猪中发病率和致死率较高[1]。该病在1978年被发现以来,主要在欧洲和亚洲地区流行[2,3],且以散发为主。2010年变异的PEDV袭击了我国大部分地区,造成了猪流行性腹泻疫情的大面积爆发和流行[4,5],2013年又跨界出现在美国,随后在北美地区爆发和流行[6]。这种疫病的流行对新生仔猪的生存造成了极大威胁,对养猪产业造成巨大的经济损失[7]。PEDV为具有囊膜的单股正链RNA病毒,属于冠状病毒科(Coronaviridae),冠状病毒属(Coronavirus),α冠状病毒亚属的成员[8,9]。PEDV编码4种结构蛋白:纤突蛋白(S)、小膜蛋白(E)、囊膜蛋白(M)和核衣壳蛋白(N)[10]。其中PEDV的S蛋白是I型跨膜蛋白,其主要功能是与细胞表面受体结合介导病毒侵入宿主细胞[11],同时可以诱导机体产生中和抗体[12]。S蛋白的细胞外部分由3个结构域组成,即N-末端结构域(N-terminal domain,NTD),S1结构域和S2结构域。在S1和S2结构域中含有一些潜在的病毒中和性抗原表位,因此该抗原区域常常成为人们开展抗PEDV研究的首选靶标[12,13]。然而,由于S蛋白位于病毒粒子的表面,受外界环境刺激、免疫压力等因素的影响,该基因容易发生变异。近几年在我国新流行的PEDV毒株其变异的主要特征是病毒的S基因发生了缺失和插入突变,这些突变对S蛋白的抗原性是否会有影响尚不得知,本研究拟利用杆状病毒-昆虫细胞表达系统对分离获得的PEDV流行毒株FJzz1/2011株S蛋白进行了表达和鉴定,为进一步研究S蛋白的抗原性奠定基础。
1 材料和方法
1.1 质粒、菌株和细胞株 PEDV FJzz1/2011株[14]、pFastBacHTA质粒、含AcMNPV的E.coli DH10Bac菌种和草地贪夜蛾Sf9细胞株由本实验室保存;E.coli DH5α购自天根生化科技(北京)有限公司
1.2 主要试剂 Pfu 高保真DNA聚合酶购自Agilent 公司;限制性内切酶及T4 DNA连接酶购自NEB公司;核酸凝胶回收试剂盒购自OMEGA公司;质粒中提试剂盒购自QIAGEN公司;辣根过氧化物酶(HRP)标记的山羊抗鼠IgG和FITC标记的兔抗猪IgG购自Sigma公司;驴抗鼠IgG-FITC购自Thermo Fisher公司;抗PEDVS蛋白单抗、抗PEDV阳性猪血清由本实验制备保存。Sf-900TMII SFM细胞培养基、Grace’s Insect Medium,Unsupplemented和Cellfectin® II Reagent转染试剂购自Invitrogen 公司。
1.3 S1基因的扩增 提取PEDV流行毒FJzz1/2011株病毒基因组RNA,反转录合成cDNA,根据FJzz1/2011株病毒基因组序列设计引物(表1),对FJzz1/2011株的S1基因进行PCR扩增。PCR反应程序:95℃预变性5 min;95℃变性30 s、55℃退火30 s、72℃延伸90 s,共32个循环;72℃延伸10 min。
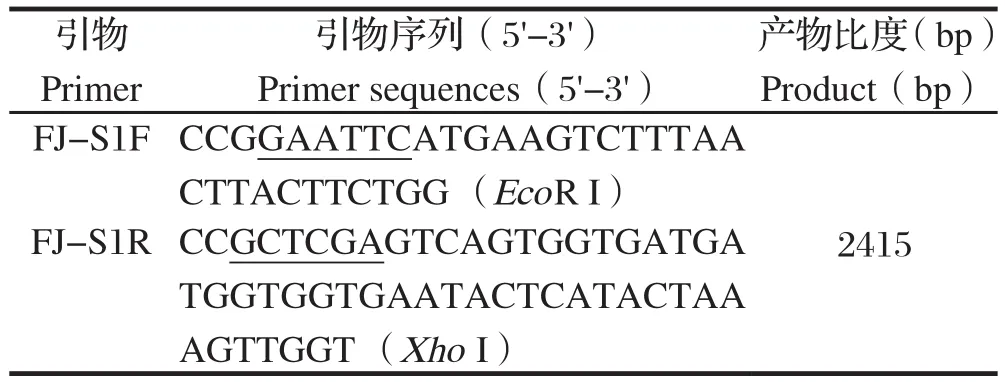
表1 本文所使用的引物Table 1 Primers used in this study
1.4 转座载体的构建 将PCR产物经胶回收试剂盒纯化后,与pFastBacHTA 转移载体同时利用EcoR I和Xho I进行双酶切,回收目的片段,用T4连接酶将其与pFastBacHTA载体连接和转化,获得的重组质粒经菌落PCR鉴定、重组质粒双酶切鉴定和测序鉴定,筛选阳性重组质粒。
1.5 阳性重组穿梭质粒的筛选 将鉴定正确的重组质粒转化至含AcMNPV 的E.coli DH10Bac 感受态细胞中,于同时含有卡那霉素(50 μg/mL)、庆大霉素(7 μg/mL)、四环素(10 μg/mL)的三种抗性以及含有终浓度为100 μg/mL X-Gal和40 μg/mL IPTG的固体培养基中37℃温箱进行培养,48 h后通过蓝白斑筛选和PCR鉴定的方法筛选出阳性重组穿梭质粒。
1.6 转染 利用质粒中提试剂盒提纯阳性重组穿梭质粒,在转染前24 h,预先将Sf9细胞传代至6孔板中,使细胞单层达到50%左右,取1 μg的重组穿梭质粒和8 μL的cellfectin II Reagent转染试剂分别加入Grace’s Insect Medium,Unsupplemented至100 μL,涡旋,将重组穿梭质粒和Cellfectin II Reagent转染试剂充分混匀后室温静置15 min,再将混合物加入至Sf9细胞中,同时设置空白对照组,于27℃培养箱中培养和观察,72 h后收集细胞上清,500×g离心5 min,取上清分装保存于-80℃低温冰箱中备用,并记为P1代重组病毒rBac-S1。
1.7 Western blot鉴定 取上述获得的P1代重组病毒在Sf9细胞上连续进行2次传代,获得P3代重组病毒。将P3代重组病毒接种于预先形成80%单层的Sf9细胞中,同时设置未接种病毒的Sf9细胞作为空白对照,在27℃培养箱内培养和观察,在感染72 h后用含有蛋白酶抑制剂的细胞裂解液(RIPA)裂解细胞,裂解产物经过10%的SDS-PAGE电泳后,用考马斯亮蓝染色,观察目标蛋白的表达。同时P3代病毒感染后的Sf9细胞裂解产物经过10%的SDS-PAGE电泳后,用半干法转印至硝酸纤维素膜(NC膜),用5%的脱脂乳室温封闭2 h,然后以抗PEDV S蛋白的特异性单抗作为一抗,利用辣根过氧化物酶(HRP)标记的山羊抗鼠IgG为二抗进行Western blot鉴定,二抗经过TBST充分洗涤后,利用ECL显影观察检测结果。
1.8 IFA检测 分别用P1、P2和P3病毒感染Sf9细胞,在感染72 h后,弃去培养基,用80%冰乙醇4℃固定细胞1 h,然后分别利用稀释至工作浓度的抗PEDV S蛋白的特异性单抗和抗PEDV的阳性猪血清作为一抗,37℃温箱孵育1 h,经PBST洗涤3次,分别用FITC标记驴抗鼠(1:1000)荧光二抗和FITC标记山羊抗猪(1:1000)荧光二抗在37℃温箱孵育45 min,PBST洗涤3次,置于荧光显微镜观察。
2 结果
2.1 S1基因的扩增 以PEDV FJzz1/2011株为模板,利用引物FJ-S1F/FJ-S1R进行RT-PCR扩增,扩增产物大小约2400 bp,见图1。
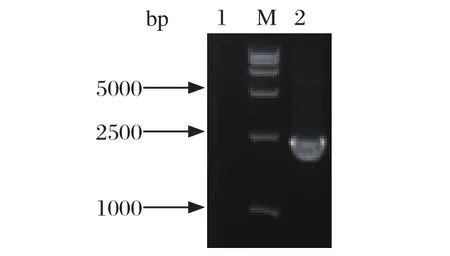
图1 PEDV S1基因的RT-PCR扩增Fig.1 RT-PCR amplif cation of PEDV S1 gene1: 阴性对照; 2: PEDV S1 基因; M: DNA分子量标准(DL15000)1: Negative control; 2: PEDV S1 gene; M: DNA Marker(DL15000)
2.2 重组穿梭质粒rBacmid-S1的鉴定 将pFastBac HTA-S1质粒转化至E.coli DH10Bac感受态细胞中,挑选白色菌落用M13通用性引物进行菌落PCR鉴定,结果显示未发生重组的菌落PCR产物大小约为300 bp,而阳性菌落PCR产物大小约为4800 bp,见图2。

图2 重组穿梭质粒rBacmid-S1的鉴定Fig.2 Identif cation of recombinant shuttle plasmid rBacmid-S11~7: 未重组穿梭质粒; 8: 阳性重组穿梭质粒rBacmid-S1; M: DNA分子量标准(DL5000)1-7: No recombinant shuttle plasmid; 2: Positive recombinant shuttle plasmid rBacmid-S1; M: DNA Marker(DL15000)
2.3 S1重组蛋白的表达 将重组穿梭质粒rBacmid-S1转染Sf9细胞72 h后可观察到明显的细胞膨胀变大,胞浆内有折光颗粒等细胞病变,取P3代病毒感染的Sf9细胞进行SDS-PAGE电泳,结果显示在大约120 kDa左右出现特异性蛋白条带,见图3A。将表达的S1重组蛋白转印至NC膜上,利用抗PEDV S1蛋白的特异性单克隆抗体做为一抗,进行Western blot鉴定,结果显示,该单抗可以特异性识别大小约为120 kDa的特异性蛋白条带,而Sf9细胞对照呈阴性,见图3B),表明PEDV S1蛋白在Sf9细胞中获得了表达。
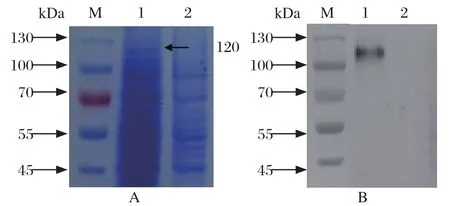
图3 PEDV S1重组蛋白的SDS-PAGE电泳及Western blot鉴定Fig.3 Identif cation of PEDV S1 recombinant protein by SDS-PAGE analysis and Western blot1: 重组病毒感染的Sf9细胞; 2: 阴性对照; M: 蛋白质分子量标准(170 kDa)1: Sf9 cells infected with recombinant virus; 2: Negative control; M: Protein Marker(170 kDa)
2.4 rBac-S1重组病毒的IFA鉴定 分别用P1、P2和P3代rBac-S1重组病毒感染Sf9细胞,72 h后,分别利用抗S蛋白特异性单抗和猪源抗PEDV的阳性血清进行IFA鉴定。结果显示P1、P2和P3代重组病毒rBac-S1感染的Sf9细胞在荧光显微镜均可检测到特异性绿色荧光,表明重组病毒rBac-S1在感染的Sf9细胞中所表达的S1蛋白能被抗S蛋白单抗和猪源抗PEDV的阳性血清所识别,见图4。
3 讨论
PEDV病毒基因组的差异主要集中在S蛋白的S1基因区域,该区域容易出现氨基酸突变、插入或缺失等,因此人们推测该区域氨基酸的突变可能与病毒的嗜性或致病性等相关,而S2基因区域相对较保守。而且PEDV S蛋白的S1基因区域具有一些重要的抗原决定簇,如已有报道证实499~638 aa和636~789 aa是中和性抗原表位区域[15],能诱导机体产生良好的免疫反应,因此S蛋白被认为是疫苗或抗病毒药物筛选的首位候选目标蛋白。而近年来出现的流行毒株与以前所流行的以CV777为代表的毒株在S1基因区域存在较大差异,尚不得知这种变化对该蛋白的抗原特性有怎样影响,本研究利用杆状病毒表达系统将PEDV流行毒株FJzz1/2011株的S1基因区域构建到该系统中,并使之获得表达。杆状病毒表达系统具有可以对表达的外源蛋白进行糖基化修饰等优点[16],在一定程度上模拟了外源蛋白在自然条件下的真实性,从而该系统常被应用于如PCV2等一些病原的亚单位疫苗的研制。本研究在杆状病毒表达系统中所表达的PEDV S1蛋白,与本实验室此前在原核表达系统中所表达的S1蛋白存在明显不同,原核系统所表达的S1蛋白无修饰,与蛋白预期的90 kDa分子量大小基本一致,而在杆状病毒表达系统中所表达的S1蛋白其分子量大小约为120 kDa左右,表明在该系统中表达的S1蛋白可能被进行了糖基化等修饰,这在一定程度的保证了体外人工表达的S1蛋白更加接近天然状态下的PEDV S1蛋白,能够较好地保留该蛋白在自然状态下的活性。本研究我们分别利用抗PEDV S1蛋白的特异性单抗和抗PEDV的猪的阳性血清对该表达蛋白进行了IFA和Western blot鉴定,证实重组病毒rBac-S1在感染Sf9细胞中表达的S1蛋白可以被抗PEDV特异性猪血清和S1蛋白单抗所识别,表明在杆状病毒表达系统中表达的S1蛋白具有较好的抗原性。同时IFA检测发现该蛋白的表达量随着感染时间的延长阳性细胞数量明显增加,SDS-PAGE可以观察到表达目标蛋白的条带,但其表达量仍需要我们今后继续通过优化细胞培养条件等方法来使其得到进一步提高。

图4 不同代次rBac-S1重组病毒感染Sf9细胞的IFA检测Fig.4 IFA detection of PEDV S1 protein in sf9 cells infected with different generations of rBac-S1
[1] Puranaveja S, Poolperm P, Lertwatcharasarakul P, et al. Chinese-like Strain of Porcine Epidemic Diarrhea Virus, Thailand[J]. Emerg Infect Dis, 2009, 15(7): 1112-1115.
[2] Pensaert M B, De Bouck P. A new coronavirus-like particle associated with diarrhea in swine[J]. Arch Virol, 1978, 58: 243-247.
[3] Takahashi K, Okada K, Ohshima K. An outbreak of swine diarrhea of a new-type associated with coronavirus-like particles in Japan[J]. Nippon Juigaku Zasshi, 1983, 45(6): 829-832.
[4] Sun R Q, Cai R J, Chen Y Q, et al. Outbreak of Porcine Epidemic Diarrhea in Suckling Piglets, China[J]. Emerging Infect Dis, 2012, 18(1): 161-163.
[5] Zhou Y J, Wu Y L, Zhu J P, et al. Complete genome sequence of a virulent porcine epidemic diarrhea virus strain[J]. J Virol, 2012, 86(24): 13862.
[6] Stevenson G W, Hoang H, Schwartz K J, et al. Emergence of Porcine epidemic diarrhea virus in the United States: clinical signs, lesions, and viral genomic sequences[J]. J Vet Diagn Invest, 2013, 25(5): 649-654.
[7] Schulz L L, Tonsor G T. Assessment of the economic impacts of porcine epidemic diarrhea virus in the United States[J]. J Anim Sci, 2015, 93(11): 5111-5118.
[8] Chasey D, Cartwright S F. Virus-like particles associated with porcine epidemic diarrhoea[J]. Res Vete Sci, 1978, 25(2): 255-256.
[9] Tobler K, Bridgen A, Ackermann M. Sequence analysis of the nucleocapsid protein gene of porcine epidemic diarrhoea virus[J]. Adv Exp Med Biol, 1993, 342: 49-54.
[10] Brian D A, Baric R S. Coronavirus genome structure and replication[J]. Cur Top Microbiol Immunol, 2005, 287, 1-30.
[11] Huang Y W, Dickerman A W, Pineyro P, et al. Origin, evolution, and genotyping of emergent porcine epidemic diarrhea virus strains in the United States[J]. MBio, 2013, 4(5), e00737-00713.
[12] Song D, Park B. Porcine epidemic diarrhoea virus: a comprehensive review of molecular epidemiology, diagnosis, and vaccines[J]. Virus Genes, 2012, 44(2): 167-175.
[13] Oh J, Lee K W, Choi H W, et al. Immunogenicity and protective efficacy of recombinant S1 domain of the porcine epidemic diarrhea virus spike protein[J]. Arch Virol, 2014, 159(11): 2977-2987.
[14] 王康. 猪流行性腹泻病毒流行毒FJzz1/2011株对仔猪的致病性分析及N蛋白抗原表位的鉴定[D]. 北京: 中国农业科学院, 2015.
[15] Sun D, Feng L, Shi H, et al. Identification of two novel B cell epitopes on porcine epidemic diarrhea virus spike protein[J]. Vet Microbiol, 2008, 131(1): 73-81.
[16] van Loo N D, Fortunati E, Ehlert E, et al. Baculovirus infection of nondividing mammalian cells: mechanisms of entry and nuclear transport of capsids[J]. J Virol, 2001, 75(2): 961-970.
CHARACTERIZATIN OF PORCINE EPIDEMIC DIARRHEA VIRUS S1 GENE EXPRESSED IN INSECT CELLS
YANG De-qiang1, LI Hui-chun1, CHEN Peng-fei1, WANG Kang1, LI Xian-bin1, ZHANG Wen-chao1, YU Ling-xue1, JIANG Yi-feng1, GAO Fei1, HUANG Qin-feng1, YU Hai1, TONG Guang-zhi1,2, ZHOU Yan-jun1,2
(1. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
In the present study, we f rst designed primers based on the cleavage site of S1/S2 of Porcine epidemic diarrhea virus. The S1 gene of PEDV was amplif ed in RT-PCR and cloned into pFastBacHTA vector and the resulting recombinant plasmid pFastBacHTA-S1 was transformed into E.coli DH10Bac competent cells to get the recombinant shuttle plasmid rBacmid-S1. The transfected cells developedvisible cytopathic effect (CPE) at 48 h post transfection (hpt). The recombinant virus (P1) was serially passaged to P3 in the Sf9 cells. The cells were collected and examined in indirect immunof uorescence assay(IFA), SDS-PAGE and Western blot. The Sf9 cells infected with recombinant virus rBac-S1-P3 showed bright green f uorescence when stained with PEDV pig antisera and monoclonal antibody (McAb) against PEDV S1 protein. The SDS-PAGE analysis showed a band at around 120 kDa corresponding to the molecular weight of candidate recombinant protein. This protein band was also visualized in Western blot using McAb against S1 protein. All these results showed that the S1 protein of PEDV strain FJzz1/2011 was expressed in the Sf9 cells using baculovirus expression system.
Porcine epidemic diarrhea virus; S1 protein; baculovirus expression system; Sf9 cells
S852.659.6
A
1674-6422(2017)03-0018-05
2017-02-23
国家自然科学基金项目(31472207);国家重点研发计划项目(2016YFD0500100);国家生猪现代产业技术体系建设项目(CARS-36)
杨德强,男,硕士研究生,预防兽医学专业
周艳君,E-mail:yjzhou@shvri.ac.cn;童光志,E-mail:gztong@shvri.ac.cn

