免疫受损人群的潜伏性结核感染筛查和预防性治疗
阮巧玲 黄希田 刘雪峰 蔡丽敏 邵凌云 张文宏
·综述·
免疫受损人群的潜伏性结核感染筛查和预防性治疗
阮巧玲 黄希田 刘雪峰 蔡丽敏 邵凌云 张文宏
免疫受损人群的潜伏性结核感染(latent tuberculosis infection,LTBI)筛查和预防是控制结核病的重要挑战之一。免疫受损人群中,人类免疫缺陷病毒感染者、免疫介导的炎症性疾病患者、移植候选人及移植患者等是结核病易感人群,对高风险人群进行靶向LTBI筛查是进行预防性治疗的前提。γ干扰素释放试验和结核菌素皮肤试验在不同类型的免疫抑制人群中诊断潜伏性结核感染的能力存在异质性,因此选择合适的筛查策略尤其重要。对LTBI诊断试验阳性者进行预防性治疗可以降低发生活动性结核病的风险,而不同的免疫受损人群在LTBI预防性治疗的方案和时间点有所不同,需要更为深入地进行探索。
免疫减弱宿主; 免疫缺陷综合征; 潜伏性结核病; 多相筛查; 预防和防护用药; 综述
最新研究估计全世界约17亿例潜伏性结核感染(latent tuberculosis infection,LTBI)患者,是活动性肺结核的巨大储蓄池[1]。免疫受损人群是LTBI进展为活动性结核病的高危人群,因为处于潜伏状态的结核分枝杆菌是否再活动,与宿主的免疫状态,尤其与获得性免疫反应有直接相关性[2]。免疫受损人群包括:人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者、免疫介导的炎症性疾病(immune-mediated inflammatory diseases,IMID)患者(尤其是使用生物制剂者)、移植候选人及移植患者等。对于免疫受损人群,LTBI患者再活动的风险不但取决于疾病的免疫抑制类型和免疫缺陷程度,也取决于既往结核分枝杆菌的暴露和当地流行情况;此外,与患者并发的脏器疾病和药物治疗亦相关[3]。对高风险人群进行靶向LTBI筛查和预防性治疗,可以降低发生活动性结核病的风险[4-5]。
免疫受损人群的LTBI筛查
LTBI的诊断尚无金标准,目前广泛接受的两种免疫学诊断方法为结核菌素皮肤试验(tuberculin skin test,TST)和γ干扰素释放试验(interferon-gamma release assay,IGRA)。两种方法都是检测宿主对结核分枝杆菌抗原的细胞免疫反应,阳性结果提示有结核分枝杆菌暴露。两类检测方法都存在局限性,尤其是TST,与卡介苗和非结核分枝杆菌之间存在交叉反应,因此诊断特异度不如IGRA。IGRA能够定量体外检测T细胞对结核分枝杆菌特异性抗原刺激的免疫反应,目前有两种商品化试剂盒:结核感染T细胞酶联免疫斑点试验(T-SPOT.TB)和全血γ干扰素释放法(QFT)。在一般人群中,IGRA的敏感度和特异度均高于TST[6]。但在不同类型的免疫受损人群中,IGRA的表现有很大异质性,这取决于患者免疫受损的机制和程度。
一、HIV感染者
HIV感染者是LTBI再活动风险最高的人群,发展为活动性结核病的年发病风险接近10%[7],接受抗HIV治疗可以降低患结核病的风险,但发病率仍高于普通人群2倍[8]。HIV感染者常出现TST试验无反应,或TST阳性者的硬结直径小于非HIV感染者[9],提示TST试验在HIV感染者中诊断LTBI可能并不可靠。QFT是全血细胞体外试验,与TST一样受到外周血细胞计数的影响。对于有相同结核感染风险的患者,HIV感染者的QFT阳性率低于非HIV感染者,并且与CD4+T细胞计数相关[10]。由于LTBI的诊断无金标准,因此IGRA在HIV患者中诊断活动性结核病的敏感度可以作为其诊断LTBI敏感度的替代指标。有研究发现,两种IGRA检测方法在HIV并发活动性结核病患者中的敏感度存在异质性,T-SPOT.TB受免疫抑制的影响似乎更小;在中、低收入国家,T-SPOT.TB检测的敏感度为72%(95%CI: 62%~81%)优于QFT(61%;95%CI:47%~75%)[11]。这可能与T-SPOT.TB操作过程中采用相同数量的外周血单个核细胞进行试验,受患者外周血CD4+T细胞数的影响较小。有研究发现,对于疑似TST假阴性的HIV感染者,在接受抗HIV病毒治疗发生免疫重建之后,TST结果可以转阳。虽然该机制尚未完全阐明,但是可以推测IGRA也会有类似的表现。因此,美国疾病预防控制中心推荐对初始IGRA阴性且CD4+T细胞计数<200个/mm3的HIV感染者在接受抗HIV病毒治疗且CD4+T细胞≥200个/mm3之后,再次检测LTBI[12]。
不确定结果是IGRA在筛查LTBI时需要注意的另一重要问题。对于T-SPOT.TB检测的不确定结果是指A 孔或者 B 孔结果为5、6或7个点;对于QFT检测来说,阳性对照孔≤0.5 IU/ml或阴性对照孔>8.0 IU/ml。在HIV感染者中,不确定结果占所有采用QFT筛查结果的8.2%,占所有采用T-SPOT.TB筛查结果的5.9%;而在结核病高发地区则更高,QFT和T-SPOT.TB的不确定结果分别高达12.0%和7.7%;另外,对于CD4+T细胞计数<200个/mm3的患者,QFT和T-SPOT.TB筛查中不确定结果分别高达11.6%和11.4%[13]。
二、免疫介导的炎症性疾病患者
免疫介导的炎症性疾病包括类风湿性关节炎、强直性脊柱炎、炎症性肠病等,可能因为疾病本身或者相关的治疗导致免疫受损,相比一般人群发展为活动性结核病的风险升高。接受不同生物制剂后发生活动性结核病的风险不同(表1)。对于长期接受肿瘤坏死因子(TNF-α)拮抗剂治疗者,监测LTBI患者发展为活动性结核病和新感染的结核病意义重大,接受TNF-α拮抗剂前对LTBI患者进行抗结核药物预防性治疗可以降低65%活动性结核病的发病风险[14]。
在免疫介导的炎症性疾病患者中,IGRA和TST诊断LTBI的研究相对样本量均较小,不同研究之间的异质性较大。目前,并没有明确的证据表明IGRA在筛查LTBI方面优于TST。Ruan等[18]研究纳入的样本涵盖来自10个国家,共1940例风湿性疾病患者在接受生物制剂治疗前进行LTBI筛查,结果发现TST和IGRA的一致性在不同研究中差异较大,QFT和T-SPOT.TB与TST的一致性分别为72%和75%;既往接种卡介苗可引起TST阳性率明显增加,而对于结核病密切接触者、出生或长期居住在结核病流行地区、肺部影像学异常的高危人群进行IGRA检测的阳性率明显增加;糖皮质激素的使用会导致TST阳性率明显下降,而对IGRA阳性率下降影响并不明显;缓解病情的抗风湿药(DMARDs)对两种方法检测的阳性率均无明显影响,因此IGRA受生物制剂外的免疫抑制药物的影响似乎小于TST。另一项针对于已经接受免疫抑制剂治疗的炎症性肠病患者的系统综述,则发现接受免疫抑制药物,尤其是糖皮质激素治疗后QFT和TST检测的阳性率均明显降低[19]。但是,不同类型免疫介导的炎症性疾病和不同类型免疫抑制药物对于LTBI患者免疫诊断的影响尚缺少深入的分析和更高质量的研究。目前,虽然没有明确证据表明IGRA和TST在免疫介导的炎症性疾病人群中筛查LTBI的优越性,但是现有的相关指南更倾向于推荐IGRA或者IGRA与TST联合使用,对于接种过BCG的患者则更推荐IGRA[18]。
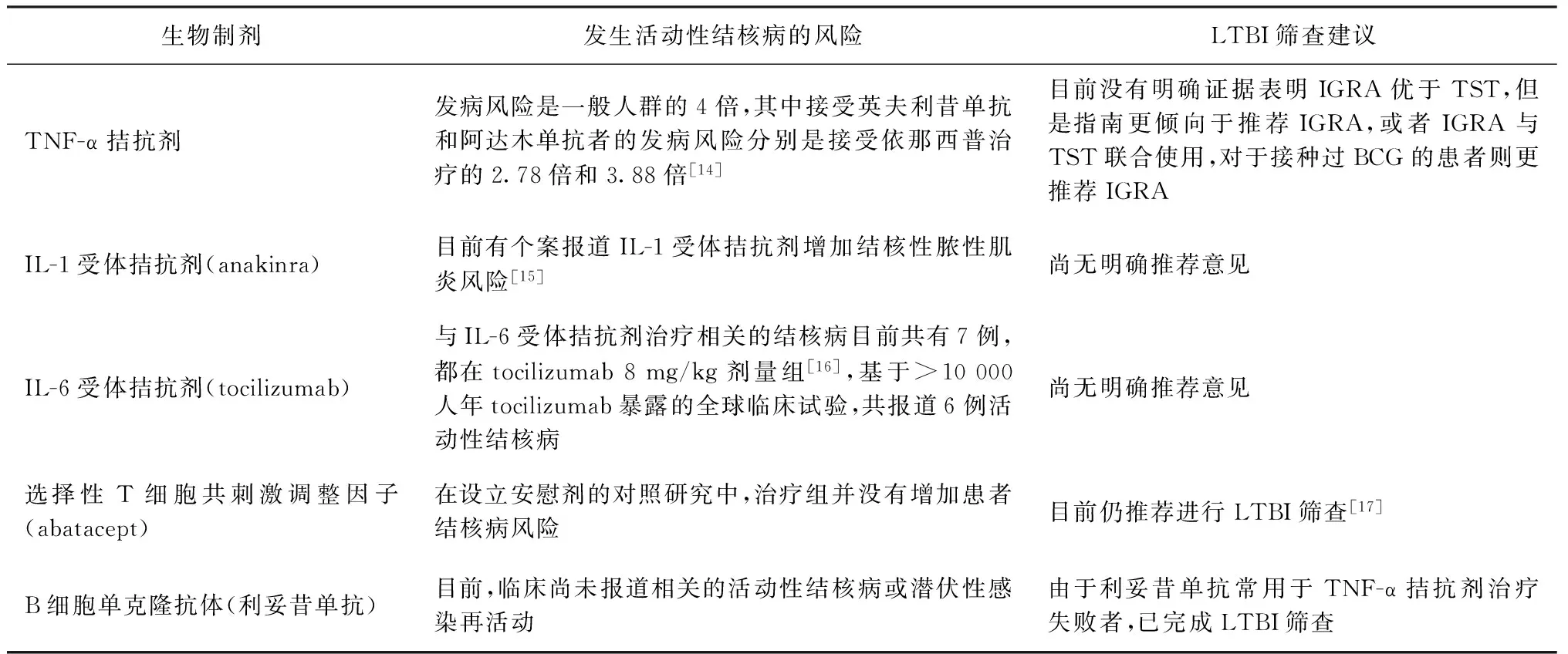
表1 对接受不同生物制剂治疗的IMID患者发生活动性结核病的风险及LTBI筛查建议
IGRA不确定结果,对于准备接受包括TNF-α拮抗剂在内的免疫抑制剂治疗的免疫介导的炎症性疾病患者来说同样是一个难题。对这类患者进行重复IGRA检测可以提高敏感度,但是从流行病学角度来说,临床和影像学评估也是系统筛查的重要组成部分。另外,不同的长期随访研究发现,开始治疗后再重复进行IGRA检测的意义存在争议,IGRA的阴转和阳转不一定与临床结局相关[20-21]。
三、移植候选人和移植受体
实体器官移植患者的结核病风险是一般人群的20~74倍,而骨髓移植者的风险则是一般人群的2倍[22],所以筛查和治疗LTBI的干预措施意义重大。移植患者患活动性结核病,其可能来源于受体或者供体的潜伏性感染再激活或者再暴露于结核分枝杆菌感染。现有的相关指南推荐移植候选人和移植受体(包括实体器官移植和骨髓干细胞移植)的患者,在移植前要接受LTBI筛查[22-23]。移植受体的结核病风险不但取决于结核分枝杆菌的流行情况,与移植器官和免疫抑制水平同样相关。因此,推荐根据当地和个体LTBI的风险进行结核病的靶向筛查为最佳策略。
对于接受实体器官移植的患者来说,IGRA检测的敏感度似乎优于TST,两者的一致性较差或一般,而两种IGRA(T-SPOT.TB和QFT)检测方法之间的一致性较好[24-26]。IGRA不确定结果在实体器官移植患者中的比率较低,约占1%~7%[27]。对于骨髓干细胞移植的患者来说,现有的相关指南推荐对有危险因素(如结核暴露史)的患者进行活动性结核病筛查,并联合IGRA和TST进行LTBI筛查。对于骨髓干细胞移植的患者来说,之前化疗可能会影响LTBI筛查试验的敏感度[28]。大量的横断面研究发现,IGRA的诊断准确性优于TST,提示IGRA阳性可能与结核分枝杆菌的暴露关系更加密切。另外,T-SPOT.TB的敏感度可能优于TST[29]。在骨髓干细胞移植人群中,IGRA检测的不确定结果比率相对较高[3]。除了对TST或者IGRA结果为阳性的患者检查之外,全面筛查所有的结核病危险因素同样是决定是否启动预防性治疗的重要步骤;如患者有未经治疗的结核病病史,或影像学检查提示为未治愈的结核病,或与活动性结核病患者有接触史,都是启动预防性治疗的指征[30]。
免疫受损人群的LTBI预防性治疗
一、HIV感染者
HIV感染者可从LTBI预防性治疗中获益,接受预防性治疗组与采用安慰剂组比较,发生活动性结核病的风险下降32%,尤其对于TST阳性的患者[31]。2011年WHO[32]发布指南推荐对HIV感染的成年人和青少年进行TST筛查,对TST阳性和没有条件进行TST筛查者,无论这些患者免疫抑制状态如何,至少采用6个月的异烟肼单药进行预防性治疗,并且认为异烟肼单药预防性治疗不会增加其结核分枝杆菌的耐药水平。
与包含吡嗪酰胺、利福平或者利福喷丁的预防性治疗方案相比,异烟肼单药预防在疗效上差异无统计学意义,但是不良反应较少[33]。因此,WHO推荐异烟肼300 mg/d单药作为首要推荐方案。HIV感染者的LTBI预防性治疗通常采用6~12个月的异烟肼单药,2种方案的预防性治疗效果差异无统计学意义[31]。在结核病流行率中等的地区,既往研究发现6个月的预防性治疗对于HIV感染者LTBI预防性治疗似乎已经足够[34]。而对于结核病高负担地区的治疗,6~12个月的异烟肼单药预防性治疗的有效性可能仅局限在治疗期间,服药结束后预防效果下降,不能预防再感染。一项Meta分析研究对异烟肼持续性预防性治疗(至少36个月)和标准6个月预防性治疗的效果进行了比较,发现前者发生活动性结核病的风险相较后者下降了38%;尤其在TST阳性的患者中,下降了49%,而不良反应没有明确增加[35]。这提示结核病高发地区的HIV感染者可能从持续的预防性治疗中获益。
二、免疫介导的炎症性疾病患者
免疫介导的炎症性疾病包含了一大类疾病,包括类风湿性关节炎、强直性脊柱炎、炎症性肠病等,TNF-α拮抗剂的应用越来越广泛,越来越多的患者需要进行LTBI预防性治疗。
预防性治疗的时间点选择对该人群非常重要,一般推荐在开始使用TNF-α拮抗剂前3~4周开始进行LTBI预防性治疗,欧洲及美国推荐预防性治疗4周后开始TNF-α拮抗剂治疗是安全的[36-37]。目前,对于不同LTBI预防性治疗方案在使用不同类型TNF-α拮抗剂的患者中的有效性仍缺乏针对性研究,包括WHO指南在内大多数的指南认为针对其他人群的预防性治疗方案,包括异烟肼单药、利福平单药或者联合异烟肼均可以选择[5, 38]。有研究认为3个月异烟肼联合利福平方案在该人群中不良反应低,完成率高,因而更为推荐[39]。中国2009年推出了英夫利昔单抗治疗前结核预防与管理专家建议,推荐治疗前进行结核预防性治疗至少4周,方案包括异烟肼300 mg/d单药治疗3~6个月,异烟肼300 mg/d联合利福平450 mg/d治疗3~6个月,以及异烟肼600 mg/次联合利福喷丁600 mg/次,每周2次,治疗3~6个月[40]。
三、移植候选人和移植患者
移植患者LTBI预防性治疗方案的选择受到多种因素影响,包括当地结核分枝杆菌的耐药情况、药物毒性、药物之间的相互作用和患者依从性等。实体器官移植患者开始进行LTBI预防性治疗的最佳时间点尚不明确。部分临床医生倾向于移植前进行预防性治疗以降低药物之间相互作用的风险,但是也有部分医生倾向于移植后开始进行预防性治疗,因为开始使用抗排异药物之后LTBI再激活的概率更高,从而产生药物间相互作用,尤其是利福霉素类药物。常用的预防性治疗方案包括9个月的异烟肼(通常与维生素B6共服)或者4个月的利福平单药方案,另外也有专家认为在排除禁忌征保证安全的情况下,氟喹诺酮类药物也是预防性治疗的备选药物。
肝移植和肾移植在国内广泛开展,但是对于有肝炎或者终末期肾病的患者来说,移植前的预防性治疗相对复杂,治疗更加个体化。对接受预防性治疗的患者,强烈推荐密切监测药物相关性肝损伤的临床表现,治疗期间每月复查肝功能。对于高危患者,特别是年龄大和容易出现药物不良反应者,需增加监测频率。肝移植患者因为出现异烟肼预防性治疗相关肝损伤的风险高,而更短疗程的利福平单药治疗发生肝损伤的不良反应发生率低[41],因此可能更适合等待肝移植者;也可以考虑采用氟喹诺酮类药物进行预防性治疗,但是长期用药的不良反应已经有报道[42]。对于等待肝移植的患者,也有专家推荐仅对肝硬化代偿期或者有条件密切监测肝毒性的患者进行预防性治疗,临床医生也更倾向于推迟预防性治疗至肝移植术后。移植后的预防性治疗方案与移植前相似,但是需要注意预防性治疗药物与抗排异药物之间的相互作用。目前研究发现,异烟肼与钙调磷酸酶抑制剂的相互作用有限;此外,利福霉素通常不推荐用于移植后患者的LTBI预防性治疗,因为利福霉素可降低包括他克莫司、环孢素A、霉酚酸酯、雷帕霉素在内的移植后使用的免疫抑制剂的药物浓度[42]。
对于该人群来说,最佳的预防性治疗疗程尚不明确。但是对于一些免疫抑制程度高、结核病风险高的患者推荐适当延长预防性治疗的时间。实际上,由于不良反应和药物之间的相互作用,延长预防性治疗的时间有时并不能实现,治疗过程也可能会中断;但是目前尚不明确疗程中断是否会增加患活动性结核病的风险。如果预防性治疗在移植前开始,但是患者在移植前没有完成预防性治疗,推荐在移植后患者能够耐受的情况下,尽快重新开始预防性治疗[43]。
总 结
活动性结核病在免疫受损人群中(包括HIV感染者、接受生物制剂治疗的IMID患者和移植患者)的发生率不断升高,LTBI的预防性治疗能够降低活动性结核病的发病率。IGRA和TST在不同免疫受损人群中的检测结果异质性大,IGRA在一些特定的人群和特定的情况下优于TST,但仍需要更多的研究证实IGRA在该人群中的诊断和预测价值。针对免疫受损人群,尤其是LTBI诊断试验阳性者进行预防性治疗的意义重大,不同的免疫受损人群在LTBI预防性治疗的方案和时间点有所不同,希望未来有针对不同人群的更为深入的治疗方案的探索和细化。
[1] Houben RM, Dodd PJ. The Global Burden of Latent Tuberculosis Infection: A Re-estimation Using Mathematical Modelling. PLoS Med, 2016, 13(10):e1002152.
[2] Philips JA, Ernst JD. Tuberculosis pathogenesis and immunity. Annu Rev Pathol, 2012, 7:353-384.
[3] Sester M, van Leth F, Bruchfeld J, et al. Risk assessment of tuberculosis in immunocompromised patients. A TBNET study. Am J Respir Crit Care Med, 2014, 190(10):1168-1176.
[4] 艾静文, 阮巧玲, 张文宏. 结核分枝杆菌潜伏感染预防性治疗的进展. 中国防痨杂志, 2015, 37(1): 80-85.
[5] World Health Organization. Guidelines on the management of latent tuberculosis infection. Geneva: World Health Organization, 2015.
[6] 熊勇超, 侯月云, 赵建忠, 等. γ干扰素释放试验在检测结核分枝杆菌潜伏感染中的应用. 中国防痨杂志, 2012, 34(9):613-616.
[7] Corbett EL, Watt CJ, Walker N, et al. The growing burden of tuberculosis: global trends and interactions with the HIV epidemic. Arch Intern Med, 2003, 163(9):1009-1021.
[8] Horsburgh CR Jr. Priorities for the treatment of latent tuberculosis infection in the United States. N Engl J Med, 2004, 350(20):2060-2067.
[9] Cobelens FG, Egwaga SM, van Ginkel T, et al. Tuberculin skin testing in patients with HIV infection: limited benefit of reduced cutoff values. Clin Infect Dis, 2006, 43(5):634-639.
[10] Santin M, Casas S, Saumoy M, et al. Detection of latent tuberculosis by the tuberculin skin test and a whole-blood interferon-gamma release assay, and the development of active tuberculosis in HIV-seropositive persons. Diagn Microbiol Infect Dis, 2011, 69(1):59-65.
[11] Cattamanchi A, Smith R, Steingart KR, et al. Interferon-gamma release assays for the diagnosis of latent tuberculosis infection in HIV-infected individuals: a systematic review and meta-analysis. J Acquir Immune Defic Syndr, 2011, 56(3): 230-238.
[12] Kaplan JE, Benson C, Holmes KK, et al. Guidelines for prevention and treatment of opportunistic infections in HIV-infected adults and adolescents: recommendations from CDC, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. MMWR Recomm Rep, 2009, 58:1-207.
[13] Santin M,Muoz L,Rigau D. Interferon-gamma release assays for the diagnosis of tuberculosis and tuberculosis infection in HIV-infected adults: a systematic review and meta-analysis. PLoS One, 2012, 7(3):e32482.
[14] Ai JW, Zhang S, Ruan QL, et al. The risk of tuberculosis in patients with rheumatoid arthritis treated with tumor necrosis factor-alpha antagonist: a metaanalysis of both randomized controlled trials and registry/cohort studies. J Rheumatol, 2015, 42(12):2229-2237.
[15] Migkos MP, Somarakis GA, Markatseli TE, et al. Tuberculous pyomyositis in a rheumatoid arthritis patient treated with anakinra. Clin Exp Rheumatol, 2015, 33(5): 734-736.
[16] Schiff MH, Kremer JM, Jahreis A, et al. Integrated safety in tocilizumab clinical trials. Arthritis Res Ther, 2011, 13(5):R141.
[17] Salmon JH, Gottenberg JE, Ravaud P, et al. Predictive risk factors of serious infections in patients with rheumatoid arthritis treated with abatacept in common practice: results from the Orencia and Rheumatoid Arthritis (ORA) registry. Ann Rheum Dis, 2016, 75(6):1108-1113.
[18] Ruan Q, Zhang S, Ai J, et al. Screening of latent tuberculosis infection by interferon-gamma release assays in rheumatic patients: a systemic review and meta-analysis. Clin Rheumatol, 2016, 35(2):417-425.
[19] Belard E, Semb S, Ruhwald M, et al. Prednisolone treatment affects the performance of the Quanti FERON gold in-tube test and the tuberculin skin test in patients with autoimmune disorders screened for latent tuberculosis infection. Inflamm Bowel Dis, 2011, 17(11):2340-2349.
[20] Drago L, Nicola L, Signori V, et al. Dynamic QuantiFERON response in psoriasis patients taking long-term biologic therapy. Dermatol Ther (Heidelb), 2013, 3(1):73-81.
[21] Scrivo R, Sauzullo I, Mengoni F, et al. Mycobacterial interferon-gamma release variations during longterm treatment with tumor necrosis factor blockers: lack of correlation with clinical outcome. J Rheumatol, 2013, 40(2):157-165.
[22] Bumbacea D, Arend SM, Eyuboglu F, et al. The risk of tuberculosis in transplant candidates and recipients: a TBNET consensus statement. Eur Respir J, 2012, 40(4):990-1013.
[23] Aguado JM, Torre-Cisneros J, Fortun J, et al. Tuberculosis in solid-organ transplant recipients: consensus statement of the group for the study of infection in transplant recipients (GESITRA) of the Spanish Society of Infectious Diseases and Clinical Microbiology. Clin Infect Dis, 2009, 48(9):1276-1284.
[24] Kim SY, Jung GS, Kim SK, et al. Comparison of the tuberculin skin test and interferon-gamma release assay for the diagnosis of latent tuberculosis infection before kidney transplantation. Infection, 2013, 41:103-110.
[25] Hadaya K, Bridevaux PO, Roux-Lombard P, et al. Contribution of interferon-gamma release assays (IGRAs) to the diagnosis of latent tuberculosis infection after renal transplantation. Transplantation, 2013, 95(12):1485-1490.
[26] Lee YM, Lee SO, Choi SH, et al. A prospective longitudinal study evaluating the usefulness of the interferon-gamma releasing assay for predicting active tuberculosis in allogeneic hematopoietic stem cell transplant recipients. J Infect, 2014, 69(2):165-173.
[27] Sauzullo I, Vullo V, Mastroianni CM. Detecting latent tuberculosis in compromised patients. Curr Opin Infect Dis, 2015, 28(3):275-282.
[28] Kobashi Y, Mouri K, Obase Y, et al. Clinical evaluation of QuantiFERON TB-2G test for immunocompromised patients. Eur Respir J, 2007, 30(5):945-950.
[29] Ramos JF, Batista MV, Costa SF. Tuberculosis in hematopoie-tic stem cell transplant recipients(Review). Mediterr J Hematol Infect Dis, 2013, 5(1):e2013061.
[30] Meije Y, Piersimoni C, Torre-Cisneros J, et al. Mycobacterial infections in solid organ transplant recipients. Clin Microbiol Infect, 2014, 20(Suppl7):89-101.
[31] Akolo C, Adetifa I, Shepperd S, et al. Treatment of latent tuberculosis infection in HIV infected persons. Cochrane Database Syst Rev, 2010,(1):CD000171.
[32] World Health Organization. Guidelines for intensified tuberculosis case-finding and isoniazid preventive therapy for people living with HIV in resource-constrained settings. Geneva: World Health Organization,2011.
[33] Martinson NA, Barnes GL, Moulton LH, et al. New regimens to prevent tuberculosis in adults with HIV infection. N Engl J Med, 2011, 365(1):11-20.
[34] Golub JE, Cohn S, Saraceni V, et al. Long-term protection from isoniazid preventive therapy for tuberculosis in HIV-infected patients in a medium-burden tuberculosis setting: the TB/HIV in Rio (THRio) study. Clin Infect Dis, 2015, 60(4):639-645.
[35] Den Boon S, Matteelli A, Ford N, et al. Continuous isoniazid for the treatment of latent tuberculosis infection in people living with HIV. AIDS, 2016, 30(5):797-801.
[36] Singh JA, Furst DE, Bharat A, et al. 2012 update of the 2008 American College of Rheumatology recommendations for the use of disease-modifying antirheumatic drugs and biologic agents in the treatment of rheumatoid arthritis. Arthritis Care Res (Hoboken), 2012, 64(5):625-639.
[37] Solovic I, Sester M, Gomez-Reino JJ, et al. The risk of tuberculosis related to tumour necrosis factor antagonist therapies: a TBNET consensus statement. Eur Respir J, 2010, 36(5):1185-1206.
[38] Shim TS. Diagnosis and treatment of latent tuberculosis infection due to initiation of anti-TNF therapy. Tuberc Respir Dis (Seoul), 2014, 76(6):261-268.
[39] Park SJ, Jo KW, Yoo B, et al. Comparison of LTBI treatment regimens for patients receiving anti-tumour necrosis factor therapy. Int J Tuberc Lung Dis, 2015, 19(3):342-348.
[40] 英夫利昔单抗治疗前预防与管理专家建议组. 英夫利西单抗治疗前结核预防与管理专家建议. 中华内科杂志, 2009, 48(11):980-982.
[41] Stagg HR, Zenner D, Harris RJ, et al. Treatment of latent tuberculosis infection: a network meta-analysis. Ann Intern Med, 2014, 161(6):419-428.
[42] Meije Y, Piersimoni C, Torre-Cisneros J, et al. Mycobacterial infections in solid organ transplant recipients. Clin Microbiol Infect, 2014, 20(Suppl 7): 89-101.
(本文编辑:王然 李敬文)
Detection and preventive treatment of latent tuberculosis infection in immunocompromised patients
RUAN Qiao-ling*, HUANG Xi-tian, LIU Xue-feng, CAI Li-min, SHAO Ling-yun, ZHANG Wen-hong.
*Department of Infectious Disease, Huashan Hospital, Fudan University, Shanghai 200040, China
ZHANG Wen-hong, Email: zhangwenhong@fudan.edu.cn
The latent tuberculosis infection (LTBI) detection and preventive treatment in the immuno-compromised patients is one of the key challenges of tuberculosis (TB) control. Immunocompromised patients, including the patients with human immunodeficiency virus (HIV) infection, the patients with immune-mediated inflammatory diseases, the transplant candidates and recipients, are especially susceptible to TB. A targeted detection of LTBI in these high-risk groups is a precondition for providing the preventive treatment of TB. The perfor-mance of the two immunodiagnostic tests (interferon-gamma release assay and tuberculin skin test) is highly variable among different immunocompromised groups, so the selection of an appropriate screening strategy is very important. Preventive treatment of LTBI can reduce the risk of TB development, but the treatment regimens and the time of treatment can be different among different categories of compromised patients, and further researches are needed.
Immunocompromised host; Immunologic deficiency syndromes; Latent tuberculosis; Multiphasic screening; Protective agents; Review
10.3969/j.issn.1000-6621.2017.07.020
“十三五”国家科技重大专项(2017ZX10201302-004)
200040 上海, 复旦大学附属华山医院感染科(阮巧玲、邵凌云、张文宏);温岭市第一人民医院感染科(黄希田、刘雪峰、蔡丽敏)
张文宏,Email:zhangwenhong@fudan.edu.cn
2016-12-20)

