产后蒜薹灰霉病菌产毒条件研究
王勇+张春祥+高苇+孔庆学+阎瑞香+张娜

摘要:由灰葡萄孢霉引起的蒜薹灰霉病是贮藏期蒜薹的重要病害之一。灰葡萄孢霉可以产生真菌毒素,为明确灰葡萄孢霉的最佳产毒培养基和培养时间,本研究从蒜薹主产区采集的蒜薹灰霉病病样上分离到灰葡萄孢霉强致病菌株BC-3,通过黄瓜种子萌发生长法、叶片圆盘法、蒜薹悬滴接种法及系统侵染法4种方法测定灰葡萄孢霉毒素对黄瓜和蒜薹的生物活性。结果表明,蒜薹灰葡萄孢霉毒素为非寄主选择性毒素,最适产毒培养基为马铃薯葡萄糖培养基和淀粉酵母培养基,培养时间为12~18 d。
关键词:蒜薹;灰霉病;灰葡萄孢霉;培养条件;真菌毒素;生物活性
中图分类号:S436.33 文献标识号:A 文章编号:1001-4942(2017)07-0116-04
Abstract The grey mold on garlic scape infected by Botrytis cinerea is one of the main fungal diseases during the storage of garlic scape. The pathogen Botrytis cinerea can produce mycotoxin. In order to research the optimum medium and culture time of mycotoxin production of Botrytis cinerea, the Botrytis cinerea BC-3 with high pathogenicity isolated from garlic scape was selected for target strain in this study. The bioassay of crude toxin was detected by germination-growth of cucumber seeds, plant leaf disc test, garlic scape droplet inoculation and scape wilting method. The results showed that the toxin of Botrytis cinerea was nonhost-selective toxin, the optimal medium for mycotoxin production was potato glucose medium and starch yeast medium, and the culture time was 12~18 days.
Keywords Garlic scape; Grey mold; Botrytis cinerea; Culture condition;Mycotoxin; Bioassay
灰葡萄孢霉(Botrytis cinerea)是引起产后蒜薹灰霉病的重要致病病原之一[1,2],严重威胁蒜薹贮藏和市场供应。灰葡萄孢霉常在植物发育早期侵入宿主,并在相当长时间内保持沉默,直到宿主植物生理发生变化有利于其生长时,引发宿主软腐、组织坏死。究其原因是由于灰葡萄孢霉在与宿主植物相互识别、相互作用的过程中会产生次生代谢产物——真菌毒素,毒素在致病过程中会起决定因子的作用[3,4]。1974年灰葡萄孢霉产生的二环倍半萜烯类毒素Botrydial最早被分离鉴定出来,经检测Botrydial的毒性很高,其它毒素多为其前体或衍生物[5,6]。检测发现被灰葡萄孢霉侵染的宿主植物出现伤口后,植物组织细胞中就可以检测到Botrydial,但植物本身并不能分泌这种化合物。随着植物叶片上萎黄程度增高,检测到Botrydial的量也增加,所以灰葡萄孢霉分泌的二环倍半萜类毒素被认为是灰霉病致病的关键因素,这些毒素可以引发宿主植物萎黄病和组织细胞破裂[7]。
目前,关于灰葡萄孢霉毒素的分离提取、活性成分鑒定方面已有部分研究报道[8],发现灰葡萄孢霉产生的毒素Botrydial是非寄主选择性毒素[9],但研究显示侵染蒜薹和黄瓜的灰葡萄孢霉在菌株的生物学、致病力上都存在显著差异[10-12]。而目前对采后蒜薹灰葡萄孢霉毒素的研究报道较少,且毒素对采后蒜薹的致病作用方式尚不明确。据此,本试验对蒜薹灰葡萄孢霉的产毒条件及毒素对蒜薹和黄瓜活性进行研究,以期找到该病原菌产毒的最适培养条件和毒素活性评价方法,为产后蒜薹灰霉病毒素致病机制等方面的研究奠定基础。
1 材料与方法
1.1 供试菌株
采集产后蒜薹灰霉病典型发病样本,按常规组织分离方法分离获得病原菌,经纯化获得蒜薹灰霉病菌纯培养菌株10株。依据柯赫氏法则进行致病性测定,验证结果表明该10个菌株均可侵染蒜薹,在蒜薹薹条和薹苞上形成黄色的梭形或不规则形病斑。其中菌株BC-3致病力较强,经鉴定为灰葡萄孢霉(Botrytis cinerea),选其作为产毒培养基筛选的靶标菌株。
1.2 灰葡萄孢霉粗毒素滤液的制备
本试验采用以下5种液体培养基:(1)马铃薯葡萄糖培养基(简称PD培养基,下同):马铃薯200 g,葡萄糖20 g,加蒸馏水至1 L。(2)淀粉酵母培养基:可溶性淀粉40 g,酵母浸膏5 g,蒸馏水1 L。(3)酵母浸膏Ⅰ培养基:酵母浸膏0.9 g、蒸馏水1 L。(4)酵母浸膏Ⅱ培养基:酵母浸膏4 g、麦芽膏10 g、葡萄糖4 g、蒸馏水1 L。(5)Czapeks培养基:NaNO3 3 g,K2HPO4 0.5 g,MgSO4·7H2O 0.5 g,KCl 1 g, FeSO4·7H2O 0.01 g,蔗糖30 g,蒸馏水1 L。
在250 mL三角瓶中分别加入150 mL上述5种液体培养基,每种培养基每个取样时间段设定3次重复。将供试灰葡萄孢霉BC-3菌株移至PDA培养基上活化,于25℃下培养4 d,用直径4 mm打孔器在长势一致的菌落边缘打取菌饼,每瓶接种5块菌饼,在黑暗条件下25℃、120 r/min摇床振荡培养。培养第0、3、6、9、12、15、18、21、24 d各取一瓶培养液。将培养液通过双层灭菌滤纸过滤除去菌丝体和孢子,后用0.22 μm微孔滤膜加压抽滤,获得无菌滤液,即灰葡萄孢霉Botrydial粗毒素滤液。4℃冰箱中保存备用。
1.3 不同培养条件下灰葡萄孢霉毒素对黄瓜和蒜薹生物活性的测定
1.3.1 对黄瓜种子活性 采用种子萌发生长法测定。黄瓜品种为长春密刺,将50粒种子置于铺有双层灭菌滤纸的培养皿内,分别加入不同培养条件下灰葡萄孢霉产毒素滤液5 mL,以无菌水为对照,各处理设定3次重复。在28℃培养箱中催芽3 d,统计种子发芽情况,测量芽长,计算毒素抑制发芽率。
1.3.2 对黄瓜离体叶片活性 采用圆盘叶片法测定。将同一生长期的黄瓜叶片用直径1 cm的打孔器打取叶盘,然后每20个叶盘为一个重复,立即浸入含有10 mL灰葡萄孢霉粗毒素滤液的直径为9 cm培养皿中(叶盘背面朝下),以不同培养条件下灰葡萄孢霉产毒素滤液浸黄瓜叶片为处理,以无菌蒸馏水为对照,每处理设3次重复。于25℃培养箱中培养3 d(光/暗周期为12 h)后,采用SPAD-502叶绿素仪测定叶绿素含量。毒素作用会使黄瓜叶盘褪绿变黄,通过叶盘的叶绿素变化来衡量毒素活性。
1.3.3 对蒜薹薹条活性 ①采用悬滴接种法测定。选取同一生长期的蒜薹薹条,将其放在铺有两层浸湿滤纸的大培养皿中,在蒜薹薹条表面采用接种针制造伤口,悬滴接种20 μL粗毒素滤液于伤口表面,以不同培养条件下灰葡萄孢霉产毒素滤液悬滴接种蒜薹薹条为处理,每皿放入5根蒜薹薹条,以接种20 μL无菌水为对照,每处理重复3皿。25℃培养箱中培养3 d后(光/暗周期为12 h),调查毒素接种点的细胞损伤情况。毒素作用蒜薹细胞造成细胞损伤,会使其自接种点位置褪绿变黄,并扩展形成病斑,通过接种点细胞坏死、黄变、扩展程度衡量毒素细胞损伤活性。
②采用系统侵染法测定。取20 mL烧瓶,分别加入各处理获得的粗毒素滤液5 mL,将同一生长期的蒜薹薹条浸入滤液中,以浸入5 mL无菌水为对照,每处理重复3次。25℃培养箱中培养3 d后(光/暗周期为12 h),调查蒜薹薹条的黄变程度。毒素作用会通过蒜薹输导系统传导使蒜薹上部发生褪绿、黄化,可通过蒜薹的整体黄变程度来衡量毒素对蒜薹产生毒性影响的活性。
2 结果与分析
2.1 不同培养条件下灰葡萄孢霉毒素滤液对黄瓜种子生长的抑制作用
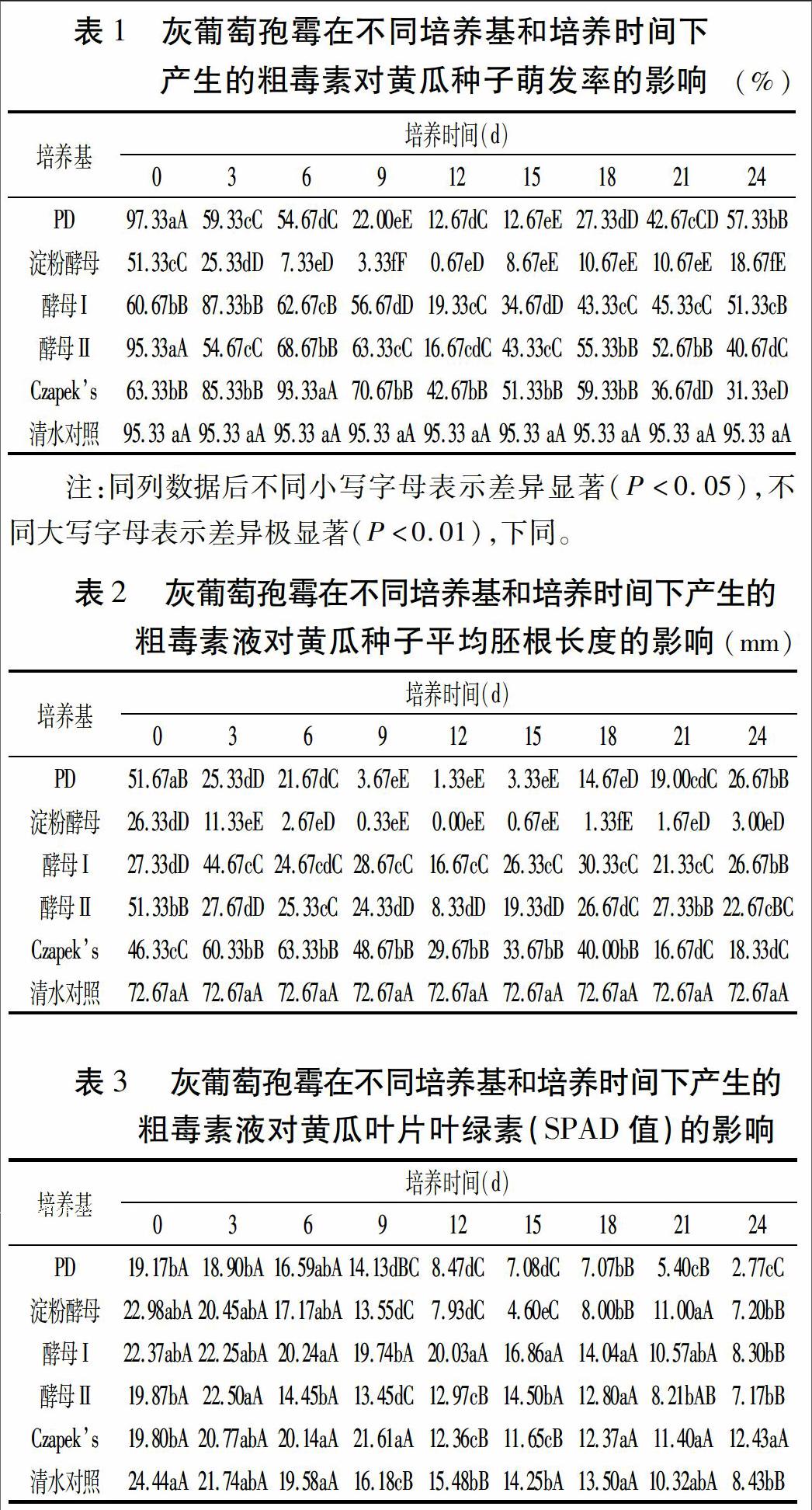
试验结果(表1)表明,灰葡萄孢霉在5种培养基中均能正常生长,其中在PD培养基中菌丝生长较快,培养6 d后菌丝生长较多,培养滤液显著少于其它培养基,菌丝聚集缠绕形成较大的菌球。在Czapeks培养基中菌丝生长缓慢,形成较小的菌丝球。其它3种培养基中,菌丝生长中等。
不同条件产毒素处理对黄瓜种子的萌发率和胚根生长影响有极显著差异。其中,在相同培养基上,随时间延长毒素作用呈现先增强再减弱的趋势, PD培养9~18 d、淀粉酵母培养6~21 d、酵母Ⅰ和酵母Ⅱ培养12~15 d、Czapeks培養21~24 d产生毒素对黄瓜种子萌发和胚根伸长影响较大;在相同培养时间, 淀粉酵母培养灰葡萄孢霉产生的毒素对黄瓜种子萌发和胚根生长的抑制作用最强,显著或极显著高于其他处理和对照,PD培养基次之。灰葡萄孢霉在淀粉酵母培养基和PD培养基培养12 d后产生的毒素对黄瓜种子萌发和胚根伸长抑制最为明显,酵母Ⅱ、酵母Ⅰ和Czapeks培养毒素次之,但抑制效果均高于对照(表2)。
2.2 不同培养条件下灰葡萄孢霉毒素滤液对黄瓜离体叶片的影响
由表3可见,由5种培养基培养3、6 d的毒素滤液处理黄瓜叶盘后,叶绿素SPAD值与清水对照无极显著差异,而从培养9 d开始,随培养时间延长,5种培养基产生毒素滤液处理黄瓜叶盘,叶绿素SPAD值基本呈逐渐减少趋势。但在相同时间不同培养基处理对叶绿素SPAD值影响程度不同。其中PD培养9~24 d的毒素处理叶绿素SPAD值显著或极显著低于清水对照、酵母Ⅰ和Czapeks培养毒素处理;淀粉酵母培养9~18 d毒素处理的叶绿素极显著低于清水对照、酵母Ⅰ和Czapeks培养毒素处理;酵母Ⅰ培养9~15 d毒素处理的叶绿素显著高于清水对照;酵母Ⅱ培养9~12 d和Czapeks培养12~15 d毒素处理的叶绿素显著低于清水对照。综合不同培养基和不同培养时间灰葡萄孢霉产生的粗毒素液处理黄瓜叶片叶绿素SPAD值,PD和淀粉酵母培养基处理产生的毒素抑制作用最强。
2.3 悬滴接种法测定粗毒素滤液对蒜薹薹条的影响
由表4可见,接种3 d后,对照处理薹条基本无变化,而接种毒素滤液处理的薹条接种点出现不同程度褪绿黄斑。其中PD培养基对蒜薹薹条接种点细胞的损伤程度最大,培养3 d产生的毒素即可使接种点失绿,培养15 d产生的毒素即可使接种点失绿变黄,培养18 d产生的毒素即可使接种点失绿变黄扩展;淀粉酵母和酵母Ⅱ培养基次之,培养3 d产生的毒素即可使接种点失绿,培养18 d产生的毒素即可使接种点失绿变黄;酵母Ⅰ培养基培养9 d产生的毒素可使接种点失绿,培养21 d产生的毒素可使接种点失绿变黄; Czapeks培养基培养18 d产生的毒素才可使接种点失绿。
2.4 系统侵染法测定粗毒素滤液对蒜薹薹条的影响
由表5结果可知,接种3 d后清水对照薹条上未见变化,而毒素滤液处理薹条呈现不同程度的褪绿现象,说明毒素可通过蒜薹输导组织使蒜薹整体发生褪绿、黄化。不同培养基之间及相同培养基不同培养时间产生毒素引起的蒜薹薹条的黄花程度趋势同悬滴接种法,只是系统侵染法下各处理影响程度略低于悬滴接种法。
3 讨论与结论
通过黄瓜种子萌发生长法、黄瓜圆盘叶片法以及蒜薹悬滴接种法、蒜薹系统侵染法,对不同培养条件和培养时间获得灰葡萄孢霉毒素活性进行量化比较,发现不同培养条件获得毒素对黄瓜和蒜薹表现的毒素反应和强弱趋于一致,即灰葡萄孢霉的产毒能力与其培养基成分密切相关,在PD、淀粉酵母培养基中培养产生毒素的活性较高,可作为其产毒培养基;在相同的培养条件下,培养时间对毒素活性也具有显著影响,PD和淀粉酵母培养基中培养12~18 d,产毒活性最大,培养时间过长对毒素活性具有抑制作用。说明采后蒜薹灰葡萄孢霉毒素为非寄主选择性毒素,该试验结果与Colmenares等[9]报道的结果一致。
种子萌发生长法和圆盘叶片法均可对毒素活性进行量化比较,而悬滴接种法及系统侵染法主要通过症状观察衡量毒素活性强弱,且灰葡萄孢霉毒素为非寄主选择性毒素,因此笔者认为在毒素产生条件筛选试验中,在获得的毒素浓度有限的条件下,可以采用种子萌发生长法和圆盘叶片法两种活性测定方法。
参 考 文 献:
[1]赵淑艳,李喜宏,陈丽,等. 蒜薹采后致病菌种类及侵染规律研究[J].中国农学通报,2005,21(9):74-78.
[2]刘丽影.影响蒜薹物流质量安全的病害诊断及致病性研究[D].上海:华东师范大学,2013.
[3]石凤梅. 植物病原真菌毒素研究进展[J]. 黑龙江农业科学,2006,26(2):70-73.
[4]Aksenova V A. Toxicity of polysaccharide fraction of toxin of Botrytis cinerea[J]. Doklady.,1963,147:1426.
[5]Culter H G, Jacyno J M, Harwood J S, et al. Botcinolide: a biologically active natural product from Botrytis cinerea[J].Bioscience, Biotechnology and Biochemist, 1993, 57(11):1980-1982.
[6]Jacyno J M, Harwood J S, Culter H G, et al. Structure and solution - state conformation of botcinolide, a new biologically active metabolite from the fungus Botrytis cinerea[J]. Tetrahedron, 1994, 50(40):11585-11592.
[7]Deighton N, Muckenschnabel I, Colmenares A J, et al.Botrydial is produced in plant tissues infected by Botrytis cinerea[J]. Phytochemistry, 2001, 57(5):689-692.
[8]Patron R D, Galan R H, Rebordinos L G, et al. Structure-activity relationships of new phytotoxie metabolites with the botryane skeleton from Botrytis cinerea[J]. Tetrahedron, 1999, 55:2389-2400.
[9]Colmenares A J, Aleu J, Durun-Patron R, et al. The putative role of botrydial and related metabolites in the infection [J]. Journal of Chemical Ecology, 2002, 28(5):997-1005.
[10]王燕燕,薛婷,梁寧,等. 蒜薹灰霉病菌的生物学特性研究[J]. 河南农业科学,2006(8):113-116.
[11]张从宇,高智谋,岳永德. 番茄灰霉病菌生物学性状研究[J]. 安徽技术示范学院学报,2002,16(3):10-14.
[12]童蕴慧,陈夕军,徐敬友,等. 江苏省蔬菜灰葡萄孢生物学性状及致病力研究初报[J]. 中国蔬菜,2003(1):33-34.

