乙酸乙酯制备实验中酚酞褪色原因的探究
谢雕+唐娅
摘要:在乙酸乙酯制备演示实验中,向饱和碳酸钠溶液中滴入酚酞,观察分层及振荡褪色现象,酚酞褪色的原因多被解释为碳酸钠溶液被蒸出的乙酸中和。为此,进行了一系列实验和理论探究,发现酯化实验过程中蒸出的乙酸量较少,不足以中和碳酸钠溶液,碳酸钠溶液褪色的原因是酚酞被乙酸乙酯萃取到了酯层中;以多元恒沸混合物的理论数据为依据,进一步改进了酯化反应的实验装置,证明了实验过程中乙酸不会被大量蒸出。
关键词:乙酸乙酯;酚酞褪色原因;二元共沸;实验探究
文章编号:1005–6629(2016)12–0064–03 中图分类号:G633.8 文献标识码:B
乙酸乙酯的制备(人教版《化学2》第75页)是高中有机化学的重要演示实验,体现了有机化学实验的基本思想和方法。在乙酸乙酯制备的演示实验中,为了让学生能更清楚地看到乙酸乙酯与碳酸钠溶液的分层现象,教师在演示时常向饱和碳酸钠溶液中滴加几滴酚酞使溶液呈红色。当制备完成收集产物后,溶液上层为无色,下层为红色,振荡试管后,两层均变为了无色。对下层碳酸钠溶液褪色的原因,教师一般解释为:蒸出的物质中含有乙酸,与碳酸钠溶液反应而使酚酞褪色,并以此来强化碳酸钠溶液的作用。
这个推理看似合理,在某些资料上甚至以此设置考题。余灼森老师[1]进行了一些实验探究,也认为碳酸钠被蒸出的乙酸完全消耗而导致酚酞褪色。该结论与笔者平时的实验结果有较大的差异,为此笔者设计了一系列实验,多角度、多因素分析碳酸钠溶液中酚酞褪色的原因,还对酯化反应中蒸出乙酸的量进行了测定和理论分析,并从不同角度设计实验进行验证。
1 实验探究一 反应后水层溶液中是否有碳酸钠剩余
(1)用pH计测试所用饱和碳酸钠溶液pH为12.23。
(2)用“3mL无水乙醇+2mL浓硫酸+2mL冰醋酸”进行酯化实验,用5mL饱和碳酸钠溶液收集乙酸乙酯,振荡静止分层后,分离出下层液体,将液体分成三份,分别完成下面实验。
当然由于测定过程存在实验误差,计算结果只是一个估算值,但我们仍可清晰地看出碳酸钠溶液的浓度变化很小,因此可以推测Na2CO3溶液吸收乙酸的量应是比较少的。
但我们不禁又想到,由于酯化反应自身的特点,加热程度和时间长短不同,蒸出乙酸的量可能会出现较大差异。因此我们将测试在规范的实验操作情况下,不同的实验者进行酯化反应实验时,蒸出乙酸的量。
2 实验探究二 蒸出乙酸量的测定
在乙酸乙酯的制取实验中,将5mL饱和碳酸钠溶液改为5mL饱和氯化钠溶液来收集乙酸乙酯,然后分离出下层溶液并测pH。我们选取三位不同的教师在相同实验条件下平行进行该实验,结果如下:
由此可见,酯化实验时,不同的实验者由于个人实验差异,蒸出乙酸的量也不相同,但只要在相同实验条件、规范操作的情况下,蒸出的乙酸都是少量的,只有加入乙酸量的1%左右。
既然乙酸蒸出量很少,碳酸钠溶液还有相当多的剩余,溶液仍然呈现较强的碱性,那红色为什么褪去了?酚酞去哪儿了?
查阅资料可知:酚酞是一种白色晶体状粉末,不溶于水,1g酚酞可溶于13mL乙醇或70mL乙醚中[3]。由此可见,酚酞难溶于水而易溶于有机溶剂,那么酚酞是否被乙酸乙酯萃取到上层去了呢?
3 实验探究三 乙酸乙酯层中是否溶有酚酞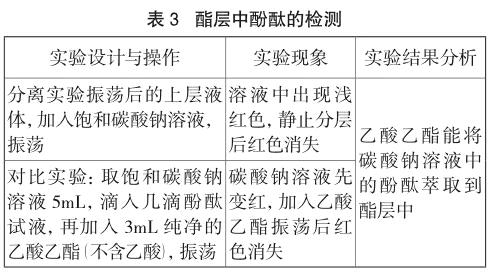
萃取能否发生与溶质在不同溶剂中的溶解度紧密相关。因此,我们又做了如下三组对比实验,从溶解度的角度找到酚酞被乙酸乙酯萃取的依据。
4 实验探究四 酚酞在不同溶剂中溶解度的测定
从下面的实验可以看出,酚酞在水中的溶解度非常小,几乎不溶于水,而酚酞在乙酸乙酯中的溶解度比在乙醇中还要大,因此乙酸乙酯将酚酞从碳酸钠溶液中萃取出来是完全合理的,这才是酚酞褪色的真正原因。
我们一般认为乙醇、乙酸、乙酸乙酯都是易挥发的液体,为何在乙酸乙酯制备实验的实际加热过程中,乙酸蒸出会很少呢?笔者通过查阅文献得到下面的數据。
从上面表格可以看出,乙酸、乙醇、乙酸乙酯的沸点是118.1℃、78.3℃、77.1℃,乙酸的沸点比乙醇和乙酸乙酯高得多,且乙酸不能和水、乙醇、乙酸乙酯形成恒沸物;而乙酸乙酯可以和乙醇、水分别形成二元恒沸物,导致沸点分别降为71.8℃和70.4℃,这与乙酸的沸点相差就更大了,相差达到46℃左右。因此不难分析出,酯化实验加热时从反应试管蒸出的主要是乙酸乙酯和乙醇,而乙酸是不易被蒸出来的,即使蒸出来也是少量的。那么在酯化反应实验的操作过程中,溶液温度是如何变化的?笔者设计了如下实验进行验证。
5 实验探究五 酯化反应过程中加热温度的测定
如图1所示,在酯化实验装置中加上一支温度计,测量加热过程中溶液的温度变化。实验结果如下:
反应液受热时温度迅速上升,70℃左右微沸,保持微沸1~2分钟后,大火加热到80℃剧烈沸腾,85℃左右产生大量馏出液,此时可抽出温度计至试管口,测试试管口温度在80℃左右。这一实验结果和上面沸点数据基本吻合。
通过上述实验探究,可以得出以下结论:该实验中由于乙酸乙酯能形成二元恒沸物使沸点降低,而乙酸不能形成恒沸物,因此在酯化反应实验条件下,乙酸乙酯易被大量蒸出,而乙酸蒸出量较少;虽然有少量碳酸钠会被乙酸中和,但仍有大量碳酸钠剩余,因此乙酸与碳酸钠反应不是酚酞褪色的主要原因;由于酚酞在乙酸乙酯中的溶解度较大,所以振荡后酚酞被乙酸乙酯萃取到了酯层中,这才是碳酸钠溶液中酚酞褪色的根本原因。
参考文献:
[1]余灼森.制取乙酸乙酯时使含酚酞的碳酸钠溶液褪色的原因探究[J].化学教学,2007,(9):36,72.
[2]武汉大学.分析化学(第四版)[M].北京:高等教育出版社,2000:319.
[3]张孙玮,汤福隆,张泰.现代化学试剂手册(第二分册)·化学分析试剂[M].北京:化学工业出版社,1987:35.
[4] J. A.迪安主编.魏俊发等译.兰氏化学手册(第十三版)[M].北京:科学出版社,2003:64~74.

