绿原酸在小鼠3T3-L1前脂肪细胞分化进程中的作用
朱 琪,康劲翮,杨佳蒴,彭曙光*,王 征*
(1湖南农业大学生物科学技术学院,长沙 410128; 2中国科学院亚热带农业生态研究所/中国科学院亚热带农业生态过程重点实验室/湖南省农业生态过程重点实验室,长沙 410125;3湖南省烟草科学研究所,长沙 410125)
绿原酸在小鼠3T3-L1前脂肪细胞分化进程中的作用
朱 琪1,康劲翮2,杨佳蒴3,彭曙光3*,王 征1*
(1湖南农业大学生物科学技术学院,长沙 410128;2中国科学院亚热带农业生态研究所/中国科学院亚热带农业生态过程重点实验室/湖南省农业生态过程重点实验室,长沙 410125;3湖南省烟草科学研究所,长沙 410125)
目的:探讨绿原酸(CGA)对小鼠3T3-L1前脂肪细胞分化的影响。方法:培养小鼠3T3-L1前脂肪细胞,分别设置空白对照组(CG)、阳性对照组罗格列酮组(RG)、阴性对照组GW9662组 (GG)和绿原酸组(CGA)。油红O染色观察小鼠3T3-L1前脂肪细胞分化后的细胞形态变化以及脂滴形成情况;组织细胞甘油三酯(TAG)酶法测定各组分化后的细胞TAG积累量;实时荧光定量PCR技术(qPCR)检测小鼠3T3-L1前脂肪细胞在分化过程中关键基因PPARγ2 mRNA表达水平。结果:CGA组被油红O染色的区域大于CG组和GG组,但CGA组颜色没有RG组鲜艳,且脂滴形状也与RG组存在差异。CGA组TAG积累量低于CG组和RG组,与CG组比较无显著性差异(P>0.05),但与RG组比较有显著性差异(P<0.05)。在分化过程中,CGA组和RG组PPARγ2 mRNA的表达量高于CG组和GG组,有显著性差异(P<0.01),GG组PPARγ2 mRNA的表达量自细胞分化第4d起低于CG组,有显著性差异(P<0.01)。结论:CGA可以促进小鼠3T3-L1前脂肪细胞的分化,同时降低分化后成熟脂肪细胞中TAG的积累量,其机制与分化相关因子PPARγ2的表达有关。
绿原酸(CGA);3T3-L1前脂肪细胞;细胞分化;PPARγ2;甘油三酯(TAG)
脂肪细胞分化与肥胖与胰岛素抵抗等慢性疾病有密切关系。肥胖是一种慢性低度炎症,造成肥胖的主要原因就是脂肪组织的炎症现象,肥胖引起的慢性炎症与诸多代谢性疾病如胰岛素抵抗、2型糖尿病和心血管疾病等密切相关[1-3]。很多研究表明,多种茶饮、水果及蔬菜中都富含多酚类物质,具有降糖降脂等生物活性。
绿原酸(CGA)是由咖啡酸与奎尼酸组成的羧酚酸[4]。绿原酸是植物体有氧呼吸代谢的产物,具有抗炎症、抗氧化活性、抗病毒活性、抗肿瘤活性和神经保护效应等多种生物活性[5]。Liu SL等[6]研究发现,绿原酸可以改善肥胖及相关代谢紊乱,通过阻碍炎症途径NF- kB通路,并上调PPARγ2的表达。Huang K等[7]研究发现,绿原酸可有效改善饲喂高脂SD大鼠的肝脏脂代谢,增加肝脏PPARα的表达,加速脂肪酸的β-氧化,下调脂肪酸合成限速酶乙酰CoA羧化酶的表达。宋卓等[8]研究表明,绿原酸可以调节大鼠脂肪组织的脂肪合成。Shimoda H等[9]研究表明,口服绿原酸有降低大鼠内脏脂肪堆积和体脂量的作用,这可能与绿原酸能够降低肝脏TG水平有关。De Sotillo D V R等[10]研究发现,大鼠通过静脉注射绿原酸5mg/mL,连续注射3w,其血浆中的胆固醇以及甘油三醋含量分别下降了44%和58%,而且绿原酸也能够显著降低肝脏中的甘油三酯水平。这些研究表明,绿原酸对脂代谢的调节起到了很有效的作用,对因肥胖引起的慢性炎症有明显的抑制。Dos Santos M D等[11]研究表明,绿原酸对角叉莱胶和福尔马林诱导炎症的动物具有抗炎、镇痛作用,这可能与动物外周炎症介质的合成和释放有关。Matsuda E等[12]研究发现,杜仲提取物能够抑制脂质在3T3-L1脂肪细胞中的堆积,杜仲提取物的主要组成成分有儿茶素、原儿茶酸、没食子酸、绿原酸。杨斌等[13]通过研究广西山银花绿原酸体外抗炎作用及分子机制发现绿原酸具有体外抗炎作用,其作用机制可能与抑制TNF-α、IL-6等炎症因子的活化以及影响花生四烯酸(AA)代谢有关。
我们前期工作表明,绿原酸可以上调饲喂高脂的SD大鼠脂肪细胞PPARγ的表达,但是绿原酸组SD大鼠并没有出现明显的肥胖。为了进一步研究其机理,我们拟研究绿原酸对小鼠3T3-L1前脂肪细胞分化的影响及其影响机制,探讨绿原酸改善肥胖、抵抗炎症在前脂肪细胞中的作用,为膳食结构的调整和和优化提供有意的参考数据。
1 材料与方法
1.1 试剂与仪器
小鼠3T3-L1前脂肪细胞系、油红O染液,中国维尔生物;乙醇、异丙醇、三氯甲烷、多聚甲醛,国药;RIPA裂解液,中国北京普利莱;组织细胞甘油三酯酶法测定试剂盒,中国碧云天;引物,上海生工;高糖培养基、磷酸缓冲液,美国Hyclone公司;小牛血清、胎牛血清、胰蛋白酶、青霉素/链霉素溶液,美国GIBCO公司;绿原酸(≥95%)、罗格列酮(≥98%)、GW9662(≥99%)、二甲基亚砜(DMSO)、胰岛素、3-异丁基-1-甲基黄嘌呤(IBMX)(≥99%)、焦碳酸二乙酯(DEPC),美国Sigma公司;TRIzol Reagent,美国Invitrogen公司;地塞米松,日本TCI公司;RNA反转录试剂盒、SYBR Premix Ex TaqTM Ⅱ(Tli RNaseH Plus),日本TaKaRa公司。
超净工作台,苏州集团安泰空气技术有限公司;恒温水浴锅HH-S2,中国河南金博;旋涡混合器,中国江苏其林贝尔;细胞培养恒温箱、超低温冰箱、实时荧光PCR仪,美国Thermo公司;酶标仪,美国Biotek公司;Allegra X-22R Centrifuge离心机,美国Beckman coulter公司;DMI3000B倒置显微镜,德国Leica公司。
1.2 方法
1.2.1 小鼠3T3-L1前脂肪细胞的培养 小鼠3T3-L1前脂肪细胞用完全培养基(DMEM高糖培养基+10%小牛血清+1%青霉素/链霉素溶液)在条件为37°C、5%CO2的细胞培养箱中培养,当细胞长满培养皿的80%~90%时,用于接种细胞培养板。
1.2.2 小鼠3T3-L1前脂肪细胞的诱导分化 细胞按105个/mL的密度接种于6孔细胞培养板中,2mL/孔,当细胞增殖至接触抑制时,换完全培养基继续培养2d,然后换分化培养基1(DMEM高糖培养基+10%胎牛血清+500μmol/L IBMX+1μmol/L地塞米松+5μg/mL胰岛素)培养(分化第0d),2d后换分化培养基2(DMEM高糖培养基+10%胎牛血清+5μg/mL胰岛素)培养,2d后换分化维持培养基(DMEM高糖培养基+10%胎牛血清)培养,之后每隔2d换1次分化维持培养基,连续培养6d,至大部分前脂肪细胞分化为脂肪细胞,细胞中可见明显脂滴。
1.2.3 小鼠3T3-L1前脂肪细胞加药处理 在细胞分化的第0天分别在阳性对照组中加入罗格列酮,在阴性对照组中加入GW9662,在绿原酸组中加入绿原酸,药物作用2d,并设置空白对照组。
1.2.4 油红O染色法观察细胞诱导分化情况 在细胞分化的第10d,弃去细胞培养基,用预冷的PBS清洗细胞两次。加入4%多聚甲醛室温下固定30~60min,弃去固定液。加入1mL油红O稀释液(油红O染液:去离子水=3:2),使其完全覆盖细胞表面,室温下染色1h,弃去染色液。75%酒精多次漂洗,除去多余的染料。超纯水多次冲洗,倒置显微镜下观察,拍照记录。
1.2.5 组织细胞甘油三酯测定试剂盒检测分化后细胞甘油三酯积累情况 在细胞分化的第10d收集细胞,按照组织细胞甘油三酯测定试剂盒说明书操作。测定波长550nm处的吸光值。绘制标准曲线并计算甘油三酯浓度。以每mg蛋白浓度或细胞数校正甘油三酯含量。
1.2.6 qPCR法检测小鼠3T3-L1前脂肪细胞PPARγ2的表达 在细胞分化的第0、2、4、6、8、10d,提取细胞RNA并检测RNA浓度;按RNA反转试剂盒步骤反转成cDNA(总体积20μL);用Primer Premier 5.0进行引物设计,以β-actin为参照基因进行qPCR[10μL体系:SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)5μL+PCR Forward Primer(10μmol/L)0.5μL+PCR Reverse Primer(10μmol/L)0.5μL+样本cDNA1μL+dH2O 3mL]。反件:stage1:预变性95°C 30sec,stage2:PCR反应95°C 5sec、60°C 30sec(single)40cycles,stage3:溶解曲线分析95°C 5sec、60°C 1min、97°C 1cycle,stage4:降温40°C 30sec 1cycle。反应结束后导出CT值进行分析计算,基因的相对表达量=2-△△CT。引物设计如附表。

附表 目的基因及引物序列
1.2.7 统计分析 所有数据均以平均值±标准差表示,通过SPSS 19.0软件进行统计分析,P<0.05表示有显著性差异、P<0.01表示有极大显著性差异、P>0.05表示无显著性差异。
2 结果与分析
2.1 CGA对小鼠3T3-L1前脂肪细胞分化的影响
细胞分化第10d油红O染色后,通过倒置光学显微镜对细胞染色情况进行观察拍照,结果见图2。CG组被油红O染色的区域较少,颜色较浅,呈圆形的细胞较少,大部分细胞还是呈梭形的前脂肪细胞(图1-A)。RG组有大量被油红O染色的圆形脂滴,颜色鲜红,80%以上的细胞都是呈圆形的脂肪细胞(图1-B)。GG组和其他组相比,被油红O染色的区域是最少的,颜色很浅,呈圆形的细胞也最少(图1-C)。CGA组也有大片区域被油红O染成红色,但其颜色没有RG组鲜艳,也不是像RG组那样是明显的圆形脂滴,有大量呈圆形的细胞(图1-D)。
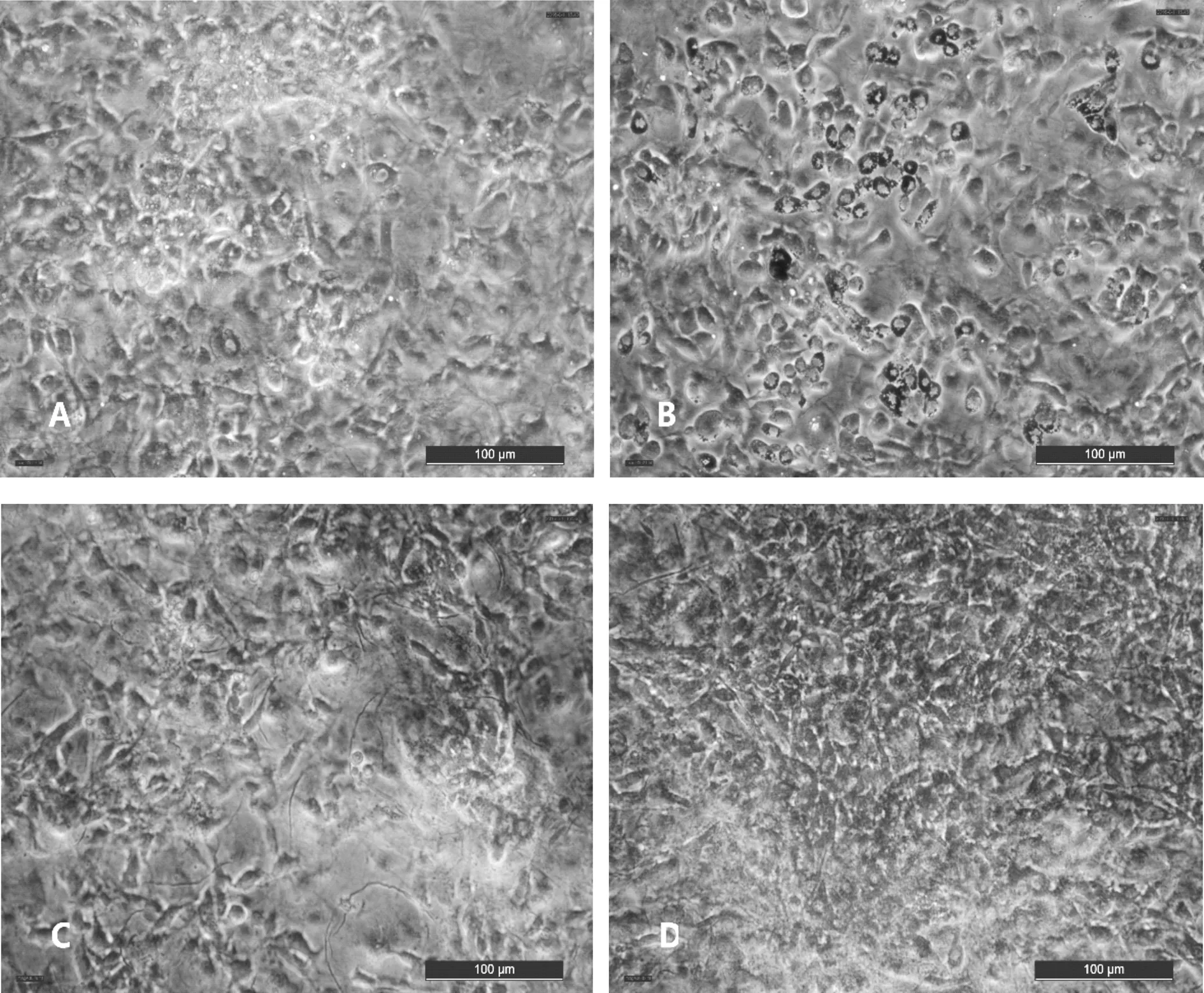
A:CG组 B:RG组 C:GG组 D:CGA组图1 CGA对小鼠3T3-L1前脂肪细胞分化的影响(油红o染色×200)注:*P<0.05 vs CG、**P<0.01 vs CG、#P<0.05 vs RG、##P<0.01 vs RG(同图2、图3)。
2.2 CGA对小鼠3T3-L1前脂肪细胞分化后TAG积累量的影响
细胞分化第10d后,收集细胞用组织细胞甘油三酯测定试剂盒检测分化后细胞TAG积累情况,结果如图2。RG组TAG积累量最大,与CG组相比有显著性差异(P<0.05)。GG组TAG积累量最少,与CG组相比无显著性差异,但与RG组相比有显著性差异(P<0.05)。CGA组TAG积累量与CG组相比无显著性差异(P>0.05),与RG组相比有显著性差异(P<0.05)。
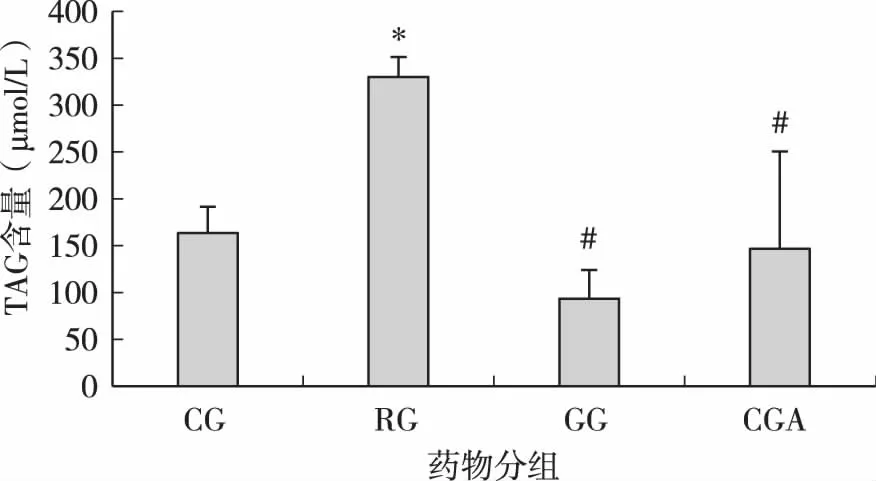
图2 CGA对小鼠3T3-L1前脂肪细胞分化后TAG积累量的影响
2.3 CGA对小鼠3T3-L1前脂肪细胞分化过程中PPARγ2表达的影响
如图3,在细胞分化的第2d各组PPARγ2 mRNA的表达量相比,RG组和CAG组的表达量高于CG组和GG组,CGA组表达量最高,与其他组相比有显著性差异(P<0.01),GG组与CG组相比无显著性差异(P>0.05)。在细胞分化的第4d各组PPARγ2 mRNA的表达量相比,RG组和CGA组的表达量高于CG组和GG组,CGA组和RG组相比无显著性差异(P>0.05),与CG组比较有显著性差异(P<0.01),GG组表达量最低,与其他组比较有显著性差异(P<0.01)。在分化的第6、8、10d各组PPARγ2 mRNA的表达量相比,RG组和CGA组的表达量高于CG组和GG组,CGA组表达量最高,GG组表达量最低,与CG组比较有显著性差异(P<0.01)。随着分化的进行PPARγ2 mRNA的表达有逐渐上升的趋势,在分化后期处于高表达的水平。

图3 CGA对小鼠3T3-L1前脂肪细胞分化过程中PPARγ2 mRNA表达的影响
3 结论
绿原酸可以促进小鼠 3T3-L1前脂肪细胞的分化,其机制是绿原酸能够上调分化相关基因PPAPγ2的表达。与罗格列酮不同是,虽然两者都能提高PPARγ2的表达,但被绿原酸干预的前脂肪细胞分化后的得到的成熟脂肪细胞中TAG的积累量却并不高,我们课题组在之前的实验结果表明,绿原酸干预的高脂饲喂SD大鼠组中,脂肪组织激素敏感脂肪酶mRNA表达上调,三酰甘油加速代谢[8]。我们认为,虽然绿原酸可以上调PPARγ2的表达,促进前脂肪细胞的分化,但并不造成三酰甘油的含量的积累。其机制有待作进一步研究。
4 讨论
脂肪组织主要由大量群集的脂肪细胞构成,聚集成团的脂肪细胞由薄层疏松结缔组织分隔成小叶。脂肪细胞是高度分化的成熟细胞,在脂肪组织中形成并储存脂肪,在脊椎动物体内能量的平衡中发挥着重要的作用。成人体内脂肪细胞的数量是恒定的,保持不变的,而且约10%的脂肪细胞在成人年龄和身体质量指数水平下,每年更新1次[14]。成熟的脂肪细胞中有大量脂滴的积累,它可以由前脂肪细胞分化形成。前脂肪细胞是呈梭形或多边形的,且不含脂滴,成熟的脂肪细胞呈圆形,且细胞内有大量脂滴积累[15]。
脂肪细胞增殖、分化异常会引起脂肪组织的过多堆积,继而导致脂肪细胞内分泌功能失调,引起肥胖和胰岛素抵抗的发生[16]。Liu SL等[6]研究发现,绿原酸能降低高脂饲喂SD大鼠血清中总胆固醇、甘油三酯、游离脂肪酸水平,有效缓解高脂饮食造成的体重增加。Harmon A W等[17]研究了染料木黄酮及柚皮素对3T3-L1前脂肪细胞中脂代谢的影响,发现染料木黄酮能抑制3T3-L1 前脂肪细胞的增殖、减少胞内甘油三酯的积聚并上调PPARγmRNA 的表达,而柚皮素无此作用。Hu E等[18]研究表明,PPARγ和C/EBPα是前脂肪细胞分化为脂肪细胞的关键转录因子,PPARγ能促进培养的成肌细胞转化为脂肪细胞,尤其在与C/EBPα共表达时作用更加明显。本试验以PPARγ激动剂罗格列酮作阳性对照,以PPARγ抑制剂GW9662作阴性对照;油红O染色结果可以看出RG组的细胞分化程度较其他组高,且可见大量被染成红色的脂滴,脂滴形状呈圆形。作为能抑制其表达,油红O染色结果可以看出GG组中被染色的区域较其他组少,且颜色较浅,呈圆形的脂肪细胞也很少。CGA组被油红O染色的区域较CG组多,但其颜色较浅,且脂滴形状与RG组有差异,脂滴大小也较RG组小。TAG测定结果显示,RG组TAG的积累量最多,高出空白组1倍。GG组TAG积累量最低,但其与CG组无显著性差异,CGA组TAG积累量略低于CG组,与CG组无显著性差异。说明CGA可以促进细胞的分化,并且降低分化后的脂肪细胞中的脂质积累,其机制可能与CGA能够上调前脂肪细胞中PPARγ表达有关。
前脂肪细胞的分化过程有很多分化相关因子的参与,其中起关键作用的是PPARγ[19]。PPARγ是重要的细胞分化转录因子,在哺乳动物的脂肪组织、血管平滑肌组织、心肌组织中均有表达,它至少有两种亚型:在大多数组织中都表达的PPARγ1和特异表达于脂肪组织的PPARγ2[20]。PPARγ必须与类视黄醇X受体(Retinoid X receptor,RXR)形成二聚体,才能结合DNA表现出转录活性;在前脂肪细胞中通过PPARγ、C/EBPs和ADD1/SREBP-1的相互作用来调控细胞的分化[21]。PPARγ和C/EBPα在前脂肪细胞分化的调控中处于同一途径,C/EBPα的活动依赖于PPARγ,此外,PPARγ和C/EBPα还能协同激活分化相关基因的表达[22]。本试验PPARγ2 mRNA表达结果显示:罗格列酮能够促进PPARγ2 mRNA的表达,在细胞分化的第2d时PPARγ2 mRNA的表达量已经高于CG组;GW9662能够抑制PPARγ2 mRNA的表达,在细胞分化的第4d,GG组PPARγ2 mRNA的表达量明显低于CG组,表现出抑制效果。CAG组在细胞分化的第2dPPARγ2 mRNA的表达量高于CG组,之后其表达逐渐上调。说明CGA和罗格列酮有一样的功能,CGA可以促进PPARγ2 mRNA的表达。总的来说,CGA具有促进小鼠 3T3-L1前脂肪细胞PPARγ2表达,从而促进细胞分化的作用。这与黄康[23]绿原酸对大鼠肝脏脂肪代谢调节机制研究和Liu SL等[6]的研究结果相似。◇
[1]詹莉莉,杨志秋,傅正伟.肥胖与慢性炎症的研究进展[J].中国细胞生物学学报,2011(3):297-305.
[2]Baker R G,et al.NF-κB,inflammation,and Metabolic disease[J]. Cell metabolism,2011,13(1):11-22.
[3]Wellen K E,Hotamisligil G S.Obesity-induced inflammatory changes in adipose tissue[J]. Journal of Clinical Investigation,2003,112(12):1785.
[4]孙健,吴国娟.绿原酸的研究进展[C].北京畜牧兽医领域青年科技工作者“新思想、新观点、新方法”论坛,2009.
[5]刘颖,郭明晔,白根本.绿原酸的研究进展[J]. 中药材,2012,35(7):1180-1185.
[6]Liu S L,Peng B J,Zhong Y L,et al.Effect of 5-caffeoylquinic acid on theNF-κBsignaling pathway,peroxisome proliferator-activated receptor gamma 2,and macrophage infiltration in high-fat diet-fed Sprague-Dawley rat adipose tissue[J]. Food & Function,2015,6(8):2779-2786.
[7]Huang K,Liang X,Zhong Y,et al.5-Caffeoylquinic acid decreases diet-induced obesity in rats by modulatingPPARαandLXRαtranscription[J]. Journal of the Science of Food and Agriculture,2015,95(9):1903-1910.
[8]宋卓,蔡小庆,闫晓东,等.绿原酸对高脂饲喂SD大鼠脂肪组织三酰甘油合成降解关键酶基因表达的影响[J].食品工业科技,2015,36(11):336-340.
[9]Shimoda H,Seki E,Aitani M.Inhibitory effect of green coffee bean extract on fat accumulation and body weight gain in mice[J]. BMC Complementary and Alternative Medicine,2006,6(1):1-9.
[10]De Sotillo D V R,Hadley M.Chlorogenic acid modifies plasma and liver concentrations of:cholesterol,triacylglycerol,and minerals in (fa/fa)Zucker rats[J]. The Journal of Nutritional Biochemistry,2002,13(12):717-726.
[11]Dos Santos M D,et al.Evaluation of the anti-inflammatory,analgesic and antipyretic activities of the natural polyphenol chlorogenic acid.[J]. Biological & Pharmaceutical Bulletin,2006,29(11):2236-2240.
[12]Matsuda E,et al.Effects of Eucommia ulmoides Oliver leaf extract on 3T3-L1 differentiation into adipocytes[J]. Journal of Natural Medicines,2006,60(2):126-129.
[13]杨斌,丘岳,王柳萍,等.广西山银花绿原酸体外抗炎作用及分子机制研究[J].中国药理学通报,2009,25(4):542-545.
[14]Spalding K L,et al.Dynamics of fat cell turnover in humans[J]. Nature,2008,453(7196):783-787.
[15]Moreno-Navarrete J M,Fernández-Real J M.Adipocyte Differentiation[M].Adipose Tissue Biology,2012:17-38.
[16]蔡东升.脂肪细胞分化与肥胖,胰岛素抵抗[J].国外医学:内分泌学分册,1999,19(3):97-100.
[17]Harmon A W,Harp J B.Differential effects of flavonoids on 3T3-L1 adipogenesis and lipolysis[J]. American Journal of Physiology-cell Physiology,2001,280(4):C807-C813.
[18]Hu E,Tontonoz P,Spiegelman B M.Transdifferentiation of myoblasts by the adipogenic transcription factorsPPARgammaandC/EBPalpha[J]. Proceedings of the National Academy of Sciences,1995,92(21):9856-9860.
[19]Lefterova M I,Lazar M A.New developments in adipogenesis.[J]. Medical Clinics of North America,2009,20(3):107-114.
[20]陈永熙,王伟铭,周同,等.PPAR-γ作用及其相关信号转导途径[J].中国细胞生物学学报,2006,28(3):382-386.
[21]Morrison R F,Farmer S R.Hormonal signaling and transcriptional control of adipocyte differentiation[J]. The Journal of Nutrition,2000,130(12):3116S-3121S.
[22]Rosen E D,Hsu C H,Wang X,et al.C/EBPαinduces adipogenesis throughPPARγ:a unified pathway[J]. Genes & Development,2002,16(1):22-26.
[23]黄康.绿原酸对大鼠肝脏脂肪代谢调节机制研究[D].湖南农业大学,2014.
(责任编辑 李婷婷)
Effects of Chlorogenic Acid During Differentiation Process of Mouse 3T3-L1 Preadipocytes
ZHU Qi1,KANG Jin-he2,YANG Jia-shuo3,PENG Shu-guang3,WANG Zheng1
(1College of Bioscience and Biotechnology,Hunan Agricultural University,Changsha 410128,China;2Institute of Subtropical Agriculture,The Chinese Academy of Sciences / Key Laboratory of Agro-ecological Processes in Subtropical Region/Hunan Key Laboratory of Agro-ecological Processes,,Changsha 410125,China;3Research Institute of Hunan Tobacco Science,Changsha 410125,China)
ObjectiveTo investigate the effects of chlorogenic acid(CGA)on the differentiation of mouse 3T3-L1 preadipocytes .MethodThe culture of mouse 3T3-L1 preadipocytes were divided into 4 groups including control group(CG),the positive control group of rosiglitazone group(RG),the negative control group of GW9662 group (GG)and chlorogenic acid group(CGA).The cell morphological changes and formation of lipids droplet of mouse 3T3-L1 preadipocytes after differentiation were observed by oil red O staining method.The triacylglyceride (TAG)accumulation of differentiation cells in different groups was determined by tissue cell triglyceride enzyme method.The expressions ofPPARγ2 mRNA during the differentiation process of mouse 3T3-L1 preadipocytes was determined by quantitative Real-time PCR(qPCR).ResultIn CGA group,the area of oil red O staining was larger than that of CG group and GG group,but the color of CGA group was not bright and the shape of lipids droplet was also different from that of RG group.In CGA group,the accumulation of TAG was lower than that in CG group and RG group,and compared with CG group it was not significantly (P>0.05)but compared with RG group it was significantly (P<0.05).During the differentiation process of mouse 3T3-L1 preadipocytes:The expressions ofPPARγ2 mRNA in CGA group and RG group was higher than that in CG group and GG group (P<0.01).To begin fourth days of differentiation,the expressions ofPPARγ2 mRNA in GG group was lower than that in CG group (P<0.01).ConclusionCGA can promote the differentiation of mouse 3T3-L1 preadipocytes,and decrease the accumulation of TAG in mouse 3T3-L1 preadipocytes after differentiation.The mechanism is connected with the expression ofPPARγ2.
CGA;3T3-L1 preadipocytes;cell differentiation;PPARγ2;TAG
湖南省教育厅重点项目(项目编号:14A071);中国烟草总公司湖南省公司科技项目(项目编号:15-17Aa04)。
朱琪(1993— ),女,学术型硕士研究生,研究方向:天然产物的开发与利用。
*共同通信作者:王征(1967— ),女,博士,教授,博士生导师,研究方向:食物营养与药理;彭曙光(1973— ),男,高级农艺师,研究方向:烟草资源利用。

