磷酸铁正极材料的研究进展
柯 翔,肖仁贵,廖 霞,,杨 睿,赵 曼
(贵州大学 化学与化工学院,贵州 贵阳 550025)
·综 述·
磷酸铁正极材料的研究进展
柯 翔1,肖仁贵1,廖 霞1,2,杨 睿2,赵 曼2
(贵州大学 化学与化工学院,贵州 贵阳 550025)
从磷酸铁(FePO4)的晶体结构和充放电机理出发,综述了不同结构的磷酸铁的电化学性能差异,并对其充放电机理进行了分析。叙述了不同制备方法得到FePO4的电化学性能,并对制备方法的优缺点进行了对比。同时,论述了改性手段对FePO4电化学性能的影响,并对FePO4作为锂离子电池正极材料的未来发展方向作出了展望。
磷酸铁;晶体结构;综述;充放电机理;正极材料;制备;改性
随着全球能源危机和气候变暖,有限的能源资源和严重的环境污染使我们迫切需要利用可再生能源(如太阳能、风能、潮汐能等等)。但由于这些可再生能源是不连续的,所以需要设计相应的储能材料,使之变成可持续供人类利用的能源。相对于燃料电池和电容器,锂离子电池因其具有能量密度高、循环寿命长、充放电过程无记忆性、工作电压相对稳定等优点,所以作为储能的首选材料而得到广泛应用。锂电池主要由正极、隔膜、负极及外壳组成。目前,负极材料金属锂的比容量远远超过正极材料,一般情况下正极材料的性能决定了锂电池的整体性能。传统的正极材料物质很多,主要有 LiCoO2、LiMn2O4、LiNiO2、LiFePO4及 FePO4等。层状 LiCoO2是目前使用最为广泛的正极材料,但其存在结构不稳定、价格昂贵、对环境污染且Co有毒等负面问题;LiNiO2与LiCoO2结构相似,虽然其理论比容量高,无污染,但充放电过程中结构不稳定,安全系数小,循环性能差[1];而 LiMn2O4虽然具有资源丰富、价格低廉、环境友好等优点,但在充放电过程中结构不稳定,比容量会随着循环的进行而衰减[2]。
相比于上述正极材料,FePO4因具有价格低廉、环境友好、结构稳定、原料丰富等优点,现在被认为是锂离子动力电池的理想正极材料,但由于其存在导电率低和锂离子扩散慢等缺点,制约它的实际应用。为了克服这些缺点,提升其电化学性能,研究者多通过离子掺杂、表面包覆、合成纳米级别材料、合成多孔材料等手段来改善其导电率和锂离子扩散速度,提高 FePO4作为正极材料应用于锂离子电池行业的巨大潜力。本文通过对比不同结构的磷酸铁的电化学性能,分析了其充放电过程,对FePO4正极材料的制备方法及改性手段进行了相关论述。
1 磷酸铁的结构及充放电原理
1.1 FePO4的晶型结构
FePO4主要有三种结构,分别是无定形结构、α-石英型结构、异磷铁锰矿型结构。在这三种结构中,无定形结构和异磷铁锰矿结构属于亚稳定性结构。在700 ℃下无定形和异磷铁锰矿结构不可逆地转化为 α-石英型结构,α-石英型结构属于稳定性结构。在以上结构中,无定形结构和异磷铁锰矿结构电化学性能强于α-石英型结构。
在锂离子电池中,正极 FePO4放电后形成橄榄石型 LiFePO4,随着充放电过程循环进行,电池中FePO4以FePO4和LiFePO4两相形式存在。表1列出了不同结构FePO4的性能参数。
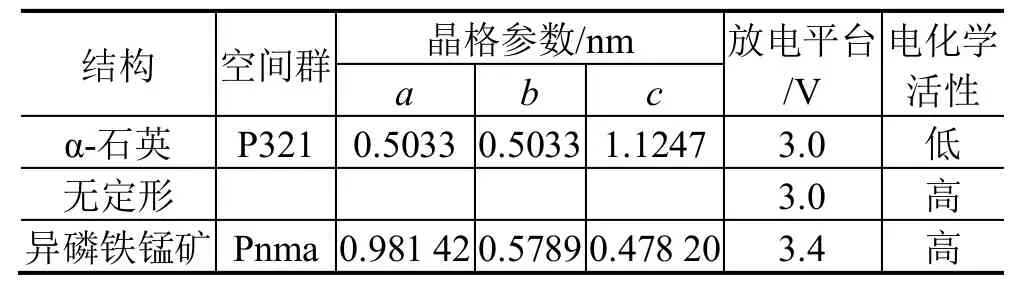
表1 不同结构FePO4性能参数[3-7]Tab.1 Performance parameters of FePO4with different structures[3-7]
1.2 FePO4的充放电机理
FePO4的嵌锂反应是两相反应,充放电反应如式(1)和(2)所示:
放电反应:
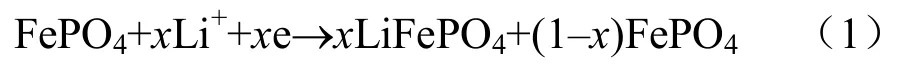
充电反应:
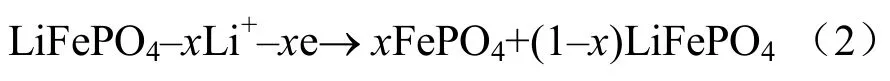
FePO4和LiFePO4的结构相似,体积接近。FePO4嵌锂后体积增加6.8%,密度增大2.59%,充放电过程中体积变化非常小,始终保持首次放电时的结构,这使得电极具有良好的循环性能和安全性。
磷酸铁的充放电机理模型主要有以下两种:
(1)1997年Padhi等[8]提出的LiFePO4充放电的收缩核模型。如图 1(a)所示,此模型指出在放电过程中LiFePO4相自外向内径向收缩,FePO4相由于锂离子的嵌入而逐渐减小,最终 FePO4相全部转化为LiFePO4。在充电过程中,由于LiFePO4相中锂离子的脱出,FePO4自内向外径向扩张,最终完全转化为 FePO4,在实际的充放电过程中,由于充放电的不完全,在电极内部两相始终共存。
(2)Andersson等[9]利用原位穆斯堡尔谱研究了LiFePO4的充放电过程,他们提出的两种机理模型。如图 1(b)和图 1(c)所示,图 1(b)为 Mosaic模型。Mosaic模型则认为,嵌脱锂会在LiFePO4颗粒中的许多区域进行,这些区域都有可能存在非活性的部分。图1(c)为Radial模型。Radial模型中,当LiFePO4充电时,粒子外部首先转化为FePO4,FePO4/LiFePO4界面自外向内移动,在这个过程中,锂离子和电子必须在新生成的FePO4中传输[9]。
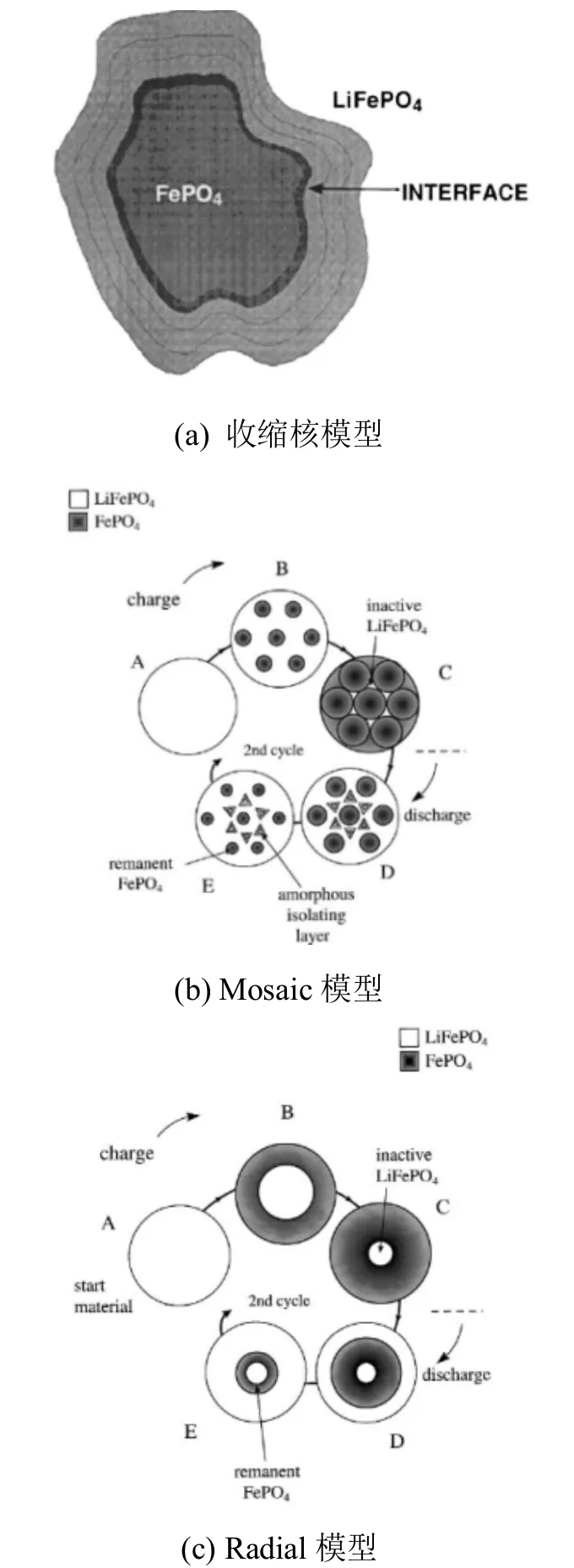
图1 磷酸铁的充放电机理模型Fig.1 Charge and discharge mechanism model of iron phosphate
2 FePO4 的制备方法
2.1 固相合成法
固相合成法是以固体反应物作为原料,在一定温度下混合均匀的反应物,再经过高温反应得到产物。Okada等[10]以Fe为铁源、P2O5为磷源合成了无定形的FePO4。直接作为电极材料时,在10-4A/cm2的电流密度下首次充放电的比容量为125 mAh/g,10次循环后容量保持不变。经 500 ℃处理后的 FePO4依然是无定形结构,但在相同电流密度下首次充放电比容量提高至153 mAh/g。第2次放电时比容量降低至142 mAh/g,之后循环10次容量保持不变。原因是经 500 ℃处理后,FePO4完全脱除结晶水,微观结构发生微小变化,使FePO4的电化学活性增强,根据Andersson等[9]研究表明,高温处理可以减少正极中的非活性的FePO4比例,提高材料的整体性能。此方法的优点是工艺简单,可快速实现工业化生产;缺点是耗能、耗时、粒度分布不均匀、反应条件难控制。
2.2 水热法
水热法是在高温高压条件下,在水蒸气或水相中进行化学反应的总称。因为反应在封闭容器中进行,与固相法相比反应温度相对较低,属于均相反应,该法制备的产品粒径小且分布均匀。Song等[3]用FeCl2、LiCl、H3PO4为原料,以HCl调节pH值,通过控制反应时间可得到单斜和正交晶系的FePO4。而且时间对产物的晶系具有选择性,在较短的反应时间下,产物为正交晶系和单斜晶系结构的混合,若反应时间增加到一定程度,产物只有单斜晶系。在 0.2×10-3A/cm2的电流密度下正交晶系首次充放电比容量为84 mAh/g,单斜晶系的首次充放电比容量为45 mAh/g,单斜晶系的电化学活性要低于正交晶系。Kandori等[11]通过严格控制反应物 Fe(ClO4)3和H3PO4的浓度,水热反应16 h得到球形FePO4,得到的球形颗粒是由尺寸更小的颗粒团聚堆积而成。若目标产品为粒径小的球形颗粒,可以通过增加反应物浓度和缩短陈化时间来完成,目的是在作为正极材料时在同等尺寸下有更大的比表面积。但水热法反应时间较长,反应条件难以控制,制约了其进一步发展。
2.3 溶胶-凝胶法
溶胶-凝胶法就是用高活性组分的化合物作为前驱体,在液相条件下将原料混合均匀,在此体系中反应物进行水解、缩合等化学反应,形成透明稳定的溶胶体系,溶胶陈化后得到凝胶,再经干燥、固化等过程得到产物。Kahoul等[12]将己二醇在90 ℃处理30 min后加入等摩尔的Fe(NO3)3和(NH4)H2PO4加热到 140 ℃进行反应,得到凝胶,干燥和热处理后得到粒径分布均匀的 FePO4。与其他温度处理相比较,经400 ℃处理后得到的FePO4的电性能最为优异,其比表面积为28 m2/g,组装为电池后其内阻也最小。电化学测试表明,在30 mA/g的电流密度下首次充放电的比容量为132 mAh/g。Lu等[13]以4,4-甲酸基-二苯酯基磷酸(HOPO(OC6H4COOH)2)为有机磷配体,Fe(NO3)3为铁源,反应制得粒径均匀的FePO4,经380 ℃处理后进行电化学测试,得到首次充放电比容量为146 mAh/g。此法所得产品粒径小且分布均匀,但其制备工艺复杂,所需时间长。
2.4 模板法
模板法分为化学模板法和生物模板法。化学模板法是溶胶凝胶法的进一步发展,通过不同的模板剂可以得到不同形貌的材料;Shi等[14]用EO20-PO70-EO20为模板剂以 OP(OC2H5)3和FeCl3·6H2O为原料,以 C2H5OH为分散剂,制得粒径为15 nm的FePO4。所得产品经400 ℃处理后,电化学性能测试表明,在0.1C首次充放电比容量为135 mAh/g;该课题组[15]改进此法制备出FePO4,充放电测试表明,在0.1C下首次充放电比容量提高至159 mAh/g。Cui等[16]用聚苯乙烯为模板成功制备出粒径为250 nm的FePO4,产品经400 ℃处理后再进行电化学性能测试,结果表明,在 0.05C首次充放电比容量为 110 mAh/g。Cai等[17]以三辛基氧膦(TOPO)为模板剂,先把铁源制成 Fe2O3纳米管,并让其均匀分布在TOPO内,在308 ℃条件下反应50 min制得 FePO4,经电化学性能测试表明,在 0.1C首次充放电比容量为160.5 mAh/g。
生物模板法是以微生物为模板,通过控制微生物代谢条件制备出所需产品,Zhou等[18]以Na2HPO4为磷源,酵母细胞为模板,成功合成了FePO4/C复合材料,该材料具有良好的电化学活性。Lee等[19]报道了用多肽病毒基因构建高功率锂离子电池的研究成果,在多功能病毒M13上构建两个基因体系,以其中的一个蛋白质基(pⅧ)为模板合成了 α-FePO4纳米线,另一个蛋白质基因(pⅢ)则具有分子识别能力,能够与单壁碳纳米管(SWNT)结合,从而成功制备了α-FePO4/WNT纳米复合物,在0.1C下,首次放电比容量达到170 mAh/g。Guo等[20]以DNA为模板成功合成双臂碳纳米管/FePO4复合材料(FePO4-DNA@DWNT),在0.1C下,首次充放电比容量为 174 mAh/g。模板法制备的产品具有粒径可控,粒径分布均匀,但其制备过程复杂,难以大规模生产。
2.5 超声化学法
超声化学法是利用超声能量加速和控制化学反应的方法。此方法的优点在于能改变反应体系的条件和提高反应产率。Okawa等[21]以(NH4)H2PO4和FeSO4·7H2O为原料,在搅拌速率为100 r/min,超声功率为200 W的条件下反应制备得到FePO4。经电化学性能测试表明,在0.2C下,首次充放电比容量为100 mAh/g。在制备过程中无需加入氧化剂,反应时间短,比表面积大于40 m2/g,从制备方法的角度来看此法较为简单,反应时间短,超声功率和搅拌速度都可控。但缺点就是容易产生副反应,条件不好控制且设备成本高。
2.6 均相沉淀法
均相沉淀法是以可溶性盐为原料,通过调节溶液的 pH 值产生沉淀。Xu等[22]以 Fe(NO3)3和HOPO(OC6H4COOH)2为原料,制得 FePO4,经 380 ℃处理后,经电化学性能测试表明首次充放电比容量为 146 mAh/g;Zhang 等[23]以 Fe(NO3)3·9H2O 和NH4H2PO4为原料制得纳米级 FePO4,在 0.1C下,首次充放电的比容量为142.3 mAh/g。此法所需设备简单,但在实际操作过程中pH难控,难以控制产品的粒径。
2.7 离子交换脱锂法
脱锂法是先制备出LiFePO4,然后通过离子交换脱去 Li+制得 FePO4。Marx等[24]通过水热法制备出LiFePO4(OH),然后通过 Li+/H+交换获得 FePO4,在0.02C下首次充放电比容量为125 mAh/g。该课题组[25]在此基础上进行改进,制备出 FePO4,通过热处理后经电化学性能测试。结果表明,在 0.02C下首次放电比容量为 173 mAh/g,循环容量保持在 120 mAh/g。此方法能制备出高纯度的FePO4,但是合成工艺复杂。
2.8 空气氧化法
空气氧化法又叫空气湿式氧化法,一般指的是在溶液中,高温(150~350 ℃)高压(5~20 MPa)条件下,用氧气或空气作为氧化剂,氧化溶液中溶解态或悬浮态的有机物或还原态的无机物的一种处理方法,反应的最终产物是二氧化碳和水。刘烺等[26]采用空气氧化法,分别以FeSO4·7H2O和H3PO4作为铁源和磷源,用氨水调控溶液的 pH,制备FePO4·2H2O,并在空气气氛下热处理后得到不含结晶水的FePO4粉体,采用X射线衍射、扫描电镜、元素含量分析等对合成产物进行表征。结果表明,当反应原料中铁、磷元素物质的量比为1:2,反应温度为80 ℃时,成功制备出晶型完整、类球形、尺寸均一、粒径为1 μm左右的纯FePO4·2H2O,520 ℃热处理后得到 FePO4。其他反应条件下所得的产物均含有杂质,后续随着表面活性剂聚乙二醇的加入,有效抑制了产物颗粒晶体的长大,改善了颗粒的团聚程度,得到分散均匀的椭球形 FePO4颗粒,粒径为0.5~1 μm。此法制备的产物纯度高,且粒度可控,但生产成本高。
2.9 小结
表2总结了不同制备方法的优缺点。通过对以上方法制备出的磷酸铁的形貌粒度以及电化学性能差异的比较发现,温度处理对材料的性能影响是至关重要的,制备方法主要影响材料的微观结构和粒度,Okada等[10]通过固相法制备出粒度为2 μm左右的颗粒。刘烺等[26]利用空气氧化法制备出粒径为 1 μm左右颗粒。Shi等[14]利用模板法制备出粒度为15 nm的颗粒。而高温处理,从一定程度上改变了材料的微观结构。但由于制备方法的差异,各种制备方法得到产品的处理温度有差异,但都是保证其晶体结构不发生转变的前提下处理。高温处理的目的是(1)除去材料的结晶水和自由水;(2)激发材料的活性,增加材料的导电性和稳定性。在现有的制备方法中,模板法在控制粒径方面有较大优势,通过传统模板法制备的 FePO4颗粒直径小,电化学性能优异。生物模板法作为一种新兴的模板法,这种方法以微生物作为模板,在粒径控制方面比传统方法更好,且粒度分布均匀,电化学性能比传统制备方法更好。模板法制备材料的优点在于粒径可控,可制备多孔材料和球形材料。
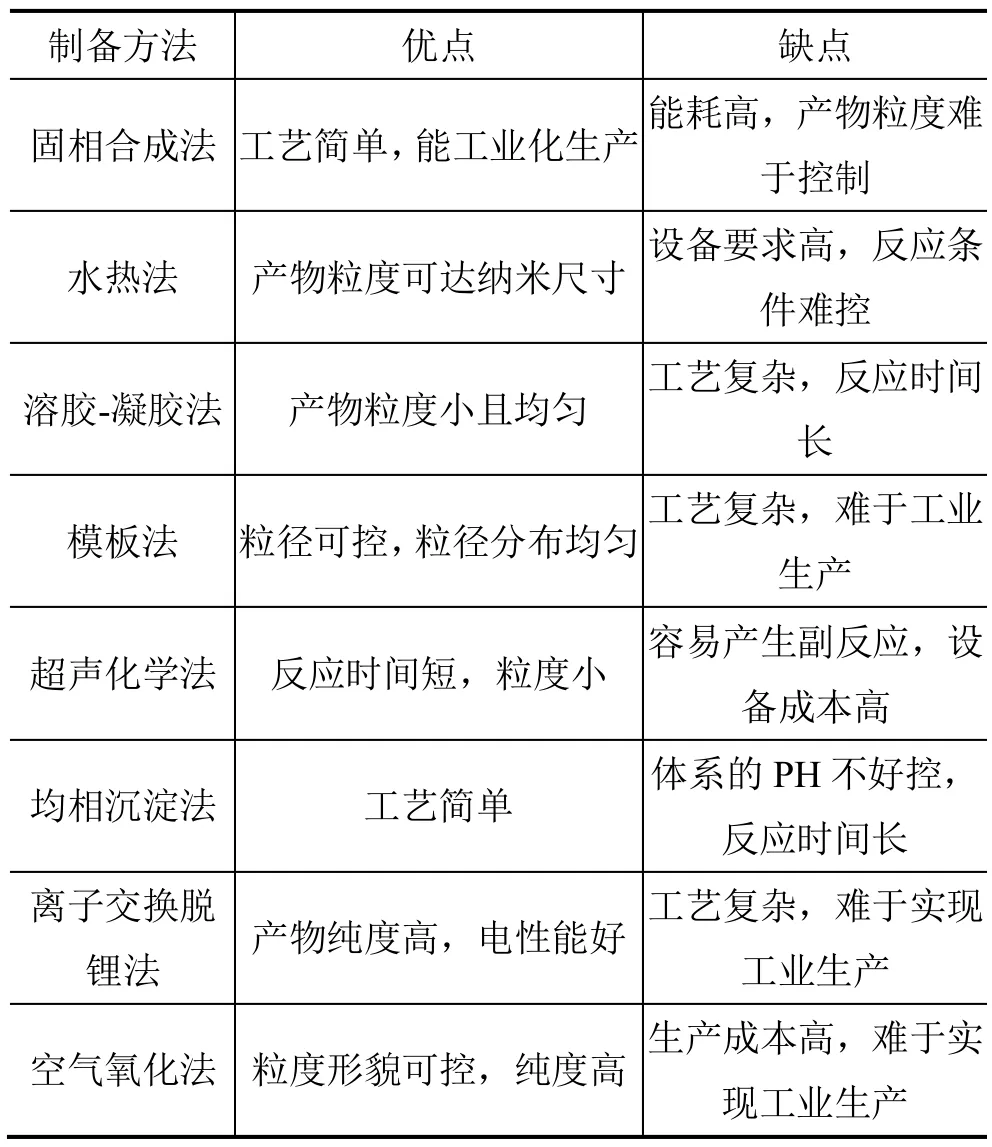
表2 不同制备方法的优缺点Tab.2 The advantages and disadvantages of different preparation methods
3 FePO4 的改性
由于纯的 FePO4电导率极低以及锂离子在充放电过程中扩散速率慢,制约了它的实际运用。所以它在作为电极材料使用时必须对其进行改性,提高它的电化学性能。目前,对 FePO4的性能改性,一为物理方法,具体方法是在 FePO4颗粒表面覆盖一层导电性能极好的物质增加它的导电性;二是化学方法,具体方法是通过金属离子或非金属离子的一元或多元掺杂改变 FePO4晶体的内部结构,使其产生晶格缺陷,增加导电性;三是控制产物尺寸和形貌,即是制备纳米级的颗粒或者制备多孔材料,纳米级的颗粒尺寸缩短了锂离子在充放电过程中的扩散路径,多孔材料的丰富孔道不仅有利于锂离子的大量储存,而且降低锂离子在充放电过程中的扩散阻力,从而增加材料的导电性。
3.1 包覆改性
Kim 等[27]先制备出多壁碳纳米管(CNT)模板,再将此模板用酸处理后得到CNT骨架,然后将Fe3+和PO43+在此骨架中进行反应,制得FePO4/CNT多孔复合电极材料,这种处理方式增加了Li+的脱嵌通道,同时也提高了 FePO4本身的导电性,经电化学性能测试表明,在20 mA/g的电流密度下首次充放电比容量为149 mAh/g。Dou等[28]用1-丁基-3-甲基咪唑四氯高铁和(NH4)3PO4·3H2O分别作为铁源和磷源,在1-丁基-3-甲基咪唑氯化物的存在下加入多壁层碳纳米管(MWCNTs)通过机械力化学过程,合成FePO4/MWCNTs复合材料,作为锂离子电池正极材料,在电流密度为40 mA/g时,放电比容量为171 mAh/g,接近理论值(178 mAh/g),在电流密度为50 mA/g下,100次循环后,放电比容量仍然保持135 mAh/g。此法制备的FePO4具有良好的放电比容量和极好的循环性能。Yin等[29]通过水热法合成石墨烯/FePO4复合材料,石墨烯是导电性能好的材料,本身也可以作为电极,经电化学性能测试表明,在20 mA/g的电流密度下首次充放电比容量为 174 mAh/g,50次循环后的充放电比容量为173 mAh/g。由此可见,石墨烯/FePO4复合材料具有良好的导电性和循环性。Hao等[30]以P2O5和金属铁为原料,先制备出FePO4,再将FePO4与聚丙烯腈(PAN)以质量比为1:1混合均匀,在N2氛围下800 ℃处理2 h得到石榴型多孔的FePO4/C复合材料。此经电化学性能测试表明,在 0.2C下首次充放电比容量为 109 mAh/g。此方法制备的多孔材料为Li+提供了更多的脱嵌通道,从而增加了材料的导电性能。Liu等[31]应用 Fe(NO3)3·9H2O和(NH4)2HPO4作为铁源和磷源,加入噻吩单体,在溶液中聚合生成 FePO4/PTh复合材料,再以此材料为原材料,加入LiOH·H2O和柠檬酸,在N2氛围下700 ℃处理10 h后得到壳孔状的FePO4/C复合材料,用作锂离子正极材料时,经电化学性能测试表明,在0.1C下首次充放电比容量为158 mAh/g,且在1000次循环后,容量依旧保持着 92%。这种材料不仅为多孔材料,而且表面包覆了一层导电聚合物薄膜,此薄膜又能抑制产物颗粒的生长,所以使得此种材料拥有极好的循环性能。Fan等[32]通过碳热还原法制得 FePO4-LiFePO4/石墨烯复合材料,在制备过程中通过自组装的方法,把石墨烯剥离成单层,得到粒度分布均匀的复合材料,在 0.1C下,首次充放电比容量为 164 mAh/g。Liu等[33]通过微乳液技术合成 FePO4/(rGO)纳米片复合材料,用作锂离子正极材料时,展现了较好的充放电比容量和较好的倍率性能,充放电比容量分别为154.5 mAh/g(0.1C),151.6 mAh/g(0.2C),122.3 mAh/g(0.5C)和 100.6 mAh/g(1C)。Wu 等[34]用Fe2(SO4)3和 NH4H2PO4分别作为铁源和磷源,加入氧化石墨烯(GO),利用原位沉淀法先制备出GO-FePO4·2H2O复合材料,再加入Li2CO3和葡萄糖,应用高温固相还原法制备出LFP/石墨烯/C复合材料,用作锂离子正极材料时,在0.1C下首次充放电比容量为156.7 mAh/g,在10C下首次充放电比容量为118.8 mAh/g,且经过120次循环以后,容量才减弱2.3%。上述石墨烯改性的复合材料由于石墨烯薄片的存在,不仅使活性材料颗粒之间有更好的接触,避免材料在充放电过程中所引起的材料体积的变化,使得材料更加的稳定,安全性能更好,同时石墨烯薄片可作为三维导电网络,有利于电子的传导,从而提高材料的导电率。Lee等[35]以病毒M13为模板,在低温下制备出表面用纳米 Ag包覆的FePO4纳米颗粒,经电化学性能测试表明在0.1C下首次充放电比容量为165 mAh/g。Ag等贵金属的导电性能优越,当包覆在材料表面,提高电子的传导率,从而提高材料的电性能,但贵金属使得此类复合材料的成本变高。
包覆改性的包覆材料都具有良好的导电性能,加入适量的包覆层,大大提高了电极材料的导电性,增加了电子的传导。但如果包覆的量太多,反而会阻碍制约材料的电性能,而石墨烯包覆是现今复合材料电极发展的一种趋势,因为石墨烯的优越性能,提高了电池的整体性能,且让电池的充放电比容量、循环性能、安全性能都保持得更好。
3.2 金属离子掺杂
金属离子掺杂主要是改变其纯 FePO4的晶体结构,使其产生晶格缺陷,从而提高 FePO4的导电性能。Croce等[36]先将 Fe(NO3)3·H2O 和 H3PO4溶于去离子水中,然后将 RuO2加入上述溶液中,用NH3·H2O调节pH值,用溶胶凝胶法制得RuO2-FePO4电极材料,阻抗测试表明RuO2掺杂的FePO4的阻抗值明显小于FePO4的阻抗值;在0.1C首次充放电比容量为110 mAh/g;Yang等[37]先将Fe(NO3)3·9H2O和 NH4H2PO4溶于去离子水中,加入尿素作为分散剂,然后加入 Ce(NO3)3,通过均相沉淀法制得Fe1-xCexPO4电极材料,阻抗测试表明,当x=0.02时材料的阻抗值最小,在 0.05C首次充放电测试的放电比容量为100.3 mAh/g。
在此改性方法中,掺杂使用的金属元素多为过渡金属元素。过渡金属的掺杂,使得原始材料的晶格结构发生缺陷或者产生空缺,使得Li+和电子更能有效储存和释放,同时过渡金属自身的优越电性能,与磷酸铁材料本身的电性能形成协同作用,从而提高了材料的整体电性能,同时现在也在大力开发二元或者三元材料。
3.3 制备纳米级的颗粒或多孔材料
武玉玲等[38]分别用Fe(NO)3、H3PO4作为铁源和磷源,用NH3·H2O调节反应溶液的pH值,采用控制结晶技术合成了纳米 FePO4·xH2O,将FePO4·xH2O于500 ℃热处理4 h后得到纳米FePO4前驱体,然后通过碳热还原在不同温度下煅烧合成橄榄石结构的纳米LiFePO4/C样品。采用差热/热重、X射线衍射、扫描电镜、比表面积测试、电化学性能测试等分析测试方法对纳米FePO4·xH2O、FePO4前驱体及不同煅烧温度下制得的纳米LiFePO4/C样品进行表征。研究结果表明,700 ℃烧结 10 h合成LiFePO4/C样品的粒径在40~100 nm,比表面积为79.8 m2/g;700 ℃煅烧合成样品在电压2.5~4.2 V,倍率为0.1C,1C,5C,10C,15C时的放电比容量分别达到156.5,134.9,105.8,90.3和80.9 mAh/g,具有较好的倍率性能,样品还表现出较好的循环性能。
伍凌等[39]分别用Fe2(SO4)3和H3PO4作为铁源和磷源,用NH3·H2O调节反应溶液的pH=2.10±0.05,控制温度(50 ℃)、加料速度(0.8 L/h)、搅拌速度(600 r/min)及出料时间(8 h),用控制结晶法制备了多孔前驱体FePO4·xH2O,之后将葡萄糖和Li2CO3渗入到前驱体中,然后通过碳热还原反应合成LiFePO4/C。采用XRD、SEM、恒流充放电和交流阻抗等方法对样品进行了表征。结果表明,反应剩余的碳分布在LiFePO4颗粒的内部及表面,提高了材料的电化学性能。在620 ℃下合成的LiFePO4/C在0.1C,0.5C和1C下的首次放电比容量分别为 156,139和 136 mAh/g,循环 30次后的容量衰减率仅为 0.64%,2.16%和4.41%。该样品虽然含碳质量分数9.74%,但振实密度只有1.20 g/cm3。此方法虽然提高了电性能和循环性能,但使得材料的振实密度减小,使得材料的稳定性和安全性降低。
3.4 小结
包覆改性是现阶段研究的主流,有碳包覆、石墨烯包覆、纳米金属颗粒包覆。其共同的特性是包覆物都具有良好的导电性,石墨烯具有良好的导电性能和大的比表面积,为锂离子提供了更多的通道,也提高了电子的传导速率,用其包覆不仅提高了电极材料的比容量,同时也加强了材料的循环性能和稳定性能。金属离子掺杂改变了材料晶体原来内部的结构,构成了晶体缺陷,增加了材料的导电率,降低了电池的内阻,从本质解决了材料导电率的问题,但是对掺杂的机理至今还没有明确的理论支撑,有待于进一步完善。而合成纳米级尺寸和多孔的电池级材料,虽然缩短了锂离子和电子的扩散速率,减小了锂离子和电子的扩散阻力,但是电极材料内部的振实密度却减小了,降低了电极材料的稳定性。
4 结语与展望
随着电动车和混合电动车日益发展的趋势,对于锂电池的安全性能和循环寿命等方面的要求越来越高。FePO4正极材料具有较高理论比容量、资源丰富、结构稳定、环境友好等优点,符合电源的各种要求。尽管材料自身也存在着电导率低、锂离子扩散速率慢等缺陷,但通过选择适当的制备方法和改性手段,能够制备高放电比容量的FePO4正极材料。随着对导电聚合物和碳纳米管(单壁和多壁)以及石墨烯的深入研究,将其作为 FePO4的改性物质,制备出相应的复合材料,他们之间产生协同作用,使得材料表现出优异的电化学性能,特别是随着科学技术的发展,FePO4/石墨烯复合材料有望实现工业化生产,满足人类生产生活的需要。而石墨烯改性的储能材料和储能设备也有待开发和研究,才能最终造福人类的生产生活。
[1] POUILLERIE C, CROGUENNEC L, BIENSAN P, et al.Synthesis and characterization of new LiNil-yMgyO2positive electrode materials for lithium-ion batteries [J]. J Electrochem Soc, 2000, 147(6): 2061-2069.
[2] LIU W, KOWAL K, FARRINGTON G C, et al.Electrochemical characteristics of spinel phase LiMn2O4-based cathode materials prepared by the Pechini process: influence of firing temperature and dopants [J]. J Electrochem Soc, 1996, 143(11): 3590-3596.
[3] SONG Y, ZAVALIJ P Y, SUZUKI M, et al. New iron(III)phosphate phases: crystal structure and electrochemical and magnetic properties [J]. Inorg Chem, 2002, 41(22):5778-5786.
[4] SONG Y, YANG S, ZAVALIJ P Y, et al.Temperature-dependent properties of FePO4cathode materials [J]. Mater Res Bull, 2002, 37(7): 1249-1257.
[5] ANDERSSON A S, KALSKA B, HÄGGSTRÖM L, et al.Lithium extraction/insertion in LiFePO4: an X-ray diffraction and moessbauer spectroscopy study [J]. Solid State Ionics, 2000, 130(1): 41-52.
[6] KIM S W, RYU J, PARK C B, et al. Carbon nanotube-amorphous FePO4core-shell nanowires as cathode material for Li ion batteries [J]. Chem Commun,2010, 46(39): 7409-7411.
[7] SON D, KIM E, KIM T G, et al. Nanoparticle iron-phosphate anode material for Li-ion battery [J]. Appl Phys Lett, 2004, 85(24): 5875-5877.
[8] PADHI A K, NANJUNDASWAMY K S, GOODENOUGH J B D, et al. Phospho-olivines as positive-electrode materials for rechargeable lithium batteries [J]. J Electrochem Soc, 1997, 144(4): 1188-1194.
[9] ANDERSSON A S, THOMAS J O. The source of first-cycle capacity loss in LiFePO4[J]. J Power Sources,2001, 97: 498-502.
[10] OKADA S, YAMAMOTO T, OKAZAKI Y, et al. Cathode properties of amorphous and crystalline FePO4[J]. J Power Sources, 2005, 146(1): 570-574.
[11] KANDORI K, KUWAE T, ISHIKAWA T. Control on size and adsorptive properties of spherical ferric phosphate particles [J]. J Colloid Interface Sci, 2006, 300(1): 225-231.
[12] KAHOUL A, HAMMOUCHE A. Electrochemical performances of FePO4-positive active mass prepared through a new sol-gel method [J]. Ionics, 2010, 16(2):105-109.
[13] LU Y J, XU Y B, YANG R D, et al. A versatile method for preparing FePO4as a promising electrode material rechargeable 1ithium batteries [J]. J Lanzhou Univ (Nat Sci), 2007, 43(4): 144-146.
[14] SHI Z, LI Y, YE W, et al. Mesoporous FePO4with enhanced electrochemical performance as cathode materials of rechargeable lithium batteries [J]. Electrochem Solid-State Lett, 2005, 8(8): A396-A399.
[15] SHI Z C, ATTIA A, YE W L, et al. Synthesis,characterization and electrochemical performance of mesoporous FePO4as cathode material for rechargeable lithium batteries [J]. Electrochim Acta, 2008, 53(6):2665-2673.
[16] CUI W, LIU H, WANG C, et al. Highly ordered three-dimensional macroporous FePO4as cathode materials for lithium-ion batteries [J]. Electrochem Commun, 2008,10(10): 1587-1589.
[17] CAI R, DU Y, ZHANG W, et al. Synthesis of porous amorphous FePO4nanotubes and their lithium storage properties [J]. Chem-A Eur J, 2013, 19(5): 1568-1572.
[18] ZHOU W, HE W, ZHANG X, et al. Biosynthesis and characterization of mesoporous organic-inorganic hybrid iron phosphate [J]. Mater Chem Phys, 2009, 116(2):319-322.
[19] LEE Y J, YI H, KIM W J, et al. Fabricating genetically engineered high-power lithium-ion batteries using multiple virus genes [J]. Science, 2009, 324(5930): 1051-1055.
[20] GUO C X, SHEN Y Q, DONG Z L, et al. DNA-directed growth of FePO4nanostructures on carbon nanotubes to achieve nearly 100% theoretical capacity for lithium-ion batteries [J]. Energy Environ Sci, 2012, 5(5): 6919-6922.
[21] OKAWA, YABUKI, KAWAMURA, et al. Synthesis of FePO4cathode materal for lithium ion batteries by asonochemical method [J]. Mater Res Bull, 2008, 43(5):1203-1208.
[22] XU Y, LU Y, YIN P, et al. A versatile method for preparing FePO4and study on its electrode performance in lithium ion batteries [J]. J Mater Process Technol, 2008, 204(1):513-519.
[23] ZHANG S M, ZHANG J X, XU S J, et al. Li ion diffusivity and electrochemical properties of FePO4nanoparticles acted directly as cathode materials in lithium ion rechargeable batteries [J]. Electrochim Acta, 2013, 88:287-293.
[24] MARX N, CROGUENNEC L, CARLIER D, et al.Structural and electrochemical study of a new crystalline hydrated iron (III) Phosphate FePO4·H2O obtained from LiFePO4(OH) by ion exchange [J]. Chem Mater, 2010,22(5): 1854-1861.
[25] MARX N, BOURGEOIS L, CARLIER D, et al. Iron(III)phosphates obtained by thermal treatment of the tavorite-type FePO4·H2O material: structures and electrochemical properties in lithium batteries [J]. Inorg Chem, 2012, 51(5): 3146-3155.
[26] 刘烺, 王鹏, 周星辰, 等. 空气氧化法制备FePO4超细颗粒 [J]. 中国粉体技术, 2013, 19(2): 24-32.
[27] KIM S W, RYU J, PARK C B, et al. Carbon nanotube-amorphous FePO4core-shell nanowires as cathode material for Li ion batteries [J]. Chem Commun,2010, 46(39): 7409-7411.
[28] DOU H, NIE P, DOUGLAS R, et al. Mechano-chemical synthesis of nanostructured FePO4/MWCNTs composites as cathode materials for lithium-ion batteries [J]. J Mater Chem A, 2014, 2(45): 19536-19541.
[29] YIN Y, HU Y, WU P, et al. A graphene-amorphous FePO4hollow nanosphere hybrid as a cathode material for lithium ion batteries [J]. Chem Commun, 2012, 48(15): 2137-2139.
[30] HAO G, ZHANG H, CHEN X H, et al. A novel method for preparing pomegranate-structured FePO4/C composite materials as cathode for lithium-ion batteries [J]. Mater Res Bull, 2012, 47(12): 4048-4053.
[31] LIU J, YANG G L, ZHANG X F, et al. Synthesis of the LiFePO4/C core-shell nanocomposite using a nano-FePO4/polythiophene as an iron source [J]. J Power Sources, 2012, 197: 253-259.
[32] FAN Q, LEI L, XU X, et al. Direct growth of FePO4/graphene and LiFePO4/graphene hybrids for high rate Li-ion batteries [J]. J Power Sources, 2014, 257: 65-69.
[33] LIU Y, XU S J, ZHANG S M, et al. Direct growth of FePO4/reduced graphene oxide nanosheet composites for the sodium-ion battery [J]. J Mater Chem A, 2015, 3(10):5501-5508.
[34] WU K P, HU G R, PENG Z D, et al. Improved electrochemical properties of LiFePO4/graphene/carbon composite synthesized from FePO4·2H2O/graphene oxide[J]. Ceram Int, 2015, 41(10): 13867-13871.
[35] LEE Y J, BELCHER A M. Nanostructure design of amorphous FePO4facilitated by a virus for 3V lithium ion battery cathodes [J]. J Mater Chem, 2011, 21(4):1033-1039.
[36] CROCE F, D’EPIFANIO A, REALE P, et al. Ruthenium oxide-added quartz iron phosphate as a new intercalation electrode in rechargeable lithium cells [J]. J Electrochem Soc, 2003, 150(5): A576-A581.
[37] YANG X, ZHANG S M, ZHANG J X., Synthesis and modification of iron-based cathode materials: iron phosphate for lithium secondary batteries [J]. Arabian J Sci Engin, 2014, 39(9): 6687-6691.
[38] 武玉玲, 蒲薇华, 任建国, 等. 纳米FePO4的合成及其正极材料LiFePO4/C的电化学性能研究 [J]. 无机材料学报,2012, 27(4): 422-426.
[39] 伍凌, 李新海, 王志兴, 等. 多孔前驱体渗碳制备LiFePO4/C [J]. 电池, 2008, 38(3): 163-165.
(编辑:陈丰)
Research progress of FePO4cathode material
KE Xiang1, XIAO Rengui1, LIAO Xia1,2, YANG Rui2, ZHAO Man2
(College of Chemistry and Chemical Engineering, Guizhou University, Guiyang 550025, China)
Based on the crystal structure and mechanism for charge and discharge of ferric phosphate (FePO4), the difference of electrochemical performance of ferric phosphate with different structures is summarized, and the charge and discharge mechanism is analyzed. The electrochemical properties of FePO4prepared by different methods and the advantages and disadvantages of the preparation methods are compared. Meanwhile, the influence of modification methods on FePO4electrochemical performance is discussed. The directions for future development of FePO4as cathode material for lithium ion batttery are expected.
FePO4; crystal structure; review; charge and discharge mechanism; cathode material; preparation;modification
10.14106/j.cnki.1001-2028.2017.07.001
TM911
A
1001-2028(2017)07-0001-08
2017-05-22
肖仁贵
贵州省科技厅工业攻关项目资助(黔科合GY字[2012]3024)
肖仁贵(1969-)男,湖南湘潭人,教授,主要从事锂离子电池正极材料和电化学腐蚀铝箔研究,E-mail: rgxiao@gzu.edu.cn ;柯翔(1991-)男,贵州安顺人,研究生,研究方向为锂离子电池正极材料,E-mail: 893177314@qq.com 。
时间:2017-06-29 10:22
http://kns.cnki.net/kcms/detail/51.1241.TN.20170629.1022.001.html

