微生物被膜形成因子及其对厚壳贻贝附着的影响
高伟,郭行磐,徐嘉康,彭莉华,沈和定,杨金龙、2,梁箫、2
(1.上海海洋大学水产种质资源发掘与利用教育部重点实验室,上海201306;2.海洋生物科学国际联合研究中心(上海海洋大学),科学技术部,上海201306)
微生物被膜形成因子及其对厚壳贻贝附着的影响
高伟1,郭行磐1,徐嘉康1,彭莉华1,沈和定1,杨金龙1、2,梁箫1、2
(1.上海海洋大学水产种质资源发掘与利用教育部重点实验室,上海201306;2.海洋生物科学国际联合研究中心(上海海洋大学),科学技术部,上海201306)
为调查环境因子对微生物被膜形成能力的影响以及在此条件下形成的微生物被膜对厚壳贻贝Mytilus coruscus稚贝(壳长为1.81 mm±0.13 mm)附着的影响,通过显微共聚焦技术和荧光染色技术,探讨了在18℃条件下盐度为10、20、30时和盐度为30的条件下温度为8、18、28℃时,环境因子对希瓦氏细菌Shewanella loihica ECSMB14101形成微生物被膜产生的影响,调查了上述环境下形成微生物被膜的细菌密度、分布、膜厚等生物学特性及其对厚壳贻贝稚贝附着的影响。结果表明:S.loihica ECSMB14101形成微生物被膜的最终密度随盐度的升高而增加;不同密度的微生物被膜诱导活性不同,且与盐度呈线性关系;微生物被膜上细菌密度随温度的升高而增多,在8℃和18℃时对稚贝的附着诱导活性有显著性差异(P<0.05),附着率分别为31%和68%,18℃与28℃时的微生物被膜诱导活性无显著性差异(P>0.05);随盐度和温度的上升,微生物被膜上的细菌分布逐渐密集,膜厚显著增加,且在盐度为30、温度为28℃条件下微生物被膜的膜厚达到最大值(4.4 μm±0.1 μm);在温度为18℃、盐度为30条件下,膜厚的最大值为(4.3±0.1)μm。研究表明,盐度和温度改变微生物被膜的生物学特性,并导致贻贝附着率的显著差异。
环境因子;微生物被膜;厚壳贻贝;稚贝;附着
厚壳贻贝Mytilus coruscus是一种十分重要的海洋经济贝类,广泛分布于朝鲜、日本及中国黄、渤海和东海等沿岸[1]。厚壳贻贝的生活史经历两个主要阶段,分别是浮游生活阶段和附着生活阶段[2]。厚壳贻贝幼虫附着变态的成功与否直接影响其后的正常发育和健康生长,从而决定了贻贝养殖产业的经济效益与发展前景[3]。
微生物被膜是地球上分布最广和最为成功的生命模式之一[4],几乎存在于海洋环境中的所有附着基表面,其形成受营养条件、附着基质特性等诸多因素影响[5-8]。孙俊杰等[8]研究表明,营养盐变化可导致海洋细菌形成的微生物被膜形态、分布和蛋白含量发生改变。Lau等[9]发现,温度和盐度的变化会影响自然微生物被膜的细菌群落结构、细菌密度和总生物量。微生物被膜在生物地球化学循环过程及海洋无脊椎动物附着过程中发挥了关键性调控作用[10-11]。大量研究表明,自然微生物被膜、单一细菌形成的微生物被膜均能在不同程度上影响厚壳贻贝稚贝的附着过程[12-15]。
希瓦氏细菌属Shewanella于1985年首次被鉴定为新属[16],隶属于变形菌门、γ-变形菌纲,为广泛分布于海洋和淡水环境中的兼性厌氧菌[17]。由于其不同代谢特性,希瓦氏细菌属现已成为研究碳循环和生态环境修复的模式菌[17]。与此同时,自然微生物被膜中分离出的希瓦氏菌属Shewanella spp.能促进厚壳贻贝的幼虫附着变态,且希瓦氏细菌微生物被膜中的两种化学信号参与调控了幼虫附着变态的发育过程[18],也能促进厚壳贻贝的稚贝附着[14]。与以上研究相比,环境因子对单一细菌形成的微生物被膜形成及其对厚壳贻贝附着的影响研究尚且较少。本试验中,以厚壳贻贝和希瓦氏菌属Shewanella loihica ECSMB14101[19]为研究对象,调查了不同温度和盐度对微生物被膜形成及其对稚贝附着的影响,旨在探索环境因子、微生物被膜形成和贻贝附着三者间的相互关系,为解析贻贝附着分子机制及稚贝的中间培育提供理论依据。
1 材料与方法
1.1 材料
试验用海洋细菌S.loihica ECSMB14101分离于自然微生物被膜并冷冻保存(-80℃)。试验用稚贝采自浙江嵊泗养殖场,稚贝带回实验室暂养1周后进行附着试验。暂养条件:水温为18℃,无光照,持续充气;每天换水并投喂金藻Isochrysis galbana。附着试验所用稚贝壳长为(1.81±0.13) mm、壳高为(1.13±0.08)mm。
1.2 方法
1.2.1 微生物被膜的制备 参考杨金龙等[20]的方法制备被膜。挑取保种S.loihica ECSMB14101到100 mL ZoBell 2216E液体培养基中,在200 r/min、25℃、黑暗条件下培养48 h,去上清收集细菌,加入适量灭菌过滤海水(Autoclaved filtered seawater,AFSW),混匀后即制成细菌悬浮液。以0.22 μm滤膜过滤,然后用0.1%吖啶橙溶液染色5 min,在荧光显微镜(奥林巴斯BX51,1000倍)下取10个随机视野计数,得出细菌总密度。盐度30组微生物被膜形成时,培养皿中添加细菌悬浮液,用AFSW定容至20 mL,初始细菌密度为1× 108CFU/mL,分别放在8、18、28℃、无光照条件下培养48 h;温度18℃组微生物被膜形成时,培养皿中添加细菌悬浮液,用AFSW定容至20 mL,终盐度分别为10、20、30,初始细菌密度为1×108CFU/mL,18℃、无光照条件下培养48 h。
1.2.2 细菌密度计数 微生物被膜经5%甲醛溶液固定,用0.1%吖啶橙染色,5 min后用荧光显微镜观察取10个随机视野计数,以确定形成的微生物被膜密度。试验设3个平行组,其计算公式参考杨金龙等[20]方法。
1.2.3 微生物被膜形态及厚度分析 微生物被膜经5%甲醛溶液固定,24 h后用5 μg/mL的碘化丙啶溶液在黑暗条件下染色15 min,激光共聚焦扫描显微镜(Confocal laser scanning microscopy, CLSM,630×)下拍照。试验设置3个平行组,每组随机选10个视野用于成像和分析。
1.2.4 稚贝附着试验 厚壳贻贝稚贝附着试验及附着率计算参照杨金龙等[20]的方法。将一片附有微生物被膜的玻片作为附着基放入无菌培养皿(64 mm×19 mm)中,并加入20 mL ASFW,再将10只稚贝放入培养皿中,在18℃和无光照条件下于6、12、24、48 h时记录并计算稚贝在微生物被膜上的附着率。每组设9个平行,以无微生物被膜的载玻片为空白对照组。
1.3 数据处理
试验结果用JMP 10.0.0软件进行差异统计分析和相关性检验。稚贝附着率和细菌密度的相关性使用Spearman'多元分析方法进行分析,显著性水平设为0.05。
2 结果与分析
2.1 不同环境因子下微生物被膜的密度变化
从图1可见:在盐度30条件下,随着温度的上升,S.loihica ECSMB14101形成的微生物被膜的终密度显著增加,8、18、28℃时,微生物被膜的终密度分别为1.9×107、2.6×107、3.6×107cells/cm2;在温度18℃条件下,随着盐度的升高, S.loihica ECSMB14101形成的微生物被膜的终密度也逐渐增加,盐度为10、20、30时,微生物被膜的终密度分别为0.6×107、1.2×107、2.3×107cells/cm2。作为环境因子的温度和盐度,均与微生物被膜细菌终密度显著相关(P<0.05)(表1)。
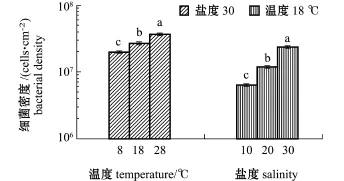
图1 不同环境因子下形成希瓦氏菌ECSMB14101微生物被膜的密度变化Fig.1 Density of Shewanella loihica ECSMB14101 biofilms under different environmental factors
2.2 微生物被膜厚度和形态
随着温度的升高,S.loihica ECSMB14101形成的微生物被膜分布越来越密集,细菌数量越来越多(图2-A);同时,微生物被膜膜厚显著增加(P<0.05)(图2-B),且在28℃时微生物被膜的膜厚最大,为(4.4±0.1)μm。随着盐度的不断升高, S.loihica ECSMB14101微生物被膜也更加密集(图3-A),同时,S.loihica ECSMB14101微生物被膜的膜厚显著增厚(P<0.05)(图3-B),且在盐度为30时膜厚最大值达到(4.3±0.1)μm。
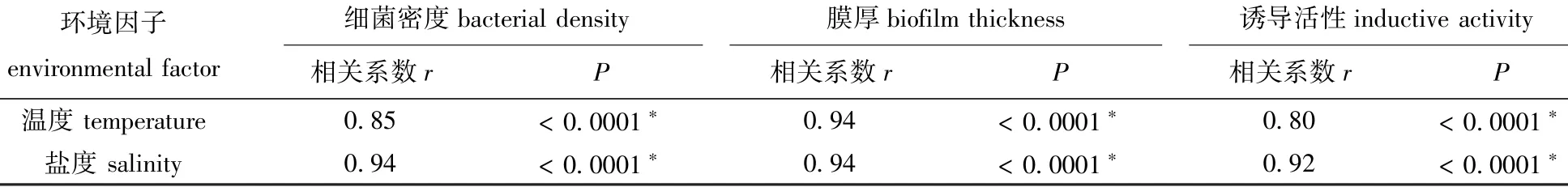
表1 环境因子与Shewanella loihica ECSMB14101微生物被膜细菌密度、膜厚和诱导活性的相关性分析Tab.1 Correlation analysis between environmental factors and bacterial density,thickness and inducing activity of Shewanella loihica ECSMB14101 biofilms
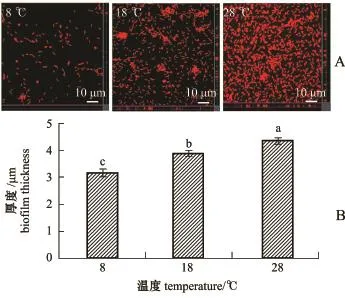
图2 激光共聚焦测定温度影响下希瓦氏菌ECSMB14101微生物被膜图像(A)及膜厚(B)Fig.2 CLSM reveals micrographs(A)and thickness (B)of Shewanella loihica ECSMB14101 biofilms at varying temperatures

图3 激光共聚焦测定盐度影响下希瓦氏菌ECSMB14101微生物被膜图像(A)及膜厚(B)Fig.3 CLSM reveals micrographs(A)and thickness (B)of Shewanella loihica ECSMB14101 biofilms at varying salinities
2.3 不同温度和盐度条件下微生物被膜对稚贝附着的影响
由于12 h后稚贝在微生物被膜上的附着率基本稳定,因此,本研究中仅列出12 h时的试验结果(图4)。温度试验中,在盐度为30时,对照组稚贝的附着率为10.0%±2.3%,微生物被膜试验组与对照组存在显著性差异(P<0.05);18℃时稚贝附着率较8℃时显著升高(P<0.05),但与28℃时无显著性差异(P>0.05)。盐度试验中,在温度为18℃时,对照组稚贝的附着率最低;随着盐度的不断升高,S.loihica ECSMB14101微生物被膜对稚贝附着的诱导活性显著升高(P<0.05)。

图4 不同环境因子影响下希瓦氏菌ECSMB14101微生物被膜对厚壳贻贝稚贝附着的影响Fig.4 Percentages of settlement of plantigrades of mussel Mytilus coruscus on Shewanella loihica ECSMB14101 biofilms under different environmental factors
2.4 微生物被膜终密度与稚贝附着率的关系
由图5可知,S.loihica ECSMB14101微生物被膜上的细菌密度变化影响厚壳贻贝稚贝附着的诱导活性。随着细菌密度的逐渐升高,微生物被膜对厚壳贻贝稚贝的诱导活性明显增加(P<0.05)。
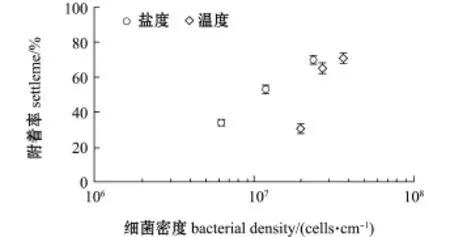
图5 厚壳贻贝稚贝附着与希瓦氏菌ECSMB14101微生物被膜终密度的关系Fig.5 Interaction between settlement rate of plantigrades of mussel Mytilus coruscus and cells density of Shewanella loihica ECSMB14101 biofilms under different environmental factors
3 讨论
3.1 盐度和水温对微生物被膜形成及微生物被膜对厚壳贻贝附着的影响
前期研究发现,盐度影响多种微生物形成的微生物被膜的干质量、叶绿素a含量、细菌密度和群落结构等,进而影响厚壳贻贝的附着[5]。本试验结果表明,随着温度和盐度的不断升高,S.loihica ECSMB14101微生物被膜中的细菌密度、分布和膜厚等生物学特性显著改变,表明盐度和温度的变化影响了微生物被膜的形成和细菌密度。以往在温度和盐度对自然微生物被膜形成的影响研究与本研究结果相同[9]。本研究中发现,随盐度的升高,形成的S.loihica ECSMB14101微生物被膜的附着诱导活性也随之升高。推测盐度影响了微生物被膜形成,同样还发现,随温度的升高,形成的S.loihica ECSMB14101微生物被膜对厚壳贻贝稚贝的附着率也随之升高,且在18℃时保持稳定。因此,微生物被膜的生物学特性影响稚贝的附着行为。
微生物被膜中细菌密度的高低影响其群落结构及功能的行使,如细菌分泌群体感应信号分子调控鱿鱼发光,只有细菌密度达到一定阈值时才能够发光[21]。微生物被膜中细菌的密度影响着海洋贻贝类的附着[13-14]。对华美盘管虫Hydroides elegans幼虫附着变态过程的研究发现,微生物被膜中细菌的终密度随细菌初始密度的增加而增加,并且细菌密度也与幼虫的附着率呈正相关趋势[22]。同样,微生物被膜中细菌密度与厚壳贻贝幼虫的附着变态相关[23]。本试验中发现:不同盐度和温度条件下,形成的微生物被膜对稚贝附着的诱导活性与细菌密度显著相关;同时还发现,在相对较低的温度(8、18℃)时,S.loihica ECSMB14101微生物被膜对稚贝的诱导活性显著增加,但18℃与28℃时形成微生物被膜对稚贝的诱导活性无显著性差异。这可能是由于温度变化能影响到微生物被膜的形成,改变特定的生物学特性,但存在阈值效应,这需要进一步研究验证。
3.2 细菌种属与微生物被膜形成以及厚壳贻贝附着的相互关系
由不同种属细菌形成的微生物被膜对海洋无脊椎动物的附着也不尽相同,其原因可能与微生物分泌的代谢产物相关[20]。本研究中选取的S.loihica ECSMB14101形成的微生物被膜已被证实能够对厚壳贻贝幼虫和稚贝的附着具有极好的诱导活性[14,18],且二者均与该菌释放的水溶性代谢产物及微生物被膜表面活性物质相关。为适应环境,浮游的细菌会形成微生物被膜以抵御外界环境的变化,Shewanella spp.的细菌亦是如此[24],且在不同环境条件下微生物被膜释放的代谢产物不同。
本试验中首次证实了温度和盐度能够调控单一细菌微生物被膜的形成过程,且在适宜条件下形成的微生物被膜能够有效诱导海产贝类厚壳贻贝稚贝的附着。
[1] 常亚青.贝类增养殖学[M].北京:中国农业出版社,2007.
[2] 李太武.海洋生物学[M].北京:海洋出版社,2013.
[3] 孙俊杰,张显,郭行磐,等.硅烷化表面海洋细菌对厚壳贻贝稚贝附着的影响[J].水产学报,2015,39(10):1530-1538.
[4] Stoodley P,Sauer K,Davies D G,et al.Biofilms as complex differentiated communities[J].Annual Review of Microbiology,2002, 56:187-209.
[5] Yang J L,Li Y F,Liang X,et al.Silver nanoparticles impact biofilm communities and mussel settlement[J].Scientific Reports, 2016,6:37406.
[6] Yang J L,Li Y F,Guo X P,et al.The effect of carbon nanotubes and titanium dioxide incorporated in PDMS on biofilm community composition and subsequent mussel plantigrade settlement[J].Biofouling,2016,32(7):763-777.
[7] Yang J L,Zhou X,Li Y F,et al.Plantigrade settlement of the mussel Mytilus coruscus in response to natural biofilms on different surfaces[J].Journal of the Marine Biological Association of the United Kingdom,2014,94(8):1639-1649.
[8] 孙俊杰,梁箫,郭行磐,等.培养基对微生物被膜形成和厚壳贻贝附着的影响[J].水产学报,2016,40(8):1229-1238.
[9] Lau S C K,Thiyagarajan V,Cheung S C K,et al.Roles of bacterial community composition in biofilms as a mediator for larval settlement of three marine invertebrates[J].Aquatic Microbial Ecology, 2005,38(1):41-51.
[10] Flemming H C,Wingender J,Szewzyk U,et al.Biofilms:an emergent form of bacterial life[J].Nature Reviews Microbiology, 2016,14(9):563-575.
[11] 杨金龙,王冲,顾忠旗,等.微生物膜对海洋无脊椎动物幼体附着变态的影响研究[J].海洋科学,2012,36(8):116-121.
[12] 杨金龙,李响,王冲,等.低盐度形成的微生物膜对厚壳贻贝稚贝附着的影响[J].海洋科学,2013,37(8):107-113.
[13] Yang J L,Li X,Liang X,et al.Effects of natural biofilms on settlement of plantigrades of the mussel Mytilus coruscus[J].Aquaculture,2014,424-425:228-233.
[14] Li Y F,Guo X P,Yang J L,et al.Effects of bacterial biofilms on settlement of plantigrades of the mussel Mytilus coruscus[J].Aquaculture,2014,433:434-441.
[15] 周轩,郭行磐,陈芋如,等.低湿度表面的海洋附着细菌对厚壳贻贝附着的影响[J].大连海洋大学学报,2015,30(1):30-35.
[16] MacDonell M,Colwell R R.Phylogeny of the Vibrionaceae,and recommendation for two new genera,Listonella and Shewanella [J].Systematic and Applied Microbiology,1985,6(2):171-182.
[17] Fredrickson J K,Romine M F,Beliaev A S,et al.Towards environmental systems biology of Shewanella[J].Nature Reviews Microbiology,2008,6(8):592-603.
[18] Yang J L,Shen P J,Liang X,et al.Larval settlement and metamorphosis of the mussel Mytilus coruscus in response to monospecific bacterial biofilms[J].Biofouling,2013,29(3):247-259.
[19] Yang J L,Guo X P,Ding D W.Draft genome sequence of Shewanella sp.ECSMB14101,isolated from the East China Sea[J]. Genome Announcement,2015,3(1):e01388-14.
[20] 杨金龙,郭行磐,陈芋如,等.中湿度表面的海洋细菌对厚壳贻贝稚贝附着的影响[J].水产学报,2015,39(3):421-428.
[21] Ruby E G,Lee K H.The Vibrio fischeri-Euprymna scolopes light organ association:current ecological paradigms[J].Applied and Environmental Microbiology,1998,64(3):805-812.
[22] Huang S Y,Hadfield M G.Composition and density of bacterial biofilms determine larval settlement of the polychaete Hydroides elegans[J].Marine Ecology Progress Series,2003,260:161-172.
[23] Wang C,Bao W Y,Gu Z Q,et al.Larval settlement and metamorphosis of the mussel Mytilus coruscus in response to natural biofilms[J].Biofouling,2012,28(3):249-256.
[24] Zeng Z S,Liu X X,Yao J Y,et al.Cold adaptation regulated by cryptic prophage excision in Shewanella oneidensis[J].The ISME Journal,2016,10(12):2787-2800.
Effects of environmental factors on formation of bacterial biofilms and settlement of plantigrades of mussel Mytilus coruscus
GAO Wei1,GUO Xing-pan1,XU Jia-kang1,PENG Li-hua1, SHEN He-ding1,YANG Jin-long1,2,LIANG Xiao1,2
(1.Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources,Ministry of Education,Shanghai Ocean University,Shanghai 201306, China;2.International Research Center for Marine Biosciences at Shanghai Ocean University,Ministry of Science and Technology,Shanghai 201306, China)
Effects of water temperature(8,18 and 28℃)and salinity of 10,20,and 30 on Shewanella loihica ECSMB14101 biofilms and subsequent effect on settlement of plantigrades of mussel Mytilus coruscus with shell length of(1.81±0.13)mm were studied.The confocal laser scanning microscopy technique was used to investigate the characteristics of biofilms including biofilm thickness and the distribution of bacteria in biofilms.The results showed that the final density and thickness of the ECSMB14101 biofilm were increased with increase in temperature and salinity,with the maximal thickness of(4.4±0.1)μm at a salinity of 30 and at temperature of 28℃. The settlement inducing activities of the biofilms were different under different conditions of temperatures and salinities.The amount of bacteria in the biofilm was found to be increased with the increasing temperature,and the mussel had settlement rate of 31%at 8℃and 68%at 18℃,with significant difference(P<0.05).In contrast, there was no significant difference in inducing activity at 18℃and 28℃(P>0.05).The findings explored the interplay between environmental factors,biofilm formation,and settlement of mussel plantigrades.
environmental factor;biofilm;Mytilus coruscus;plantigrade of mussel;settlement
S968.3
A
10.16535/j.cnki.dlhyxb.2017.04.005
2095-1388(2017)04-0405-05
2016-12-01
国家自然科学基金资助项目(41476131);上海市教委创新重点项目(14ZZ143);上海高校水产高峰学科建设项目
高伟(1991—),男,硕士研究生。E-mail:m140150331@st.shou.edu.cn
梁箫(1983—),女,博士,讲师。E-mail:x-liang@shou.edu.cn

