不同饵料对厚壳贻贝稚贝生长、存活及淀粉酶活性的影响
顾忠旗,杨娜,彭莉华,周民栋,沈和定,杨金龙,梁箫
(1.浙江省嵊泗县海洋科技研究所,浙江舟山202450;2.上海海洋大学水产种质资源发掘与利用教育部重点实验室,上海201306;3.上海海洋大学水产科学国家级实验教学示范中心,上海201306;4.上海海洋大学科技部海洋生物科学国际联合中心,上海201306)
不同饵料对厚壳贻贝稚贝生长、存活及淀粉酶活性的影响
顾忠旗1,杨娜2、3、4,彭莉华2、3、4,周民栋1,沈和定2、3,杨金龙2、3、4,梁箫2、3、4
(1.浙江省嵊泗县海洋科技研究所,浙江舟山202450;2.上海海洋大学水产种质资源发掘与利用教育部重点实验室,上海201306;3.上海海洋大学水产科学国家级实验教学示范中心,上海201306;4.上海海洋大学科技部海洋生物科学国际联合中心,上海201306)
为了解不同饵料对厚壳贻贝Mytilus coruscus稚贝生长、存活及消化能力的影响,在温度为18℃、盐度为30的条件下,使用单一湛江等边金藻、青岛大扁藻及其二者的混合饵料(体积比为1∶1)分别投喂壳长为1.31 mm±0.05 mm的厚壳贻贝稚贝,并检测其21 d内的存活率、壳长、壳高、湿质量、特定生长率和淀粉酶活力变化。结果表明:在不同饵料条件下,稚贝的存活率均大于93%,不同处理组间无显著性差异(P>0.05);饲养14 d以上时,各饵料组稚贝的壳长、壳高、特定生长率、湿重和淀粉酶活力均为混合饵料组高于其他饵料组;试验结束时,混合饵料组稚贝的各项生长指标及淀粉酶活力均显著高于两个单一饵料组(P<0.05)。
厚壳贻贝;稚贝;微藻;生长;淀粉酶
目前,过度捕捞、生境破坏和全球变暖等因素对河海生物造成了严重危害,已引起众多学者对贝类资源修复和保护工作的重视。贝类资源的修复与增殖,与贝类人工繁育技术的快速发展密不可分[1]。近年来,中国的人工繁育技术一直处于不断提升状态,大规模人工放流及其他养殖模式中的苗种基本上源于人工培育[1]。而无论自然条件或是养殖条件,贝类幼虫和稚贝生长发育所需要的饵料,主要源自于单细胞藻类[1-2]。
不同贝类及发育阶段对饵料的营养需求也存在诸多差异[3-4]。贝类生长发育时主要需要脂类、碳水化合物和蛋白质等能量物质,同时,矿物质、维生素、微量元素、多不饱和脂肪酸(PUFAs)等营养因子,也能影响贝类的生长发育。而不同种类微藻间的生化组成也具有较大的差异[5-7]。
厚壳贻贝Mytilus coruscus隶属于软体动物门Mollusca、双壳纲Bivalvia、贻贝目Mytilodia、贻贝科Mytilidae,其营养价值高,市场前景广阔。但是,近年来调查发现,厚壳贻贝的资源量正在以可视量化的速度减少。然而,市场的需求量又在持续地增长,导致供不应求。目前,有关微生物被膜对厚壳贻贝稚贝附着调控的研究较多[8-10],而有关稚贝生长与微藻饵料间的相互关系的研究尚未见报道。本试验中,比较了厚壳贻贝稚贝在不同微藻饵料条件下生长和存活的差异,通过测定不同饵料条件下稚贝淀粉酶活力来检测稚贝对不同饵料的消化能力,以期为厚壳贻贝人工苗种繁育技术的优化提供参考依据。
1 材料与方法
1.1 材料
试验用稚贝源于浙江省嵊泗县东海贻贝科技创新服务有限公司。在大样本内挑选足量的厚壳贻贝稚贝样本,以保证每个试验组中供试的稚贝样本量均在400枚以上。稚贝在培养水温为18℃、盐度为30的条件下充气暂养1周。
1.2 方法
1.2.1 厚壳贻贝稚贝的培育 选取两种藻类作为稚贝饵料,分别为湛江等鞭金藻Isochrysis zhanjiangensis和青岛大扁藻Platymonashelgolandica var.tsingtaoensis。试验设2个饵料单独投喂组和1个混合微藻组,共3个处理组,其中混合组中湛江等边金藻与青岛大扁藻两种藻类按体积比为1∶1混合,每组设3个重复。日投饵2~3次,日投饵量为(3.0×105~4.0×105)cells/mL,每天换水1次。1.2.2 稚贝的生长与存活 利用OLYMPUS解剖显微镜(SZX2-FOF)测量稚贝的壳长和壳高,精确到0.01 mm。随机挑取30枚稚贝,测量其初始壳长和壳高作为空白对照组,壳长和壳高的平均值分别为(1.31±0.05)mm和(0.85±0.03)mm。分别于试验的第7、14和21天随机挑取不同饵料试验组30枚稚贝测量壳长和壳高。使用电子天平测定每组稚贝的湿质量,并计算每组稚贝的存活率。试验周期为21 d,并在试验结束时计算稚贝壳长和壳高的特定生长率(SGR,%/d):
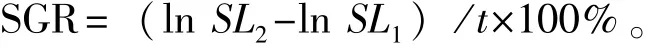
其中:SL1和SL2分别为稚贝的初始壳长(或壳高, mm)和各时间段的壳长(或壳高,mm);t为试验时间(d)。
1.2.3 稚贝淀粉酶活力的测定 用生理盐水将每个阶段的稚贝清洗干净后,放入2 mL的平底离心管中,并置于冰上,再加入0.9%的生理盐水(质量体积比为1 mg∶9 mL),用匀浆机充分将样品研磨匀浆。将稚贝组织样品充分打散后将组织匀浆液置于预冷的离心机内,在4℃下以2000 r/min离心15 min,取上清液于4℃下保存用于后续分析,样品于24 h内分析完成。
利用考马斯亮蓝法测定稚贝体内的淀粉酶活力。淀粉酶活力单位定义为:样品组织中每mg蛋白在37℃条件下与底物反应30 min,水解10 mg淀粉定义为1个淀粉酶活性单位(U)。根据以下算式计算淀粉酶活力(AMS):
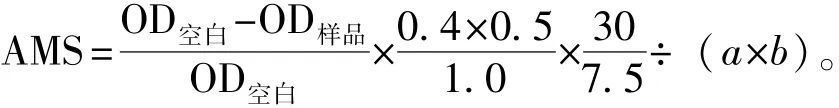
其中:a为取样量,为0.1 mL;b为待测样本蛋白浓度(mg prot/mL);0.4为底物缓冲液浓度(mg/mL);0.5为加入底物体积(mL);7.5为底物缓冲液与待测样本的反应时间(min)。
1.3 数据处理
试验结果用平均值±标准差(mean±S.D.)表示。试验数据采用JMP 10.0.0软件进行统计分析,所有数据均进行正态性检验。若不满足正态分布,则采用非参数多重比较,对每对执行Wilcoxon检验,进行不同处理组间稚贝生长、存活的差异比较,显著性水平设为0.05。
2 结果与分析
2.1 不同饵料条件下厚壳贻贝稚贝的存活率
从表1可见:第7、14、和21天时,3个饵料组间的存活率范围分别为(93.94~98.99)%、(94.95~97.98)%、(94.95~98.99)%;混合饵料组成活率略高于单一饵料投喂组,但不同饵料条件下,不同时期的稚贝存活率均无显著性差异(P>0.05)。
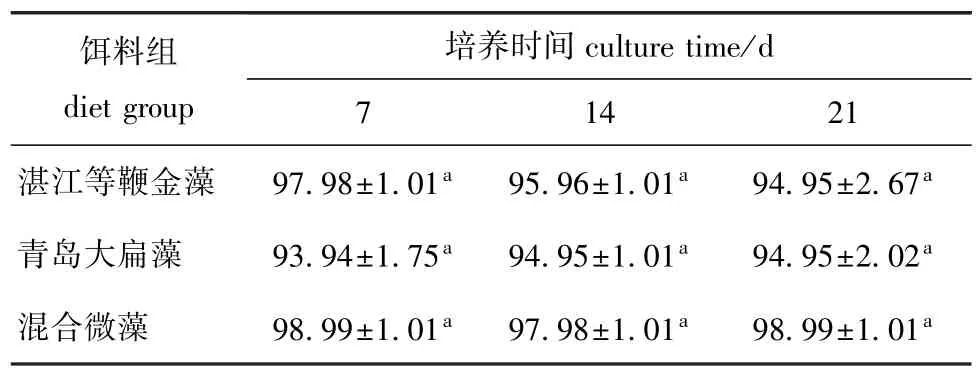
表1 不同饵料条件下厚壳贻贝稚贝的存活率Tab.1 Survival rate of thick shell mussel Mytilus coruscus plantigrades fed different diets%
2.2 不同饵料条件下厚壳贻贝稚贝的壳长及其特定生长率
从表2可见:随着养殖时间的延长,混合饵料组和湛江等鞭金藻稚贝的壳长呈显著增大的趋势;投喂湛江等边金藻的稚贝在第21天时,其壳长均显著高于第7、14天时(P<0.05);投喂青岛大扁藻的稚贝在第7、14、21天时,其壳长均无显著性差异(P>0.05);投喂混合饵料组的稚贝在第7、14、21天时,其壳长均有显著性差异(P<0.05),且在第21天时壳长达到最大(1.56±0.02)mm,表现出明显的生长优势。
同一养殖时间下,第7天时,不同饵料条件下稚贝的壳长均无显著性差异(P>0.05),第14、21天时,3种饵料条件下稚贝的壳长均为混合饵料组>湛江等边金藻组>青岛大扁藻组,且混合饵料组稚贝的壳长均显著高于单一饵料组(P<0.05)。
从图1可见:试验结束时,投喂3种饵料的稚贝壳长特定生长率大小依次为混合饵料组>湛江等鞭金藻组>青岛大扁藻组;不同饵料条件下,稚贝壳长特定生长率范围为(0.78~1.43)%/d,混合饵料组稚贝的壳长特定生长率显著高于单一饵料组(P<0.05)。
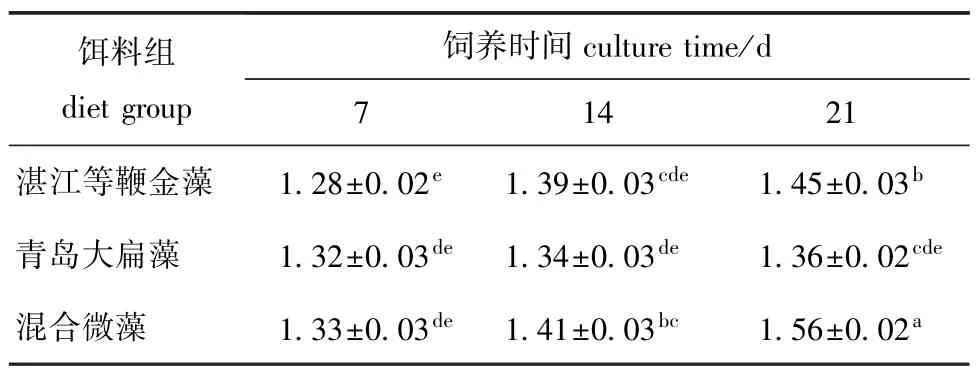
表2 不同饵料条件下厚壳贻贝稚贝的壳长Tab.2 Mean shell length of thick shell mussel Mytilus coruscus plantigrades fed different dietsmm

图1 不同饵料条件下厚壳贻贝稚贝的壳长特定生长率Fig.1 Specific growth rate(SGR)in shell length in thick shell mussel Mytilus coruscus plantigrades fed different diets
2.3 不同饵料条件下厚壳贻贝稚贝的壳高及其特定生长率
从表3可见:随着养殖时间的延长,混合饵料组和湛江等鞭金藻组稚贝的壳高呈显著增大的趋势;投喂湛江等边金藻的稚贝在第21天时,其壳高显著大于第7天时(P<0.05);投喂青岛大扁藻的稚贝在第7、14、21天时,其壳高均无显著性差异(P>0.05);投喂混合饵料组的稚贝在第21天时,其壳高显著大于第7天时(P<0.05),且在第21天时壳高达到最大(1.04±0.02)mm,表现出明显的生长优势。
同一养殖时间下,3种饵料组的壳高均为混合饵料组>湛江等鞭金藻组>青岛大扁藻组;第7、14天时,不同饵料条件下稚贝的壳高均无显著性差异(P>0.05),第21天时混合饵料组稚贝的壳高显著高于单一饵料组(P<0.05)。
从图2可见:试验结束时,投喂3组饵料的稚贝壳高特定生长率与壳长特定生长率变化趋势相同,均为混合饵料组>湛江等鞭金藻组>青岛大扁藻组;不同饵料条件下,稚贝壳高特定生长率范围为(0.84~1.39)%/d,混合饵料组稚贝的壳高特定生长率显著高于单一饵料组(P<0.05)。

表3 不同饵料条件下厚壳贻贝稚贝的壳高Tab.3 Shell height of thick shell mussel Mytilus coruscus plantigrades fed different dietsmm

图2 不同饵料条件下厚壳贻贝稚贝的壳高特定生长率Fig.2 Specific growth rate(SGR)in shell height in thick shell mussel Mytilus coruscus plantigrades fed different diets
2.4 不同饵料条件下厚壳贻贝稚贝的湿质量
从图3可见:随着培养时间的延长,3个饵料组厚壳贻贝稚贝的湿质量均有不同程度的增加;饲养第7天时,单一湛江等鞭金藻组稚贝体质量增长最快;饲养第14、21天时,混合饵料组稚贝的湿质量最大,且显著高于单一饵料组(P<0.05)。
2.5 不同饵料条件下厚壳贻贝稚贝的淀粉酶活力
从图4可见:饲养第7天时,不同饵料条件下各组稚贝的淀粉酶活力无显著性差异(P>0.05);饲养第14、21天时,3种饵料条件下稚贝的淀粉酶活力均为混合饵料组>湛江等鞭金藻组>青岛大扁藻组,且3种饵料组间稚贝的淀粉酶活力有显著性差异(P<0.05)。这表明,投喂混合饵料会促进稚贝体内淀粉酶的活力,从而在稚贝的生长中起到较大作用,更适合于稚贝生长。

图3 不同饵料条件下厚壳贻贝稚贝的湿质量Fig.3 Wet body weight of thick shell mussel Mytilus coruscus plantigrades fed different diets
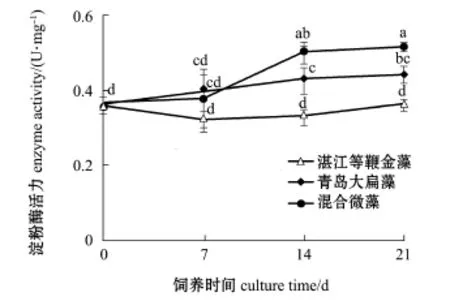
图4 不同饵料条件下厚壳贻贝稚贝的淀粉酶活力Fig.4 Amylase activity of thick shell mussel Mytilus coruscus plantigrades fed different diets
3 讨论
3.1 不同藻类对贝类存活率的影响
目前,国内外在双壳贝类育苗中广泛使用的饵料类群是绿藻、金藻和硅藻,本试验中所选取的两种藻类饵料分别来自金藻门Chrysophyta、金藻纲Chrysophyceae的湛江等鞭金藻I.zhanjiangensis以及绿藻门Chlorophyta、绿藻纲Chlorophyceae的青岛大扁藻P.helgolandica var.tsingtaoensis。
本研究结果表明,不同微藻饵料组的厚壳贻贝稚贝的存活率为93.94%~98.99%,且不同微藻饵料组间无显著性差异(P>0.05),表明试验微藻均能提供厚壳贻贝稚贝生长所需。王庆志等[1]研究表明,不同饵料条件下魁蚶Scapharca broughtonii稚贝的存活率为95.3%~99.0%。Lora-Vilchis等[11]研究表明,5种饵料条件下,江珧Atrina maura稚贝的存活率为100%。李文波等[12]研究表明,不同饵料条件下,西施舌Coelomactra antiquata稚贝的成活率为88.2%~96.6%。以上研究结果均与本研究结果类似。
3.2 不同藻类对贝类各项生长指标的影响
藻类饵料对各种贝类的生长速度均有直接关系,饵料的种类会影响贝类生长的速度。本研究结果表明,从第14天开始,不同饵料组的稚贝壳长和壳高均表现出差异,不同饵料对厚壳贻贝稚贝壳长和壳高的生长均有影响。投喂单一饵料的试验组组间相比较,投喂湛江等边金藻的稚贝壳长、壳高、特定生长率和湿质量均高于投喂青岛大扁藻的稚贝。王庆志等[1]研究表明,单一投喂球等边金藻组的魁蚶稚贝生长速度优于其他单一饵料投喂组;李文波等[12]研究表明,添加藻类组比未添加藻类组更有利于西施舌稚贝的存活和生长;另有研究表明,青岛大扁藻对泥蚶Tegi llarcagranosa和缢蛏Sinonov aculaconstricta稚贝的饵料效果较差[2]。以上结果说明,不同藻类对贝类稚贝的投喂效果不同,其原因可能是不同藻类在生化组成方面具有较大的差异,尤其是脂肪和脂肪酸含量等,例如,金藻中总脂含量明显高于绝大多数绿藻,且金藻的C14∶0脂肪酸和DHA含量较高;而绿藻中的C16∶0脂肪酸含量较高,DHA和长链脂肪酸的含量则较低,因此,不同藻类生化组成的差异对稚贝产生了不同的喂养效果。许多研究均报道了饵料生化组成与贝类稚贝和幼虫的生长关系[13-15]。
本研究中,与单一饵料投喂组相比较,投喂混合饵料组的稚贝壳长和壳高在第21天时均为最高,且特定生长率和湿质量也最高,其表现出明显的生长优势。王庆志等[1]研究表明,投喂混合饵料(小球藻与球等鞭金藻混合、角毛藻与球等鞭金藻混合)对魁蚶稚贝的生长比投喂单一饵料组效果更好[1]。有研究表明,相比于投喂单一饵料,投喂混合饵料对贝类幼虫或稚贝的生长效果更好,其原因是各微藻具有不同的营养成分,混合投喂时,不同微藻的营养成分互相补充,幼虫或稚贝能够获得较全面的营养,更利于贝类幼虫或稚贝的生长[16-17]。但也有研究表明,相比于投喂单一饵料,投喂混合饵料对贝类幼虫或稚贝并未表现出更好的投喂效果,如Liu等[18]研究发现,在大蓝鸟蛤Clinocardiu mnuttallii的幼虫和稚贝阶段,分别投喂单一金藻和牟氏角毛藻更有利于促进幼虫和稚贝的生长,而投喂混合饵料并未产生更好的投喂效果; Rivero-Rodríguez等[19]研究也发现,对红树林牡蛎Crassostrea corteziensis稚贝投喂单一角毛藻比投喂混合饵料(角毛藻与其他微藻混合)效果更佳。其原因可能是微藻的混合均可以产生积极、消极或中间的影响,这主要取决于所选微藻的种类[20]。
3.3 不同藻类对贝类消化酶活力的影响
贝类消化酶的活性与贝类的种类和摄食密切相关,贝类摄取的不同食物对主要消化酶活性会产生一定的影响,从而对贝类的生长产生作用[21]。本研究结果表明,混合饵料投喂组稚贝淀粉酶活力比单一饵料投喂组要高;单一湛江等边金藻投喂组稚贝又比单一青岛大扁藻稚贝投喂组淀粉酶活力高。刘万顺等[22]研究表明,滨螺Littorina sp.主要摄食定生藻类,紫贻贝Mytilus edulis主要以浮游性单胞藻类为食,两种贝类体内的蛋白酶活力均较高,但滨螺体内的纤维素酶活力较高,而淀粉酶活力较低,而紫贻贝则与此相反。李文波等[12]研究表明,单一藻类与混合饵料相比,混合饵料组西施舌稚贝的淀粉酶活力较高[12],说明藻类饵料能够促进稚贝淀粉酶活力的升高。安贤惠等[23]分别检测了缢蛏Sinonovacula constricta、剖刀蛏Cultellus scalpellum、文蛤Meretrix linnaeus、栉孔扇贝Chlamys farreri、杂色鲍Haliotis diversicolor等5种贝类的消化酶活力,发现杂色鲍的淀粉酶活力最高,其次为文蛤、栉孔扇贝和缢蛏,而剖刀蛏的淀粉酶活力最低。这一结论与贝类的生活和摄食习性不同有密切关系。
综上所述,投喂湛江等边金藻与青岛大扁藻的混合饵料组厚壳贻贝稚贝的生长明显优于单一饵料组,且混合饵料组稚贝特定生长率和淀粉酶的活力也最高,表明其消化能力最好。本研究结果对今后开展厚壳贻贝稚贝的中间培育提供了理论依据和技术支撑。
[1] 王庆志,张明,滕炜鸣,等.不同饵料对魁蚶稚贝生长和存活的影响[J].应用生态学报,2014,25(8):2405-2410.
[2] 朱雨瑞,徐继林,严小军,等.5种微藻对4种滩涂贝类稚贝生长的影响[J].海洋学研究,2010,28(3):60-66.
[3] Ponis E,Probert I,Véron B,et al.Nutritional value of six Pavlovophyceae for Crassostrea gigas and Pecten maximus larvae[J].Aquaculture,2006,254(1-4):544-553.
[4] Napolitano G E,Ackman R G,Silva-Serra M A.Incorporation of dietary sterols by the sea scallop Placopecten magellanicus(Gmelin)fed on microalgae[J].Marine Biology,1993,117(5):647-654.
[5] Bachok Z,Mfilinge P L,Tsuchiya M.The diet of the mud clam Geloina coaxans(Mollusca,Bivalvia)as indicated by fatty acid markers in a subtropical mangrove forest of Okinawa,Japan[J]. Journal of Experimental Marine Biology and Ecology,2003,292 (2):187-197.
[6] Soudant P,Marty Y,Moal J,et al.Effect of food fatty acid and sterol quality on Pecten maximus gonad composition and reproduction process[J].Aquaculture,1996(3-4):361-378.
[7] 李荷芳,周汉秋.海洋微藻脂肪酸组成的比较研究[J].海洋与湖沼,1999,30(1):34-40.
[8] Yang J L,Li X,Liang X,et al.Effects of natural biofilms on settlement of plantigrades of the mussel Mytilus coruscus[J].Aquaculture,2014,424-425:228-233.
[9] Li Y F,Guo X P,Yang J L,et al.Effects of bacterial biofilms on settlement of plantigrades of the mussel Mytilus coruscus[J].Aquaculture,2014,433:434-441.
[10] 周轩,郭行磐,陈芋如,等.低湿度表面的海洋附着细菌对厚壳贻贝附着的影响[J].大连海洋大学学报,2015,30(1):30-35.
[11] Lora-Vilchis M C,Ruiz-Velasco-Cruz E,Reynoso-Granados T, et al.Evaluation of five microalgae diets for juvenile pen shells Atrina maura[J].Journal of the World Aquaculture Society,2004, 35(2):232-236.
[12] 李文波,高如承,潘辉,等.不同饵料对西施舌稚贝生长及消化酶活性的影响[J].安徽农学通报,2012,18(9):175-178.
[13] Brown M R,Jeffrey S W,Volkman J K,et al.Nutritional properties of microalgae for mariculture[J].Aquaculture,1997,151(1-4):315-331.
[14] Marshall R,McKinley S,Pearce C M.Effects of nutrition on larval growth and survival in bivalves[J].Reviews in Aquaculture, 2010,2(1):33-55.
[15] 陈自强,寿鹿,廖一波,等.微藻饵料对双壳贝类幼体生长影响的研究进展[J].科技通报,2013,29(7):46-55,67.
[16] Martínez-Fernández E,Acosta-Salmón H,Southgate P C.The nutritional value of seven species of tropical microalgae for blacklip pearl oyster(Pinctada margaritifera L.)larvae[J].Aquaculture,2006,257(1-4):491-503.
[17] McCausland M A,Brown M R,Barrett S M,et al.Evaluation of live microalgae and microalgal pastes as supplementary food for juvenile Pacific oysters(Crassostrea gigas)[J].Aquaculture, 1999,174(3-4):323-342.
[18] Liu W,Pearce C M,Alabi A O,et al.Effects of microalgal diets on the growth and survival of larvae and post-larvae of the basket cockle,Clinocardiu mnuttallii[J].Aquaculture,2009,293(3-4):248-254.
[19] Rivero-Rodríguez S,Beaumont A R,Lora-Vilchis M C.The effect of microalgal diets on growth,biochemical composition,and fatty acid profile of Crassostrea corteziensis(Hertlein)juveniles [J].Aquaculture,2007,263(1-4):199-210.
[20] Velaseo L A.Energetic physiology of the Caribbean scallops Arg-opecten nucleus and Nodipecten nodosus fed with different microalgal diets[J].Aquaculture,2007,270(1-4):299-311.
[21] 冯琳,邹文钟,肖思棋,等.西施舌的摄食与饵料[J].水产养殖,2010,31(3):14-15.
[22] 刘万顺,李濒.海洋无脊椎动物消化酶的研究I.紫贻贝、日本蟳、滨螺消化酶的初步分析及其应用[J].山东海洋学院学报,1988,18(1):54-62.
[23] 安贤惠,李联泰,林春梅.几种贝类消化酶活力的比较[J].淮海工学院学报:自然科学版,2007,16(1):57-59.
Effects of different diets on growth,survival and amylase activity in plantigrades of thick shell mussel Mytilus coruscus
GU Zhong-qi1,YANG Na2,3,4,PENG Li-hua2,3,4,ZHOU Min-dong1, SHEN He-ding2,3,YANG Jin-long2,3,4,LIANG Xiao2,3,4
(1.Shengsi Institute of Marine Science and Technology in Zhejiang Province,Zhoushan 202450,China;2.Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources,Ministry of Education,Shanghai Ocean University,Shanghai 201306,China;3.National Demonstration Center for Experimental Fisheries Science,Ministry of Education,Shanghai Ocean University,Shanghai 201306,China;4.National Marine Biosciences International Joint Research Center,Ministry of Science and Technology,Shanghai Ocean University,Shanghai 201306,China)
Plantigrades of thick shell mussel Mytilus coruscus with shell length of(1.31±0.05)mm were fed algae Isochrysis zhanjiangensis,and Platymonas helgolandica var.tsingtaoensis,and a mixture of the two algae at volumetric proportion of 1∶1 at water temperature of 18℃and a salinity of 30 for 21 days,and survival rate,shell length,shell height,wet body weight,specific growth rate(SGR)and amylase activity of the plantigrades were determined in order to understand the effects of different diets on the growth,survival and digestion of thick shell mussel juveniles.The results showed that there were no significant differences in survival rates(over 93%)in all groups(P>0.05).However,the plantigrades fed the mixture of the two algae had significantly higher SGR,and amylase activity than the animals fed single alga did during over 14 day rearing period(P<0.05).The findings will provide an important theoretical basis for the cultivation of thick shell mussel plantigrades.
Mytilus coruscus;plantigrade;microalga;growth;amylase
S968.3
A
10.16535/j.cnki.dlhyxb.2017.04.009
2095-1388(2017)04-0428-06
2017-04-08
国家自然科学基金资助项目(41476131);上海高校水产高峰学科建设项目
顾忠旗(1980—),男,工程师。E-mail:guzhongqi100@126.com
梁箫(1983—),女,博士,讲师。E-mail:x-liang@shou.edu.cn

