重组抗c-Met嵌合抗体的构建及其利用慢病毒快速表达
张龙真, 郭 佳,2, 顾 华, 房健民(.同济大学 生命科学与技术学院,上海 200092; 2.烟台荣昌制药股份有限公司,山东 烟台 264006)
重组抗c-Met嵌合抗体的构建及其利用慢病毒快速表达
张龙真1, 郭 佳1,2, 顾 华1, 房健民1
(1.同济大学 生命科学与技术学院,上海 200092; 2.烟台荣昌制药股份有限公司,山东 烟台 264006)
文章采用兼并引物逆转录PCR(reverse transcription PCR,RT-PCR)从特异性分泌抗人c-Met阻断型单克隆抗体的杂交瘤细胞株3E1D7中扩增抗体重、轻链可变区基因(VH和VL)。通过重叠延伸PCR(splice overlap extension PCR,SOE-PCR)方法分别将鼠源VH与人IgG1的重链恒定区基因Cγ1相连,鼠源VL与人IgG1的轻链恒定区基因Cκ相连获得嵌合抗体重链基因(H)和轻链基因(L)。将嵌合抗体重、轻链基因连接到慢病毒表达载体中,经双酶切和测序鉴定成功构建了慢病毒表达质粒pRRL-CMV-ch3E-H和pRRL-CMV-ch3E-L。磷酸钙法转染293T细胞,表达的嵌合抗体经Protein A Sepharose 4B亲和层析柱纯化,通过SDS-PAGE检测抗体的完整性,ELISA法检测嵌合抗体的特异性抗原结合活性及人源性。感染慢病毒的293T细胞上清纯化后,经SDS-PAGE分析,可见25 kDa嵌合抗体轻链和50 kDa的嵌合抗体重链蛋白。且纯化后的嵌合抗体能够与c-Met抗原特异性结合成功获得重组抗人c-Met嵌合抗体,该抗体减少了鼠源成分,降低了免疫原性,利用慢病毒可以快速获得大量重组抗体蛋白,为该抗体药物的体内外评估奠定基础。
抗人间质表皮转化因子;肝细胞生长因子;嵌合抗体;慢病毒表达载体;生物学活性
人间质表皮转化因子(c-Mesenchymal epithelial transition factor,c-Met)是一类具有自主磷酸化活性的跨膜受体,属于酪氨酸激酶受体超家族成员,也是肝细胞生长因子(hepatocyte growth factor,HGF)已知的唯一受体[1]。其被受体激活后介导细胞信息传递,调控细胞骨架重排,是细胞增殖、分化和运动的重要调节因素。近年来研究发现,c-Met在我国发病率较高的肺癌、肝癌、乳腺癌、胃癌、胰腺癌、脑胶质瘤等肿瘤组织中呈现异常高表达、突变或活性改变[2-5]。且HGF/c-Met信号通路的激活程度与肿瘤侵袭和转移呈正相关[6-7]。目前,c-Met已经成为抗肿瘤药物研究的一个重要靶点。2011年8月,第1个c-Met激酶抑制剂药物克唑替尼胶囊(crizotinib)获得FDA批准用于治疗晚期和ROS1阳性非小细胞肺癌[8]。目前,还没有FDA批准的抗c-Met的中和抗体药物。传统鼠源抗体在人体内会产生人抗鼠抗体反应(human anti-mouse antibody,HAMA),且不能有效地活化补体和Fc受体相关的免疫效应,抑制了其临床应用。而基因工程改造后的人鼠嵌合抗体很好地解决了该问题[9]。本研究在获得阻断HGF与c-Met结合的中和抗体3E1D7基础上,对其进行人源化结构改造。构建、表达了抗人c-Met的人-鼠嵌合抗体ch3E1D7,并对其结构和活性进行分析,为研制靶向c-Met的抗肿瘤抗体药物奠定基础。
1 材料与方法
1.1 质粒、菌株和细胞
HEK293T细胞购自中国科学院上海细胞生物学研究所;克隆载体pCR-Blunt购自Invitrogen公司;感受态大肠杆菌DH5α购自北京全式金生物技术有限公司;分泌抗c-Met中和抗体的杂交瘤细胞株3E1D7、慢病毒表达质粒pRRL-CMV、质粒pcDNA3.1-Cκ(含有人IgG1轻链恒定区基因Cκ)和质粒pcDNA3.1-IgG1(含有人IgG1重链恒定区基因Cγ1)均为本实验室构建并保存。
1.2 主要试剂
各种限制性内切酶、T4DNA连接酶、Taq酶、MMLV逆转录酶及DNA marker均购自大连宝生物工程有限公司;胶回收试剂盒、小量质粒抽提试剂盒购自MN公司;无内毒素质粒提取试剂盒购自Promega公司;TRIzol总RNA提取试剂购自Invitrogen公司;DMEM培养基及胎牛血清购自Gibco公司;商品化人c-Met胞外区重组蛋白购自R&D公司;羊抗人IgG-HRP购自sigma;Protein A Sepharose 4B 购自美国Pharmacia公司。本研究中所用引物由苏州金唯智生物科技有限公司合成,引物名称及序列见表1所列。

表1 引物名称及序列
1.3 亲本基因的扩增及测序
TRIzol法从分泌抗人c-Met的杂交瘤细胞株3E1D7中提取细胞总RNA,并逆转录为cDNA。以合成的cDNA为模板,分别利用引物P1、P2和P3、P4扩增鼠单抗3E1D7的重、轻链可变区VH和VL基因。同时,以质粒pcDNA3.1-IgG1为模板,以P5、P6为引物扩增出人IgG1重链恒定区基因Cγ1。以质粒pcDNA3.1-Cκ为模板,以P7、P8为引物扩增出人IgG1轻链恒定区基因Cκ。扩增条件为:98 ℃预变性3 min;98 ℃变性15 s,56 ℃退火30 s,72 ℃延伸40 s,32个循环;72 ℃再延伸10 min。将上述扩增基因分别连入克隆载体pCR-Blunt中,转化感受态大肠杆菌DH5α,送苏州金唯智生物技术有限公司测序。
1.4 嵌合抗体完整重、轻链基因的扩增
利用P9、P10和P11、P12引物,通过重叠延伸聚合酶链式反应(polymerase chain reaction,PCR)连接鼠源可变区基因与人源恒定区基因,得到完整的嵌合抗体重、轻链基因。再次克隆测序鉴定,分别得到含有嵌合抗体完整重链的质粒pCR-Blunt-ch3E-H和完整轻链的质粒pCR-Blunt-ch3E-L。
1.5 嵌合抗体慢病毒表达质粒的构建
分别将pCR-Blunt-ch3E-H和pCR-Blunt-ch3E-L质粒用AgeⅠ和SalⅠ双酶切,同时用AgeⅠ和SalⅠ酶切慢病毒表达载体pRRL-CMV。用T4连接酶将目的片段和慢病毒表达载体连接,连接产物转化大肠杆菌感受态DH5α,筛选阳性克隆,对获得慢病毒表达质粒pRRL-CMV-ch3E-H和pRRL-CMV-ch3E-L进行酶切及DNA序列测定。
1.6 嵌合抗体在293T细胞中的表达
1.6.1 绿色荧光蛋白的表达
接种处于对数生长期的293T细胞,待细胞生长至50%~60%融合时进行转染。嵌合抗体组将5.4 μg慢病毒包装质粒混合物和5.0 μg慢病毒表达质粒(pRRL-CMV-ch3E-H与pRRL-CMV-ch3E-L各为2.5 μg)用基础培养基重悬至84 μL,利用磷酸钙法转染293T细胞。同时,以含有绿色荧光蛋白的空载体(pRRL-CMV-GFP)作为阳性对照,以未转染质粒的293T细胞作为空白对照。转染24 h后病毒包装成功,换完全DMEM培养基,加入工作浓度的助感染剂polybrene,以利于病毒颗粒进一步感染293T细胞。感染24 h后通过荧光显微镜观察慢病毒感染后的293T细胞绿色荧光蛋白表达情况。
1.6.2 检测H、L链基因mRNA的表达
收集感染后24 h的293T细胞,TRIzol法提取总RNA,将总RNA逆转录为cDNA,PCR法鉴定嵌合抗体在转录水平的表达情况。以P9、P6为上、下引物扩增嵌合抗体重链基因片段,以P11、P8为上、下游引物扩增嵌合抗体轻链基因片段。
1.7 嵌合抗体的纯化
收集293T细胞培养上清液,将其经0.45 μm的滤膜过滤。将滤过的培养液与PBS缓冲液等体积混合,采用Protein A Sepharose 4B亲和层析柱纯化,操作方法按说明书进行。将收集的洗脱液进行10%的SDS-PAGE电泳分析。BCA试剂盒测定蛋白质量浓度,-80 ℃保存备用。
1.8 嵌合抗体ch3E1D7生物学活性检测
ELISA法检测抗体活性。将人c-Met胞外区重组蛋白按照每孔200 ng进行过夜包被,次日封闭后,加入倍比稀释的嵌合抗体ch3E1D7。以亲本鼠源抗体作为对照,37 ℃孵育2 h,PBST洗板3次,每次5 min,再加入HRP标记的羊抗人IgG Fc片段,37 ℃孵育1 h,显色,测定OD450数值。该值为3次平行实验的平均值。
2 结果分析
2.1 表达载体构建鉴定
利用设计引物,扩增单克隆抗体3E1D7的重、轻链可变区VH和VL基因及人IgG1重链恒定区Cγ1基因和轻链恒定区Cκ基因,如图1所示。1.5%琼脂糖凝胶结果显示,鼠源VH和VL基因的PCR产物分别可见约400、370 bp的特异性条带,人源Cγ1和Cκ基因的PCR产物可见约1 000、350 bp的特异性条带,大小均与理论值相符。且鼠源VH和VL基因测序后,通过与Kabat数据库比较,确定无论是在基因序列还是氨基酸序列上均具有唯一性。说明成功扩增克隆抗体3E1D7的VH和VL基因及人IgG1的Cγ1和Cκ基因。通过重叠延伸PCR拼接,分别将鼠VH与人IgG1的Cγ1、VL与人IgG1的Cκ连接起来形成完整的嵌合抗体H链和L链。测序结果表明成功构建了嵌合抗体H链基因和L链基因,H链基因大小为1 410 bp,轻链大小为723 bp。通过AgeⅠ和SalⅠ酶切H、L链和慢病毒表达载体pRRL-CMV,获得慢病毒表达质粒p RRL-CMV-ch3E-H和p RRL-CMV-ch3E-L,酶切及PCR鉴定结果如图1c所示。酶切后条带大小与预期条带相符,表明慢病毒表达载体构建成功。图1中,M表示DNA marker。
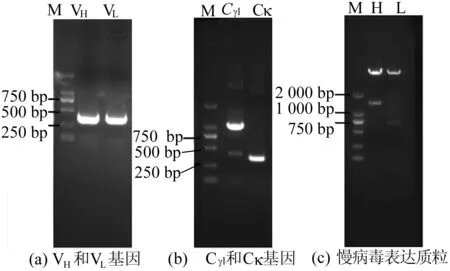
图1 PCR产物的琼脂糖凝胶电泳
2.2 感染细胞的荧光显微镜观察
感染后24 h,荧光显微镜观察发现,嵌合抗体组及阳性对照组细胞均有绿色荧光蛋白。未转染质粒的空白对照293T细胞则无荧光表达,如图2所示,图2中,荧光显微镜的放大倍数100倍。初步证明慢病毒表达体系快速产生了嵌合抗体蛋白。
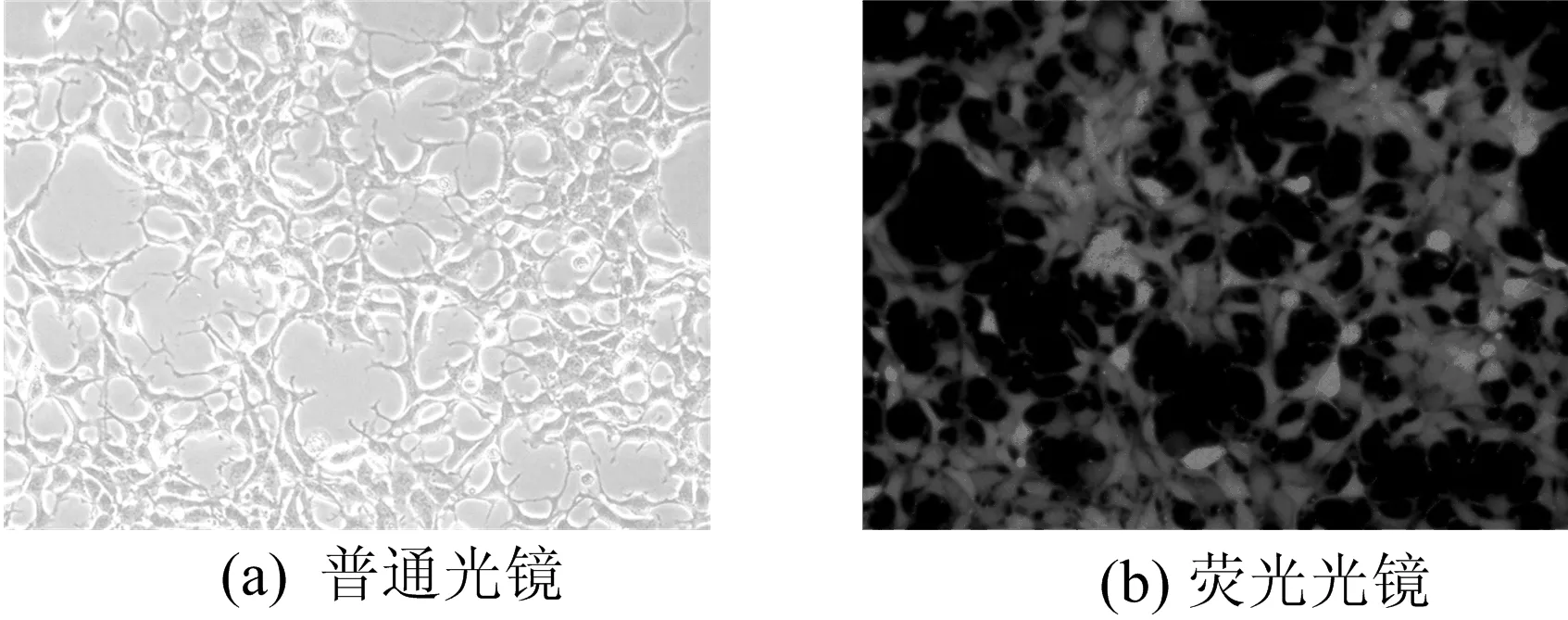
图2 嵌合抗体慢病毒感染293T细胞
2.3 转录水平鉴定嵌合抗体重、轻链基因的表达
1.5%琼脂糖凝胶电泳结果显示,嵌合抗体组293T细胞中有大小约1 400 bp的嵌合抗体重链基因片段和大小约700 bp的嵌合抗体轻链基因片段,如图3所示。测序结果表明,目的条带为编码嵌合抗体重链、轻链的基因序列。
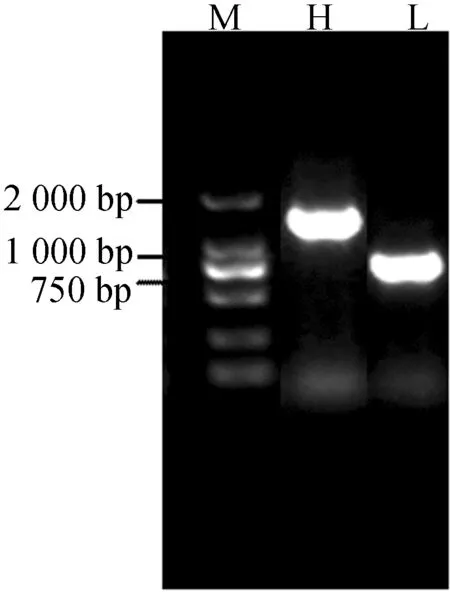
图3 RT-PCR鉴定c-Met嵌合抗体重、轻链的表达
2.4 SDS-PAGE分析
通过Protein A纯化得到的c-Met嵌合抗体经10%SDS-PAGE电泳分析,结果显示蛋白纯化效果较好,无明显杂带。可见分子质量分别约为25 kDa和50 kDa的蛋白条带,与理论值一致,表明纯化得到的蛋白是完整的嵌合抗体,如图4所示。图4中,M表示蛋白marker;lane1表示细胞培养原液;lane2表示滤过液;lane3表示纯化后的嵌合抗体ch3E1D7。
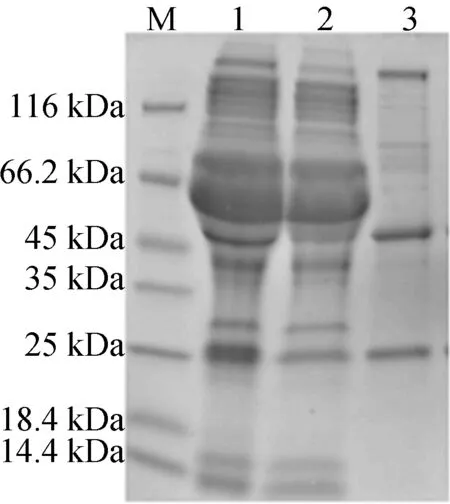
图4 嵌合抗体ch3E1D7的还原性SDS-PAGE检测
2.5 嵌合抗体生物学活性检测
用商品化人c-Met胞外区重组蛋白包被酶标板,用HRP标记的羊抗人IgG为二抗,进行ELISA检测。加入纯化后的嵌合抗体呈强阳性反应,且随着质量浓度的增加,信号逐渐增强。而加入鼠源亲本抗体则呈阴性反应。表明嵌合抗体可与人c-Met抗原特异性结合,同时具有人抗体的恒定区,如图5所示。
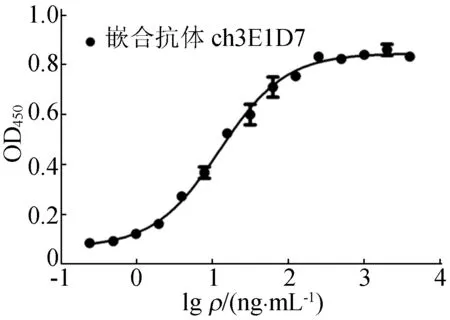
图5 ELISA检测嵌合抗体与人HGFR的结合活性
3 讨 论
c-Met是由c-Met原癌基因编码的蛋白产物,为HGF的细胞膜受体。HGF与c-Met结合使其构象发生改变,自身磷酸化激酶区域内的Tyrl235和Tyrl234,继而导致位于C末端的Tyrl349和Tyrl356磷酸化,启动接头蛋白停泊位点,导致多种底物蛋白的酪氨酸磷酸化,包括生长因子受体结合蛋白(growth factor receptor-bound protein 2,Grb2)及其相关蛋白(Grb2-associated binder,Gab1)、粘着斑激酶(focal adhesion kinase,FAK)、丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路和磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)信号通路[10-11]。在肿瘤细胞中,c-Met持续性高表达,使得该信号通路处于持续活化状态,促进肿瘤细胞的增殖、侵袭和转移。
一旦肿瘤细胞中异常活化的HGF/c-Met信号转导被阻断,肿瘤细胞就会出现细胞增殖减缓、血管生成抑制、侵袭能力下降等一系列变化[12]。文献[13]证实c-Met激酶抑制剂明显抑制人肝癌细胞增殖,推测抑制c-Met激酶活性可能是抗肝细胞肝癌药物研究与开发的合理策略。文献[14]证实阻断HGF与c-Met结合的单克隆抗体onartuzumab(OA-5D5)明显抑制人神经胶质瘤U87-MG裸鼠移植瘤的生长增殖,裸鼠胶质瘤细胞凋亡率、微血管密集度均下降。因此筛选阻断HGF与c-Met结合的中和抗体尤为重要。
本研究已获得阻断HGF与c-Met结合的中和抗体3E1D7,但是为了克服鼠源单抗治疗人体疾病所引起的HAHA反应,需要对鼠源单抗进行人源化结构改造。多项研究表明,人鼠嵌合抗体在保留鼠源单抗亲和力和特异性的同时,大大降低了单抗的免疫原性,具有极大的成药潜力[15-17]。目前,治疗B淋巴细胞非霍奇金淋巴瘤的利妥昔单抗、抗风湿药物英利昔单抗均为人鼠嵌合抗体。本研究结果表明,人鼠嵌合抗体在保留鼠源亲本抗体活性的基础上,减少了鼠源成分,降低了免疫原性,为研制安全、有效性的抗c-Met抗体药物奠定基础。
[1] GHERARDI E,BIRCHMEIER W,BIRCHMEIER C,et al.Targeting MET in cancer:rationale and progress[J].Nat Rev Cancer,2012,12(2):89-103.
[2] SPIQEL D R,ERVIN T J,RAMLAU R A,et al.Randomized phase Ⅱ trial of onartuzumab in combination with erlotinib in patients with advanced non-small-cell lung cancer[J].J Clin Oncol,2013,31(32):4105-4114.
[3] GOYAL L,MUZUMDAR M D,ZHU A X.Targeting the HGF/c-MET pathway in hepatocellular carcinoma[J].Clin Cancer Res,2013,19(9):2310-2318.
[4] XIE Q,BRADLEY R,KANG L,et al.Hepatocyte growth factor(HGF) autocrine activation predicts sensitivity to MET inhibition in glioblastoma[J].Proc Natl AcadSci USA,2012,109(2):570-575.
[5] SENNINO B,ISHIQURO-OONUMA T,WEI Y,et al.Suppression of tumor invasion and metastasis by concurrent inhibition of c-Met and VEGF signaling in pancreatic neuroendocrine tumors[J].Cancer Discov,2012,2(3):270-287.
[6] GAO J,FENG X,INAGAKI Y,et al.Des-γ-carboxy prothrombin and c-Met were concurrently and extensively expressed in hepatocellular carcinoma and associated with tumor recurrence[J].Biosci Trends,2012,6(4):153-159.
[7] BASILICO C,ARNESANO A,GALLUZZO M,et al.A high affinity hepatocyte growth factor-binding site in the immunoglobulin-like region of Met[J].J Biol Chem,2008,283(30):21267-21277.
[8] SHAW A T,OU S-H I,BANG Y J,et al.Crizotinib in ROS1-rearranged non-small-cell lung cancer[J].N Engl J Med,2014,371(21):1963-1971.
[9] 杨光,冉宇靓,孙立新,等.抗人p185erbB2嵌合抗体在CHO细胞中高效表达及其活性分析[J].生物化学与生物物理学报,2001,3(1):87-92.
[10] VENEPALLI N K,GOFF L.Targeting the HGF-cMET axis in hepatocellular carcinoma[J].International Journa of Hepatology,2013,2013:341636-11.
[11] GAO J J,YOSHINORI I,SONG P.et al.Targeting c-Met as a promising strategy for the treatment of hepatocellular Carcinoma[J].Pharmacol Res,2012,65(1):23-30.
[12] ORGAN S L,TSAO M S.An overview of the c-MET signaling pathway[J].Ther Adv Med Oncol,2011,3(S1): 7-19.
[13] 高建军.肝癌治疗潜在靶点C-Met及肿瘤靶向治疗效果及机制研究[D].济南:山东大学,2012.
[14] MARTENS T,SCHMIDT N O,ECKERICH C,et al.A novel one-armed anti-c-Met antibody inhibits glioblastoma growth in vivo [J].Clin Cancer Res,2006,12(20 Pt 1):6144-6152.
[15] KONDRO W,SIBBALD B.Patient demand and politics push Herceptin forward[J].Canadian Medical Association Journal,2005,173(4):347-348.
[16] 郭佳,尹衍新,蒋明,等.人C-Met胞外区慢病毒穿梭载体构建及在293T细胞中的表达[J].生物医学工程学杂志,2015,32(2):401-404.
[17] 陈永华,郭佳,尹衍新,等.抗人肝细胞生长因子受体单链抗体慢病毒载体的构建和表达[J].细胞与分子免疫学杂志,2014,30(9):960-963.
(责任编辑 闫杏丽)
Construction of chimeric anti-c-Met antibody and its rapid expression using lentiviral vector
ZHANG Longzhen1, GUO Jia1,2, GU Hua1, FANG Jianmin1
(1.School of Life Sciences and Technology, Tongji University, Shanghai 200092, China; 2.Yantai Rongchang Pharmaceutical Co., Ltd., Yantai 264006, China)
The variable region of the heavy chain(VH) and light chain(VL) genes were amplified directly from the cDNA of 3E1D7 hybridoma cells which secreted mouse anti-human c-Mesenchymal epithelial transition factor(c-Met) antibody using the reverse transcription PCR(RT-PCR). Full length chimeric IgG was assembled by fusing the VHand VLwith the constant region of human heavy and light chains(IgG1 Cγ1 and Cκ) respectively using the splice overlap extension PCR(SOE-PCR). The constructed chimeric antibody heavy chain(H) and light chain(L) were inserted into the lentiviral transfer plasmid pRRL-CMV respectively, which were identified by the restriction enzyme digestion and sequencing. The lentiviral expression vectors were transfected into 293T cells with lentiviral packaging plasmid and the transfected cell pool was used to produce the recombinant antibody. The expressed chimeric antibody was purified by Protein A Sepharose 4B affinity chromatography, then identified by reduced SDS-PAGE and its biological affinity was determined by ELISA. Restriction enzyme digestion analysis proved that recombinant plasmid pRRL-CMV-ch3E-H and pRRL-CMV-ch3E-L were constructed correctly. Light and heavy chains of the chimeric antibody, with molecular masses of about 25 and 50 kDa, were observed on reduced 10% SDS-PAGE. ELISA results showed the purified chimeric antibody could bind to c-Met specifically. Chimeric anti-c-Met antibody was successfully prepared, which was expected to be less immunogenic due to the decrease of components from mouse origin. It laid a foundation for further study of anti-c-Met therapeutic antibody.
anti-c-Mesenchymal epithelial transition factor(anti-c-Met); hepatocyte growth factor(HGF); chimeric antibody; lentiviral vector; biological activity
2016-03-15;
2017-03-24
国家自然科学基金青年科学基金资助项目(81402399);中央高校基本科研业务费专项资金资助项目(2000219121)和江苏省自然科学基金资助项目(BK2012162)
张龙真(1988-),女,安徽阜阳人,同济大学硕士生; 房健民(1962-),男,浙江宁波人,博士,同济大学教授,博士生导师.
10.3969/j.issn.1003-5060.2017.06.022
Q786
A
1003-5060(2017)06-0835-05

