曼氏迭宫绦虫中亮氨酸氨基肽酶基因的生物信息学分析和转录水平检测
李奕基 符瑞佳 周晓君 尹飞飞 梁鹏 吕刚 梁培
曼氏迭宫绦虫中亮氨酸氨基肽酶基因的生物信息学分析和转录水平检测
李奕基1符瑞佳1周晓君2尹飞飞1梁鹏1吕刚1梁培1
目的 检测曼氏迭宫绦虫的3个亮氨酸氨基肽酶亚类(leucine aminopeptidases of Spirometra mansoni,SmLAPs)基因在虫体不同发育阶段的转录水平,为进一步病原诊断研究奠定基础。方法运用生物信息学相关软件对3个亮氨酸氨基肽酶亚类编码蛋白的氨基酸序列的功能区域、免疫学特征、信号肽和跨膜区预测分析。应用Real time PCR方法检测SmLAPs在曼氏迭宫绦虫的成节、孕节和裂头蚴阶段的转录水平。结果对SmLAPs编码氨基酸序列的保守区域进行比对,SmLAPa与SmLAPb、SmLAPc的氨基酸序列一致性均为38%,SmLAPb和SmLAPc的一致性也只有44%。多功能位点分析发现,SmLAPs均含有底物结合位点、锌离子结合位点和多肽结合位点。在B细胞线性表位预测结果显示,SmLAPa有13个、SmLAPb有14个、SmLAPc有13个。T细胞表位预测中,SmLAPa有12个、SmLAPb有13个、SmLAPc有14个。3个SmLAPs亚类序列中均含有一个强烈的信号肽,并且均没有跨膜区域。在虫体各个发育阶段的转录水平检测中,在成节阶段,SmLAPb的转录水平是SmLAPa的1.34倍,SmLAPc的转录水平是SmLAPa的46.53倍。在孕节阶段,SmLAPb的转录水平是SmLAPa的1.96倍,SmLAPc的转录水平是SmLAPa的56.89倍。在裂头蚴阶段,只有SmLAPc有转录,没有检测到SmLAPa和SmLAPb的转录。结论在3个SmLAPs亚类基因中,SmLAPc是裂头蚴病更有价值的免疫诊断分子。
曼氏迭宫绦虫;亮氨酸氨基肽酶亚类;生物信息特征;转录水平;免疫诊断分子
曼氏迭宫绦虫属于影响人体中枢神经系统的寄生虫[1],也是一种重要的食源性人畜共患病寄生虫。曼氏迭宫绦虫(Spirometra mansoni,Sm)成虫主要寄生在猫科动物,偶然寄生于人体肠道,但中期裂头蚴也可寄生于人体,寄生部位多,引起曼氏裂头蚴病更为严重,危害远大于成虫。感染裂头蚴最主要的途径是食用含有裂头蚴的生的或是半生的青蛙肉或蛇肉和饮用含有原尾蚴的剑水蚤的水。裂头蚴病流行区域非常广泛,在亚洲、非洲、美洲及欧洲都有发现[2]。据不完全统计,全球有1 400多例病例报道,我国占了上千例[3]。虽然全球病例不多,但是发病率呈逐年上升的趋势,并且裂头蚴寄生部位多数在脑部和眼部[4]。裂头蚴寄生于脑部能够导致抽搐昏迷甚至死亡;眼裂头蚴则能够影响视力甚至导致失明。此外,裂头蚴还可以寄生于内脏组织和皮下组织,且能够在体内移行。目前临床上针对裂头蚴病的诊断方法是手术取活组织进行确诊,但是手术不仅风险大,而且适用范围有限,不适用于内脏和深部脑组织的裂头蚴的诊断。目前,临床中使用最为广泛的方法是免疫诊断,不仅便于操作,且价格实惠。免疫诊断的特异性和灵敏度主要是依靠特异性的诊断分子。
亮氨酸氨基肽酶(leucine aminopeptidase,LAP)是一类具有HEXXH(X)(18)E 锌离子结合的活性中心的M17金属蛋白酶,其能够定位在细胞胞液、微粒体内和细胞膜上[5]。LAP是一种细胞表面的亮氨酸氨基肽酶,能够催化蛋白或是肽类底物的末端亮氨酸残基的水解。疟原虫的LAP可调节细胞内氨基酸代谢,从而对寄生虫的生长和发育发挥重要作用,是一个抗疟疾药物的潜在靶标分子[6]。在曼氏迭宫绦虫的研究中,对一个亮氨酸氨基肽酶亚类(leucine aminopeptidase C of Spirometra mansoni,SmLAPc)进行了相关的生物信息学分析、原核表达和蛋白纯化,证实了其可能是一个潜在的免疫诊断分子[7]。本研究对来源于曼氏迭宫绦虫的3个LAP[SmLAPa(leucine aminopeptidase A of Spirometra mansoni)、SmLAPb(leucine aminopeptidase B of Spirometra mansoni)、SmLAPc]进行生物信息学比对分析,并检测在虫体各个发育阶段的转录水平,为进一开展曼氏裂头蚴病免疫诊断研究提供理论依据。
1 材料与方法
1.1 材料
亮氨酸氨基肽酶核苷酸序列从吕刚等[8]构建的曼氏迭宫绦虫成虫基因组文库中获取。动物组织总RNA提取试剂盒(DP431)、FastQuant cDNA第一链合成试剂盒(KR103)购自天根生化科技(北京)有限公司;SYBR Premix Ex TaqTM II kit购自宝生物工程(大连)有限公司;PCR八连管购自Axygen公司;电动组织破碎仪(型号:9001272,QIAGEN Hilden公司,德国);Real time PCR仪器(型号:stratagene Mx3005P instrument,Agilent Technologies公司,美国);NanoDrop 2000c(Thermo Scientific,美国)。
1.2 方法
1.2.1 生物信息学分析
将从基因组文库调取的3个SmLAPs亚类序列利用在线软件https://blast.ncbi.nlm.nih.gov/Blast.cgi进行BLASTx比对分析、保守功能域预测(CDSearch)和多序列比对(multiple alignment)。利用蛋白专家分析工具http://www.expasy.org/中相关在线软件进行信号肽分析、跨膜结构预测;利用http://www.cbs.dtu.dk/services/进行 B 细胞线性表位和T细胞表位预测分析。
1.2.2 曼氏迭宫绦虫成节、孕节和裂头蚴总RNA的提取
①将枪头、EP管、电动组织破碎仪的转头等浸泡于0.1%DEPC处理的去离子水中,浸泡过夜,121℃,30 min高压灭活,烘干备用。
②已加入样品保护剂的组织,分别置于冰上利用组织破碎仪裂解15~30 min左右,超声破碎1 min停2 min,次数视样品而定,超声结束后室温放置5 min,使其充分裂解。
③按照动物组织总蛋白RNA提取试剂盒说明进行操作。
④将得到的总RNA利用NanoDrop 2000c进行浓度测定和琼脂糖电泳验证质量。
1.2.3 曼氏迭宫绦虫各个发育阶段cDNA的合成
①将上述提取的绦虫的成节、孕节和裂头蚴的总RNA中的基因组DNA去除,按照(5×gDNA Buffer 2 μL;Total RNA 0.5 μg;RNAase-Free ddH2O 补足到10 μL)配制混合液A,彻底混匀。瞬时离心,并置于42℃孵育3 min,然后置于冰上。
②反转录反应体系配制混合液按照(10×Fast RT Buffer 2 μL;RT Enzyme Mix 1 μL;FQ-RT Primer Mix 2 μL;RNase-Free ddH2O 补足到 10 μL)进行配制,将配制好的Mix加到gDNA去除步骤的反应液A中,充分混匀。
③42℃孵育15 min;95℃孵育3 min处理之后放于冰上,得到的cDNA可用于后续实验,-80℃保存。
1.2.4 定量PCR引物
SmLAPs定量PCR检测引物如表1所示,引物是通过DNA club、Primer Premier相关软件针对3个亚类序列中的差异区域进行设计。
1.2.5 Real-time PCR检测
将得到的成节、孕节和裂头蚴阶段的cDNA作为模板,以相应基因的引物进行扩增。同时以不加cDNA模板作为空白对照。反应体系如下:SYBR Premix Ex Taq(2×)10.0 μL;Forward primer 0.2 μL(10 pmol/L);Reverse primer 0.2 μL(10 pmol/L);cDNA 2.0 μL;ddH2O 7.6 μL;
将反应混合物在Agilent Technologies stratagene Mx3005P仪器上自动运行。每个反应均设3个复孔,并重复3次取平均值。记录各个阶段的Ct值,用 2-ΔΔCt法计算 SmLAPa、SmLAPb、SmLAPc在成节、孕节和裂头蚴发育阶段的转录水平的差异[9]。
2 结果
2.1 SmLAPs亚类的序列比对和免疫特征分析
通过对SmLAPs编码的氨基酸序列保守区域进行比对,SmLAPa与SmLAPb、SmLAPc的氨基酸序列一致性均为38%,SmLAPb与SmLAPc的一致性也只有44%。此外,进行多功能位点分析发现,3种SmLAPb亚类均含有底物结合位点、锌离子结合位点和多肽结合位点。在B细胞线性表位预测中,Sm-LAPa和SmLAPc有13个B细胞线性表位,而SmLAPb有14个B细胞线性表位。SmLAPa与SmLAPb有8个B细胞线性表位重合,与SmLAPc有9个B细胞线性表位重合;SmLAPb与SmLAPc有13个B细胞线性表位重合。T细胞表位预测中,SmLAPa有12个T细胞表位,SmLAPb有13个T细胞表位,SmLAPc有14个T细胞表位,然而3个SmLAPs的功能区域中只有2个完全重叠的T细胞表位,这2个表位也正好是SmLAPa和SmLAPc的2个重合表位区域,而SmLAPa和SmLAPb只有4个表位重合。

表1 SmLAPs的定量检测引物序列Table 1 Primer sequences of SmLAPs for real time PCR
2.2 SmLAPs亚类进行信号肽预测和跨膜结构分析
3个SmLAPs亚类均具有一个强烈的信号肽,SmLAPa位于第18 amino acid(aa)、SmLAPb位于第17aa的位置、SmLAPc位于第21 aa的位置(图2)。这提示了这3个基因在真核系统中表达均是需要后期蛋白的修饰之后才能发挥作用的。如后续开展研究需要进行原核表达,则需要人为去除信号肽方可进行基因的克隆。通过图3结果可以得知,这3个亚类均没有跨膜区域。
2.3 不同在虫体发育阶段的转录水平检测
转录水平检测结果显示(图4),在孕节阶段,SmLAPb的转录水平是SmLAPa转录水平的1.96倍,SmLAPc转录水平是SmLAPa转录水平的56.89倍。成节阶段的SmLAPb的转录水平是SmLAPa转录水平的1.34倍,SmLAPc的转录水平是SmLAPa转录水平的46.53倍。在孕节和成节中,SmLAPc均有转录,并且转录水平均高于SmLAPa和SmLAPb的转录水平。在裂头蚴阶段,只有SmLAPc有转录,却没有检测到SmLAPa和SmLAPb的转录。
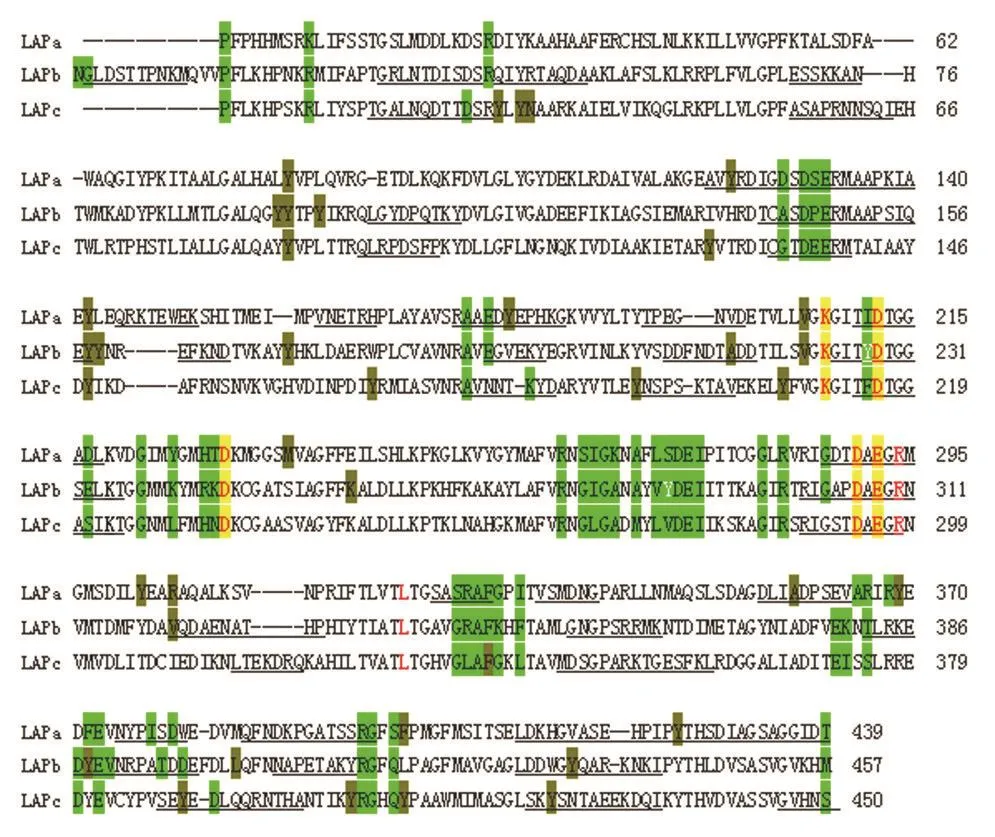
图1 曼氏迭宫绦虫SmLAP亚类氨基酸序列比对Figure 1 Aligment of SmLAPs amino acid sequences
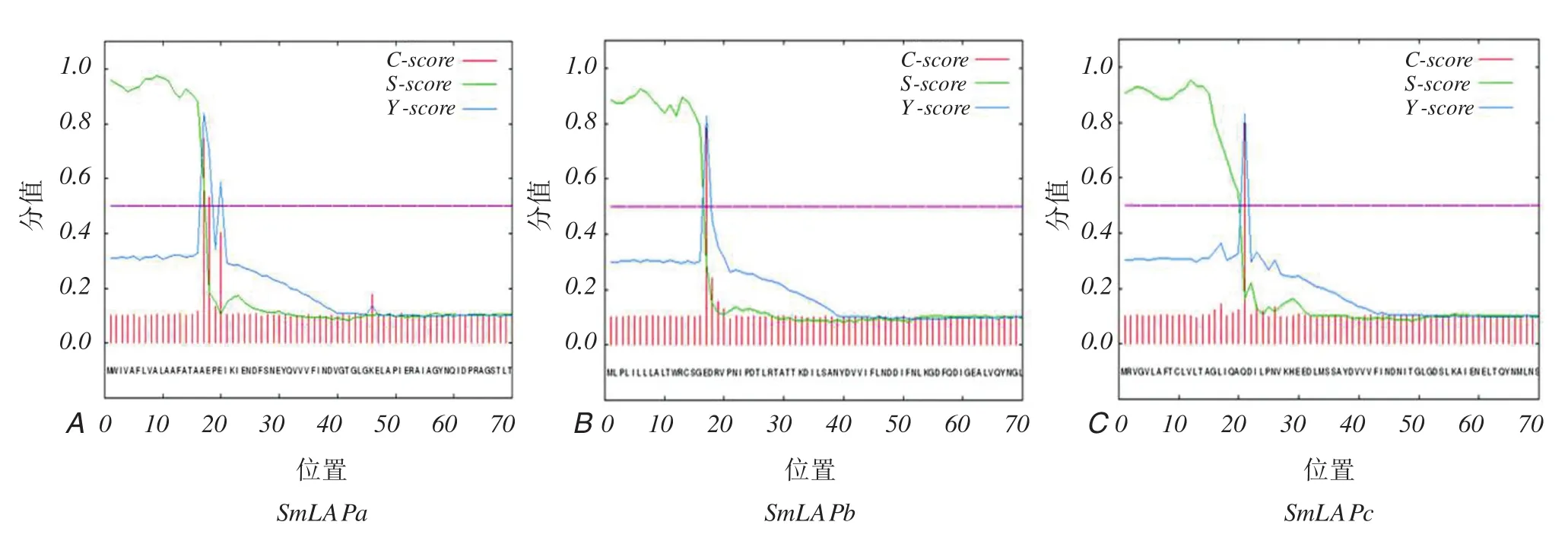
图2 信号肽预测Figure 2 Signal peptide pepdiction of SmLAPs sequences
3 讨论
LAP是一类金属肽酶,在调节细胞分解代谢和合成代谢平衡中发挥非常重要的作用[10]。我们从曼氏迭宫绦虫成虫文库中成功获取了3个SmLAPs的亚类,通过多序列比对,显示3个基因编码的氨基酸序列一致性比较低,仅有38%和44%。但是根据编码蛋白的氨基酸序列中保守位点分析,可以得知功能位点高度保守,尤其是底物结合位点和锌离子结合位点,只有在多肽结合位点存在少数氨基酸差异。虽然在B细胞表位分析中,3个基因的氨基酸序列中的B细胞表位数量相差较小,并且基本都重合,但是T细胞表位分布存在着较大的差异。杨祖婷等[7]研究发现,SmLAPc与人类的同源性基因相比较,B细胞表位的氨基酸存在较大的差异。此外,通过信号肽预测分析,得知3个基因均有强烈的信号肽。在真核生物中,信号肽具有蛋白质定向转运功能,能使蛋白分泌到胞外,提高其分泌率。这一预测结果提示这3个蛋白均具有胞外分泌的可能。分泌蛋白作为免疫诊断抗原,其特异性和敏感性均优于粗抗原[11]。通过酶联免疫法(enzyme-linked immunosorbent assay,ELISA)检测研究,发现日本血吸虫的亮氨酸氨基肽酶具有较好的敏感性和特异性,在血吸虫诊断中具有潜在的免疫诊断价值[12]。综上所述,SmLAPs在诊断方面有一定的研究价值。此外,根据Real time PCR定量检测结果,3个基因在成节和孕节阶段均有表达,且SmLAPc亚类的转录水平最高。在裂头蚴阶段,没有检测SmLAPa和SmLAPb亚类的转录,只检测到SmLAPc的转录表达。通过这个结果更充分的说明,SmLAPc更有可能开发成检测靶标分子。

图3 跨膜螺旋预测Figure 3 Transmembrane helical prediction of SmLAPs sequences

图4 SmLAPs转录水平检测Figure 4 Transcriptional level detection of SmLAPs
此外,许多研究发现病原生物主要是依赖肽酶完成许多生理过程[13]。在华支睾吸虫的研究中,发现亮氨酸氨基肽酶主要在虫体的肠道表皮细胞表达,揭示其可能参与了寄生虫的营养吸收和蛋白质代谢过程[14]。在锥虫的研究中发现,亮氨酸氨基肽酶是一个330 kDa的同源四聚体的金属氨基肽酶,在虫体营养供应中发挥重要作用[15]。那么,SmLAPs在曼氏迭宫绦虫不同发育阶段的表达存在差异,这可能是由于SmLAPs在不同的发育时期,发挥的作用不同,这进一步提示了SmLAPc可能还是一个有效防控裂头蚴病的药物靶点。
[1]侯智,李维,安宁,等.神经系统曼氏迭宫绦虫裂头蚴病2例[J].中国临床神经外科杂志,2017,22(2):122.
[2]Anantaphruti MT,Nawa Y,Vanvanitchai Y.Human sparganosis in Thailand:an overview[J].Acta Trop,2011,118(3):171-176.
[3]Cui J,Li N,Wang ZQ,et al.Serodiagnosis of experimental sparganum infections of mice and human sparganosis by ELISA using ES antigens of Spirometra mansoni spargana[J].Parasitol Res,2011,108(6):1551-1556.
[4]Lo Presti A,Aguirre DT,De Andrés P,et al.Cerebral sparganosis:case report and review of the European cases[J].Acta Neurochir(Wien),2015,157(8):1339-1343.
[5]纪晓霞,陈林.亮氨酸氨基肽酶的基础研究及临床应用[J].海峡药学,2011,23(12):175-177.
[6]Chaudhary M,Singh V,Anvikar AR,et al.Screening and in vitro evaluation of potential Plasmodium falciparum leucyl aminopeptidase inhibitors[J].Curr Comput Aided Drug Des,2016,12(4):282-293.
[7]杨祖婷,陈立强,符瑞佳,等.曼氏迭宫绦虫亮氨酸氨基肽酶(SmLAP)的生物信息学分析、克隆及表达[J].中国病原生物学杂志,2016,11(11):1004-1009.
[8]李奕基,陈新新,符瑞佳,等.曼氏迭宫绦虫钙/钙调素依赖蛋白激酶I(SmCaMK I)基因的生物信息学分析与表达鉴定[J].中国人兽共患病学报,2016,32(12):1044-1050,1057.
[9]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[10]Ziemska J,Solecka J.Tyrosine kinase,aurora kinase and leucine aminopeptidase as attractive drug targets in anticancer therapy-characterisation of their inhibitors[J].Rocz Panstw Zakl Hig,2016,67(4):329-342.
[11]Liang P,He L,Xu Y,et al.Identification,immunolocalization,and characterization analyses of an exopeptidase of papain superfamily,(cathepsin C)from Clonorchis sinensis[J].Parasitol Res,2014,113(10):3621-3629.
[12]Faustina HL,Luo QL,Zhong ZR,et al.Evaluation of recombinant SjLAP and SjFBPA in detecting antibodies to Schistosoma japonicum[J].Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi,2011,29(5):339-347.
[13]Helgren TR,Chen C,Wangtrakuldee P,et al.Rickettsia prowazekii methionine aminopeptidase as a promising target for the development of antibacterial agents[J].Bioorg Med Chem,2017,25(3):813-824.
[14]Kang JM,Ju HL,Ju JW,et al.Comparative biochemical and functional properties of two leucine aminopeptidases of Clonorchis sinensis[J].Mol Biochem Parasitol,2012,182(1-2):17-26.
[15]Cadavid-Restrepo G,Gastardelo TS,Faudry E,et al.The major leucyl aminopeptidase of Trypanosoma cruzi(LAPTc) assembles into a homohexamer and belongs to the M17 family of metallopeptidases[J].BMC Biochem,2011,12:46.
Bioinformatics analysis,transcriptional level detection of leucine aminopeptidases from Spirometra mansoni
LI Yiji1,FU Ruijia1,ZHOU Xiaojun2,YIN Feifei1,LIANG Peng1,LV Gang1,LIANG Pei1
(1.School of Tropical Medicine and Laboratory Medicine,Hainan Medical University,Haikou,Hainan,China,571199;2.Clinical Laboratory,Hainan Province People’s Hospital,Haikou,Hainan,China,570311)
Objective Todetecttranscriptionlevelsof3leucineaminopeptidasesfrom Spirometra mansoni in different developmental stages of the parasite,which lays a foundation for pathogenic diagnosis of further study. Methods Using bioinformatics software,the functional region,immunological characteristics,signal peptide and transmembrane domain of SmLAPs were analyzed.The transcriptional levels of SmLAPs at mature proglottid,gravid proglottid and sparganum stages were detected. Results In the alignment of conserved domains of SmLAPs,the amino acid sequence identities of SmLAPa were 38%compared with SmLAPb and SmLAPc.The identity between SmLAPb and SmLAPc was 44%.Multi-functional sites analysis found that SmLAPs contained substrate binding sites,zinc ion binding sites and peptide binding sites.In the prediction of B cell epitopes,SmLAPa and SmLAPc had 13 B cell epitopes,while SmLAPb had 14B cell epitopes.The T cell epitope prediction showed that SmLAPa,SmLAPb and SmLAPc contained 12,13 and 14 T cell epitopes,respectively.3 SmLAPs had strong signal peptides.In addition,there were no transmembrane regions in the amino acid sequences.The transcriptional level of SmLAPb was 1.34 times and that of SmLAPc was about 46.53 times compared with that of SmLAPb at the mature proglottid.In the gravid proglottid stages,the results of SmLAPb and SmLAPc were 1.96 times and 46.53 times respectively,while SmLAPa was at the background value.Interestingly,at the sparganum stage,SmLAPc transcription expression was detected,whereas the transcriptional levels of SmLAPa and SmLAPb were low. Conclusions SmLAPc might be a valuable diagnostic molecule for Spirometra mansoni infection.
Spirometra mansoni;SmLAPs;Bioinformatics characteristics;Transcriptional level;Diagnostic molecule
国家自然科学基金课题(81560332);海南省自然科学基金课题(814298)
1.海南医学院热带医学与检验医学院,海南,海口571199
2.海南省人民医院检验科,海南,海口570311
梁培,E-mail:liangpeilp2012@163.com

