牦牛CCND2基因的克隆及其在不同发情时期卵巢中的表达
石仙,熊显荣,兰道亮,陈伟明,胡嘉嘉,蔡雯祎,李键
牦牛CCND2基因的克隆及其在不同发情时期卵巢中的表达
石仙1,熊显荣1,兰道亮2,陈伟明1,胡嘉嘉1,蔡雯祎1,李键1
(1西南民族大学生命科学与技术学院,成都610041;2西南民族大学青藏高原研究院,成都610041)
【目的】研究牦牛细胞周期蛋白D2(Cyclin D2, CCND2)基因序列特征及其在牦牛不同发情时期卵巢中的表达。【方法】以牦牛为研究对象,提取卵巢的总RNA进行反转录为第一链cDNA,根据GenBank中黄牛CCND2的mRNA序列(GenBank登录号:NM_001076372.1),使用Primer 5.0 软件设计引物。应用PCR方法对CCND2基因扩增克隆,并测序获得CCND2基因完整的CDS区序列及部分5′端和3′端UTR区。使用Protparam、SOPMA、SWISS-MODEL及SMART分别对牦牛CCND2蛋白的理化性质、二级结构、三级结构及结构域进行预测分析,并进行同源性分析和系统进化树构建,利用半定量PCR方法对CCND2基因在牦牛各组织中的表达进行检测;同时采用实时荧光定量PCR技术分析CCND2基因在牦牛不同发情时期(卵泡期、红体期、黄体期)卵巢中的相对表达量。【结果】克隆获得牦牛CCND2基因序列为909 bp,其中包含可编码289个氨基酸残基的长为870 bp的CDS区。与黄牛相比,牦牛CCND2的CDS区存在5个碱基突变,导致其中一个氨基酸改变。牦牛CCND2基因CDs序列与野牦牛、黄牛、印度水牛、绵羊、野猪、马、家犬、猫、人类的进行比对同源性分别是99.54%、99.31%、99.31%、98.16%、94.81%、90.46%、90.80%、91.49%、88.62%,物种之间同源性较高,与进化树分析显示的亲缘关系远近一致,表明CCND2基因编码区在进化中较为保守。对CCND2蛋白预测分析知牦牛CCND2基因编码蛋白的分子式为C1445H2315N377O440S18,相对分子质量约为32.59kD,理论等电点为4.75,总平均亲水性为-0.107,不稳定指数为44.56,属亲水不稳定的酸性蛋白,该蛋白无跨膜区和信号肽;二级结构主要包含α-螺旋和无规卷曲,且与三级结构分析结果一致。蛋白含位于第26—152位氨基酸处的Cyclin_N和位于第154—257位氨基酸处的Cyclin_C两个结构域。CCND2 基因在牦牛各组织中均有表达,其中在胃、卵巢和脑中表达相对较高;qRT-PCR结果显示在牦牛不同发情时期卵巢中CCND2 mRNA均有表达,且卵泡期卵巢中的表达水平最高(<0.01),在红体期和黄体期卵巢中表达水平无差异(>0.05)。【结论】成功获得了牦牛CCND2基因的CDS区全长序列和组织表达谱,对其进行生物信息分析及蛋白功能结构分析为该基因在牦牛繁殖调控中的进一步研究提供理论依据;在牦牛不同发情时期卵巢中CCND2 mRNA表达水平存在差异,可能与卵泡发育过程中颗粒细胞增殖分化、卵泡发生波及卵巢内分泌有关,为进一步研究牦牛卵巢发育机制及改善牦牛繁殖效率提供了基础资料。
牦牛;CCND2;克隆;发情周期;卵巢;表达
0 引言
【研究意义】牦牛()是中国青藏高原及其周围海拔3 000 m以上高原地区的重要牛种,能够很好地适应高寒、缺氧的生态环境,素有“高原之舟”之称。牦牛为当地居民提供肉、奶、毛、皮、役力、燃料等材料,是当地牧民赖以生存的生活生产资料。然而牦牛性成熟晚,繁殖和生长性能低下,牦牛产业发展还很有限。虽然牦牛育种改良取得一定的进展,但总体仍十分落后[1]。细胞周期蛋白D(Cyclin Ds,CCNDs)在细胞周期进程中起着重要的作用,是G1期转入S期的限速因子,主要介导细胞外的信号分子与细胞有丝分裂周期之间的传导,通过与细胞周期蛋白依赖性激酶4/6(cyclin-dependent kinase,CDK4/6)结合并激活其活性复合物磷酸化下游的视网膜母细胞瘤蛋白(retinoblastoma protein,RB),进而释放转录因子E2F,启动细胞的DNA复制[2-4]。CCNDs家族的首次分离是由MOTOKURA等在甲状旁腺癌的研究中获得的,包括3个亚型,即CCND1/CCND2和CCND3[5]。在卵巢中,CCND2主要在颗粒细胞中表达,且作为促卵泡素(follicle-Stimulating hormone,FSH)的下游因子之一在卵泡的发育过程中促进颗粒细胞的增殖[6-7]。SHIMIZU等[8]研究发现,在牛卵泡不同发育阶段中,雌激素活跃阶段及排卵前卵泡中颗粒细胞CCND2的表达水平都较CCND1、CCND3的表达水平高,并且与卵泡颗粒细胞增殖密切相关。颗粒细胞的增殖、分化及黄体化在卵泡的正常生长、优势卵泡选择、排卵、黄素化及胚胎着床和发育起着非常重要的作用[9]。研究发现通过正向调节CCND2的表达可促进细胞周期进程,从而加速颗粒细胞增殖;相反,下调CCND2的表达,颗粒细胞的增殖被抑制[10-11]。因此,对牦牛CCND2基因的研究为进一步探讨其在牦牛生殖中的作用具有重要意义。【前人研究进展】早期研究中CCND2作为致癌基因,主要在癌症的发生发展机制中研究较多,如胃癌[12]等。近几年研究发现CCND2参与免疫应答,通过调控淋巴细胞T和B细胞周期控制其增殖[13]。CCND2过表达会促使乙肝病毒复制,猜想通过CCND2抑制剂可对乙肝病毒感染进行治疗[14]。同时研究发现CCND2基因在生殖中也具有非常重要的作用。一方面CCND2作为致癌基因,它的过表达与男性睾丸生殖细胞肿瘤和女性颗粒细胞肿瘤、多囊性卵巢综合征的发生发展有关[15-17]。另一方面CCND2基因的表达与卵泡发育、排卵、黄体化及胚胎发育等密切相关。研究表明抑制有丝分裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)途径会使CCND2表达下调,降低了生殖细胞的自我更新能力[18];相反,CCND2高表达则可调控原始生殖细胞的自我更新[19]。LEI等[9]在研究中发现,水牛颗粒细胞中CCND2的表达影响颗粒细胞周期进行,从而影响优势卵泡的选择和排卵。另有研究发现,敲除小鼠CCND2基因其颗粒细胞的增殖将会受损,致使卵泡发育受到阻滞,表现出小卵泡状态,即不能生成成熟卵泡而无排卵现象[6]。CCND2在颗粒细胞的增殖过程中作为激素调节的媒介,当垂体被切除时,CCND2表达水平很低,颗粒细胞对FSH等激素介导的促增殖反应缺乏,卵泡发育障碍,从而雌性小鼠不孕[20]。WIANNY等[21]研究表明在胚胎附植前后的增殖和分化中CCND2出现上调。【本研究切入点】目前针对CCND2基因在生殖方面的研究主要集中在人和小鼠上,在牦牛上的研究尚未见报道。【拟解决的关键问题】通过RT-PCR等技术,克隆得到包含完整CDs区序列的牦牛CCND2基因,并对该基因序列进行生物信息学分析及蛋白功能结构预测分析;应用实时荧光定量PCR技术检测牦牛不同发情时期(卵泡期、红体期和黄体期)卵巢中该基因的表达水平,为进一步研究牦牛CCND2基因及其在牦牛卵巢发育过程中的作用提供基础资料。
1 材料与方法
1.1 材料和试剂
试验样品采自四川成都青白江区向阳镇屠宰场,试验动物为健康的空怀期成年母牦牛,屠宰后立即无菌采集牦牛心脏、肝脏、肺、肾脏、小肠、脑、胃、脾、肌肉和卵巢10个组织;另外屠宰后立即用无菌剪刀采集卵泡期卵巢、红体期卵巢和黄体期卵巢,所有样品放入已编号的冻存管中,迅速将其投入液氮中保存。
Trizol Reagent购自Invitrogen(美国)公司,PrimeScriptTMRT Reagent Kit反转录试剂盒、Premix TapTMDNA聚合酶、pMDTM19-T载体、SYBR®Premix Ex TaqTMⅡ试剂盒均购自TaKaRa(大连)公司,DNA胶回收试剂盒购自Axygen(北京)公司,DNA Marker、感受态细胞DH5α均购于天根生化科技(北京)有限公司,其他无特殊说明均为国产分析纯生化试剂。
试验在西南民族大学生命科学与技术学院细胞胚胎与工程实验室进行,试验时间为2015年11月至2016年4月。
1.2 总RNA的提取和反转录
采用Trizol法和液氮研磨法提取样本总RNA,应用核酸分析仪测其纯度和浓度,OD值在1.8—2.0之间符合要求。根据反转录试剂盒PrimeScriptTMRT Reagent Kit说明书以Oligo(dT)为引物对总RNA进行反转录合成cDNA第一链,分别编号后-20℃保存。
1.3 牦牛CCND2基因的扩增克隆
根据NCBI中已报道的黄牛()CCND2的mRNA序列(GenBank登录号:NM_001076372.1),使用Primer 5.0 软件设计引物(表1),由成都擎科梓熙生物技术有限公司合成。以牦牛卵巢cNDA为模板,利用PCR技术扩增牦牛CCND2基因CDS区序列。PCR反应体系为25 µL:cNDA 1.0 µL,Premix TaqTMDNA聚合酶12.5 µL,上、下游引物(10 µmol·L-1)各1.0 µL,最后ddH2O 9.5 µL补至总体积25 µL;PCR扩增条件为:94℃预变性4 min,94℃变性45 s,60℃退火45 s,72℃延伸45 s,30个循环,72℃再延伸7 min。用15 g·L-1琼脂糖凝胶电泳检测目的条带后,根据DNA胶回收试剂盒说明书切胶回收目的DNA,然后将回收产物与pMDTM19-T载体16℃条件下连接过夜后转化到DH5α感受态细胞中,并均匀涂于已制备好的LB固体培养基(AMP+)平板上,37℃培养过夜后挑取白色单菌落,接种于LB液体培养基(AMP+)中摇床培养6 h,菌液PCR鉴定,结果为阳性的克隆菌液送成都擎科梓熙生物技术有限公司测序。
1.4 牦牛CCND2基因的生物信息分析
利用NCBI中ORF Finder(http://www.ncbi.nlm.nih. gov/gorf/gorf.html)对获得CCND2序列进行开放阅读框分析,并获得氨基酸序列,同时进行氨基酸相似性比对;利用在线软件ExPASY(http://www.expasy.org/ proteomics)工具包中Protparam、ProtScale、SignalP、TMHMM、NetPhos、NetOGlyc、NetNGlyc、SOPMA、SWISS-MODEL及SMART分别对牦牛CCND2蛋白的理化性质、疏水性、信号肽、跨膜区、磷酸化位点、O-糖基化位点、N-糖基化位、二级结构、三级结构及结构域进行预测分析;利用MEGA 5.0软件进行系统进化树构建。
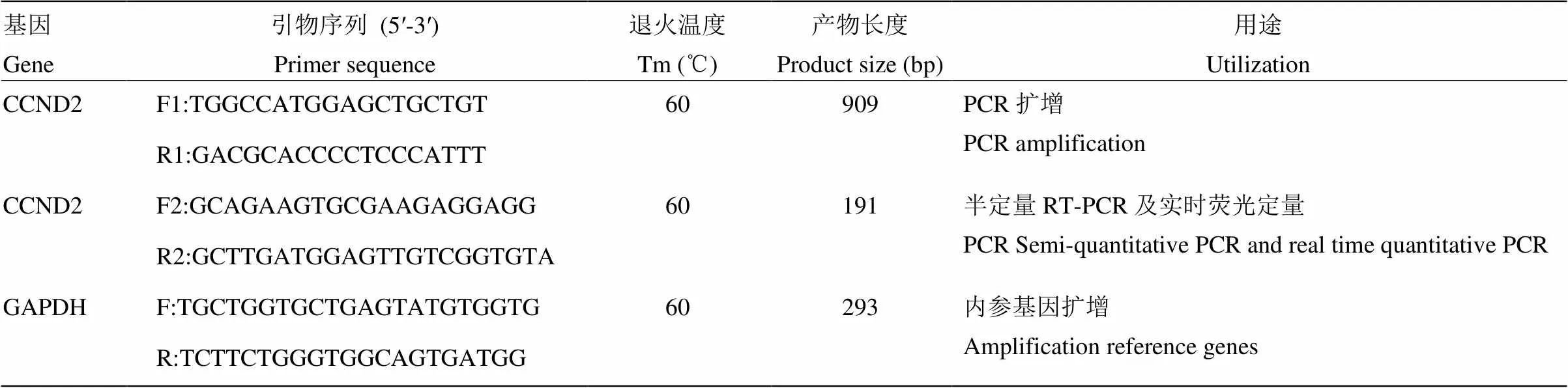
表1 引物信息
F:正向引物;R:反向引物
F: Sense primer; R: Antisense primer
1.5 牦牛CCND2基因组织表达谱
根据该研究克隆得到的CCND2较保守的ORF序列,采用(GenBank登录号:AC000162.1)为内参基因,利用Primer 5.0软件分别设计引物(表1),送成都擎科梓熙生物技术有限公司进行合成。利用半定量PCR检测牦牛各组织中CCND2基因的表达,反应体系25 µL:Premix TaqTMDNA聚合酶12.5 µL,上、下游引物(10 µmol·L-1)各1.0 µL,各组织cNDA模板1.0 µL,最后ddH2O 9.5 µL补至25 µL;PCR反应条件为:94℃4 min,94℃45 s,60℃30 s,72℃30 s,40个循环,最后72℃7 min。15 g·L-1琼脂糖凝胶电泳检测扩增结果。
1.6 牦牛CCND2基因在不同发情时期卵巢中的表达
采用实时荧光定量PCR(Quantitative Real-time PCR, qRT-PCR)检测CCND2基因在牦牛卵泡期、红体期和黄体期卵巢中的表达。qRT-PCR反应体系为15 µL:SYBR®Premix Ex TaqTMⅡ7.5 µL,上、下游引物(10 µmol·L-1)各0.5 µL,cNDA 1.0 µL,最后ddH2O 5.5 µL补至15 µL;PCR扩增条件为:95℃3 min,95℃10 s,60℃30 s, 共40个循环。引物见表1,每个样本进行3次重复。
1.7 数据统计分析
定量分析以卵泡期卵巢的Ct值为对照来计算,用2-△△Ct方法进行统计分析,试验统计数据用平均值±标准误(Mean±SD)表示,最后采用SPSS 18.0软件进行显著性分析,<0.05则为差异显著,<0.01则为差异极显著。
2 结果
2.1 牦牛CCND2基因CDS克隆测序
经RT-PCR方法扩增,琼脂糖凝胶电泳检测,获得和预期目的基因CCND2片段大小一致的单一清晰条带(图1),进一步克隆测序验证获得牦牛CCND2基因核苷酸序列为909 bp,包括5′端非编码区5 bp,可编码289个氨基酸的CDS区870 bp和3′端非编码区34 bp。
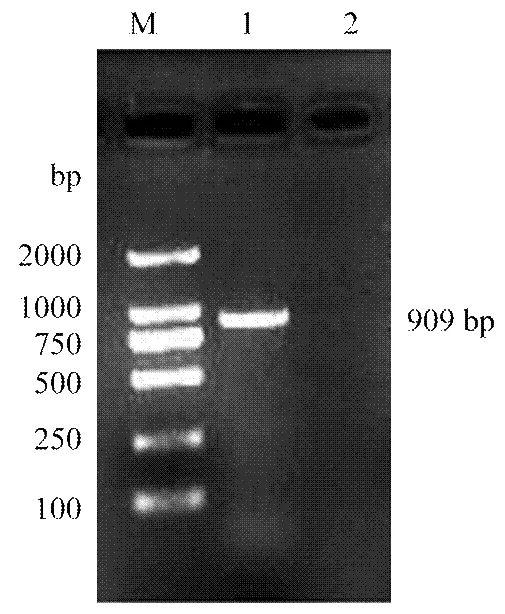
M:DL2000 DNA marker;1:PCR 产物;2:阴性对照(ddH2O)
2.2 牦牛与黄牛CCND2基因核苷酸和氨基酸的比对
利用NCBI在线软件BLAST将牦牛CCND2测定序列(CDS区及部分5′端和3′端非编码区)与黄牛的(GenBank登录号:NM_001076372.1)相应序列进行比对显示,同源性为99%,且测序所得牦牛CCND2基因序列共被检测到9个碱基突变,其中5个出现在CDS区,导致的密码子变化GAG→GAA、CTG→TCT、GTA→GTG,第二个密码子改变使得编码区第3位氨基酸变化L→S;4个在3′-UTR区,导致的密码子变化ATG→TGG、GGA→AGG,分别使得氨基酸变化M→W、G→R。
2.3 物种间CCND2基因同源性比较及进化树构建
利用DNAMAN软件将克隆测序所得的牦牛CCND2基因CDS区序列与野牦牛(XM_005897940.2)、黄牛(NM_001076372.1)、印度水牛(XM_006069006.1)、绵羊(NM_001127290.1)、野猪(NM_214088.1)、马(NM_001309189.1)、家犬(XM_849493.4)、猫(XM_003988283.3)、人类(BT019847.1)的进行比对,同源性都较高,分别是99.54%、99.31%、99.31%、98.16%、94.81%、90.46%、90.80%、91.49%、88.62%。使用MEGA 5.0软件对10个物种的CCND2 基因编码区序列构建了系统进化树分析,结果表明,CCND2基因CDS区核苷酸具有很高的保守性,牦牛与野牦牛CCND2基因的亲缘关系最近,其次是黄牛、绵羊、野猪等(图2)。
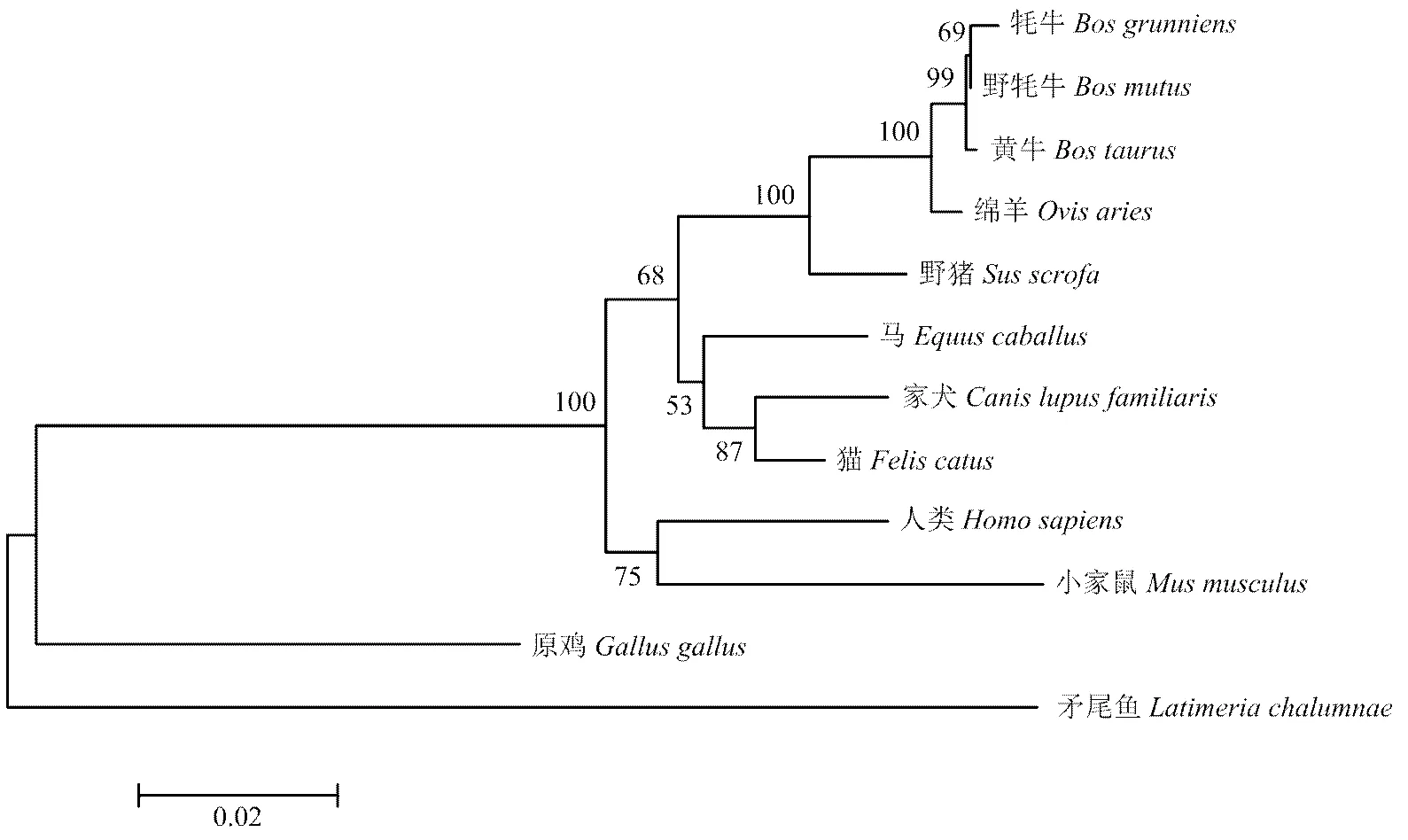
图2 不同物种间的系统进化树
2.4 CCND2蛋白理化性质
采用ExPASY中Protparam在线工具对该蛋白理化性质进行分析,结果表明,该蛋白分子式C1445H2315N377O440S18,相对分子质量为32.59kD,理论等电点为4.75,总原子数是4 595,带负电残基数(Asp + Glu)为44,带正电残基数(Arg + Lys)为28。出现频率较高的氨基酸残基有Leu(13.8%)、Glu(8.0%)、Ala(7.3%)、Asp(7.3%),且不包括Pyl和Sec。总平均亲水性为-0.107<0,脂肪系数为101.56,估计哺乳动物网织红细胞(体外)半衰期是30 h,不稳定指数为44.56。综上推测该蛋白质可能是亲水不稳定的酸性蛋白。
2.5 CCND2蛋白结构和功能预测
疏水性预测分析,CCND2蛋白亲水性分值在第263位最小为-3.022,第104位最大为2.689,且较大多数氨基酸残基具有亲水性,推测该蛋白是亲水性蛋白,与所分析的蛋白理化性质结果一致。跨膜结构域和信号肽分析显示,牦牛CCND2蛋白无跨膜结构和信号肽。蛋白修饰磷酸化位点预测发现,该蛋白有丝氨酸(Ser)位点11个,苏氨酸(Thr)位点6个和络氨酸(Tyr)位点1个。糖基化位点预测发现,该蛋白不存在N-糖基化和O-糖基化位点。CCND2蛋白二级结构预测知,171个α-螺旋占59.17%,17个β-折叠占5.88%,75个无规卷曲占25.95%,26个延伸链占9.00%(图3)。可推测α-螺旋和无规卷曲为该蛋白二级结构主要的组成元件,这与三级结构预测显示的结果相符(图4)。对该蛋白结构域预测分析发现,该蛋白包括2个结构域。其中Cyclin_N domain为第26—152氨基酸;Cyclin_C domain为154-257氨基酸(图5)。

图3 牦牛CCND2蛋白的二级结构
2.6 牦牛CCND2基因的组织表达分析
以为内参基因,采用半定量RT-PCR方法,研究牦牛CCND2基因在心脏、肝脏、肺、肾脏、小肠、脑、胃、脾脏、肌肉和卵巢组织中的表达情况,结果表明,在牦牛各组织中CCND2基因广泛表达,但仍存在差异,其中该基因在胃、脑、卵巢中的表达相对较高,肝脏、肺、肾脏、脾脏、肌肉中的表达次之,心脏和小肠中表达的相对较低(图6)。
2.7 牦牛不同发情时期卵巢CCND2基因的表达
qRT-PCR结果显示,CCND2基因mRNA在牦牛不同发情时期卵巢中均有表达(图7),其中卵泡期的表达水平极显著高于红体期和黄体期(<0.01),而红体期和黄体期中CCND2 mRNA表达水平无显著差异(<0.05)。
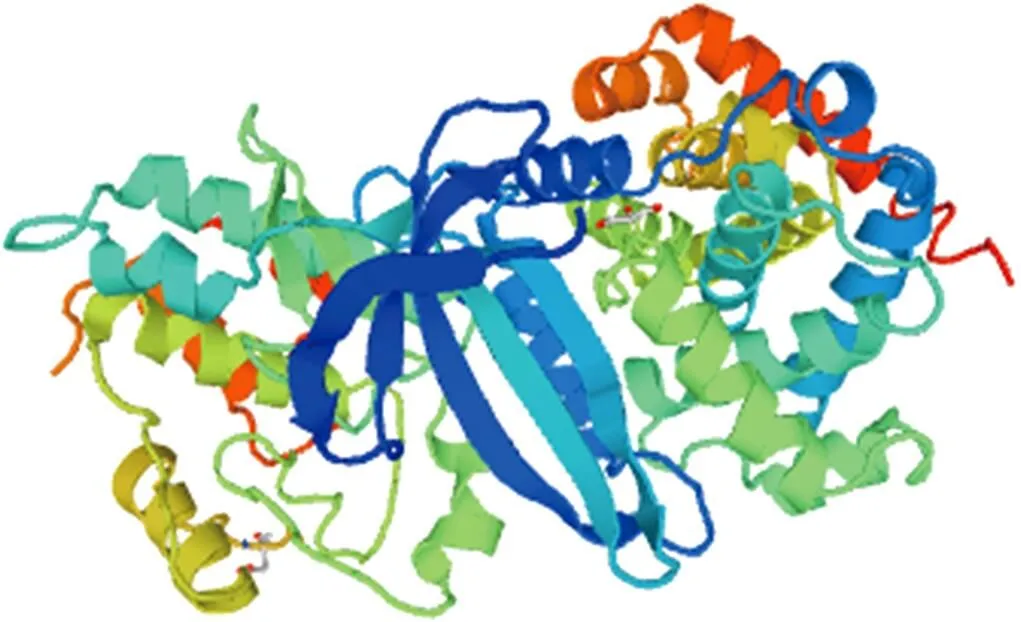
图4 牦牛CCND2蛋白三级结构预测
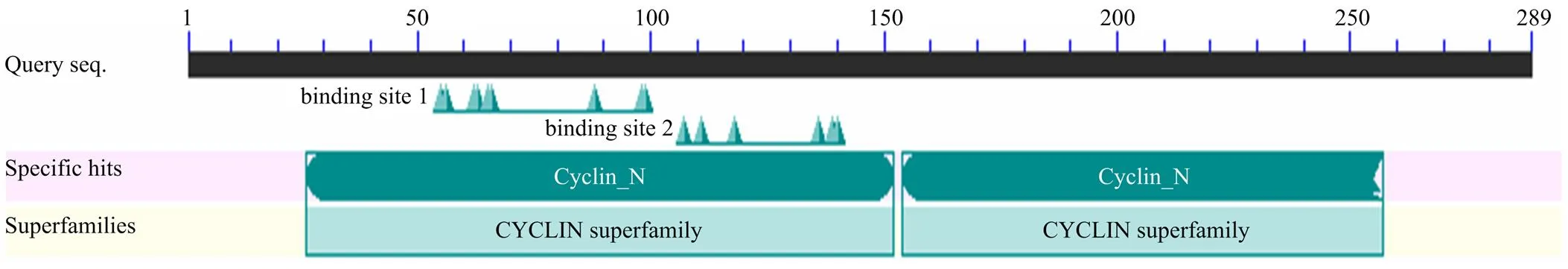
图5 牦牛CCND2蛋白的结构域预测
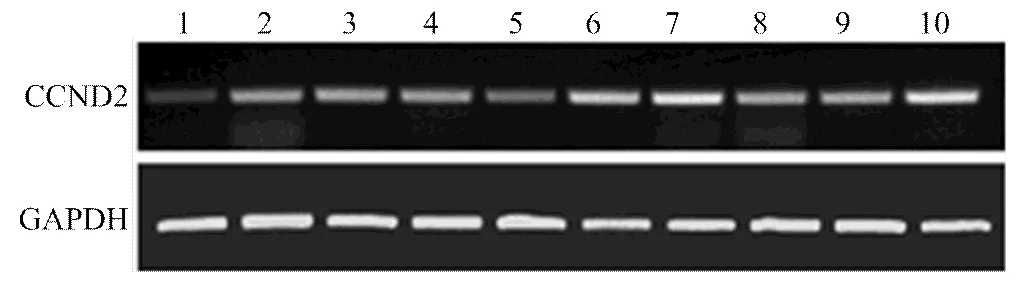
1.心脏;2.肝脏;3.肺;4.肾脏;5.小肠;6.脑;7.胃;8.脾脏;9.肌肉;10.卵巢
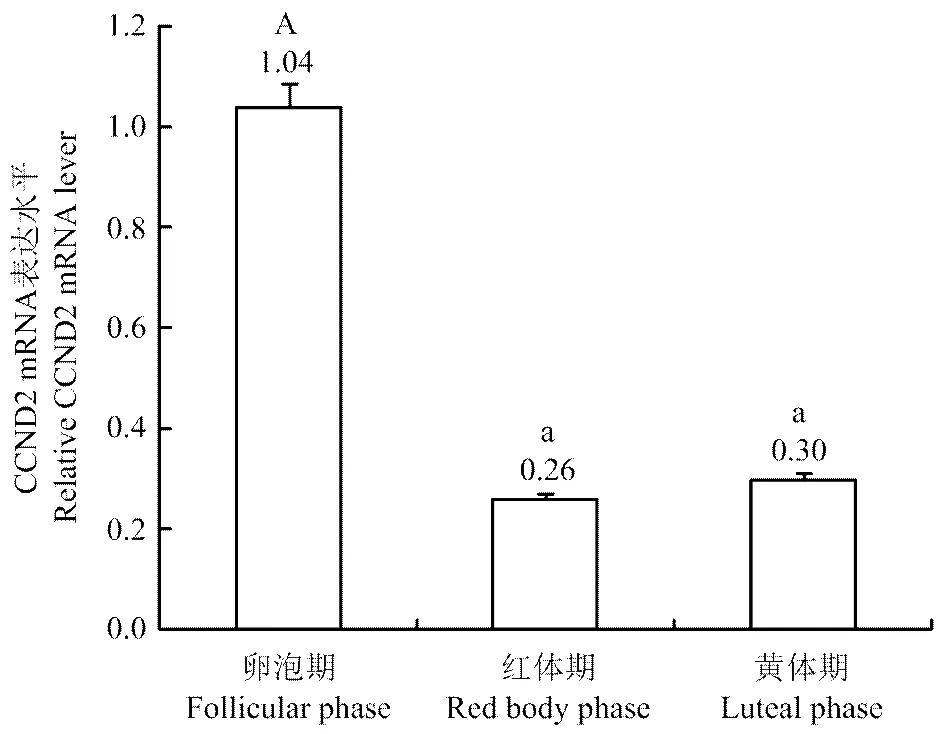
误差线上不同的字母表示差异极显著(P<0.01)
3 讨论
目前,国内外针对CCND2在牦牛上的研究仍未见报道。本试验首次从牦牛卵巢中成功克隆获得牦牛CCND2基因,其中包含完整CDS区的核苷酸序列。与黄牛对比,发现编码区存在5个碱基突变,导致氨基酸序列第3位发生改变,但这种氨基酸的突变是否导致该蛋白的生殖功能差异有待进一步研究。同源性分析发现,该基因与野牦牛、黄牛、绵羊、野猪等的同源性较高,与进化树分析结果的亲缘关系相符,说明牦牛CCND2基因编码区在长期进化中具有较高的保守性。
早期WIANNY等[21]发现,不同的器官和组织中CCND2都有其特异的表达。本试验中通过半定量RT-PCR对CCND2基因的组织表达分析得知,该基因mRNA在牦牛各组织中普遍表达,这与WIANNY等的研究结果相似。但各组织间CCND2基因转录水平差异是否影响翻译蛋白的表达水平,从而影响各组织功能的改变有待进一步研究,尤其在卵巢中的高表达提示CCND2基因可能在牦牛生殖中发挥重要作用。
哺乳动物性成熟以后,卵巢就是一个动态发育器官,每一个发情周期中卵巢上的卵泡都进行周期性的生长发育、排卵、红体形成、黄体形成及退化的过程,即卵泡期和黄体期的交替变换过程。而在这个过程中卵泡膜细胞、间质细胞以及颗粒细胞产生许多因子和激素,周期性地调节卵细胞的发育[22-23]。有研究表明颗粒细胞的增殖、分化和凋亡在卵泡发育、排卵、闭锁及黄素化中起着重要作用[24-25]。CCND2基因在卵巢发育中主要表达于颗粒细胞中,脊椎动物中属G1期周期蛋白,主要调控细胞周期中G1期及G1期向S期的过渡,正性调节着细胞周期的进程[2,9]。为了进一步研究牦牛CCND2基因在生殖中的作用,本试验使用qRT-PCR技术检测了该基因在牦牛不同发情时期卵巢中的表达差异。结果指出,CCND2 mRNA在卵泡期、红体期和黄体期卵巢中均有表达,但在卵泡期卵巢中的表达水平极显著地高于其他两个发情时期卵巢中的表达。HAMEL等[26]研究发现在卵泡发育的窦卵泡阶段,随着卵泡腔形成颗粒细胞加速增殖,分化形成卵丘细胞(cumulus cells,CCs)和壁颗粒细胞(mural granulose cells,MGCs)。组织学研究发现,CCND2在小鼠卵巢各级卵泡中颗粒细胞均有表达,并且在颗粒细胞快速增殖的窦前卵泡中表达较多[27];在窦卵泡阶段,CCND2表达内化,即主要在CCs和MGCs内层表达,并且随着卵泡不断生长发育,颗粒细胞中CCND2表达增加[6,28]。在卵泡期即卵泡排卵前时期,CCND2的高表达可能与卵泡发育中颗粒细胞的快速增殖分化有关。在红体期即卵泡排卵后,一方面成熟卵泡CCs及小部分MGCs随卵母细胞直接排出卵泡腔[29];另一方面较多颗粒细胞周期发生停滞,大量细胞凋亡,大部分的从属卵泡随之发生闭锁[30]。因此,在卵泡期和黄体期之间的过渡期,即红体期卵巢中CCND2表达会出现明显下降。之后卵巢进入黄体期,一方面卵巢中成熟卵泡排卵后颗粒细胞以快速黄体化为主,增殖减缓,形成粒黄体细胞;卵泡膜细胞快速增殖分化,形成小黄体[31-32]。同时研究发现在黄体形成小黄体中CCND2的表达明显高于粒黄体细胞中的表达[33]。由此可见,CCND2与黄体细胞的增殖和卵巢黄体化密切相关;另一方面由于每个发情周期存在2—3个卵泡波,在最后一个卵泡波的优势卵泡排卵后,卵巢上又有新的卵泡开始发育,进入第一个卵泡波[34]。所以在黄体期卵巢中CCND2的表达较红体期增加而较卵泡期时显著降低的原因可能是颗粒细胞黄体化及新的卵泡发育缓慢且大多数处于卵泡波的征集期和选择期。由此说明牦牛CCND2基因参与牦牛发情周期的调控。
卵巢内促性腺激素和类固醇激素对雌性哺乳动物的发情周期有着重要的影响[35-37]。在卵泡发育早期阶段,卵巢通过“双细胞-双促性腺激素”模式合成雌激素和雄激素,即在FSH作用下颗粒细胞合成雌激素,促黄体素(luteinizing hormone,LH)作用下膜细胞合成雄激素[32]。HERNANDEZ-GONZALEZ等[38]研究发现CCND2在颗粒细胞中的表达与排卵前促性腺激素峰值有关。李泰云等[39]发现FSH受体在发情期中高表达,LH受体在发情后期中高表达。在母牛的发情周期中FSH在卵泡波前出现波峰,刺激小卵泡的募集,之后浓度降低刺激优势卵泡的选择和发育,并且随着发育的进行,小卵泡则会因不能利用低浓度FSH使其不断减少和闭锁[40]。卵泡发育中CCND2作为调节激素的媒介之一,FSH和雌二醇(estradiol,E2)通过cAMP/PKA(cyclin adenosine monophosphate/ protein kinase A)诱导CCND2的表达,加速颗粒细胞的增殖[20]。
4 结论
本试验首次从牦牛成功克隆获得了CCND2基因全长870 bp的CDS和部分非编码区序列。CCND2基因编码区在生物进化中具有很高的保守性。牦牛CCND2 mRNA广泛表达在各组织中,其中胃、脑、卵巢中的表达相对较高。CCND2基因在不同发情周期卵巢中的表达水平可能与卵泡发育过程中颗粒细胞的增殖、凋亡、黄素化及卵巢的内分泌有关。研究结果为进一步探索CCND2基因对牦牛生殖作用的影响机制提供理论基础。
References
[1] 兰道亮, 熊显荣, 位艳丽, 徐通, 钟金城, 字向东, 王永, 李键. 基于RNA-Seq 高通量测序技术的牦牛卵巢转录组研究:进一步完善牦牛基因结构及挖掘与繁殖相关新基因. 中国科学, 2014, 44(3): 307-317.
LAN D L, XIONG X R, WEI Y L, XU T, ZHONG J C, ZI X D, WANG Y, LI J. RNA-Seq analysis of yak ovary: improving yak gene structure information and mining reproduction-related genes., 2014, 44(3): 307-317. (in Chinese)
[2] MALUMBRES M, BARBACID M. Cell cycle, CDKs and cancer: a changing paradigm.2009, 9(3): 153-166.
[3] ZHANG Q, SAKAMOTO K, WAGNER K U. D-type cyclins are important downstream effectors of cytokine signaling that regulate the proliferation of normal and neoplastic mammary epithelial cells.2014, 382(1): 583-559.
[4] COQUERET O. Linking cyclins to transcriptional control., 2002, 299(1/2): 35-55.
[5] MOTOKURA T, BLOOM T, KIM H G, JÜPPNER H, RUDERMAN J V, KRONENBERG H M, ARNOLD A. A novel cyclin encoded by a bcl1-linked candidate oncogene., 1991, 350 (6318): 512-515.
[6] SICINSKI P, DONAHER J L, GENG Y, PARKER S B, GARDNER H, PARK M Y, ROBKER R L, RICHARDS J S, MCGINNIS L K, BIGGERS J D, EPPIG J J, BRONSON R T, ELLEDGE S J, WEINBERG R A. Cyclin D2 is an FSH-responsive gene involved in gonadal cell proliferation and oncogenesis., 1996, 384(6608): 470-474.
[7] PARK Y, MAIZELS E T, FEIGE Z J, ALAM H, PETERS C A, WOODRUF T K, UNTERMAN T G, LEE E J, JAMESON J L, HUNZICKER-DUN M. Induction of cyclin D2 in rat granulosa cells requires FSH-dependent relief from FOX01 repression coupled with positive signals from Smad., 2005, 280(10): 9135-9148.
[8] SHIMIZU T, HIRAI Y, MIYAMOTO A. Expression of cyclins and cyclin-dependent kinase inhibitors in granulosa cells from bovine ovary., 2013, 48(5): e65-e69.
[9] LEI X C, CUI K Q , LI Z P, SU J, JIANG J R, ZHANG H H, LIU Q Y, SHI D. BMP-1 participates in the selection and dominance of buffalo follicles by regulating the proliferation and apoptosis of granulosa cells., 2016, 85(5): 999-1012.
[10] SUMMERS A F, POHLMEIER W E, SARGENT K M, COLE B D, VINTON R J, KURZ S G, MCTEE R M, CUSHMAN R A, CUPP A S, WOOD J R. Altered theca and cumulus oocyte complex gene expression, follicular arrest and reduced fertility in cows with dominant follicle follicular fluid androgen excess.2014, 9(10):e110683.
[11] ZHANG Q, SUN H X, JIANG Y, DING L J, WU S G, FANG T, YAN G J, HU Y L. MicroRNA-181a suppresses mouse granulosa cell proliferation by targeting activin receptor IIA., 2013, 8 (3): e59667.
[12] OSHIMO Y, NAKAYAMA H, ITO R, KITADAI Y, YOSHIDA K, CHAYAMA K, YASUI W. Promoter methylation of cyclin D2 gene in gastric carcinoma.. 2003, 23(6): 1663-1670.
[13] MORITO N, YOH K, MAEDA A, NAKANO T, FUJITA A, KUSAKABE M, HANADA M, KUDO T, YAMAGATA K, TAKAHASHI S. A novel transgenic mouse model of the human multiple myeloma chromosomal translocationt.. 2011, 71(2): 339-348.
[14] SONG C L, REN J H, RAN L K, LI Y G, LI X S, CHEN X, LI W Y, HUANG A L, CHEN J. Cyclin D2 plays a regulatory role in HBV replication., 2014, 8(462/463): 149-157.
[15] CHAGANTI R S, HOULDSWORTH J. Genetics and biology of adult human male germ cell tumors., 2000, 60(6): 1475-1482.
[16] ANTTONEN M, PIHLAJOKI M, ANDERSSON N, GEORGES A, LHOTO D, VATTULAINEN S, FARKKILA A, UNKILA-KALLIO L, VEITIA R A, HEIKINHEIMO M. FOXL2, GATA4 and SMAD3 co-operatively modulate gene expression, cell viability and apoptosis in ovarian granulosa cell tumor cells., 2014, 9(1): e85545.
[17] SHAFIEE M N, MALIK D A, YUNOS R I, ATIMO W, OMAR M H, GHANI N A, HATTA A Z, SEEDHOUSE C, Chapman C, MOKHTAR N M. The effect of Metformin on endometrial tumor-regulatory genes and systemic metabolic parameters in polycystic ovarian syndrome--a proof-of-concept study., 2015, 31(4): 286-290.
[18] SAHARE M, OTOMO A, KOMATSU K, MINAMI N, YAMADA M, IMAI H. The role of signaling pathways on proliferation and self-renewal of cultured bovine primitive germ cells., 2015,14(1): 17-25.
[19] LEE J, KANATSU-SHINOHARA M, MORIMOTO H, KAZUKI Y, TAKASHIMA S. Genetic reconstruction of mouse spermatogonial stem cell self-renewal in vitro by Ras-cyclin D2 activation., 2009, 5(1): 76-86.
[20] ROBKER R L, RIEHARDS J S. Hormone-induced proliferation and differentiation of granulose cells: a coordinated balance of the cell cycle regulators cyclin D2 and p27Kipl., 1998, 12(7): 924-940.
[21] WIANNY F, REAL F X, MUMMERY C L, VAN-ROOIJEN M, LAHTI J, SAMARUT J, SAVATIER P. G1-phase regulators, cyclin D1,cyclin D2, and cyclin D3:up-regulation at gastrulation and dynamic expression during neurulation., 1998, 212(1): 49-62.
[22] ADAMS G P, JAISWAL R, SINGH J, MALHI P. Progress in understanding ovarian follicular dynamics in cattle., 2008, 69(1): 72-80.
[23] 郑红飞, 潘阳阳, 刘鹏刚, 彭秀梅, 崔燕, 余四九. 牦牛基因特征分析及其在不同发情时期卵巢中的表达. 华北农学报, 2015, 30(5) : 93-99.
ZHENG H F, PAN Y Y, LIU P G, PENG X M, CUI Y, YU S J. Characteristics of yak tumor protein p53 Gene() and its expression in different periods of estrus ovaries., 2015, 30(5): 93-99. (in Chinese )
[24] MASTUDA-MINEHATA F, INOUE N, GOTO Y, MANABE N. The regulation of ovarian granulosa cell death by pro- and anti-apoptotic molecules., 2006, 52(6): 695-705.
[25] MCRAE R S, JOHNSTON H M, MIHM M, O'SHAUGHNESSY P J. Changes in mouse granulosa cell gene expression during early luteinization., 2005, 146(1): 309-317.
[26] HAMEL M, DUFORT I, ROBERT C, GRAVEL C, LEVEILLE M C, LEADER A, SIRARD M A. Identification of differentially expressed markers in human follicular cells associated with competent oocytes., 2008, 23(5): 1118-1127.
[27] SHIINA H, MATSUMOTO T, SATO T, IGARASI K, MIYAMOTO J, TAKEMASA S, SAKARI M, TAKADA I, NAKAMURA T, METZGER D, CHAMBON P, KANNO J, YOSHIKAWA H, KATO S. Premature ovarian failure in androgen receptor-deficient mice., 2006, 103(1): 224-229.
[28] NEGANOVA I, AI-QASSAB H, HEFFRON H, SELMAN C, CHOUDHURY A I, LINGARD S J, DIAKONOV I, PATTERSON M, GHATEI M, BLOOM S R, FRANKS S, HUHTANIEMII, HARDY K, WITHERS D J. Role of central nervous system and ovarian insulin receptor substrate 2 signaling in female reproductive function in the mouse., 2007, 76(6): 1045-1053.
[29] GILCHRIST R B, LANE M, THOMPSON J G. Oocyte-secreted factors: regulators of cumulus cell function and oocyte quality., 2008, 14(2):159-177.
[30] RJCHARDS J S, RUSSELL D L, OCHSNER S, ESPEY L L. Ovulation: new dimensions and new regulators of the inflammatory- like response., 2002, 64: 69-92.
[31] KAYANI A R, GLISTER C, KNIGHT P G. Evidence for an inhibitory role of bone morphogenetic protein(s) in the follicular-luteal transition in cattle., 2009, 137(1): 67-78.
[32] KWINTKIEWICE J, GIUDICE L C. The interplay of insulin-like growth factors, gonadotropins, and endocrine disruptors in ovarian follicular development and function.icine,2009, 27(1): 43-51.
[33] YOSHIOKA S, ABE H, SAKUMOTO R, OKUDA K. Proliferation of luteal Steroidogenic Cells in Cattle., 2013, 8(12): e84186.
[34] GINTHER O J, BERGFELT D R, KULICK L J, KOT K. Selection of the dominant follicle in cattle: establishment of follicle deviation in less than 8 hours through depression of FSH concentrations., 1999, 52(6): 1079-1093.
[35] 应诗家, 彭中友, 李燕,蔡柳萍, 施振旦. 绵羊黄体期卵巢类固醇激素调节基因的表达研究. 畜牧兽医学报, 2013, 44(11): 1775-1780.
YING S J, PENG Z Y, LI Y, CAN L P, SHI Z D. Study on ovarian sterol-regulatory genes expression in sheep during luteal phase., 2013, 44(11): 1775-1780. (in Chinese)
[36] 王锋. 动物繁殖学. 北京: 中国农业大学出版社, 2012.
WANG F.Beijing: China Agricultural University Press, 2012. (in Chinese)
[37] HILLIER S G, WHITELAW P F, SMYTH C D. Follicular oestrogen synthesis: the 'two-cell, two-gonadotrophin' model revisited., 1994, 100(1/2): 51-54.
[38] HERMANDEZ-GONZALEZ I, GONZALEZ-ROBAYNA I, SHIMADA M, WAYNE C M, OCHSNER S A, WHITE L, RICHARDS J S. Gene expression profiles of cumulus cell oocyte complexes during ovulation reveal cumulus cells express neuronal and immune-related genes: does this expand their role in the ovulation process?, 2006, 20(6): 1300-1321.
[39] 李泰云, 韩小康, 丁彦红, 王树迎, 王丽, 石中强. 沂蒙黑山羊发情周期不同阶段卵巢中FSHR和LHR基因表达规律的研究. 中国兽医科学, 2011, 41(09): 954-959.
LI T Y, HAN X K, DING Y H, WANG S Y, WANG L, SHI Z Q. Expression of FSHR gene and LHR gene in the ovary of Yimeng Black goat in different stages of estrous cycle., 2011, 41(09): 954-959. (in Chinese)
[40] 葛利江, 徐常林, 石瑞青, 谭景和, 罗明久. 德州驴发情周期中卵泡动力学和激素变化规律的研究. 畜牧兽医学报, 2011, 42(9): 1256-1263.
GE L J, XU C L, SHI R Q, TAN J H, LUO M J. Ovarian follicular and hormonal dynamics in dezhou jenny during estrous cycle monitored by real-time ultrasonography., 2011, 42(9): 1256-1263. (in Chinese)
(责任编辑 林鉴非)
Cloning and Expression Analysis ofGene in Yak Ovaries During Different Periods of Estrus
SHI Xian1, XIONG XianRong1, LAN DaoLiang2, CHEN WeiMing1, HU JiaJia1, CAI WenYi1, LI Jian1
(1College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041;2College of Tibetan Plateau Research, Southwest University for Nationalities, Chengdu 610041)
【Objective】The aim of the study was to investigate the sequence characteristics and expression level of cyclin D2(CCND2) in yak ovary during different periods of estrus. 【Method】Total RNA of yak ovary were extracted and reverse transcribed into cDNA. Specific primers were designed according to mRNA sequence of cattle CCND2 gene in the GenBank(GenBank accession No: NM_001076372.1) by software Primer 5.0. The CDs region and part of 5′UTR and 3′UTR in yak CCND2 gene were cloned from yak ovary by polymerase chain reaction(PCR) amplification and sequencing technology. The physicochemical properties, secondary structure, tertiary structure, domain, homology were analyzed and phylogenetic tree of CCND2 was constructed by online software like Protparam, SOPMA, SWISS-MODEL and SMART. Semi-quantitative PCR was used to examine the expression profiles of CCND2 gene in different tissues. Quantitative real-time PCR (qRT-PCR) was used to detect the expression level of CCND2 gene in the ovary during different periods of estrus (ovarian follicular phase, red body phase and luteal phase).【Result】The 909 bp length sequences of CCND2 gene in yak, including 870 bp length CDS region encoding 289 amino acids, were obtained. Alignment with cattle CCND2 gene CDS and amino acid, five bases mutations and one amino acid mutation were found. The CDs homology of CCND2 compared yak to wild yak, cattle, Indian buffalo, sheep, wild boar, horse, dog, cat and human was 99.54%, 99.31%, 99.31%, 98.16%, 94.81%, 90.46%, 90.80%, 91.49% and 88.62%, respectively. There was a high homology among different species, and phyletic evolution was the same as their genetic relationship. The research indicated that the CCND2 gene CDs was conservative in the course of evolution. The formula of protein encoded by CCND2 gene in yak was C1445H2315N377O440S18, and the molecular weight was 32.59 kD, the theory isoelectric point was 4.75, the grand average of hydroparthicity was -0.107, and the instability index was 44.56. It was an unstable, soluble and acidic protein without transmembrane regions and signal peptide. Random coil and α-helix were mainly in the secondary structure of CCND2, which were the same as the tertiary structure of CCND2 protein. The amino acids sequence of CCND2 contains Cyclin_N domain in the 26-152 amino acids and Cyclin_C domain in the 154-257 amino acids. The CCND2 gene was expressed in various tissues of yak, and relatively higher in stomach, ovary and brain. qRT-PCR results showed that the mRNA expression level of CCND2 in ovary of follicular phase was the highest (<0.01), and no difference between the red body phase and luteal phase (>0.05).【Conclusion】The complete CDs of CCND2 gene was successfully cloned and the tissues expression profiles were clarified, and its bioinformatics and encoded protein function and structure were investigated. These provide a theoretical basis for further study of CCND2 gene in regulation of yak reproduction. The different expressions of CCND2, in different periods of estrus in yak, might be related to proliferation and differentiation of granulose cells, development process of follicular wave, and ovarian endocrine. These indicated that CCND2 plays an important role during the reproductive cycle, and these results of study will provide basic information for further study on the ovarian development mechanism and improving reproductive competence in yak.
yak; CCND2; cloning; estrous cycle; ovary; expression
2016-09-09;接受日期:2017-04-28
四川省科技支撑计划(2014NZ0114)、西南民族大学中央高校基本科研业务费专项资金(2016NZYQN38)
石仙,E-mail:shixian_900824@163.com。通信作者李键,E-mail:lijian_1967@163.com

