油菜素内酯对阔世玛胁迫下谷子叶片光合荧光特性 及糖代谢的影响
杨慧杰,原向阳,郭平毅,董淑琦,张丽光,温银元,宋喜娥,王宏富
油菜素内酯对阔世玛胁迫下谷子叶片光合荧光特性 及糖代谢的影响
杨慧杰1,原向阳1,郭平毅1,董淑琦1,张丽光2,温银元1,宋喜娥1,王宏富1
(1山西农业大学农学院,山西太谷030801;2山西省农业科学院作物科学研究所,太原030031)
【目的】探明油菜素内酯(brassinolide,BR)对阔世玛胁迫下谷子叶片的光合荧光特性及糖代谢的影响,为谷子田磺酰脲类除草剂阔世玛的安全应用及利用植物生长调节剂油菜素内酯缓解除草剂药害提供理论基础和技术途径。【方法】采用完全随机设计,重复3次,以杂交高产谷张杂5号和普通优质谷晋谷21号为材料,进行盆栽试验,待幼苗长至3—5叶期时,喷施7.5 mg·L-1阔世玛,药后1 d,分别叶面喷施清水(对照)、0.05、0.1、0.2和0.4 mg·L-1的油菜素内酯,7 d后对所有处理的谷子幼苗株高、叶面积、鲜重等农艺性状、叶片光合色素含量、气体交换参数、叶绿素荧光参数、糖含量及蔗糖代谢关键酶活性进行测定与分析。【结果】在7.5 mg·L-1阔世玛胁迫下,谷子的株高、叶面积、鲜重、叶绿素a、叶绿素b、类胡萝卜素、叶绿素(a+b)、净光合速率(n)、蒸腾速率(r)、气孔导度(s)、最大光化学产量(v/m)、表观光合电子传递速率(ETR)、非调节性能量耗散量子产量(Y(NO))、中性转化酶(NI)、蔗糖合成酶(SS)及蔗糖磷酸合成酶(SPS)活性显著降低;而胞间CO2浓度(i)、调节性能量耗散量子产量(Y(NPQ))、还原性糖、蔗糖和淀粉含量显著升高。药后1 d喷施适宜浓度的BR能部分缓解阔世玛对谷子的药害,显著提高谷子的株高、叶面积、鲜重、光合色素含量、n、r、s、v/m、ETR、Y(NO)、NI、SS及SPS活性,并显著降低i、Y(NPQ)、还原性糖、蔗糖和淀粉含量;其中,0.05—0.1 mg·L-1BR对缓解张杂5号阔世玛药害的效果较好,0.1—0.2 mg·L-1BR对缓解晋谷21号阔世玛药害的效果较好。≥0.4 mg·L-1BR不能缓解阔世玛药害。【结论】7.5 mg·L-1的阔世玛对谷子产生显著药害的原因之一是降低了其光合色素含量,抑制了PSⅡ光化学活性,影响了糖代谢的正常运转。0.1 mg·L-1的油菜素内酯通过提高光合色素含量、增加气孔导度、提高PSⅡ光化学活性、促进碳水化合物的卸出、维持蔗糖代谢平衡等来缓解阔世玛对谷子光合作用的抑制。
谷子;油菜素内酯;阔世玛;光合能力;叶绿素荧光;糖代谢
0 引言
【研究意义】谷子()是中国北方地区主要的粮食作物之一,具有营养丰富、抗逆性强等特点[1-2]。每年中国因草害造成作物减产约占20%以上,严重时甚至绝收[3-4]。目前,谷子田登记注册的除草剂品种极少。阔世玛(Sigma broad)是一种可防除多种禾本科杂草和阔叶杂草的磺酰脲类除草剂,植物吸收该类除草剂后,乙酰乳酸合成酶(ALS)活性受到显著抑制,并导致生长点坏死或畸形,生长缓慢,叶片黄化失绿等[5]。油菜素内酯(brassinolide,BR)是一种新型植物甾醇类生长物质[6],可控制气孔开闭,提高光合作用[7],并广泛参与其他生理过程,促进植株的生长发育[8-9],在缓解多种逆境(包括除草剂)对作物的胁迫中发挥了重要作用[10-14]。研究油菜素内酯对阔世玛胁迫下谷子叶片光合荧光特性及糖代谢的影响对谷子田磺酰脲类除草剂的安全应用和除草剂药害的缓解具有重要意义。【前人研究进展】研究表明阔世玛对小麦相对安全[15],而黄蕾等[16]发现,阔世玛对谷子极不安全,会显著降低其株高、叶面积、生物重和光合色素含量,提高丙二醛(MDA)含量和细胞膜相对透性。在3—5叶期喷施0.05—0.2 mg∙L-1的油菜素内酯可显著提高谷子的抗逆性,减少遭受各种胁迫的机率[17]。适宜浓度的表油菜素内酯(EBR)可提高玉米幼苗的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性和叶绿素含量,降低脯氨酸含量,缓解铅的抑制与毒害作用[18]。周小毛等[19]发现天然油菜素内酯能缓解胺苯磺隆对水稻的药害,缓解效果与油菜素内酯浓度和水稻的受药害程度密切相关,油菜素内酯浸种也能提高水稻幼苗叶绿素含量和根系活力,促进甲磺隆在作物体内的代谢,缓解其对水稻根长的抑制作用,在甲黄隆浓度低于0.002 mg∙L-1的药害下恢复率可达到85%以上[20]。黄允才等[21]认为预先喷施芸苔素可促进水稻的光合作用,有效缓解和防止除草剂西草净的药害。适宜浓度的油菜素内酯还可增加谷子的株高,提高叶绿素含量,促进光合作用,增加有机物的积累,缓解2,4-D对幼苗的抑制作用[22]。【本研究切入点】阔世玛是一种杀草谱较广的优秀除草剂,但对谷子存在药害;而油菜素内酯能缓解相关除草剂对作物的药害。目前,未见到油菜素内酯在缓解谷子阔世玛药害方面的相关报道。【拟解决的关键问题】在谷子幼苗期经阔世玛处理后,叶面喷施不同浓度的油菜素内酯,研究其对谷子农艺性状、光合、叶绿素荧光特性及蔗糖代谢的影响,旨在从光合荧光和糖代谢等角度阐明油菜素内酯缓解谷子阔世玛药害的光合机理。
1 材料与方法
试验于2015—2016年在山西农业大学化学除草与化学调控实验室进行。
1.1 材料与试剂
供试谷子品种为普通优质谷子晋谷21号(山西省农业科学院经济作物研究所)和杂交高产谷子张杂5号(河北省张家口市农业科学院)。
试剂为3.6%阔世玛水分散粒剂(拜耳作物科学有限公司)。0.01%芸苔素内酯可溶性粉剂(成都新朝阳作物科学有限公司)。
1.2 试验设计
采用完全随机设计,将张杂5号和晋谷21号的种子均匀播种于13 cm×15 cm装有沙土(土﹕沙=2﹕1)混合物的营养钵中。待幼苗长至3—5叶期时,选取整齐一致的幼苗进行7.5 mg∙L-1(1/4推荐剂量)的阔世玛处理(加助剂烷基乙基磺酸盐0.4%)。
1 d后,叶面喷施不同浓度(0、0.05、0.1、0.2、0.4 mg∙L-1)的油菜素内酯进行缓解,以清水作为对照,每个处理重复3次。待7 d后,取样测定。
1.3 测定指标及方法
1.3.1 农艺性状的测定 选取生长一致的谷子幼苗,用直尺测量植株的株高(植株基部到旗叶的高度)、倒2叶的叶长和叶宽。叶面积按公式:叶面积=叶长×叶宽×0.75计算。用万分之一天平测量鲜重。
1.3.2 光合色素含量的测定 采用96%的乙醇浸提法测定[23]。取谷子叶片(倒2叶)0.05 g,共3份,放入试管中,加入5 mL 96%乙醇浸提至叶片变白,测OD665、OD649、OD470,计算出相应的叶绿素a含量(Chla)、叶绿素b含量(Chlb)、类胡萝卜素含量(Car)和叶绿素总量(Chl (a+b))。
1.3.3 气体交换参数的测定 用CI-340光合测定仪(美国思爱迪),选择晴朗无云的天气,每个处理选取有生长一致且受光方向一致、叶位相同且完全展开的倒2叶,于上午9:00—11:00,测定净光合速率(n)、蒸腾速率(r)、气孔导度(s)和胞间二氧化碳浓度(i),测定时光强为(900±50)mmol∙m-2∙s-1,温度为(30±2)℃,CO2浓度为(380±50)mmol∙mol-1。
1.3.4 叶绿素荧光参数的测定 采用DUAL-PAM-100(德国WALZ公司)进行叶绿素荧光参数,叶片经30 min暗适应(光强低于1mmol∙m-2∙s-1),照射检验光(0.12mmol∙m-2∙s-1,600 Hz)后,进行慢速动力学曲线测定。叶绿素荧光动力学参数包括初始荧光(o)、最大荧光(m)、最大光化学产量(v/m)、表观光合电子传递速率(ETR)、非光化学淬灭系数(NPQ)、调节性能量耗散的量子产量(Y (NPQ))及非调节性能量耗散的量子产量(Y (NO)),参数测定时间为1 min。饱和脉冲光强度为4 000mmol∙m-2∙s-1,脉冲时间为0.8 s。
1.3.5 蔗糖代谢酶活性的测定 根据梁建生等[24]的方法加以改进,称取0.2 g叶片置于遇冷的研钵中,分批加入2 mL的提取缓冲液(100 mmol∙L-1Tris-HCl:内含5 mmol∙L-1MgCl2、2 mmol EDTA-Na2、2%乙二醇、0.1%牛血清清蛋白(BSA)、2% PVP、5 mmol·L-1DTT)冰浴研磨提取,2℃下10 000×离心20 min,上清液为酶粗提液。
酸性转化酶(AI)和碱性转化酶(NI)活力测定:采用0.95 mL的酶反应液(pH 4.7和pH 7.5的80 mmol∙L-1乙酸-K3PO4缓冲液:内含50 mmol∙L-1蔗糖)加入200mL的粗酶液,30℃水浴10 min,对照置于沸水浴10 min,用3, 5-二硝基水杨酸法测OD540。
蔗糖合成酶(SS)和蔗糖磷酸合成酶(SPS)活力测定:采用0.4 mL的酶反应液(100 mmol∙L-1Tris-HCl缓冲液(pH 7.0)内含10 mmol∙L-1果糖(或10 mmol∙L-1果糖-6-磷酸)、5 mmol∙L-1醋酸、5mmol∙L-1DTT)加入200mL粗酶液和0.1 mL UDPG,定容至1 mL,对照为0.4 mL酶反应液内加入200mL的酶反应液,并定容至1 mL。30℃水浴反应10 min后,再沸水浴3 min后中止反应。加入0.1 mL 2 mol∙L-1的NaOH后沸水浴10 min,待冷却至室温时,加入30% HCl 3.5 mL,0.1%间二苯酚1 mL,摇匀后置于80℃中水浴锅中保温10 min,冷却后测OD480。
1.3.6 糖含量的测定 称取0.1 g谷子叶片,快速研磨后,加入80%乙醇5 mL,混匀,放入80℃恒温水浴30 min,在此过程中均匀摇动数次,在3 500×离心10 min,将上清液倒入25 mL容量瓶中,滤渣再用5 mL 80%乙醇二次提取,合并上清液,最后用80%乙醇定容,成为提取液。
向沉淀中加入2 mL蒸馏水,在沸水浴中糊化15 min冷却后加入2 mL 9.2 mol∙L-1HClO4,搅拌15 min后加入4 mL蒸馏水,在4 000×离心10 min,将上清液转入25 mL试管中,再向沉淀中加入2 mL 4.6 mol∙L-1HClO4,在搅拌15 min后加入5 mL蒸馏水,离心后合并上清液,用蒸馏水反复洗涤沉淀后,定容至25 mL,成为淀粉提取液。
还原糖含量测定:加入2 mL提取液(对照为蒸馏水)和2 mL DNS于试管,在沸水浴中加热5 min后,立即冷却,测OD540。
蔗糖含量测定:取5 mL的提取液加入5 mL 6 mol∙L-1HCl,在沸水浴加热10 min,待冷却后加入一滴酚酞,用10% NaOH中和至微红,定容至25 mL容量瓶中,成为待测液。取待测液(对照为蒸馏水)2 mL和2 mL DNS于试管中,在沸水浴中加热5 min,待冷却后测OD520。
淀粉含量测定:取1 mL淀粉提取液(对照为蒸馏水)和5 mL蒽酮-H2SO4于试管中,沸水浴加热10 min,待冷却后测OD620。
1.4 数据处理
利用Excel 2003和DPS 6.5软件进行数据处理和分析。采用Duncan新复极差法进行多重比较。
2 结果
2.1 油菜素内酯对阔世玛胁迫下谷子幼苗农艺性状的影响
阔世玛胁迫下,张杂5号和晋谷21号的株高、叶面积和鲜重与对照相比显著下降了38.54%、38.66%、44.50%、32.89%和57.11%、59.33%。叶面喷施油菜素内酯后,谷子的株高、叶面积和鲜重呈先升高后降低趋势。张杂5号的株高在油菜素内酯浓度为0.1 mg∙L-1时达到最大值,比阔世玛处理显著增高了24.58%,叶面积与鲜重在油菜素内酯浓度为0.1和0.2 mg∙L-1时均达到最大值;晋谷21号的株高、叶面积和鲜重于油菜素内酯浓度为0.1 mg∙L-1时均达到最大,分别比阔世玛处理显著增加了43.12%、47.75%和79.41%(表1)。
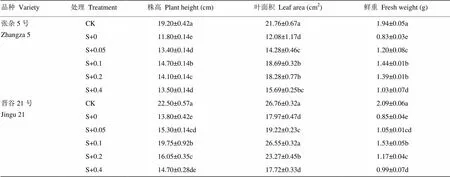
表1 油菜素内酯对阔世玛胁迫下谷子幼苗农艺性状的影响
同一列不同小写字母表示在0.05水平差异显著,0、0.05、0.1、0.2、0.4代表油菜素内酯浓度,S代表7.5 mg∙L-1阔世玛。下同
Different lowercases in the same column indicated significant differences at 0.05 level. 0, 0.05, 0.1, 0.2, 0.4 represented concentration of BR, S represented 7.5 mg∙L-1Sigma Broad. The same as below
2.2 油菜素内酯对阔世玛胁迫下谷子叶片光合色素含量的影响
阔世玛胁迫下,谷子叶片中的光合色素含量显著下降。张杂5号的Chla、Chlb、Car和Chl (a+b)含量分别比对照降低了36.77%、37.55%、38.18%和36.91%;晋谷21号分别比对照降低24.77%、83.32%、26.65%和42.95%。油菜素内酯可显著提高两品种叶片的光合色素含量,且光合色素含量均随BR浓度的增大呈先升高后降低趋势,品种间存在差异。张杂5号的Chl (a+b)、Chla和Car含量均在0.1 mg∙L-1时最高,分别比阔世玛处理升高了44.30、38.50%和57.54%;而晋谷21号的Chla、Chlb、Car和Chl (a+b)含量在0.1和0.2 mg∙L-1处均达到最高,与阔世玛处理显著差异(表2)。
2.3 油菜素内酯对阔世玛胁迫下谷子叶片气体交换参数的影响
阔世玛胁迫下,张杂5号和晋谷21号的n、r、s分别比对照显著降低35.76%、45.32%、54.73%、47.75%和39.29%、31.65%;而i分别比CK显著升高了31.95%和21.27%,与n呈相反的趋势。叶面喷施不同浓度的油菜素内酯在一定程度上可缓解阔世玛的药害,张杂5号和晋谷21号的n、r和s均随着油菜素内酯浓度的增大呈先升高后降低的趋势,其中张杂谷5号的n、r和s均在0.1 mg∙L-1处达到最大,分别比阔世玛处理增加了46.81%、113.23%和67.64%,与对照差异不显著;对于晋谷21号,油菜素内酯在0.1 mg∙L-1时n和r值最大,分别比阔世玛处理增加56.08%和81.90%,Gs在0.1和0.2 mg∙L-1时均达到最大值。叶面喷施油菜素内酯可以降低阔世玛对i的影响i随BR浓度的增大呈先降低后升高的趋势,张杂谷5号与晋谷21号均在0.1和0.2 mg∙L-1降至最低,与阔世玛处理显著差异,但与对照差异不显著(图1)。
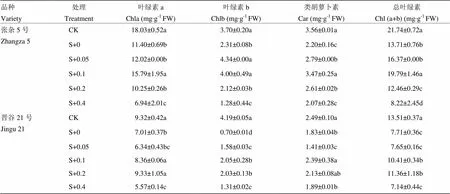
表2 油菜素内酯对阔世玛胁迫下谷子叶片光合色素含量的影响
2.4 油菜素内酯对阔世玛胁迫下谷子叶片荧光参数的影响
阔世玛使张杂5号和晋谷21号的o和NPQ分别升高了13.72%、14.63%和31.58%、37.84%;而m、v/m、ETR分别显著降低9.07%、11.03%,9.18%、11.03%和40.61%、41.59%。叶面喷施BR后,张杂5号的o和NPQ呈先降低后升高趋势,均在0.1、0.2 mg∙L-1处达到最小值;而m、v/m、ETR均呈先升高后降低的趋势,均在0.1 mg∙L-1处达到最大值,分别比阔世玛处理升高了12.93%、12.85%、60.20%。晋谷21号的o随BR浓度的增加无明显差异,m、v/m、ETR随BR浓度的增加呈先增大后降低的趋势,而NPQ呈先降低后升高的趋势,均在0.1 mg∙L-1达到最大值,与对照相比无显著差异(表3)。
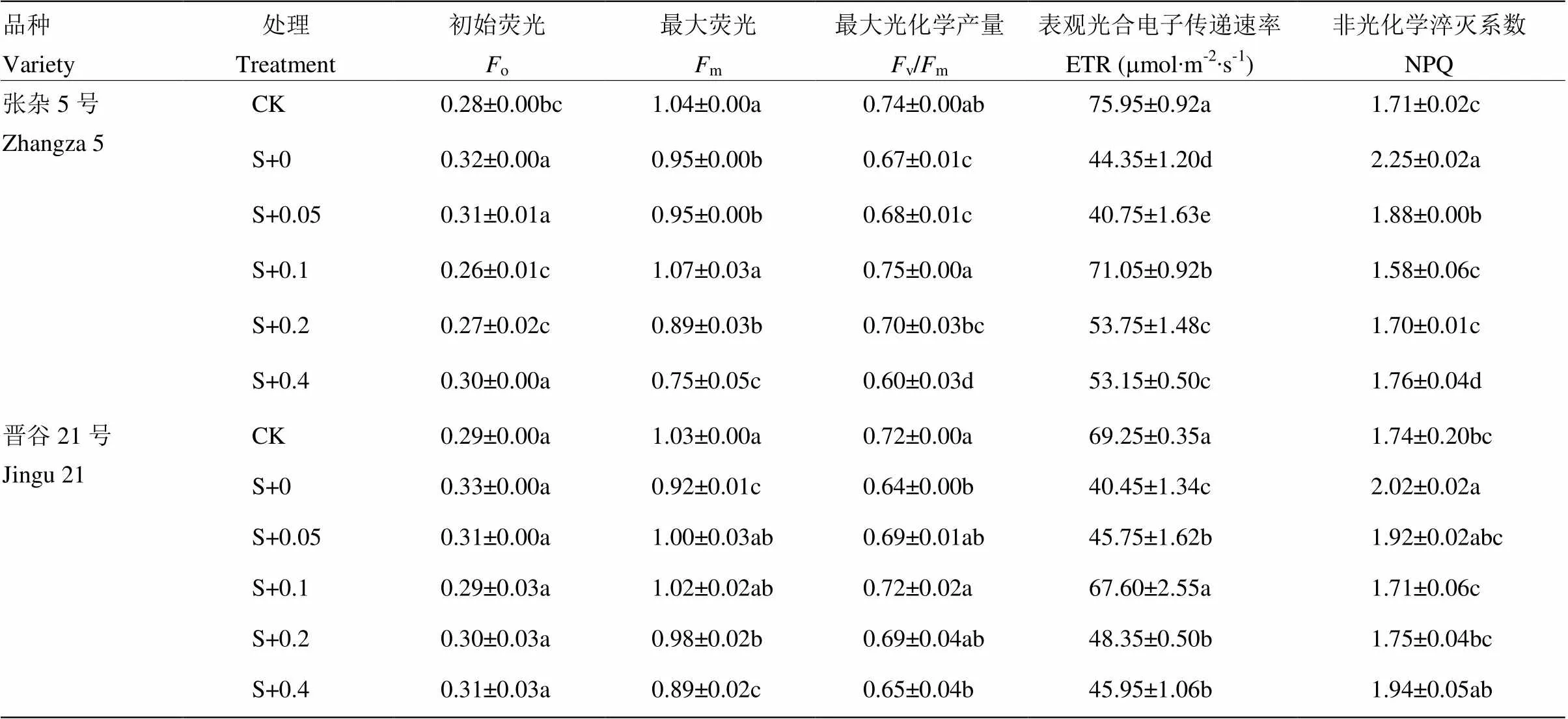
表3 油菜素内酯对阔世玛胁迫下谷子叶片叶绿素荧光参数的影响
阔世玛胁迫使张杂5号和晋谷21号的Y(NO)下降,Y(NPQ)上升,表明光化学能量转换不足以将植物吸收的光能完全消耗掉,谷子通过保护性的调节机制(如热耗散)避免受到损伤。喷施油菜素内酯后,张杂5号和晋谷21号叶片的Y(NO)呈现出先升高后降低的趋势,0.1 mg∙L-1处理比阔世玛胁迫处理分别显著提高了29.22%和5.35%,达到最大值;而Y(NPQ)随油菜素内酯浓度的增大呈现出先降低后升高的趋势,在0.1 mg∙L-1处比阔世玛胁迫处理分别显著降低了12.15%和7.88%(图2)。
2.5 油菜素内酯对阔世玛胁迫下谷子叶片糖含量的影响
阔世玛胁迫提高了张杂谷5号和晋谷21号叶片中的还原性糖、蔗糖和淀粉含量,分别比对照显著升高了42.35%、46.21%,100.84%、57.70%和50.23%、89.70%。叶面喷施油菜素内酯后,3种糖含量随浓度的增大均呈先降低后升高趋势。对于张杂谷5号,0.1 mg∙L-1油菜素内酯处理还原性糖和蔗糖含量最低,比阔世玛处理降低了9.56%和47.36%,而淀粉则是在0.2 mg∙L-1处达到最低,比阔世玛处理降低了28.09%和43.35%。对于晋谷21号,0.05 mg∙L-1BR处理的还原性糖含量最低,比阔世玛胁迫显著降低了33.42%;蔗糖含量则在0.1 mg∙L-1处降至最低,与阔世玛处理相比显著降低了47.36%和36.70%(图3)。
2.6 油菜素内酯对阔世玛胁迫下谷子叶片蔗糖代谢关键酶活性的影响
在阔世玛胁迫下,谷子叶片中的AI活性显著提高,而NI、SS、SPS活性显著降低。张杂谷5号和晋谷21号中的AI活性比对照分别升高了23.53%和73.86%,而NI、SS和SPS活性分别降低了86.82%、71.86%,47.29%、44.04%和44.52%和55.08%。喷施油菜素内酯后,AI随油菜素内酯浓度的增大呈先降低后升高趋势,张杂5号和晋谷21号均在0.1 mg∙L-1降至最低,比阔世玛处理分别显著降低了49.20%和49.10%;而NI、SS、SPS均随油菜素内酯浓度的增大呈先升高后降低的趋势,在0.1 mg∙L-1时达到最大值,分别比阔世玛胁迫显著升高603.77%、129.93%,59.80%、227.87%和44.15%、115.02%(图4)。
3 讨论
在本研究中,阔世玛胁迫显著降低了谷子的株高、叶面积和生物重,严重影响谷子的生长发育,与黄蕾等[16]的研究结果一致。及时喷施0.1 mg∙L-1的油菜素内酯能部分缓解阔世玛对谷子的伤害,使谷子的株高、叶面积和生物重增大,促进其正常生长。
喷施除草剂后植物叶片中的色素含量会明显降低[25-27],影响光合作用的正常进行。磺酰脲类除草剂中苯磺隆和单嘧磺隆会降低张杂谷10号的光合色素含量和光合速率[1],最终影响产量。本试验中,7.5 mg∙L-1的阔世玛显著降低谷子的光合色素含量(Chla、Chlb和Car)、s、r及n,却增加了i。n和r的降低与s的减小有关;而s的减小伴随i的增加,说明叶肉细胞对CO2的同化能力降低[26];并且n下降伴随着光合色素含量的减少及i的升高,说明光合色素含量及非气孔因素共同影响谷子叶片的净光合速率,与高贞攀等[1]的研究结果相似。叶面喷施一定浓度范围的油菜素内酯能提高谷子叶片的光合色素含量,降低i,从而提高n,说明适宜的油菜素内酯能降低阔世玛对谷子叶绿体的伤害,并解除阔世玛对谷子非气孔因素的限制,有效提高光合作用[28]。
o代表光系统Ⅱ反应中心全部开放,原初电子受体(QA)全部氧化时的荧光[29-30]。m代表PSⅡ反应中心原初电子受体全部还原时的荧光。阔世玛胁迫下,谷子o升高,m降低,说明光合机构(PSⅡ反应中心)可逆失活,甚至遭到了破坏。v/m用于度量植物叶片PSⅡ原初光能转换效率,ETR用于度量光化学反应导致碳固定的电子传递效率,NPQ反映的是PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分。阔世玛胁迫下v/m和ETR降低,NPQ升高,说明PSⅡ利用光能的能力降低,导致碳固定的电子传递效率降低,过剩的光能主要以热的形式耗散掉。Y(NPQ)反映了植物耗散过剩光能为热的能力,是光保护能力的重要指标,而Y(NO)则是光损伤的重要指标。阔世玛胁迫下,Y(NO)显著降低,Y(NPQ)显著升高,表明植物接受的光强过剩,需要通过热耗散等调节方式来保护自身。喷施低浓度的油菜素内酯有利于缓解阔世玛药害,提高m、v/m、ETR和Y(NO),降低o、NPQ和Y(NPQ),但高浓度的油菜素内酯可能造成谷子光合机构的破坏。
碳水化合物是植物的基础代谢之一。在植物体内,蔗糖是碳水化合物运输的主要形式,淀粉是主要的能量贮存物质,蔗糖水解后生成果糖和葡萄糖,都属于还原性糖,它们在植物体内合成、运输及含量的变化都受到AI、NI和SS、SPS的共同调节[31]。其中AI在酸性环境下(pH为4.5—5.0)将液泡中蔗糖分解产生果糖和葡萄糖,而NI是在中性条件下对细胞质中的蔗糖进行分解;而SS和SPS途径能可逆的分解和合成蔗糖,对保持植物体内的代谢平衡有重要意义。在逆境胁迫下,植物体内的糖被大量积累,对于调节渗透、维持细胞酶活性具有重要作用[32-33]。DE Sousa等[34]指出,光合作用的降低不仅仅是由于叶绿素含量和气孔导度的降低,还有可能是因为光合作用酶活性及库需求的减少导致光合产物输出能力降低而造成的。在7.5 mg∙L-1的阔世玛胁迫下,谷子叶片中的淀粉含量显著升高,可能是由光合同化产物的运输能力降低所致[31,35]。当淀粉、果糖和葡萄糖不能及时转化为蔗糖时,同化产物由叶片向根部的运输受到抑制,导致叶片中还原性糖、淀粉、蔗糖含量升高。蔗糖的积累导致SPS活性降低,减少了蔗糖的合成,又促进了其分解。在分解蔗糖的3种酶中,AI活性升高,NI和SS活性下降,说明阔世玛对谷子胁迫作用主要集中于细胞质中。糖在叶片中的积累产生的负反馈抑制作用也是光合作用下降的主要原因之一,在逆境胁迫条件下,油菜素内酯能够刺激糖信号,改变植物中糖的含量[36]。叶面喷施油菜素内酯后,在一定浓度范围内显著降低谷子叶片中的还原性糖、蔗糖和淀粉含量,激活了AI活性,抑制了NI、SS、SPS活性,这表明油菜素内酯能够促进碳水化合物由叶片向根部的运输,调节AI、NI、SS和SPS活性,保证谷子幼苗光合同化产物合成和代谢间的平衡,消除负反馈抑制,提高了阔世玛胁迫下谷子幼苗的光合能力,为谷子进一步生长分化提供更多的有机物,这与前人[35,37]研究结果相一致。
4 结论
0.1 mg∙L-1的油菜素内酯可部分缓解7.5 mg∙L-1阔世玛对谷子的伤害,且缓解效果在品种间存在差异。油菜素内酯缓解谷子阔世玛药害的部分机理在于增加了叶片气孔导度和光合色素的含量,提高了PSⅡ的活性,维持了蔗糖代谢平衡,促进了碳水化合物从“源”的卸出。
References
[1] 高贞攀, 郭平毅, 原向阳, 董淑琦, 刘阳, 高虹, 宁娜, 郭美俊, 解丽丽, 冯雷, 王斌强, 余凯凯. 苯磺隆和单嘧磺隆对张杂谷10号光合特性及产量构成的影响. 中国农业大学学报, 2015, 20(6): 36-45.
GAO Z P, GUO P Y, YUAN X Y, DONG S Q, LIU Y, GAO H, NING N, GUO M J, XIE L L, FENG L, WANG B Q, YU K K. Effects of tribenuron-methyl and monosulfuron application on photosynthetic characteristics and yield of Zhangzagu 10., 2015, 20(6): 36-45. (in Chinese)
[2] 李萍, 杨小环, 王宏富, 赵志国, 郝兴宇. 不同谷子((L.))品种对除草剂的耐药性. 生态学报, 2009, 29(2): 860-868.
LI P, YANG X H, WANG H F, ZHAO Z G, HAO X Y. The tolerance of different millet ((L.)) cultivars to herbicides., 2009, 29(2): 860-868. (in Chinese)
[3] 周汉章, 侯升林, 宋银芳, 赵宇, 董立, 贾海燕, 吕芃, 王新玉, 刘恩魁, 薄奎勇. 谷田单子叶杂草对谷子产量损失的影响. 中国农学通报, 2013, 29(12): 179-184.
ZHOU H Z, HOU S L, SONG Y F, ZHAO Y, DONG L, JIA H Y, Lü P, WANG X Y, LIU E K, BO K Y. Impact of monocotyledon weed on millet yield lossin foxtail millet field., 2013, 29(12): 179-184. (in Chinese)
[4] 周汉章, 任中秋, 刘环, 杨万桥, 寇俊杰. 谷田杂草化学防除面临的问题及发展趋势. 河北农业科学, 2010, 14(11): 56-58.
ZHOU H Z, REN Z Q, LIU H, YANG W Q, KOU J J. Problem and development trend of chemical weeding in millet field., 2010, 14 (11): 56-58. (in Chinese)
[5] 邓金保. 磺酰脲类除草剂综述. 世界农药, 2003, 25(3): 24-29, 32.
DENG J B. The sulfonylurea herbicide., 2003, 25(3): 24-29, 32. (in Chinese)
[6] 张琳. 油菜素内酯的生理效应及发展前景. 北方园艺, 2011(20): 188-191.
ZHANG L. Physiological effects and development prospects of brassinosteroids., 2011(20): 188-191. (in Chinese)
[7] YUAN L Y, SHU S, SUN J, GUO S R, Takafumi T. Effects of 24-epibrassinolide on the photosynthetic characteristics, antioxidant system, and chloroplast ultrastructure inL. under Ca(NO3)2stress., 2012, 112(3): 205-214.
[8] 冷佳奕, 叶庆生, 李玲. 植物体中油菜素内酯的信号转导. 植物生理学通讯, 2002, 38(1): 67-71.
LENG J Y, YE Q S, LI L. Brassinosteriods signal transduction in plant., 2002, 38(1): 67-71. (in Chinese)
[9] 罗杰, 陈季楚. 油菜素内酯的生理和分子生物学研究进展. 植物生理学报, 1998, 34(2): 81-87.
LUO J, CHEN J C. The physiological and molecular biological advances of brassinosteroids., 1998, 34(2): 81-87. (in Chinese)
[10] 邓天福, 吴艳兵, 李广领, 王建华. 油菜素内酯提高植物抗逆性研究进展.广东农业科学, 2009(11): 21-25.
DENG T F, WU Y B, LI G L, WANG J H. Reviews for plant stress-resistance promoting related to brassinolides., 2009(11): 21-25. (in Chinese)
[11] Dhriti K, Amandeep R, Vandana G, Nitika K, RenuB. 24-Epibrassinolide mediated changes in photosynthetic pigments and antioxidative defence system of radish seedlings under cadmium and mercury stress., 2014, 10(3): 110-121.
[12] 闫慧萍, 彭云玲, 赵小强, 吕玉燕. 外源24-表油菜素内酯对逆境胁迫下玉米种子萌发和幼苗生长的影响. 核农学报, 2016, 30(5): 988-996.
YAN H P, PENG Y L, ZHAO X Q, Lü Y Y. Effect of exogenous 24-epibrassinolide on seed germination and seedling growth of maize under different stress., 2016, 30(5): 988-996. (in Chinese)
[13] 尚庆茂, 宋士清, 张志刚, 郭世荣. 外源BR诱导黄瓜(L.)幼苗的抗盐性. 中国农业科学, 2006, 39(9): 1872-1877.
SHANG Q M, SONG S Q, ZHANG Z G, GUO S R. Exogenous brassinosteroid induced the salt resistance of cucumber (L.) seedlings., 2006, 39(9): 1872-1877. (in Chinese)
[14] SOARES C, SOUSA A D, PINTO A, AZENHA M, TEIXEIRA J, AZEVEDO R A, FIDALGO F. Effect of 24-epibrassinolide on ROS content, antioxidant system, lipid peroxidation and Ni uptake inL. under Ni stress., 2016, 122: 115-125.
[15] 王忠娣, 王太泉, 王维江, 冯文涛. 甲基二磺隆等药剂混用春季防治麦田恶性杂草安全性试验研究. 陕西农业科学, 2011(2): 49, 192.
WANG Z D, WANG T Q, WANG W J, FENG W T. The safety study of mesosulfuron-methyl controll the malignant weeds in spring wheat field., 2011(2): 49,192. (in Chinese)
[16] 黄蕾, 钟妍婷, 余凯凯, 刘阳, 宋惠洁, 原向阳. 阔世玛对谷子幼苗农艺性状和生理指标的影响. 山西农业大学学报 (自然科学版), 2015, 35(6): 603-607.
HUANG L, ZHONG Y T, YU K K, LIU Y, SONG H J, YUAN X Y. Effects of Sigma Broad on the agronomic characteristics and physiological indices of foxtail millet seedlings., 2015, 35(6): 603-607. (in Chinese)
[17] 钟妍婷, 原向阳, 刘哲, 徐佳燕, 温芳英, 张美涛, 黄蕾, 温银元, 董淑琦, 张丽光, 郭平毅. 油菜素内酯处理对谷子农艺性状和生理特性的影响. 作物杂志, 2015(2): 124-128.
ZHONG Y T, YUAN X Y, LIU Z, XU J Y, WEN F Y, ZHANG M T, HUANG L, WEN Y Y, DONG S Q, ZHANG L G, GUO P Y. Effect of brassinolide on agronomic and physiological properties of foxtail millet., 2015(2): 124-128. (in Chinese)
[18] 乔琳, 李杰, 胡春红, 乔传英. 外施表油菜素内酯缓解玉米幼苗铅毒害机制研究. 核农学报, 2014, 28(11): 2126-2131.
QIAO L, LI J, HU C H, QIAO C Y. The study on the mechanism of external epibrassinolide relieving lead toxicity on maize seedlings., 2014, 28(11): 2126-2131. (in Chinese)
[19] 周小毛, 柏连阳, 黄柯程, 卜小莉. 天然芸苔素内酯减轻胺苯磺隆对水稻药害的作用. 杂草科学, 2003(1): 26-27.
ZHOU X M, BAI L Y, HUANG K C, BU X L. The effects of natural brassinolide alleviates the injury of ethametsulfuron in rice., 2003(1): 26-27. (in Chinese)
[20] 沐兴武, 陈建国, 李良. 芸苔素内酯解除甲黄隆对水稻药害的研究. 农药, 2002, 41(11): 36-38.
MU X W, CHEN J G, LI L. The effects of brassinolide alleviates the injury of metsulfuron in rice., 2002, 41(11): 36-38. (in Chinese)
[21] 黄允才, 张格成,胡光华. 天然芸苔素缓解除草剂药害的作用. 农药, 2000, 39(6): 40-42.
HUANG Y C, ZHANG G C, HU G H. The effects of natural brassinolide alleviates the injury of herbicide., 2000, 39(6): 40-42. (in Chinese)
[22] 杨艳君, 赵红梅, 王慧阳, 曹玉风. 外源油菜素内酯对谷子2,4-D胁迫的缓解效应. 山西农业科学, 2015, 43(9): 1165-1168.
YANG Y J, ZHAO H M, WANG H Y, CAO Y F. Exogenous EBR on alleviating 2,4-D stress in foxtail millet seedlings., 2015, 43(9): 1165-1168. (in Chinese)
[23] 邹琦. 植物生理学实验指导. 北京: 中国农业出版社, 2000.
ZOU Q.. Beijing: China agriculture press, 2000. (in Chinese)
[24] 梁建生, 曹先祖, 徐生, 朱庆森, 宋平. 水稻籽粒库强度与淀粉累积之间关系的研究. 作物学报, 1994, 20(6): 685-691.
LIANG J S, CAO X Z, XU S, ZHU Q S, SONG P. Studies on the relationship between the grain sink strength and it’s starch accumulation in rice ()., 1994, 20(6): 685-691. (in Chinese)
[25] YUAN X Y, GUO P, QI X, NA N, WANG H, WANG H F, WANG X, YANG Y J. Safety of herbicide Sigma Broad on Radix Isatidis (, Fort.) seedlings and their photosynthetic physiological responses., 2013, 106(1/2): 45-50.
[26] 原向阳, 郭平毅, 黄洁, 张丽光, 郭俊, 解丽丽, 聂萌恩, 王玉国, 王宏富. 缺磷胁迫下草甘膦对抗草甘膦大豆幼苗光合作用和叶绿素荧光参数的影响. 植物营养与肥料学报, 2014, 20(1): 221-228.
YUAN X Y, GUO P Y, HUANG J, ZHANG L G, GUO J, XIE L L, NIE M E, WANG Y G, WANG H F. Effect of glyphosate on photosynthesis and chlorophyll fluorescence of leaves of glyphosate- resistant soybean [(L.) Merr] seedlings under phosphorus deficiency stress., 2014, 20(1): 221-228. (in Chinese)
[27] 刘阳, 郭平毅, 原向阳, 高贞攀, 王斌强, 宋惠洁, 黄蕾, 余凯凯. 叶面喷施骠马对张杂谷10号光合特性及产量构成的影响. 山西农业大学学报(自然科学版), 2015, 35(6): 608-613.
LIU Y, GUO P Y, YUAN X Y, GAO Z P, WANG B Q, SONG H J, HUANG L, YU K K. Effect of foliar application of fenoxaprop-p-ethy on photosynthetic characteristics and yield of Zhangza10., 2015, 35(6): 608-613. (in Chinese)
[28] FARIDUDDIN Q, KHALIL R R, MIR B A, YUSUF M, AHMAD A. 24-Epibrassinolide regulates photosynthesis, antioxidantenzyme activities and proline content ofunder salt and/or copper stress., 2013, 185(9): 7845-7856.
[29] 张守仁. 叶绿素荧光动力学参数的意义及讨论. 植物学通报, 1999, 16(4): 444-448.
ZHANG S R. A discussion on chlorophyll fluorescence kinetics parameters and their significance., 1999, 16(4): 444-448. (in Chinese)
[30] HAIRAT S, KHURANA P. Improving photosynthetic responses during recovery from heat treatments with brassinosteroid and calcium chloride in Indian bread wheat cultivars., 2001, 6(11): 1827-1849.
[31] KEUGTEN A J, PAWELZIK E. Impacts of NaCl stress on plant growth and mineral nutrient assimilation in two cultivars of strawberry., 2009, 65(2/3): 170-176.
[32] SHEN C H, KRISHNAMURTHY R, YEH K W. Decreased L-ascorbate content mediating bolting is mainly regulated by the galacturonate pathway in., 2009, 50(5): 935-946.
[33] GIBSON S I. Plant sugar-response pathways. Part of a complex regulatory web., 2000, 124(4): 1532-1539.
[34] DE SOUSA C A F, SODEK L. Alanine metabolism and alanine aminotransferase activity in soybean () during hypoxia of the root system and subsequent return to normoxia., 2003, 50(1): 1-8.
[35] 寇江涛. 24-表油菜素内酯诱导下紫花苜蓿耐盐性生理响应研究[D]. 兰州: 甘肃农业大学, 2016.
KOU J T. Physiological mechanism of 24-epibrassinolide-regulated salt stress tolerance in[D]. Lanzhou: Gansu Agricultural University, 2016. (in Chinese)
[36] YUAN L Y, ZHU S D, LI S H, SHU S, SUN J, GUO S R. 24-Epibrassinolide regulates carbohydrate metabolism and increases polyamine content in cucumber exposed to Ca(NO3)2stress., 2014, 36(11): 2845-2852.
[37] KHELIL A, MENU T, RICARD B. Adaptive response to salt involving carbohydrate metabolism in leaves of a salt-sensitive tomato cultivar., 2007, 45(8): 551-559.
(责任编辑 岳梅)
Effects of Brassinolide on Photosynthesis, Chlorophyll Fluorescence Characteristics and Carbohydrates Metabolism in Leaves of Foxtail Millet () Under Sigma Broad Stress
YANG HuiJie1, YUAN XiangYang1, GUO PingYi1, DONG ShuQi1, ZHANG LiGuang2, Wen YinYuan1, Song XiE1, Wang HongFu1
(1College of Agronomy, Shanxi Agricultural University, Taigu 030801, Shanxi;2Institute of Crop Sciences, Shanxi Academy of Agricultural Sciences, Taiyuan 030031)
【Objective】The effects of brassinolide (BR) on photosynthesis, chlorophyll fluorescence characteristics and carbohydrates metabolism of foxtail millet () under Sigma Broad stress wereexplored to provide some theoretical bases and technological approaches for security application of sulfonylurea herbicide and the alleviation of herbicide phytotoxicity in foxtail millet field. 【Method】Completely randomized design and repeated 3 times, using high-yielding hybrid Zhangza 5 and Jigu 21 withgeneral high quality as materials, through pot experiments, applicating 7.5 mg∙L-1of Sigma Broad at three-leaf to five-leaf stage, and after 1 d foliar spraying water (CK), 0.05, 0.1, 0.2 and 0.4 mg∙L-1of BR. the effect of BR on growth parameters (plant height, leaf area, fresh mass), photosynthetic pigment content (Chla, Chlb, Car, Chl (a+b)), gas exchange parameters, chlorophyll fluorescence parameters, sugar content, activities of key enzyme of sucrose metabolism were determined and analyzed to reveal the effects ofBR on modulation of photosynthetic capacity and carbohydrates metabolism by Sigma Broad of foxtail millet after 7 d.【Result】 Sigma Broad significantly decreased plant height, leaf area, fresh mass, photosynthetic pigment content, net photosynthetic rate (n), transpiration rate (r), stomatal conductance (s), the maximum photochemical yield (Fv/Fm), apparent photosynthetic electron transport rate (ETR), quantum yield dissipated by non-regulatory energy (Y(NO)), activity of neutral invertase (NI), sucrose synthetase (SS) and sucrose phosphate synthase (SPS), but significantly increased intercellular CO2concentration (i), and the quantum yield dissipated by regulatory energy (Y (NPQ), reducing sugar, sucrose and starch content. One day after Sigma Broad treatment, spraying BR dramatically increased plant height, leaf area, fresh mass, photosynthetic pigment content,n,r,s,v/m, ETR, Y (NO), NI, SS and SPS of foxtail millet, but decreasedi, Y (NPQ), reducing sugar, sucrose and starch content. BR at 0.05-0.1 mg∙L-1had a better effect on relieving the Sigma Broad of Zhangza 5, BR at 0.1-0.2 mg∙L-1had a better effect on relieving the Sigma Broad of Jingu 21.BR at ≥0.4 mg·L-1did not alleviate the phytotoxicity of Sigma Broad.【Conclusion】Results showed that one of the reasons that 7.5 mg∙L-1of Sigma Broad made obvious damage to foxtail millet is that the photosynthetic pigment content was reduced, and photosynthetic pathways and sucrose metabolism were hindered, the PSⅡ photochemical activity was inhibited,and the normal operation of sucrose metabolism was affected. treatment with BR at 0.1 mg∙L-1could alleviate the inhibition of photosynthesis of Sigma Broad in foxtail millet through improving the photosynthetic pigment content, increasing the stomatal conductance, raising PSⅡ photochemical activity, promoting the discharge of carbohydrates and maintaining balance of sucrose metabolism.
foxtail millet (); brassinolide; Sigma Broad; photosynthetic capacity;chlorophyllfluorescence characteristics; carbohydrates metabolism
2017-01-17;接受日期:2017-02-16
国家自然科学基金(31301269)、山西省农业科技攻关项目(20150311016-2)、山西农业大学青年拔尖创新人才支持计划(TYIT201406)、山西省科技重点研发计划(2015-TN-09)、“十二五”国家科技支撑计划(2014BAD07B01-09)、2015年山西省农业科技成果转化和推广示范项目(SXNKTG03)
杨慧杰,E-mail:yhj9292@163.com。通信作者原向阳,E-mail:yuanxiangyang200@163.com

