新疆褐牛基因外显子多态性及其与SCS和泌乳性状关联性分析
刘丽元,周靖航,张梦华,李金霞,方季青,谭世新,王爱芳,黄锡霞,王雅春
新疆褐牛基因外显子多态性及其与SCS和泌乳性状关联性分析
刘丽元1,2,周靖航2,张梦华1,李金霞1,方季青3,谭世新4,王爱芳4,黄锡霞1,王雅春5
(1新疆农业大学动物科学学院,乌鲁木齐 830052;2宁夏大学农学院,银川 750021;3新疆乌鲁木齐种牛场,乌鲁木齐 830000;4新疆天山畜牧生物工程股份有限公司,新疆昌吉831100;5中国农业大学动物科技学院,北京 100193)
【目的】探索和基因多态性与新疆褐牛体细胞评分及泌乳性状的相关性,旨在寻找与新疆褐牛体细胞评分及泌乳性状相关的分子标记。【方法】以新疆乌鲁木齐种牛场、新疆天山畜牧生物工程股份有限公司共169头新疆褐牛母牛为试验对象,以2008—2015年间的生产性能测定记录(包括乳脂率、乳蛋白率、总固体含量、乳糖率和体细胞计数等)和305 d产奶量为试验数据,基于课题组前期15头中国荷斯坦牛DNA混池重测序的结果筛选外显子区域10个SNPs,采用基质辅助激光电离飞行时间质谱法(sequenom massArray genotype)分型技术验证10个SNP位点的遗传多态性,运用SAS8.1软件GLM过程对这10个SNP突变与新疆褐牛体细胞评分(SCS)、305 d产奶量、乳脂率、乳蛋白率、乳糖率和总固体的关联程度进行统计分析。【结果】10个SNP位点均具有多态性,χ2检验表明群体中9个SNP位点符合Hardy-Weinberg平衡状态。关联分析结果表明基因两个位点(T98741711C和G98736141A)均与新疆褐牛305 d产奶量达到极显著关联(<0.001),其中TT型和GG型个体的产奶量最高;(C45667492G)位点与新疆褐牛乳糖率达到显著关联(<0.005),其中GG型个体的乳糖率最高;(T14533269A)位点与新疆褐牛乳脂率和总固体含量达到显著关联(<0.005),与SCS达到极显著关联(<0.001),其中TT型个体的乳脂率和总固体含量均最高,AA型个体的SCS极显著高于AT和TT型;(C26758055G)位点与新疆褐牛乳蛋白率和总固体含量达到极显著关联(<0.001),其中GG型个体显著高于CC和GC型个体。连锁不平衡分析与单倍型构建的结果发现10个SNPs构建了两个单倍型模块,其中SNP1和SNP2位点之间处于连锁不平衡状态(2>0.3),SNP4和SNP10位点之间处于强连锁不平衡状态(2>0.6),随后分析了单倍型与SCS和泌乳性状之间的相关性,发现单倍型与新疆褐牛SCS和泌乳性状无显著关联(>0.001)。【结论】 初步发现了和与新疆褐牛SCS和泌乳性能相关,结果可为新疆褐牛产奶性状的分子标记辅助选育提供参考和依据。
新疆褐牛;SCS;泌乳性状;MassArray;关联分析
0 引言
【研究意义】分子育种技术在家畜育种中的应用,不仅可以增加选择强度、提高选择准确性,同时还可实现早期个体的基因型选择[1-2]。而分子育种技术应用的前提是找到影响家畜经济性状的主效基因,本研究以初步探索、、、、和多态性与新疆褐牛体细胞评分及泌乳性状的相关性,以期为新疆褐牛产奶性状的分子标记辅助育种提供理论依据。【前人研究进展】近十年来,遗传标记育种、转基因技术、克隆技术等高新生物技术的研究取得了一定的进展,给奶牛育种工作带来了新机遇。众多的分子标记中,SNP(single nucleotide polymorphism)标记是当前遗传标记研究中最多的,作为目前最具发展潜力的分子标记,因其在基因组中数量多、分布广,已经广泛应用于基因组制图、疾病相关性分析、群体遗传学及药物研究等众多领域[3]。目前,越来越多的泌乳性状QTL和候选基因被相继报道[4-5],如王丽娟等[6]发现第4外显子C8377G位点与产奶量显著相关,VIILALA等[7]发现上F279Y突变显著影响乳蛋白率和乳脂率,LEONARD等[8]对13 662头牛群体进行多态性研究,发现第8 514位点突变与乳脂率和乳蛋白率性状存在显著关联,王杰等[9]研究发现,中国荷斯坦牛内含子上的多态性与乳脂率和乳蛋白率显著关联,张晓东等[10]研究发现,外显子8的多态性与中国荷斯坦牛的乳脂率显著相关,贾晋等[11]研究发现,不同基因型之间的305 d产奶量和乳脂率有显著差异外,还发现该基因对乳蛋白率影响显著。季敏等[12]采用直接测序和PCR-RFLP技术研究槟榔江水牛变异,结果发现多态性与产奶量及乳脂率等产奶性状具有显著相关性。研究表明,利用候选基因策略寻找影响产奶性状的主效基因进而应用于奶牛的遗传改良,从分子遗传角度来说是可行的[13]。【本研究切入点】新疆褐牛为乳肉兼用型品种,其作为新疆地区特有的品种资源,具有高乳蛋白、高乳脂、低体细胞数、抗逆性强、适应性好,乳肉平衡等优秀特质。产奶量和乳成分性状(主要包括乳脂率、乳蛋白率、乳糖率等)作为奶牛生产中的重要经济性状,属典型微效多基因控制的数量性状,不仅对奶业发展有巨大影响[14],而且在新疆褐牛产业发展中也占有重要地位。乳房炎是世界奶业的常见疾病,对牛产奶量和乳品质都会造成较大影响,通常以体细胞数为指示性状,选育提高乳房炎抗性是增加奶牛生产效益的重要措施。基质辅助激光解吸电离飞行时间质谱技术(MALDI-TOF-MS)是近年来应用在生物大分子检测领域的一项新技术,在基因组SNP的分型检测中具有高精准度、灵敏度高、一次可检测多个SNPs且成本低和周期短等优点。该分型技术是在单碱基延伸的基础上与质谱技术相结合从而进行分型,其原理是通过基质辅助激光解吸电离飞行时间质谱技术,检测延伸产物分子量的大小,应用专用的分析软件进行突变位点的分型。目前,国内外已有很多文献报道生物质谱技术在SNP分型方面的应用,研究表明,质谱检测法与其他检测方法相比,准确性更高[15-17]。【拟解决的关键问题】将分子育种技术应用于新疆褐牛育种工作中势在必行,但目前对新疆褐牛泌乳性状相关基因的研究还相对较少,因此,本文根据前期中国荷斯坦牛重测序结果选取了10个SNPs位点,探索这些SNPs的遗传多态性,并分析其与新疆褐牛SCS、305d产奶量、乳脂率、乳蛋白率、乳糖率和总固体数之间的相关性,试图寻找新疆褐牛体细胞评分和泌乳性状的有效分子标记,为今后新疆褐牛乳用性能分子育种奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 本研究以新疆地区新疆乌鲁木齐种牛场和新疆天山畜牧生物工程股份有限公司2个牛场169头具有DHI测定记录、年龄及胎次等数据的新疆褐牛母牛作为实验动物,同时采集奶样和血样。奶样自2008年至2015年期间每月采集一次送至新疆维吾尔自治区奶业办公室进行DHI测定,获得乳脂率、乳蛋白率、乳糖率、总固体以及体细胞计数等表型数据;血液为2014年分别在两个牛场采集,EDTA抗凝,用于基因型检测。
1.1.2 性状表型记录 产奶性状记录包括305 d产奶量(不足305 d的产奶量根据付雪峰[18]制定的新疆褐牛305 d产奶量校正系数进行校正)、乳脂率、乳蛋白率、乳糖率、总固体和体细胞计数(Somatic cell counts,SCC)。在进行统计分析时,利用公式将体细胞数转换为呈正态分布的体细胞评分(Somatic cell score,SCS):SCS=log2(SCC/100000)+3,并保留2位有效数字。对DHI测定记录的质控遵循以下标准[19]:305 d产奶量为1 000—18 000 kg;乳脂率为2%—7%;乳蛋白率为2%—6%;乳糖率为2%—5.5%;总固体为9%—18%;SCC为1—100 000。
1.1.3 影响因素水平划分 数据来自新疆乌鲁木齐种牛场和新疆天山畜牧生物工程股份有限公司,由于新疆天山畜牧生物工程股份有限公司样本量较少,在分析时不考虑场效应;年份和季节均以自然产犊年季划分,以中国气象数据网公布的新疆地区近30年的平均气温记录,依据候温法将新疆地区的季节划分为春季(4—5月)、夏季(6—8月)、秋季(9月)、冬季(10月至次年3月),各月份、各季节平均气温见表1和表2;胎次按自然胎次划分6个水平(1—6胎及以上);泌乳月划分为12个水平。

表1 1981-2010年各月份平均气温

表2 1981-2010年各季节平均气温
1.2 方法
1.2.1 血液基因组DNA提取 利用苯酚-氯仿抽提法进行基因组DNA提取,TE缓冲液溶解后,利用NANODROP2000紫外分光光度计和凝胶电泳检测DNA提取质量,将合格DNA放置于-20°冰箱保存备用。
1.2.2 DNA池重测序筛选SNP 课题组前期以15头新疆褐牛为试验对象,运用DNA混池重测序技术筛选到大量SNPs(表3),为保证后续试验的可行性和准确性,将对筛选出的SNPs进行进一步的筛选,筛选条件如下:①变异位点位于外显子区域;②变异类型选取错义突变;③一个基因出现多个位点变异的SNPs;④样本基因型为杂合变异;⑤测序深度大于40,测序深度越深,变异位点准确性越高。
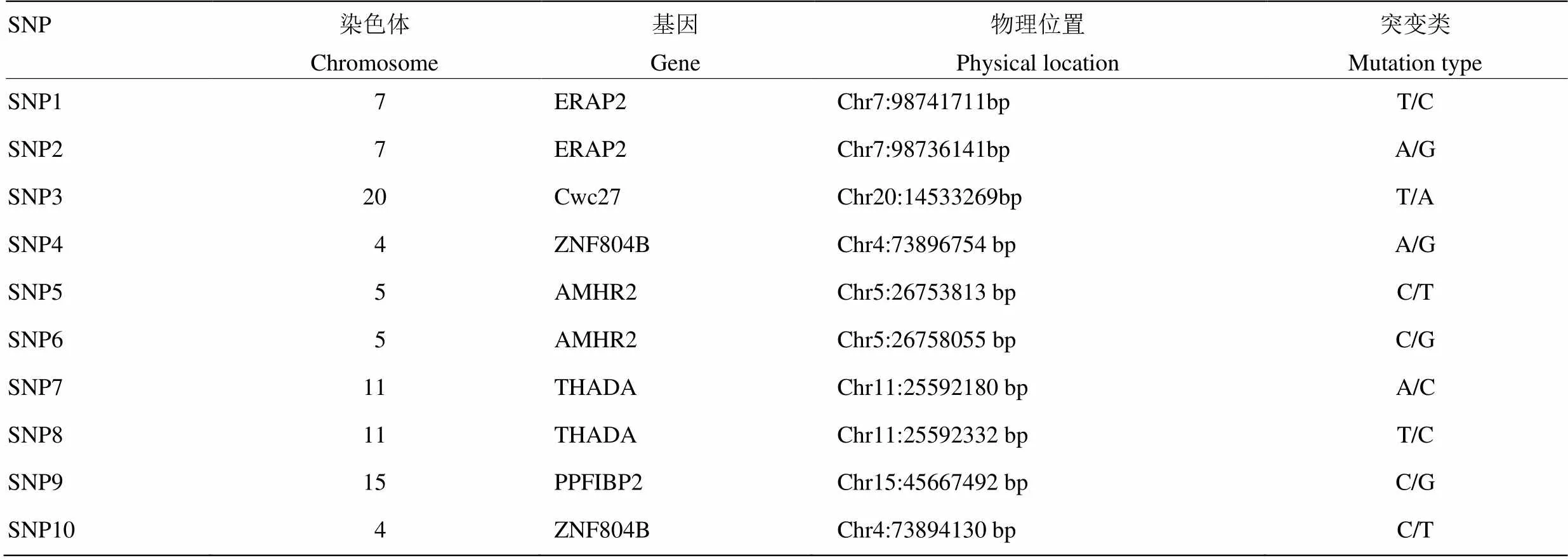
表3 10个SNPs相关信息
文中选择错义突变SNP的原因:错义突变是编码某种氨基酸的密码子经碱基替换以后,变成编码另一种氨基酸的密码子,从而使多肽链的氨基酸种类和序列发生改变。而氨基酸是构成蛋白质的基本单位,氨基酸的改变可能会改变其编码的蛋白质,而蛋白质对基因的表达有调节作用,蛋白质的改变会引起基因的功能变化[20]。
1.2.3 SNP分型 将上一步确定的SNP利用Illumina公司的MassARRAY Genotype分型技术进行SNP分型。主要步骤如下[21]:(1)引物设计:对目的SNP做PCR多重设计,使每一个SNP具有一对扩增引物及一个延伸引物,以便待分型的多个核苷酸片段能够在相同的反应体系中做多重PCR反应;(2)多重PCR扩增;(3)SAP反应;(4)延伸反应;(5)去盐。将结束反应的板内均匀填充树脂并放置10 min晾干,每个孔加入16 μL DEPC水,并在Dimpe板上缓慢扣放样本板,轻轻敲打使树脂能够落入样本孔中,离心均匀1 h。
根据已知SNP位点序列信息,使用Sequenom MassArray Assay Design软件对待测SNPs进行引物设计,引物设计中包括PCR扩增引物和单碱基延伸引物。引物设计完成后经软件测试可以使用后交由生物公司进行引物合成。共设计10对引物,10个SNPs由DNA混池全基因组重测序结果提供,表4为各位点引物信息表。
1.2.4 统计分析 计算基因型频率、等位基因型频率并检测各位点的哈代-温伯格平衡情况。运用SAS 8.1的GLM过程对基因型与SCS和泌乳性状进行关联分析的线性模型为:
Yijklm=μ+Gi+Lj+Sk+Pl+eijklm
式中,Y为产奶性状表型值(305 d 产奶量、乳脂率、乳蛋白率、乳糖率、总固体数和SCS);为群体均值;G为基因型效应;L为年季组合效应;S为胎次效应;P为泌乳月效应;e为随机误差。
为保证多重比较过程总的I型错误概率低于0.05和0.01,将显著性水平校正为<0.005(显著)和<0.001(极显著)。
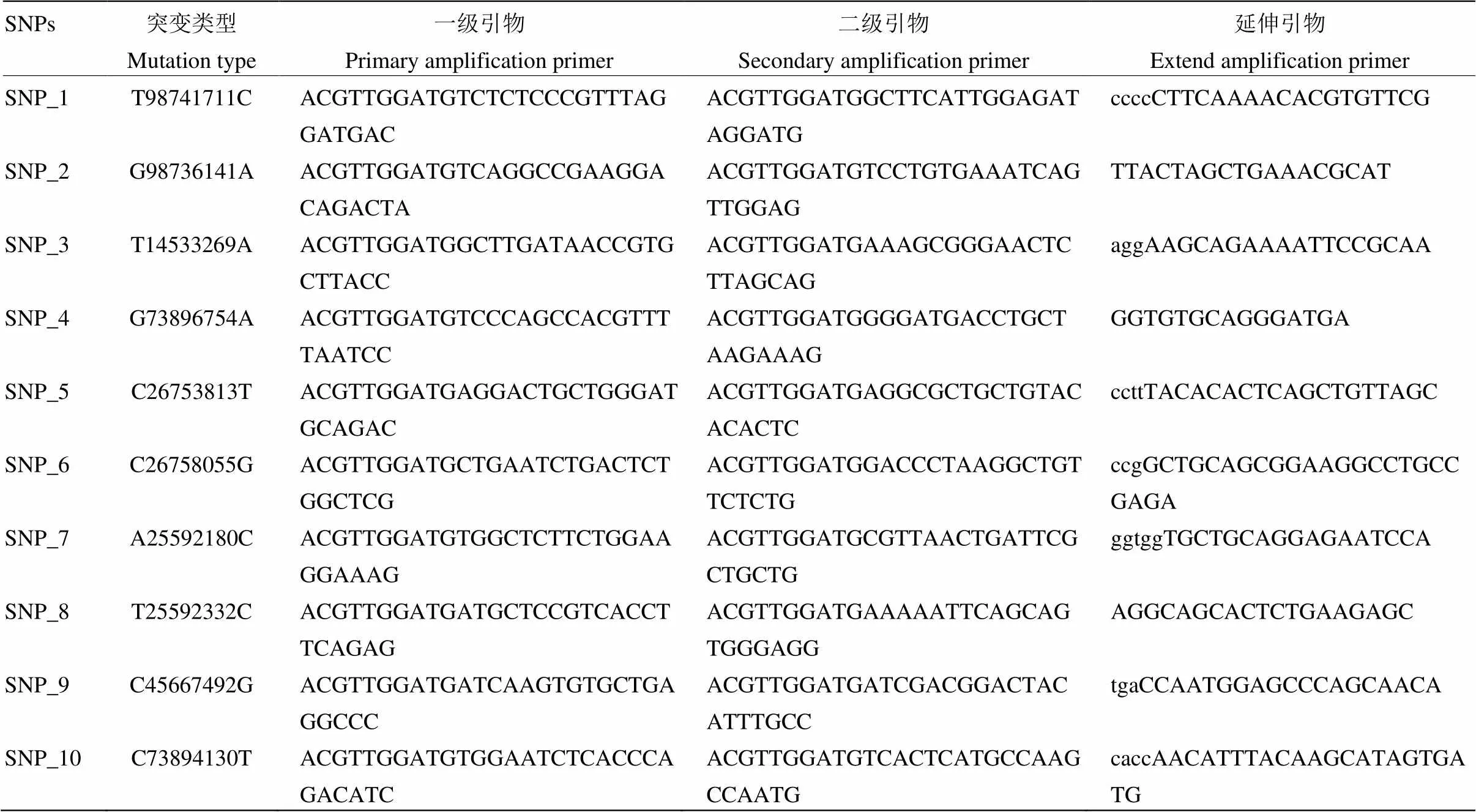
表4 引物信息表
2 结果
2.1 产奶性状描述性统计
根据2008年至2015年课题组对两个新疆褐牛牛群进行性能测定数据,统计分析得出SCS和泌乳性状的简单统计量,结果见表5。
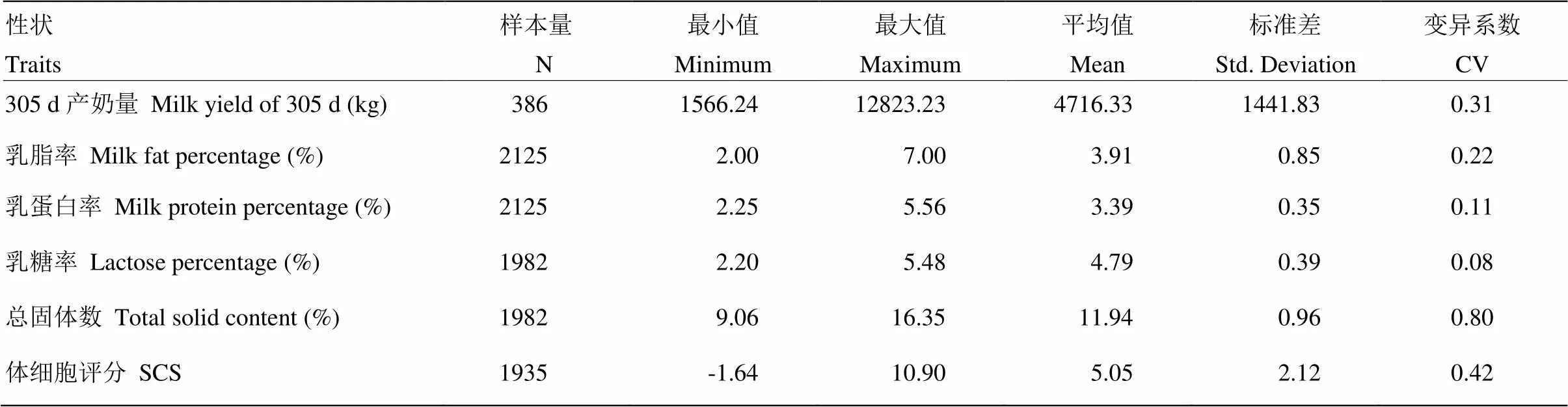
表5 泌乳性状及SCS描述性统计量
2.2 基因型检测
利用MassArray技术对新疆褐牛169个样本10个SNPs进行基因型分型,通过质谱软件统计分析得到了分型结果,10个SNPs均具有多态性,且未识别出的碱基数较少,基因多态性以AG、CT基因型为主,可以进行下一步SNP位点多态性与产奶性状遗传效应的研究。
2.3 群体等位基因频率和基因型频率
利用Excel统计上述10个SNPs的等位基因频率和基因型频率,并进行哈代-温伯格平衡检验,结果见表6。χ2检验表明SNP1、SNP2、SNP3、SNP4、SNP6、SNP 7、SNP 8、SNP 9和SNP 10这9个位点均处于Hardy-Weinberg平衡状态(>0.05)。SNP5、SNP6和SNP9位点的优势等位基因为C,其等位基因频率分别为0.985、0.912、0.736,其中SNP5、SNP6、SNP9位点的优势基因型为CC,其优势基因型频率分别为0.975、0.843、0.534;SNP1位点的优势基因型为CT,优势基因型频率为0.435。SNP2、SNP3、SNP4、SNP7位点的优势等位基因为A,其优势等位基因频率分别为0.607、0.801、0.710、0.984,其中SNP3、SNP4、SNP7位点的优势基因型为AA,其优势等位基因型频率分别为0.641、0.503、0.968;SNP2位点的优势基因型为AG,其基因型频率为0.448。SNP8和SNP10位点的优势等位基因为T,其优势等位基因频率分别为0.984、0.587,其中SNP8位点的优势基因型为TT,其基因型频率为0.968,SNP10的优势基因型为CT,其基因型频率为0.439。SNP5、SNP6、SNP7、SNP8位点处于低度多态(PIC<0.25),其余6个位点均处于中度多态(0.25<PIC<0.5)。
2.4 10个SNPs与泌乳性状及SCS的关联分析
表7显示10个SNPs不同基因型对新疆褐牛305 d产奶量、乳脂率、乳蛋白率、乳糖率、总固体数及SCS的影响。由表可知,SNP1和SNP2位点对新疆褐牛305 d 产奶量有极显著影响(<0.001),基因型为TT和GG的个体305 d 产奶量最高。SNP3位点对乳脂率和总固体含量有显著影响(<0.005),对SCS有极显著影响(<0.001),其中纯合型TT个体乳脂率和总固体均最高,而杂合型AT个体两个指标均较低,AA型个体SCS最高。SNP6对乳蛋白率和总固体性状均有极显著影响(<0.001),其中GG型个体具有较高的乳蛋白率和总固体含量。SNP9位点对乳糖率有显著影响(<0.005),其中基因型为GG的个体乳糖率显著高于CC型,而GC型显著高于CC型。
关联分析结果表明,SNP1和SNP2与新疆褐牛305 d产奶量达到极显著关联(<0.001);SNP3与乳脂率和总固体达到显著关联(<0.005),与SCS性状达到极显著关联(<0.001);SNP6与乳蛋白率和总固体均达到极显著关联(<0.001);SNP9与乳糖率达到显著关联(<0.005)。
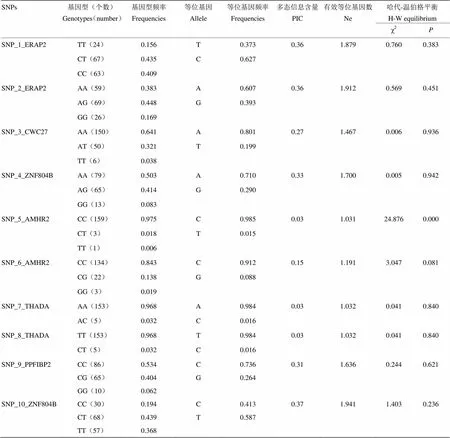
表6 新疆褐牛10个位点的基因型频率和等位基因频率及χ2检验
2.5 单倍型与连锁不平衡分析
运用Haploview软件对所有SNPs进行了单倍型与连锁不平衡分析,如图1所示,得出10个SNP位点的连锁不平衡检测结果。图的上方为标记在基因中的位置,红色方块表示D’>0.8,方块颜色越浅表示D’值越低,加框的标记处于同一单倍型域中。图2为单倍型组成,连线表示单倍型域可能的单倍型组合,下方数字是单倍型域间主要的单倍型组合的比例。由图2可以看出,本研究群体中,10个SNPs共构成2个单倍型模块,分别命名为Block1、Block2,其中Block2处于强连锁不平衡状态(2>0.6)。Block1包含SNP4和SNP10,其中D’和2值为1.000和0.587,因此Block1为连锁不平衡状态,构成3种单倍型,其中TA、CG和CA单倍型频率分别为0.596、0.292、0.121;Block2包含SNP1和SNP2,其中D’和2值为1.000和0.921,因此Block2为强连锁不平衡状态,构成3种单倍型,其中AC、GT和GC单倍型频率分别为0.607、0.373、0.019,两个单倍型模块之间的连锁不平衡系数D’为0.36(图2)。
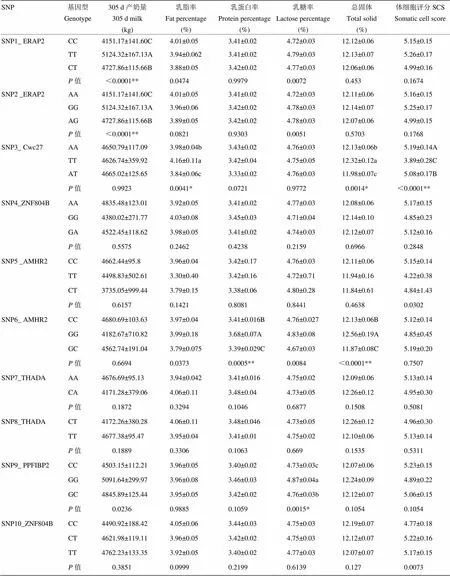
表7 10个SNP与泌乳性状及SCS的关联分析(最小二乘均值±标准误)
同一组数据不同小写字母表示差异显著(<0.005);同一组数据不同大写字母表示差异极显著(<0.001)
Different letter of small (<0.005) and capital (<0.001) letters among the genotypes of the same SNP indicate significant difference
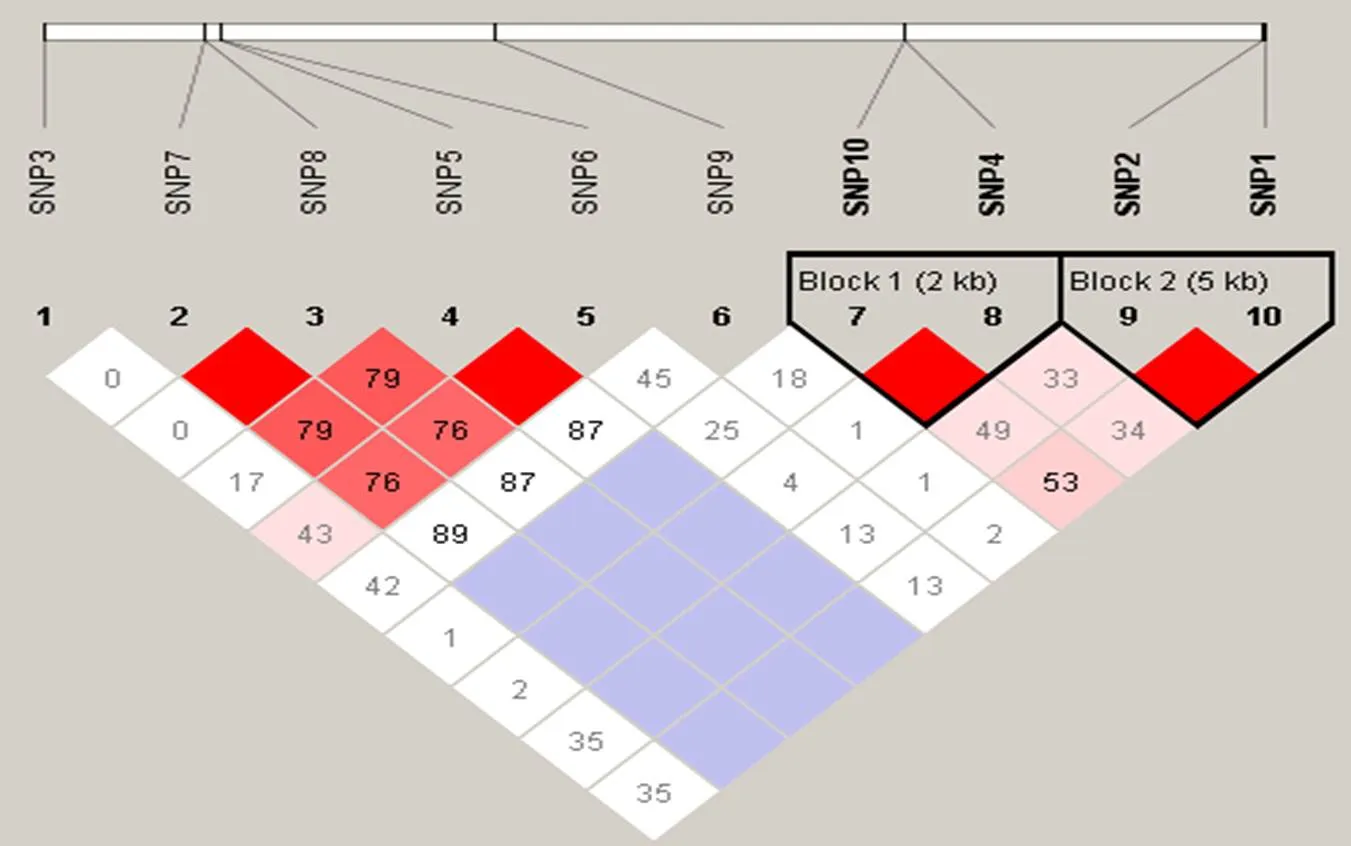
图1 10个SNPs连锁不平衡估计
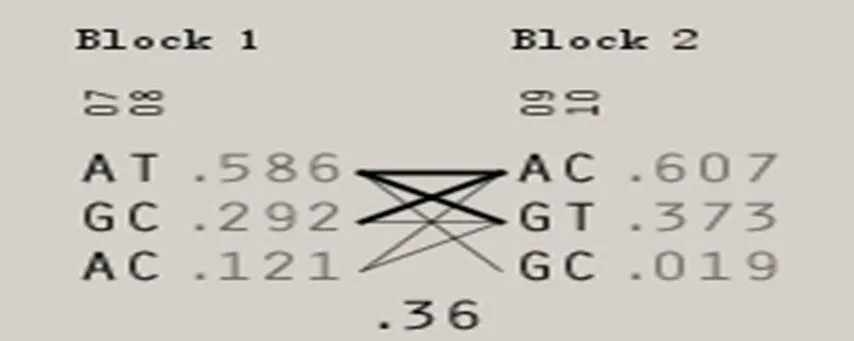
图2 单倍型域中的单倍型组成
2.6 单倍型与泌乳性状及SCS关联分析
运用SAS8.1软件进行单倍型与新疆褐牛SCS及泌乳性状的关联分析,结果如表8可知,共存在5种单倍型(本研究群体中未发现GGCC个体),在进行各单倍型与新疆褐牛泌乳性状的关联分析时,均未发现单倍型与泌乳性状的关联性,可能是由于样本量较少,或者是还有其他标记与本研究的SNPs位点紧密连锁影响着新疆褐牛SCS和泌乳性状。
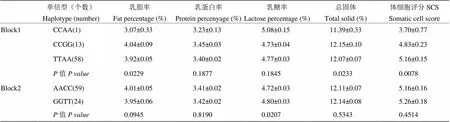
表8 单倍型与泌乳性状和SCS的关联分析(最小二乘均值±标准误)
<0.005表示差异显著;<0.001表示差异极显著
<0.005 indicate significant difference;<0.001 indicate highly significant difference
3 讨论
3.1 SNPs遗传多态性分析
采用MassArray技术对运用DNA混池重测序结果筛选的SNPs进行个体基因分型并检测其多态性。结果得知,10个位点均有多态性,卡方检验表明其中9个位点符合哈代-温伯格平衡状态,说明新疆褐牛在人工选育、迁移和遗传漂变等因素作用下,这些位点仍处于动态平衡中,反映了这些位点的选择压力不强;仅SNP5位点不符合哈代-温伯格平衡状态,说明该位点在新疆褐牛群体中具有较大的选择潜力。SNP5、SNP6、SNP7和SNP8位点均处于低度多态,且有效等位基因数目较少,即这4个位点在新疆褐牛群体中遗传变异为低等水平,4个位点位于和基因上,推测新疆褐牛在长期的育种选择及进化过程中,两个基因所受的选择压力不大;其余6个位点均处于中度多态,遗传变异较大。因此,综上所述,在新疆褐牛泌乳性状的选育过程中应当加强人工选择的强度。
3.2 SNPs与泌乳性状及SCS关联分析
本文涉及的6个基因与牛产奶性状的关联性研究鲜有报道,本研究旨在初步探索这些基因与新疆褐牛SCS和泌乳性状的相关性。其中,SNP1和SNP2位于牛7号染色体上(内质网氨基肽酶2),该基因是氨基肽酶M2家族中的一个多功能酶,是参与ER抗原加工的另一个氨基肽酶,具有高度多态性。有研究表明,与一种以高血压和蛋白尿为特征的孕期综合征——先兆子痫有关,在可能发生先兆子痫女性的前三个月胎盘中,表达常发生改变[22],其次,关于人类鸟枪弹样脉络膜视网膜病变、乳腺癌和妊娠高血压疾病等方面的研究居多[23-25]。本研究初次探索了该基因与新疆褐牛产奶性状的相关性,结果表明SNP1和SNP2均与新疆褐牛305d产奶量达到极显著相关,对于SNP1,TT基因型个体的305d产奶量显著高于CC型个体;对于SNP2,GG基因型个体305d产奶量显著高于AA基因型个体。
SNP3位于上,位于牛20号染色体上,由24个外显子组成。蛋白家族与RNA剪接体的功能相关,其表达模式和生物学功能研究至今未见实验性报道。本文初次研究了T14533269A位点与新疆褐牛泌乳性状的关联性,结果表明该位点与乳脂率、总固体和SCS性状达到显著或极显著关联,对于乳脂率和总固体性状,TT基因型个体显著高于AA基因型个体。牛奶中体细胞数与奶牛乳房炎存在显著的相关性,由于SCC分布是非正态的,通常将SCC转化为体细胞评分来研究[26]。奶牛乳房炎是一种常见的奶牛疾病,对世界奶业造成的经济损失极大,目前,已有许多学者开展了奶牛分子抗病育种研究工作,并取得了一定的成果。本研究得出T14533269A位点与新疆褐牛SCS性状达到极显著关联,初次探讨了与牛体细胞评分的关联性。
SNP4和SNP10均位于上,结果表明两位点与新疆褐牛产奶性状无显著性关联性。为锌指蛋白基因本研究之前还未有该基因与中国荷斯坦牛产奶性状的相关报道,2014年,SANTANA和OLIVEIRA等研究结果表明该基因与肉牛干物质采食量有关[27-28]。JIANG等全基因组关联分析结果表明锌指蛋白中的一个位点(rs41627764)对北京地区中国荷斯坦牛乳脂率性状有显著影响[1]。
SNP5和SNP6位于上,为抗苗勒氏管激素II型受体,也叫苗勒管抑制物,属于转化生长因子βII型受体()之一。最初分别由DI CLEMETE和BAARENDS等所在的两个实验室用不同的方法于1994年克隆获得[29-30]。关于基因大多是关于女性多囊性卵巢综合征的研究[31-32],而在牛上的研究相对较少,仅有的几篇是关于牛卵巢颗粒细胞发育研究[33-35]。CARTER等在瘤牛上研究了RNA表达与卵母细胞数量相关,且该基因与牛繁殖性能相关[36-37]。然而,目前该基因与牛产奶性状的关联性研究还未见报道。本研究得出SNP6与新疆褐牛乳蛋白率和总固体性状达到极显著关联,而SNP5与新疆褐牛各产奶性状未达到显著关联。
SNP9与新疆褐牛乳糖率性状达到显著关联。该位点位于牛15号染色体上,ABAL等[38]研究表明,该基因可作为检测人类子宫内膜癌的分子标记,COLAS等[39]研究结果表明,该基因在人类子宫内膜肿瘤中的差异表达与其在相应子宫液体样品中的表达水平相关。但目前为止,关于该基因与奶牛产奶性状的相关研究还未见报道。研究结果显示,对于遗传力低、只能在一个性别中表达、不能早期测量或测量难度大、成本高的性状,标记辅助选择(MAS)相对于常规选择法有较大优势。奶牛的产奶性状(产奶量、乳脂率、乳蛋白率)具有中等偏下的遗传力,只在母牛表现且表现时间是在一胎产奶结束之后,因此,奶牛育种中实施MAS大有可为[40]。
3.3 单倍型与连锁不平衡分析
有研究表明,与单标记SNP相比,单倍型分析对复杂性状的遗传变异具有更好的效果[41]。随着高通量SNPs检测的出现,发现的SNP量越来越多,需要进行连锁不平衡分析来估计有效群体的大小,长距离连锁不平衡可以用来估计近世代的有效群体大小,短距离连锁不平衡可以用来估计远世代的有效群体大小[42-43]。本研究群体中,检测的10个SNPs共构成2个单倍型模块,且均处于强连锁不平衡状态。由图2可以看出,单倍型模块与模块之间连锁程度较低,这可能是由于各个位点间物理位置相距较远所致。有研究表明,随着物理距离的增加,LD呈递减趋势,但某些物理位置较远的SNP之间也可能存在强LD,牛基因组不仅存在近距离的连锁不平衡,而且远距离的标记也以一定的模式存在连锁不平衡[44]。
3.4 单倍型与泌乳性状及SCS关联分析
本研究未发现单倍型与新疆褐牛SCS和泌乳性状的关联性,可能是由于样本量较少。何峰等研究结果表明单个位点乳脂量的效应不显著,而单倍型组合对乳脂量的效应却达到了显著水平,由此可见,用多个SNPs构建单倍型,进而分析单倍型对产奶性状的效应,为以标记辅助选择为基础的奶牛分子育种带来更多的遗传学信息[45]。
4 结论
本研究基于DNA混池重测序结果获得的SNPs数据,筛选6个基因的10个SNP位点在169头新疆褐牛群体中验证其遗传多态性,并分析其对新疆褐牛体细胞评分和泌乳性状的影响。初步发现了与新疆褐牛体细胞评分性状有关,、和与新疆褐牛305 d产奶量、乳脂率、乳蛋白率、乳糖率和总固体性状有关,其中A145332691T和C26758055G位点与新疆褐牛多个泌乳性状达到显著关联,提示,这些SNPs可为新疆褐牛产奶性状的分子标记辅助选育提供参考依据,但各位点的遗传效应差异及突变对乳汁合成等生理生化反应作用方面值得进一步深入研究。
References
[1] JIANG L, LIU J, SUN D, MA P, DING X, YU Y, ZHANG Q. Genome wide association studies for milk production traits in Chinese Holstein population., 2010, 5(10): e13661-e13661.
[2] 初芹, 李东, 侯诗宇, 石万海, 刘林, 王雅春. 基于DNA池测序法筛选奶牛高信息量SNP标记的可行性. 遗传, 2014, 36(7): 691-696.
CHU Q, LI D, HOU S Y, SHI W H, LIU L, WANG Y C. Direct sequencing of DNA pooling for screening highly informative SNPs in dairy cattle.2014, 36(7): 691-696. (in Chinese)
[3] 唐立群, 肖层林, 王伟平. SNP分子标记的研究及其应用进展. 中国农学通报, 2012, 28(12): 154-158.
TANG L Q, XIAO C L, WANG W P. Research and Application Progress of SNP Markers.2012, 28(12): 154-158. (in Chinese)
[4] 奇瑞利, 赖淑静, 袁陶燕, 何俊, 吴兵兵, 敷衍, 牛冬. 奶牛产奶性状候选基因的研究进展. 畜牧与兽医, 2013, 45(4): 94-97.
QI R L, LAI S J, YUAN T Y, HE J, WU B B, FU Y, NIU D. Advances in research on candidate genes for milk production in dairy cows.2013, 45(4): 94-97.
[5] 王荣霞, 袁陶燕, 赖淑静, 唐军旺, 杜雪, 赵婉秋, 敷衍, 牛冬. 影响奶牛泌乳性状的候选基因研究进展. 畜牧与兽医, 2015, 47(12): 144-146.
WANG R X, YUAN T Y, LAI S J, TANG J W, DU X, ZHAO W Q, FU Y, NIU D. Advances in research on candidate genes affecting milk character of dairy cattle., 2015, 47(12): 144-146. (in Chinese)
[6] 王丽娟, 李秋玲, 王长法, 王洪梅, 李建斌, 侯明海, 高远东, 仲跻峰. 奶牛PRL基因CRS-PCR多态性与产奶性状的关联分析. 畜牧兽医学报, 2009, 40(3): 303-308.
WANG L J, LI Q L, WANG C F, WANG H M, LI J B, HOU M H, GAO Y D, ZHONG J F. CRS-PCR Polymorphisms of prolactin gene and its relationship with milk production traits in Chinese Holstein Cows.2009, 40(3): 303-308. (in Chinese)
[7] VIITALA S, SZYDA J, BLOTT S, SCHULMAN N, LIDAUER M, MÄKI-TANILA A, GEORGES M, VILKKI J. The role of the bovine growth receptor and prolactin genes in milk, fat and protein production in finish ayrshire dairy cattle.2006, 173: 2151-2164.
[8] LEONARD S, KHATIB H, SCHUTZKUS V, CHANG Y M, MALTECCA C L. Effects of the osteopontin gene variants on milk production traits in dairy cattle.2005, 88(11): 4083-4086
[9] 王杰, 原清会, 曾长国, 张明, 赖松家. 中国荷斯坦牛OPN基因内含子4多态性及其与产奶性状的相关分析. 中国畜牧杂志, 2010, 46(15): 5-8.
WANG J, YUAN Q H, ZENG C G, ZHANG M, LAI S J. Effects of OPN gene on litter size in a Large White and a Landrace Herd.2010, 46(15): 5-8. (in Chinese)
[10] 张晓东. 奶牛DGAT1基因SNPs分析及其与产奶性能关系的研究[D]. 合肥: 安徽农业大学, 2009.
ZHANG X D. Studies on SNPs of DGAT1 gene and its association with milk production traits in dairy cattles[D]. Hefei: Anhui Agricultural University, 2009. (in Chinese)
[11] 贾晋, 马妍, 孙东晓, 张毅, 张沅. 中国荷斯坦牛DGAT1基因与产奶性状关联分析. 畜牧兽医学报, 2008, 39(12): 1661-1664.
JIA J, MA Y, SUN D X, ZHANG Y, ZHANG Y. Association analysis between DGAT1 gene and milk production traits in Chinese Holstein.2008, 39(12): 1661-1664. (in Chinese)
[12] 季敏, 刘学洪, 余长林, 余选富, 刘定江, 史宪伟. 槟榔江水牛STAT5A基因多态性及其与产奶性状的关联性研究. 中国牛业科学, 2013, 39(4): 29-35.
JI M, LIU X H, YU C L, YU X F, LIU D J, SHI X W. Association of STAT5A polymorphism and milk production traits in Binlangjiang Buffalo.2013, 39(4): 29-35. (in Chinese)
[13] 张晓东, 殷宗俊. 奶牛产奶性状候选基因研究进展. 中国奶牛, 2007(11): 23-27.
ZHANG X D, YIN Z J. Advances in research on candidate genes for milk production of dairy cows.2007(11): 23-27. (in Chinese)
[14] VIGNAL A, MILAN D, SANCRISTOBAL M, EGGEN A. A review on SNP and other types of molecular markers and their use in animal genetics.2002, 34(3): 1-31.
[15] 赵辉, 王威, 张清润, 高扬, 赵洪斌, 周珺, 林伟, 曾长青. 高通量飞行时间质谱基因分型方法的研究. 生物化学与生物物理进展, 2005(07): 667-672.
ZHAO H, WANG W, ZHANG Q R, GAO Y, ZHAO H B, ZHOU J, LIN W, ZENG C Q. The Study of high throughput MALDI-TOF genotyping assay., 2005(07): 667-672. (in Chinese)
[16] 唐剑频, 侯一平. 基质辅助激光解吸/离子化飞行时间质谱分析多态性遗传标记. 中华医学遗传学杂志, 2005(02): 185-188.
TANG J P, HOU Y P. Analysis of polymorphic markers by matrix-assisted laser desorption/ionizat ion time-of-flight mass spectrometry.2005(02): 185-188. (in Chinese)
[17] 邓廷贤, 庞春英, 朱鹏, 段安琴, 陆杏蓉, 杨炳壮, 梁贤威. 飞行时间质谱法检测水牛黑素皮质素受体4基因多态性. 中国畜牧兽医, 2015(07): 1800-1806.
DENG T X, PANG C Y, ZHU P, DUAN A Q, LU X R, YANG B Z, LIANG X W. Rapid detection of SNP in buffalo MC4R gene by matrix-assisted laser desorption/Ionization time-of-flight mass spectrometry.2015(07): 1800-1806. (in Chinese)
[18] 付雪峰, 王雅春, 郭俊青, 郭志勤, 程黎明, 周光瑞, 黄锡霞, 徐勇. 新疆褐牛产奶量校正系数的制定. 畜牧兽医学报, 2010, 41(5): 536-542.
FU X F, WANG Y C, GUO J Q, GUO Z Q, CHENG L M, ZHOU G R, HUANG X X, XU Y. Study of adjustment for standardizing milking record in Xinjiang Brown Cattle., 2010, 41(5): 536-542. (in Chinese)
[19] MAO Y, ZHU X, XING S, ZHANG M, ZHANG H, KARROW N, YANG L, YANG Z. Polymorphisms in the promoter region of the bovine lactoferrin gene influence milk somatic cell score and milk production traits in Chinese Holstein cows.2015, 103: 107-112.
[20] 邹思湘. 动物生物化学. 北京: 中国农业出版社, 2005: 307-320.
ZOU S X.. Beijing: China Agriculture Press, 2005: 307-320. (in Chinese)
[21] GABRIEL S, ZIAUGRA L, TABBAA D. SNP genotyping using the Sequenom MassARRAY iPLEX platform.2009, 2(2): 2. 12. 1-2. 12. 18.
[22] 郭爱华, 徐沪济. ERAP1结构与功能研究进展. 分子诊断与治疗杂志, 2013, 5(2): 128-133.
GUO A H, XU H J. Structural and functional research progress of ERAP1.2013, 5(2): 128-133. (in Chinese)
[23] KUIPER J J W, SETTEN J V, RIPKE S, T SLOT R V, MULDER F, MISSOTTEN T, BAARSMA G S, LAURENT C. FRANCIOLI, PULIT S L, DE KOVEL C G F, DAM-VAN LOON N T, HOLLANDER A D, HET VELD P H, HOYNG C B, CORDERO-COMA M, MARTÍN J, LLORENÇ V, ARYA B, THOMAS D, BAKKER S C, OPHOFF R A, ROTHOVA A, BAKKER P W D, MUTIS T, KOELEMAN B P C. A genome-wide association study identifies a functional ERAP2 haplotype associated with birdshot chorioretinopathy., 2014, 23(22): 6081-6087.
[24] GADALLA S E, ÖJEMALM K, VASQUEZ P L, NILSSON L, ERICSSON C, ZHAO J, NISTÉR M. EpCAM associates with endoplasmic reticulum aminopeptidase 2 (ERAP2) in breast cancer cells., 2013, 439(2): 203-208.
[25] JOHNSON M P, ROTEN LTDYER T D. The ERAP2 gene is associated with preeclampsia in Australian and Norwegian populations.2009, 126(5): 655-666.
[26] 马裴裴, 俞英, 张沅, 张勤, 王雅春, 孙东晓, 张毅. 中国荷斯坦牛SCC变化规律及其与产奶性状之间的关系. 畜牧兽医学报, 2010, 41(12): 1529-1535.
MA P P, YU Y, ZHANG Y, ZHANG Q, WANG Y C, SUN D X, ZHANG Y. The distribution of SCC and its correlation with milk production traits in Chinese Holsteins., 2010, 41(12): 1529-1535. (in Chinese)
[27] SANTANA M H, UTSUNOMIYA Y T, NEVES H H, GOMES R C, GARCIA J F, FUKUMASU H, SILVA S L, JUNIOR G A, ALEXANDER P A, LEME P R, BRASSALOTI R A, COUTINHO L L, LOPES T G, MEIRELLES F V, ELER J P, FERRAZ J B. Genome-wide association analysis of feed intake and residual feed intake in Nellore cattle.2014, 15(1): 1-8.
[28] OLIVEIRA P S, CESAR A S, DO NASCIMENTO M L, CHAVES A S, TIZIOTO P C, TULLIO R R, LANNA D P, ROSA A N, SONSTEGARD T S, MOURAO G B, REECY J M, GARRICK D J, MUDADU M A, COUTINHO L L, REGITANO L C. Identification of genomic regions associated with feed efficiency in Nelore cattle., 2014, 15(1): 1-10.
[29] DI CLEMENTE N, WILSON C, FAURE E, BOUSSIN L, CARMILLO P, TIZARD R, PICARD JY, VIGIER B, JOSSO N. Cat, Cloning, expression, and alternative splicing of the receptor for anti-Mullerian hormone., 1994, 8(8): 1006-1020.
[30] BAARENDS W M, VAN HELMOND M J, POST M, VAN DER SCHOOT P J, HOOGERBRUGGE J W, DE WINTER J P, UILENBROEK J T, KARELS B, WILMING L G, MEIJERS J H. A novel member of the transmembrane serine threonine kinase receptor family is specifically expressed in the gonads and in mesenchymalcells adjacent to the mullerian duct.1994, 120(1): 189-197.
[31] 李键, 乔杰, 闫丽盈, 唐荣欣, 甄秀梅. 抗苗勒氏管激素及其Ⅱ型受体的基因多态性与多囊卵巢综合征发病的关系. 中国妇产科临床杂志, 2008(03): 206-210.
LI J, QIAO J, YAN L Y, TANG R X, ZHEN X M. Relationship between polymorphism of anti-mullerian hormonr, anti-mullerian hormone receptor typeII and polycystic ovary syndrome.2008(03): 206-210. (in Chinese)
[32] FANG W, NIU W B, KONG H J, SUN Y P. The role of AMH and its receptor SNP in the pathogenesis of PCOS., 2017, 439: 363-368.
[33] POOLE D H, OCON-GROVE O M, JOHNSON A L. Anti-mullerian hormone receptor Type II (AMHR2) expression and activity in Bovine Granulosa Cells., 2010, 82(1): 185-185.
[34] POOLE D H, OCÓN-GROVE O M, JOHNSON A L. Anti-Müllerian hormone (AMH) receptor type II expression and AMH activity in bovine granulosa cells.2016, 86(5): 1353-1360.
[35] ILHA G F, ROVANI M T, GASPERIN B G, FERREORA R, DE MACEDO M P, NETO O A, DUGGAVATHI R, BORDIGNON V, GONCALAVES P B. Santa maria, Brazil: Regulation of anti-mullerian hormone and its receptor expression around follicle deviation in cattle.2016, 51(2): 188-194.
[36] CARTER A S, MAHBOUBI K, COSTA N N, GILLIS D J, CARTER T F, NEAL M S, MIRANDA M S, OHASHI O M , FAVETTA LA, KING W A. Systemic and local anti-mullerian hormone reflects differences in the reproduction potential of Zebu and European type cattle.2016, 167: 51-58.
[37] ILHA G F, ROVANI M T, GASPERIN B G, FERREIRA R, DE MACEDO M P, NETO O A, DUGGAVATHI R, BORDIGNON V, GONÇALVES P B. Santa Maria, Brazil: Regulation of anti-müllerian hormone and its receptor expression around fFollicle deviation in cattle.2016, 51(2): 188-194.
[38] Abal Posada M, Doll A, Gil Moreno A, Maes T, Perez C. Markers for endometrial cancer. US:US9046522[P], 2015.
[39] COLAS E, PEREZ C, CABRERA S, PEDROLA N, MONGE M, CASTELLVI J, EYZAGUIRRE F, GREGORIO J, RUIZ A, LLAURADO M, RIGAU M, GARCIA M, ERTEKIN T, MONTES M, LOPEZ-LOPEZ R, CARRERAS R, XERCAVINS J, ORTEGA A, MAES T, ROSELL E, DOLL A, ABAL M, REVENTOS J, GIL- MORENO A. Molecular markers of endometrial carcinoma detected in uterine aspirates.2011, 129(10): 2435-2444.
[40] 张沅, 张勤, 孙东晓. 奶牛分子育种技术研究. 北京: 中国农业大学出版社, 2012: 343-350.
ZHANG Y, ZHANG Q, SUN D X.China Agricultural University Press, 2012: 343-350. (in Chinese)
[41] ZHAO H, PFEIFFER R, GAIL M H. Haplotype analysis in population genetic and association studies.2016, 4(2): 171-178.
[42] HAYES B J, VISSCHER P M, MCPARTLAN H C, GODDARD M E. Novel multilocus measure of linkage disequilibrium to estimate past effective population size.2003, 13(4): 635-643.
[43] 尼桂琰, 张哲, 姜力, 马裴裴, 张勤, 丁向东. 利用全基因组连锁不平衡估计中国荷斯坦牛有效群体大小. 遗传, 2012, 34(1): 50-58.
NI G Y, ZHANG Z, JIANG L, MA P P, ZHANG Q, DING X D. Chinese Holatein Cattle effective population size estimated from whole genome linkage disequilibrium.2012, 34(1): 50-58. (in Chinese)
[44] 何云刚, 金力, 黄薇. 单核苷酸多态性与连锁不平衡研究进展. 基础医学与临床, 2004, 24(5): 487-490.
HE Y G, JIN L, HUANG W. Advance in the research of single nucleotide polymorphism and linkage disequilibrium., 2004, 24(5): 487-490. (in Chinese)
[45] 何峰, 孙东晓, 俞英, 王雅春, 张沅. 荷斯坦奶牛STAT5A基因的SNPs检测及其与产奶性状的关联分析. 畜牧兽医学报, 2007, 38(4): 326-331.
HE F, SUN D X, YU Y, WANG Y C, ZHANG Y. SNPs detection of STAT5A gene and association with milk production traits in Holstein Cattle.2007, 38(4): 326-331. (in Chinese)
(责任编辑 林鉴非)
Genetic Effect Analysis of SNPs from 6 genes on SCS and Milk Production Traits in Xinjiang Brown Cattle
LIU LiYuan1,2, ZHOU JingHang2, ZHANG MengHua1, LI JinXia1, FANG JiQing3, TAN ShiXin4, WANG AiFang4, HUANG XiXia1, WANG YaChun5
(1College of Animal Science, Xinjiang Agricultural University, Urumqi 830052;2School of Agriculture, Ningxia University, Yinchuan 750021;3Cattle Farm in Urumqi, Urumqi 830000;4Xinjiang Tianshan Animal Husbandry Biological Engineering Co., Ltd, Changji 831100, Xinjiang;5College of Animal Science and Technology, China Agricultural University, Beijing 100193)
【Objective】The association between polymorphisms ofandgeneand somatic cell score (SCS) and milk production traits in Xinjiang brown cattle were studied in order to find out molecular markers association with SCS and/or milk production traits.【Method】Taking 169 Xinjiang brown cattle cows as experimental animals from Xinjiang Urumqi cattle farm and Xinjiang Tianshan Animal Husbandry and Biotechnology Co., Ltd. The experimental data including Dairy Herd Improvement records (including milk fat percentage, milk protein percentage, lactose percentage, total solid content and SCS) and milk yield of 305 d, 10 SNPs were selected from exon area based on the results of DNA sequencing of 15 Chinese Holstein cows in an initial study and genotyped by Sequenom MassARRAY Genotype technology, the association between SNPs or haplotype and SCS and milk yield traits were analyzed by the least squares method in the GLM procedure of SAS8.1.【Result】The results showed that the 10 SNPs were polymorphic, and 9 SNPs were in Hardy-Weinberg equilibrium. Association analysis results showed that two SNPs ingene (T98741711C and G98736141A) had a highly significant association with milk yield of 305 d in Xinjiang brown cattle(<0.001), the milk yield of TT and GG genotype was the highest in T98741711C locus and G98736141A locus, respectively; C45667492G locus ingene had a significant association with milk lactose percentage (<0.005), GG genotype was the highest;(T14533269A) had a significant association with milk fat percentage and total solid content(<0.005) and had a highly significant association with SCS(<0.001), milk fat percentage of TT genotype was the highest and SCS of AA genotype was higher than AT and TT genotypes;(C26758055G) had a highly significant association with milk protein percentage and total solid content(<0.001), GG genotype was higher than CC and GC genotypes. The results of linkage disequilibrium analysis and haplotype construction revealed that the 10 SNPs constructed two haplotype blocks, among them, SNP1 and SNP2 were in linkage disequilibrium state(0.3<2<0.6), SNP4 and SNP10 in strong linkage disequilibrium state(2>0.6). Then the correlation between haplotype and SCS and/or milk production traits was analyzed, and the results showed that haplotype had no significant association with SCS and milk production traits(>0.001).【Conclusion】In this study, it was found that,,andgenes had a significant association with SCS and milk production traits, and the results of the study will provide a theoretical basis and reference for the molecular marker-assisted selection in Xinjiang Brown Cattle.
Xinjiang Brown Cattle; SCS; milk production traits; MassArray; association analysis
2016-11-03;接受日期:2017-04-28
“十二五”国家科技支撑计划(2011BAD28B02)、现代农业(奶牛)产业技术体系建设专项资金(CARS-37)
刘丽元,E-mail:729124817@qq.com。通信作者黄锡霞,E-mail:au-huangxixia@163.com。通信作者王雅春,E-mail:wangyachun@cau.edu.cn

