针对HER-2的多肽疫苗CKL9与YL20的抗肿瘤活性研究
陈龙冠,宋 燕,许元生,黄云娜,覃锦红,谢秋玲
(1. 暨南大学生命科学技术学院,基因工程药物国家工程研究中心,广东 广州 510632;2. 广州领晟医疗科技有限公司,广东 广州 510663)
针对HER-2的多肽疫苗CKL9与YL20的抗肿瘤活性研究
陈龙冠1,宋 燕2,许元生2,黄云娜1,覃锦红1,谢秋玲1
(1. 暨南大学生命科学技术学院,基因工程药物国家工程研究中心,广东 广州 510632;2. 广州领晟医疗科技有限公司,广东 广州 510663)
目的 研究能够诱导激活细胞免疫应答的多肽疫苗CKL9、YL20在细胞水平和整体动物水平的抗HER-2阳性肿瘤作用,为肿瘤新药开发提供依据。 方法 采用CCK-8法检测CKL9、YL20诱导小鼠淋巴细胞的增殖作用,采用LDH法检测细胞毒性T淋巴细胞(CTL)的活性,采用动物体内实验评价CKL9、YL20的抗肿瘤活性。 结果 CCK-8检测淋巴细胞增殖实验表明体外孵育多肽CKL9、YL20在一定程度上能够促进淋巴细胞增殖,在50 mg·L-1孵育浓度下,CKL9、YL20相对增殖率分别为11.1%、16.7%;LDH法检测细胞毒性实验表明经多肽疫苗CKL9、YL20诱导分化的T淋巴细胞对HER-2阳性的肿瘤细胞有杀伤作用,当效靶比为80 ∶1时,细胞毒性T淋巴细胞对肿瘤细胞抑制率分别可达89.8%和84.3%;动物体内实验表明预免疫多肽CKL9、YL20能对BALC/c小鼠N87移植瘤产生明显抑制作用。 结论 基于HER-2的多肽疫苗CKL9、YL20具有免疫原性,可诱导特异性CD4和CD8 T淋巴细胞免疫,以抑制HER-2阳性肿瘤细胞生长。
HER-2;多肽疫苗;T淋巴细胞;免疫应答;N87移植瘤;抗肿瘤活性
恶性肿瘤是威胁人类健康和生命的主要疾病之一,传统的癌症治疗手段如手术治疗、放射治疗、药物治疗均具有一定局限性[1]。由于靶向性较差,放射治疗和药物治疗易损伤正常人体细胞,产生不良反应。随着对肿瘤发生、发展的分子机制深入研究和生物技术的快速发展,生物治疗已经成为肿瘤综合治疗的第4种模式[2]。肿瘤多肽疫苗是由来自肿瘤细胞特异性抗原、病毒相关抗原、癌基因或者抑癌基因突变蛋白的多肽组成的疫苗,在细胞因子、趋化因子等佐剂的辅助下,能激活或者加强机体自身抗肿瘤免疫,进而杀伤和清除肿瘤细胞[3,5]。与传统疫苗相比,肿瘤多肽疫苗具有易于合成纯化、安全性高、特异性强等优点[4],因此肿瘤多肽疫苗是肿瘤疫苗研究方向的热点。目前国外已有数个多肽疫苗进入或完成II期临床试验阶段,一个进入Ⅲ期临床试验阶段[6](Tab 1),相关临床试验表明,多肽疫苗能够刺激诱导人体CD4-T 和CD8-T淋巴细胞,明显增加两者在体内的含量水平[7]。

Tab 1 Research of tumor peptide vaccines
CKL9与YL20是由我们筛选改造而来的多肽分子,分别含有11、20个氨基酸,用于HER-2阳性的实体瘤的预防和治疗,具有开发为一类抗肿瘤新药的前景。HER-2为原癌基因,在多种肿瘤(如乳腺癌、胃癌)中过度表达,并与肿瘤患者的恶性程度和预后密切相关,是肿瘤治疗的理想靶标[8]。CKL9与YL20来源于HER-2的表位肽,可以激活针对HER-2的特异性CTL,在GM-CSF免疫佐剂辅助下,攻击和溶解表达HER-2阳性的肿瘤细胞[9]。本研究通过体外细胞实验和体内动物实验探究CKL9与YL20的抗肿瘤活性,为开发为肿瘤新药提供依据。
1 材料与仪器
1.1 实验动物和细胞株 BALC/c ♀小鼠,SPF级,6~8周龄,购于广东省医学实验动物中心,动物许可证号:SQHD203364,本动物实验经动物伦理委员会批准,批准号为:20160704153544;NCI-N87人胃癌细胞、SKOV-3人卵巢癌细胞、MCF-7人乳腺癌细胞皆由购自上海中科院细胞库。
1.2 主要药物与试剂 多肽CKL9、YL20(上海强耀科技有限公司合成,纯度高于95%,批号SQH22350)RPMI 1640、DMEN培养基(Gibco,批号5114418);胎牛血清FBS(NQBB,批号7907843);青霉素、链霉素(Gibco,批号1665604);胰酶(Gibco,批号1676922);hGM-CSF人集落刺激因子(Pepro Tech,批号011330);鼠淋巴细胞分离液(达科为生物技术有限公司,批号33RO21502);Cyto Tox96®非放射性细胞毒性检测试剂盒(Promega,批号0000136684);CCK-8检测试剂(联科生物);PHA植物血凝素阳性对照(Sigma);PBS磷酸盐缓冲液(达科为,批号1437226)。
1.3 仪器 低速台式离心机(上海安亭科学仪器,型号TDL-60B);显微镜(OLYMPUS,型号CKX41);酶标仪(Thermo,型号Multiskan Fc);细胞培养箱(Thermo,型号371);全自动细胞计数仪(Nexcelom,型号AUTO 1000);超净工作台(Thermo,型号1300)。
2 方法
2.1 测定肿瘤细胞HER-2蛋白表达 选用抗HER-2荧光标记抗体与肿瘤细胞表面的HER-2结合后,利用流式细胞仪检测细胞表面荧光强度。培养肿瘤细胞至生长对数期,胰酶消化后用PBS洗涤离心,加入20μL荧光标记流式抗体到106个肿瘤细胞(0.5mL)中混合,(20~25) ℃避光孵育20 min,选用不与HER-2结合的抗体作为阴性对照,孵育后加入含1%多聚甲醛的PBS充分混匀,流式细胞仪进行上样分析细胞HER-2表达情况。
2.2 CCK-8法检测CKL9、YL20对小鼠淋巴细胞的增殖作用 小鼠脱颈处死,75%乙醇浸泡消毒,转移至超净台中,无菌去除小鼠脾脏,剪刀除去附着的脂肪组织,置于固定在培养皿的尼龙膜上,往无菌培养皿中加入5 mL淋巴细胞分离液,用注射器柱芯研磨脾脏,将分离液转入15 mL离心管中,沿管壁小心加入约200 μL RPMI 1640培养基,室温离心后用玻璃吸管将第二层淋巴细胞层吸出,加入10倍体积RPMI 1640培养基,混匀后250×g室温离心10 min,制成细胞悬液,加台盼蓝混匀后,细胞计数仪计数活细胞数。96孔细胞培养板中接种鼠淋巴细胞悬液每孔100 μL(105个细胞),共接种3块培养板,以备不同时间CCK-8检测(24、48、72h);每孔加入相应抗原刺激物PBS、CKL9、YL20、PHA各100 μL,其中PBS为阴性对照,PHA(植物血凝素)为阳性对照(10 mg·L-1),CKL9、YL20各设置2种浓度(20、50 mg·L-1),每受试物每浓度设6个复孔,37℃、5%CO2条件下孵育24、48、72 h,在指定时间点各取出1块培养板,加CCK-8检测试剂每孔10 μL,放入培养箱继续孵育1~4 h,酶标仪读OD450数值。
2.3 LDH法检测CKL9、YL20诱导小鼠细胞毒性T淋巴细胞(CTL)活性 活细胞的胞质内含有乳酸脱氢酶(LDH)。正常情况下,LDH不能透过细胞膜,当细胞受到效应细胞的杀伤后,LDH释放到细胞外。经还原后能在酶标仪上用490nm比色测定LDH含量。
靶细胞的制备:复苏N87、SKOV-3用RPMI 1640培养基(含FBS、双抗),MCF-7用DMEN培养基,置于37℃、5% CO2培养箱中常规培养,收集靶细胞,加入96孔培养板,每孔100 μL,104/孔;效应细胞制备:健康巴比斯小鼠分2组,右侧腋下分别免疫多肽药物CKL9、YL20(30 μg/只+0.2 μg/只hGM-CSF)2周1次,免疫2次后,取脾脏研磨,分离出的淋巴细胞即作为效应细胞。
取靶细胞和效应细胞各100 μL(效靶比分别为80 ∶1、40 ∶1),加入U型96孔培养板中;靶细胞自然释放孔加靶细胞和培养液各100 μL,效应细胞自然释放孔加效应细胞和培养液各100 μL,靶细胞最大释放孔加靶细胞和1%Triton各100 μL;上述各项均设3个复孔,于37℃、5%CO2培养箱中培养4 h,然后将96孔培养板250×g离心5 min,每孔吸取上清100 μL置平底96孔培养板中加入相应的孔中,按照Cyto Tox96®非放射性细胞毒性检测试剂盒说明书,测量每种效靶比的OD490,按下列公式计算细胞毒性:
特异杀伤率/%= (实验孔OD-效应细胞自发释放孔OD-靶细胞自发释放孔OD)/(靶细胞最大释放孔-靶细胞自发释放孔)×100%
2.4 CKL9、YL20对巴比斯小鼠N87肿瘤抑制作用 ♀巴比斯小鼠随机分3组,每组6只,采用胸皮下注射给药免疫,给药方案见Tab 2。免疫2次后,取对数生长期的N87细胞收集,制备成5×109·L-1细胞悬液,以0.1 mL种于小鼠右侧腋下,待接种后7 d肿瘤体积达200 mm3后用游标卡尺测量肿瘤直径,动态观察受试动物抗肿瘤的效应,肿瘤直径测量次数为每隔1天测1次,肿瘤体积(tumor volume, TV)的计算公式为:TV=1/2×a×b2,其中a、b分别表示长宽,并记录体质量。接种肿瘤4周后,处死所有小鼠,终止实验并进行评价。
抑瘤率/%=(对照组瘤体积-实验组瘤体积)/对照组×100%。
2.5 数据处理 采用SPSS12.0软件进行统计学分析,采用单因素方差分析进行比较。
3 结果
3.1 肿瘤细胞表面HER-2表达荧光检测 带有荧光标记的抗HER-2抗体能与细胞表面的HER-2受体特异性结合。细胞表面表达HER-2越多,所结合的抗体就越多,红色荧光强度也就越强,因此荧光强度与HER-2表达量成正比。如Fig 1所示,胃癌细胞N87、卵巢癌细胞SKOV-3,均有一定量的HER-2阳性表达,但表达量有差异,其中N87为高表达细胞株,SKOV-3为中表达细胞株,乳腺癌细胞MCF-7为HER-2阴性表达。

Tab 2 Dose regimen

Fig 1 Expression level of HER-2 on different tumor cell lines
A: NCI-N87(gastric cancer); B: SKOV-3(ovarian cancer); C: MCF-7(breast cancer)
3.2 CKL9、YL20体外孵育诱导小鼠淋巴细胞增殖 采用CCK-8法体外测量CKL9与YL20对淋巴细胞增殖作用,测量时间点分别为24、48、72h,并计算相对增值率。如Fig 2所示,孵育时间从0至72 h,孵育PHA的阳性对照组对小鼠淋巴细胞诱导增殖效果最明显。此外,相比空白对照组,多肽CKL9与YL20在两种浓度下(20、50 mg·L-1)均能对小鼠淋巴细胞产生增殖作用,证明淋巴细胞诱导增殖成功。由Fig 2可见,孵育多肽YL20对淋巴细胞的增殖具有量效关系,但孵育多肽CKL9并没有表现出明显的剂量效应,孵育低浓度的CKL9相比高浓度更能促进淋巴细胞的增殖。

Fig 2 The proliferation specific lymphocyte cells by incubation with CKL9 and YL20
3.3 CKL9、YL20诱导小鼠淋巴细胞毒性作用 CKL9和YL20为HER-2的表位肽,小鼠体内免疫后可以激活针对HER-2的T淋巴细胞,本研究目的是采用LDH法测试小鼠淋巴细胞被2种多肽诱导分化成CTL,对HER-2不同程度表达的肿瘤细胞的杀伤作用。结果显示,相比经PBS体内免疫的空白对照组(Fig 3C),由CKL9、YL20体内诱导产生的CTL在80 ∶1效靶比情况下均能对HER-2高表达的N87肿瘤细胞产生生长抑制作用,抑制率达84.3%、89.8%(Fig 3A、Fig 3B),而针对HER-2中表达的SKOV-3细胞, CTL效果则有一定程度的下降。同时,对于HER-2阴性表达的MCF-7细胞,2种多肽分子均无法产生有效的细胞毒性作用,说明多肽CKL9和YL20只能刺激诱导针对HER-2的特异性细胞毒性T淋巴细胞。
3.4 CKL9与YL20对巴比斯小鼠N87移植瘤抑制作用 小鼠免疫给药4周后,接种NCI-N87肿瘤细胞,观察其肿瘤生长情况(Tab 3、Fig 4)。接种细胞后,PBS免疫组、CKL9免疫组、YL20免疫组肿瘤体积生长前期差异不明显,而接种细胞后26 d的肿瘤测量体积中,PBS免疫组肿瘤体积达1300 mm3,YL20免疫组达1140 mm3,CKL9免疫组达880 mm3。CKL9组与PBS组体积相比,肿瘤体积明显变小,差异具有显著性(P=0.027)。
根据BALC/C小鼠体质量生长趋势(Fig 5)可以看出,多肽CKL9、YL20对小鼠体质量几乎没有影响,各组在实验周期内均没有出现非正常死亡事件,同时在实验周期内各组小鼠存活率均为100%,说明CKL9、YL20安全性高,没有明显不良反应产生。

Tab 3 Tumor volume of N87(mm3)
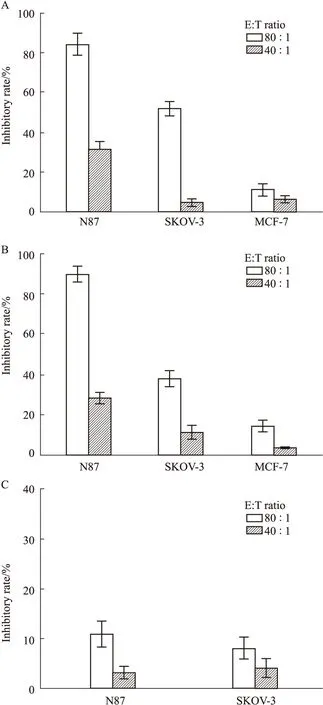
Fig 3 Lymphocytes from HER-2/neu peptide-vaccinated mice efficiently recognize and lyse HER2-positive tumor cells
A: Peptide CKL9; B: Peptide YL20; C: PBS

Fig 4 Peptide CKL9 and YL20 inhibited tumor growth in vivo

Fig 5 Average body weight of mice
4 讨论
人类表皮生长因子受体2(HER-2)在部分乳腺癌、胃癌、卵巢癌患者中均存在过度表达现象。1998年重组人源化单克隆抗体曲妥珠单抗获美国FDA批准用于转移性乳腺癌的治疗,是全球首个以HER-2为靶点的生物靶向治疗药物[10]。继曲妥珠单抗问世后,一系列针对HER-2的肿瘤治疗策略相继被建立,其中包括被动免疫治疗(如抗HER-2抗体)和主动免疫治疗(如靶向HER-2的肽疫苗)[11],目前国外已有多个基于HER-2的肿瘤多肽疫苗陆续展开相关临床试验[6]。
该类多肽疫苗来源于HER-2的表位肽片段,具有特异性强、安全性高的优点[12]。理论上可诱导持久的特异性细胞和体液免疫应答,在动物模型中,预免疫的多肽疫苗具有免疫原性,可诱导CD4和CD8阳性的T淋巴细胞免疫,以抑制HER-2阳性肿瘤细胞生长[13]。我们所合成的两种多肽分子CKL9、YL20,都来源于HER-2的表位肽,其中CKL9在原有序列基础上加入半胱氨酸环化,YL20为原有序列连接穿膜肽改造而成,能够提高多肽的稳定性,增加表位肽进入细胞的能力[14-15]。为了验证CKL9、YL20能够具有抗HER-2阳性肿瘤的活性,我们开展了细胞水平、整体动物水平相关的实验。
综合分析试验结果,多肽分子CKL9、YL20在体外孵育小鼠淋巴细胞情况下能刺激诱导淋巴细胞的增殖,增殖效果随孵育时间而明显提高,相对增殖率最高可达16.7%和17.1%,但增殖效果与孵育多肽疫苗的浓度并无明显线性关系,对表达不同程度HER-2的肿瘤细胞的体外抑制实验发现,被CKL9、YL20诱导的淋巴细胞在高效靶比时均能对HER-2阳性肿瘤细胞产生高特异性杀伤,却对HER-2阴性表达的细胞几乎无毒性作用。其中,两种多肽疫苗所诱导激活的细胞毒性T淋巴细胞均能对N87肿瘤细胞产生80%以上的杀伤,对SKOV-3产生30%~50%的杀伤,说明具有特异性。小鼠体内实验中,我们发现相比阴性对照组,预免疫多肽疫苗的实验组小鼠肿瘤增长速度缓慢,说明预免疫CKL9、YL20能诱导小鼠产生特异性细胞免疫,通过记忆T细胞产生较持久的免疫反应,进而能有效地抑制HER-2阳性肿瘤生长。目前国外已进入临床的同类HER2肿瘤疫苗E75疫苗对SKOV-3的杀伤可达72%[16-17]。这显示不同的基因序列的多肽所诱导的CTL反应会有所不同,我们将来会对多肽将进行进一步优化的工作。
(致谢:本实验在暨南大学广东省生物工程药物重点实验室完成,感谢各位老师和同学的尽心协助。)
[1] 张晓娟,王文静,王晶晶,等. 多肽AP25抗肿瘤活性研究[J].中国药理学通报,2013,29(9):1225-9.
[1] Zhang X J,Wang W J,Wang J J,et al. Study on anti-tumor effects of polypeptide AP25 [J].ChinPharmacolBull,2013,29(9):1225-9.
[2] 张天娇,田 浤,高向东. 基于HER2的多肽疫苗抗肿瘤作用研究进展[J]. 药学进展,2013,37(10):516-21.
[2] Zhang T J,Tian H,Gao X D. Advances in research on antitumor activities of HER2-based peptide vaccines [J].ProgPharmSci,2013,37(10):516-21.
[3] Amin A,Benavides L C,Holmes J P,et al. Assessment of immunologic response and recurrence patterns among patients with clinical recurrence after vaccination with a preventive HER2/neu peptide vaccine: from US Military Cancer Institute Clinical Trials Group Study I-01 and I-02 [J].CancerImmunolImmunother,2008,57(12):1817-25.
[4] 赵莲君,李 琳,邹征云. 恶性肿瘤个体化多肽疫苗的原理与临床研究[J]. 现代肿瘤医学,2014, 22(3):676-9.
[4] Zhao L J,Li L,Zhou Z Y,et al. A review of the rationale and clinical trials of personalized peptide vaccination [J].JModOncol,2014,22(3):676-9.
[5] Foy K C,Miller M J,Moldovan N,et al. Combined vaccination with HER-2 peptide followed by therapy with VEGF peptide mimics exerts effective anti-tumor and anti-angiogenic effectsinvitroandinvivo[J].Oncoimmunology,2012,1(7):1048-60.
[6] Mohit E,Hashemi A,Allahyari M. Breast cancer immunotherapy: monoclonal antibodies and peptide-based vaccines [J].ExpertRevClinImmunol,2014,10(7):1-35.
[7] Hueman M T,Stojadinovic A,Storrer C E,et al. Analysis of naive and memory CD4 and CD8 T cell populations in breast cancer patients receiving a HER2/neu peptide (E75) and GM-CSF vaccine [J].CancerImmunolImmunother,2007,56(2):135-46.
[8] Scott A M,Wolchok J D,Old L J. Antibody therapy of cancer [J].NatRevCancer,2012,12(4):278-87.
[9] Parmiani G,Castelli C,Pilla L,et al. Opposite immune functions of GM-CSF administered as vaccine adjuvant in cancer patients [J].AnnOncol,2007,18(2):226-32.
[10] Mittendorf E A,Storrer C E,Shriver C D,et al. Investigating the combination of trastuzumab and HER2/neu peptide vaccines for the treatment of breast cancer [J].AnnSurgOncol,2006,13(8):1085-98.
[11] Hueman M T,Stojadinovic A,Storrer C E,et al. Levels of circulating regulatory CD4+CD25+T cells are decreased in breast cancer patients after vaccination with a HER2/neu peptide (E75) and GM-CSF vaccine [J].BreastCancerResTreat,2006,98(1):17-29.
[12] Peoples G E,Gurney J M,Hueman M T,et al.Clinical trial results of a HER2/neu (E75) vaccine to prevent recurrence in high-risk breast cancer patients [J].JClinOncol,2005,23(30):7536-45.[13] Mittendorf E A,Gurney J M,Storrer C E,et al. Vaccination with a HER2/neu peptide induces intra-and inter-antigenic epitope spreading in patients with early stage breast cancer [J].Surgery,2006,139(3):407-18.
[14] Beignon A S,Brown F,Eftekhari P,et al. A peptide vaccine administered transcutaneously together with cholera toxin elicits potent neutralising anti-FMDV antibody responses[J].VetImmunolImmunopathol,2005, 104(3-4):273-80.
[15] Knutson K L,Schiffman K,Disis M L. Immunization with a HER-2/neu helper peptide vaccine generates HER-2/neu CD8 T-cell immunity in cancer patients [J].JClinInvest,2001,107(4):477-84.
[16] Patil R,Clifton G T,Holmes J P,et al. Clinical and immunologic responses of HLA-A3+, breast cancer patients vaccinated with the HER2/ neu-derived peptide vaccine, E75, in a phase I/II clinical trial [J].JAmCollSurg,2010,210(2):140-7.
[17] Efferson C L,Schickli J,Ko B K,et al. Activation of tumor antigen-specific cytotoxic T lymphocytes (CTLs) by human dendritic cells infected with an attenuated influenza A virus expressing a CTL epitope derived from the HER-2/neu proto-oncogene [J].JVirol,2003, 77(13):7411-24.
Anti-tumor activity of HER-specific peptide vaccines-CKL9 and YL20
CHEN Long-guan1, SONG Yan2, XU Yuan-sheng2, HUANG Yun-na1, QIN Jin-hong1, XIE Qiu-ling1
(1.NationalEngineeringResearchCenterofGeneticMedicine,CollegeofLifeScienceandTechnology,JinanUniversity,Guangzhou510632,China; 2.GuangzhouLinkHealthBiotechnologyco.Ltd,Guangzhou510663,China)
Aim To explore whether the polypeptide vaccines CKL9 and YL20 can induce immune response and anti-tumor effect on HER-2 (+) tumorsinvitroandinvivo, and to provide suggestions for clinical use. Methods The proliferation of specific lymphocytes and cytotoxic T lymphocyte activity(CTL) stimulated by CKL9 and YL20 were studied with CCK-8 assay and LDH assay, and the antitumor activity of CKL9 and YL20 was evaluatedinvivo. Results The lymphocyte proliferation was promoted by incubation with CKL9 and YL20, and the relative increase of cells was 11.1% and 16.7% respectively at the concentration of 50 mg·L-1of CKL9 and YL20 .The LDH assay confirmed the CTL effect induced by CKL9 and YL20 on HER2 -positive tumor cells, not on HER2-negtive tumor cells. With an effector-target ratio of 80 ∶1, the inhibition of tumor cell by cytotoxic T lymphocyte stimulated by CKL9 and YL20 could reach 89.8% and 84.3%, respectively. The HER2(+) tumor cell N87 transplanted in Babes mice was inhibited by pre-immune polypeptide CKL9 and YL20. Conclusion The HER2-specific polypeptide vaccines CKL9 and YL20 could induce persistent specific CD4 and CD8 T cell immune and inhibit the growth of HER2 positive tumor cells.
HER-2/neu; peptide vaccination; T-lymphocyte; immune response; N87; anti-tumor
2017-04-08,
2017-05-20
广东省科技计划项目(No 2015A020211016)
陈龙冠(1992-),男,硕士,研究方向:多肽疫苗药理学,E-mail:loganchan@126.com; 谢秋玲(1974-),女,博士,研究员,博士生导师,研究方向:抗肿瘤新药开发,通讯作者,E-mail:txql@jnu.edu.cn
时间:2017-6-7 19:04 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170607.1904.044.html
10.3969/j.issn.1001-1978.2017.07.022
A
1001-1978(2017)07-0997-05
R-332;R331.125;R392.11;R392.12;R730.2;R979.1;R979.5

