响应面法优化产右旋糖酐肠膜明串珠菌的发酵培养基
李媚,曾平,袁宇,覃琴,陈熠嘉,廖安平
(广西民族大学化学化工学院,广西多糖材料与改性重点实验室培育基地,广西高校化学与生物转化过程新技术重点实验室,广西南宁530006)
响应面法优化产右旋糖酐肠膜明串珠菌的发酵培养基
李媚,曾平,袁宇,覃琴,陈熠嘉,廖安平*
(广西民族大学化学化工学院,广西多糖材料与改性重点实验室培育基地,广西高校化学与生物转化过程新技术重点实验室,广西南宁530006)
为提高右旋糖酐的产率,对肠膜明串珠菌CICC-21725发酵培养基进行优化。在单因素试验的基础上,根据中心设计原理,采用响应面法确定培养基成分间交互作用及最优组成。结果表明:优化后各培养基成分为蔗糖80.0 g/L,蛋白质7.0 g/L,磷酸氢二钠1.5 g/L,磷酸二氢钾0.3 g/L,在pH7.1、25℃、150 r/min时发酵21 h,右旋糖酐产率可达92.79%,与单因素优化后的右旋糖酐产率相比,提高了7.2%。红外光谱及核磁共振分析表明,发酵产物为右旋糖酐。
肠膜明串珠菌;右旋糖酐;培养基优化;响应面法
右旋糖酐是由葡萄糖单元构成的高分子微生物多糖[1],在食品、化学分析、医药等行业具有重要利用[2-6]。右旋糖酐具有无毒安全等优点,是一类获得美国食品与药品管理局批准,可以在食品中使用的多糖。在食品行业,作为増稠剂用于冰激凌和果酱生产;面包生产中提高保水性及膨胀度;可作为低热量糖类用于果汁、饮料中;啤酒生产中,替代部分麦芽糖提高发泡性;目前工业上主要采用肠膜明串珠菌为工程菌,胞外利用蔗糖合成右旋糖酐[7-8]。微生物法产右旋糖酐引起国外学者广泛关注[9-12],微生物法首先要为菌体生长和酶产生提供有利条件,培养基组成优化是提高微生物产酶量、降低发酵生产成本的重要途径[10]。响应面法可获得因素与响应值间的连续关联模型,因而被广泛地应用于菌体的发酵优化和模型建立中[7-9]。本试验采用肠膜明串珠菌(CICC-21725),在单因素试验基础上,采用响应面法对发酵培养基进行优化以提高右旋糖酐的产率,为该菌的应用提供可靠数据。
1 材料与方法
1.1 材料与设备
肠膜明串珠菌(CICC-21725):中国工业微生物菌种保藏管理中心;LT-XT恒温摇床培养箱:瑞士AdolfKuhner公司;Nicolet IS10傅里叶红外光谱仪:美国 Thermo 公司;13C(150MHz),1H(600 MHz)核磁共振光谱仪:美国Varian公司。种子培养基:蔗糖130 g/L,蛋白胨2.0 g/L,磷酸氢二钠1.4 g/L,磷酸二氢钾0.3 g/L(以上药品均为国药集团化学试剂有限公司)。
1.2 试验方法
配制肠膜明串珠菌种子培养液/发酵培养液→调节pH7.1并灭菌→种子培养液接种培养(从斜面固体培养基上取3环)→发酵培养液接种培养(按发酵液的10%取种子液)→产物稀释后离心分离菌体→乙醇沉淀→离心及无水乙醇洗涤→离心后干燥→称量产物重量计算右旋糖酐产率。
1.3 分析方法
1.3.1 右旋糖酐产率测定
准确称取一定培养时间的培养液,采用乙醇沉淀分离右旋糖酐,沉淀物分别用无水乙醇和丙酮多次洗涤离心,干燥;同时测出种子液带入的右旋糖酐量。右旋糖酐量产率Y按(1)式计算。
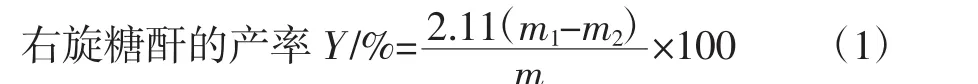
式中:m为培养初始液中蔗糖量,g;2.111为蔗糖转化为右旋糖酐理论量的换算因数;m1为培养完成液中获得的右旋糖酐量,g;m0为加入的种子液带入培养液中的右旋糖酐量,g。
1.3.2 右旋糖酐产物红外光谱分析和核磁共振分析
将干燥的右旋糖酐产品与KBr混合压片制得样品,进行红外光谱分析。发酵产物采用美国瓦里安公司的600 MHz光谱仪(VMNRS)进行核磁共振氢谱分析。
2 结果与讨论
2.1 蔗糖浓度对右旋糖酐产率的影响
选取培养基初始液中蔗糖依次为50.0、100.0、150.0、200.0、250 g/L,其它组分:蛋白质 2.0 g/L、Na2HPO41.5 g/L、KH2PO45.0 g/L,其余为二次蒸馏水。按1.2试验方法,在25℃、150 r/min,培养21 h,考查蔗糖浓度对右旋糖酐产率的影响,结果如图1。
由图1可知,试验选定范围内,蔗糖浓度为100.0 g/L时,右旋糖酐产率最高。当蔗糖浓度超过100.0 g/L,右旋糖酐产率随着蔗糖浓度的增加而减少,增加发酵液中蔗糖含量使渗透压变大从而影响菌体生长,所以蔗糖浓度选择100.0 g/L。
2.2 蛋白胨对右旋糖酐产率的影响
选取蛋白胨为 3.0、5.0、7.0、9.0、11.0 g/L 时,蔗糖、Na2HPO4、KH2PO4依次为 100.0、1.5、0.3 g/L,按 1.2 试验方法,在25℃、150 r/min培养21 h,考查蛋白胨浓度对右旋糖酐产率的影响,结果如图2。

图1 蔗糖浓度对右旋糖酐产率的影响Fig.1 The change of sucrose concentration on the influence of dextran yield
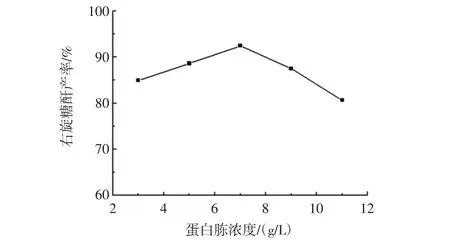
图2 蛋白质浓度对右旋糖酐产率的影响Fig.2 The change of peptone concentration on the influence of dextran yield
由图2可知,试验选定范围内,蛋白胨浓度为7.0 g/L时,右旋糖酐产率最大,蛋白胨是肠膜明串珠菌生长繁殖氮源,当蛋白胨含量过高对菌体的生长产生毒副作用而影响产物的合成,所以蛋白胨浓度选择7.0 g/L。
2.3 磷酸二氢钠对右旋糖酐产率的影响
选取 Na2HPO4为 0.5、1.0、1.5、2.0、3.0 g/L 时,蔗糖、蛋白胨、KH2PO4依次为 100.0、7.0、0.1 g/L,按 1.2 方法,在25℃、150 r/min培养21 h。考查磷酸二氢钠浓度对右旋糖酐产率的影响,结果如图3。
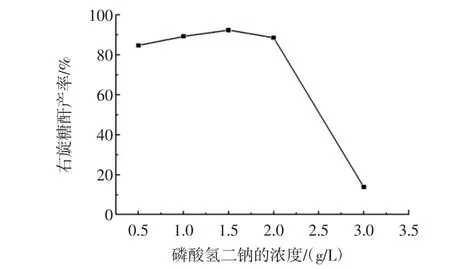
图3 磷酸氢二钠浓度对右旋糖酐产率的影响Fig.3 The change of Na2HPO4concentration on the influence of dextran yield
无机盐是微生物生长所需的元素,一定浓度无机盐可促进菌体的生长,同时对发酵液pH值起调节作用。由图3结果可知,当Na2HPO4含量在0.5 g/L~1.5 g/L时,右旋糖酐产率随着Na2HPO4含量增加而提高,但是Na2HPO4浓度达到3 g/L时,由于Na2HPO4的浓度过高影响了菌体的生长、抑制右旋糖酐转化酶活性,右旋糖酐产率急剧下降。所以Na2HPO4浓度为1.5 g/L较为适宜。
2.4 磷酸二氢钾对右旋糖酐产率的影响
选取 KH2PO4浓度为 0.1、0.3、0.5、0.7、1.4 g/L 时,蔗糖、蛋白胨、Na2HPO4分别为 100.0、7.0、1.5 g/L,按1.3方法,在25℃、150 r/min培养21 h。考察KH2PO4含量对右旋糖酐产率的影响,试验结果如图4所示。
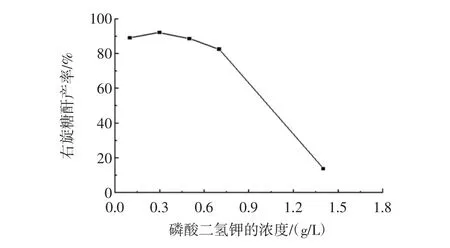
图4 磷酸二氢钾浓度对右旋糖酐产率的影响Fig.4 The change of KH2PO4concentration on the influence of dextran yield
由图4可知,在试验研究范围内,当KH2PO4浓度为0.3 g/L时,右旋糖酐产率最高,达到92.2%,KH2PO4浓度超过0.3 g/L后,随着KH2PO4浓度增加右旋糖酐收率下降,特别是当KH2PO4浓度达到1.4 g/L时,右旋糖酐产率急剧下降到13.8%,KH2PO4浓度过高影响肠膜明串珠菌生长,同时抑制右旋糖酐蔗糖酶的活性,从而阻碍了右旋糖酐的合成,所以KH2PO4浓度取0.3 g/L较为适宜。
2.5 响应面法优化肠膜明串珠菌的发酵条件
根据中心组合试验设计原理,在单因素试验结果基础上,考察蔗糖浓度、蛋白胨浓度、磷酸氢二钠浓度和磷酸二氢钾浓度对右旋糖酐产率的交互影响,以右旋糖酐产率为响应值Y,设计如表1所示四因素三水平响应面试验,试验设计及结果见表2。
采用Design-Expert8.0对表2试验结果进行二次多元方程的回归拟合,得到产率Y对自变量A、B、C和D的回归方程如式(2)所示。
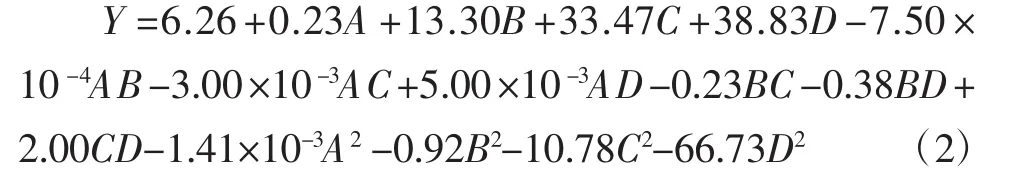
对回归拟合模型进行分析,结果如表3所示。

表1 响应面分析因素及水平表Table 1 Factors and levels of response surface method
表2 响应面试验设计及结果Table 2 The design of experiment and result of response surface
由表3可知,回归拟合模型P<0.000 1,拟合模型极显著;失拟项P=0.157>0.05,差异不显著,表示此模型合理且不必在引入更高次的项;模型拟合系数R2为0.996 6,R2adj为0.993 2,拟合模型能阐明99.32%的响应值的改变。变异系数为0.29,较小,说明拟合模型置信度较高。因此拟合模型用于右旋糖酐合成的培养基组合分析和预测是可靠的。
由表 4 可知,通过模型因素 A、A2、B2、C2和 D2极显著,说明培养基中蔗糖浓度对右旋糖酐收率有高度显著的影响,各影响因素对于右旋糖酐收率的影响并非是线性关系。由表4中F值大小可知,各因素对右旋糖酐收率影响强度为A>B>D、C。因素 A、B、C、D与产率的响应面及其等高线见图5~图10。
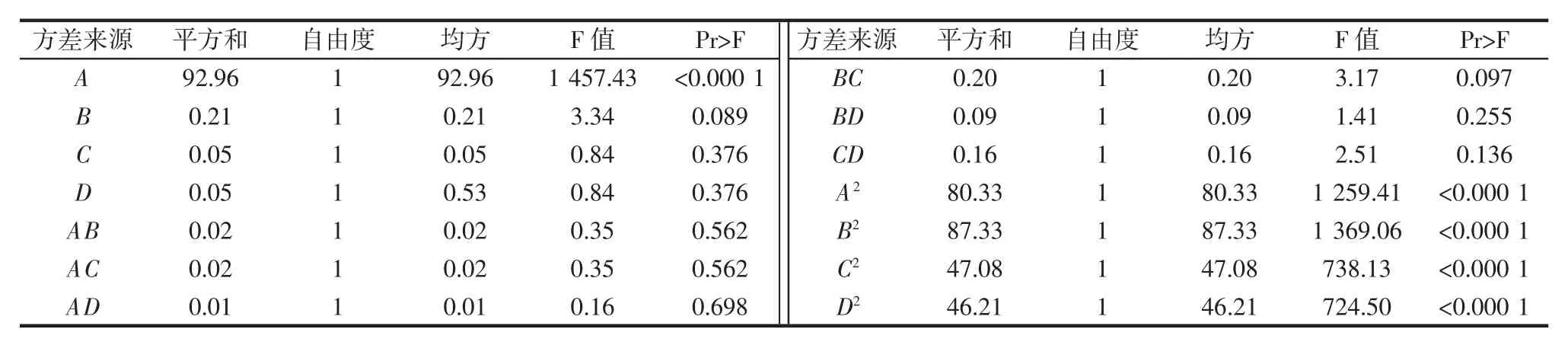
表4 回归系数方差分析Table 4 Variance analysis for each regression coefficient
2.5 验证试验
根据响应面分析获得肠膜明串珠菌(CICC-21725)最优培养基组成为:蔗糖、蛋白胨、Na2HPO4、KH2PO4依次是 80.25、6.97、1.50、0.30 g/L,右旋糖酐产率最大响应值为92.84%。将优化得到各组分中的蔗糖浓度和蛋白胨浓度调整为80.0 g/L和7.0 g/L后进行3次平行试验,得到右旋糖酐的平均产率为92.79%,与拟合模型理论预测值较相近。
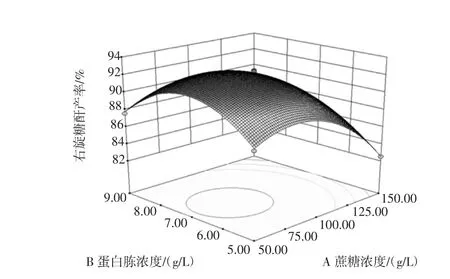
图5 蔗糖和蛋白胨的浓度影响右旋糖酐产率的响应面图Fig.5 Response surface of sucrose and peptone concentration on the influence of dextran yield
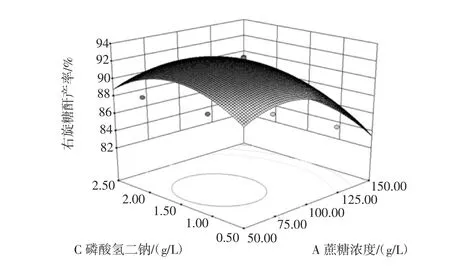
图6 蔗糖和磷酸氢二钠浓度影响右旋糖酐产率的响应面图Fig.6 Response surface of sucrose and Na2HPO4concentration on the influence of dextran yield

图7 蔗糖和磷酸二氢钾浓度影响右旋糖酐产率的响应面图Fig.7 Response surface of sucrose and KH2PO4concentration on the influence of dextran yield
2.6 肠膜明串珠菌发酵产物的结构表征
红外光谱分析:将干燥的右旋糖酐产品与KBr混合压片制得样品,傅里叶变换红外光谱仪扫描,扫描波数在 4 000 cm-1~400 cm-1处,分辨率是 8 cm-1,结果见图11。
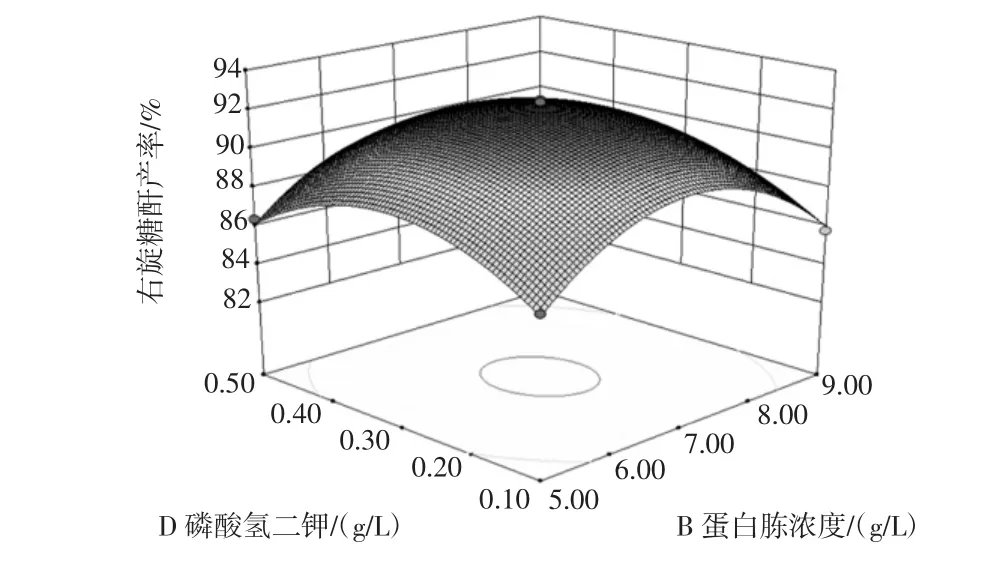
图9 蛋白胨和磷酸二氢钾浓度影响右旋糖酐产率的响应面图Fig.9 Response surface of peptone and KH2PO4concentration on the influence of dextran yield
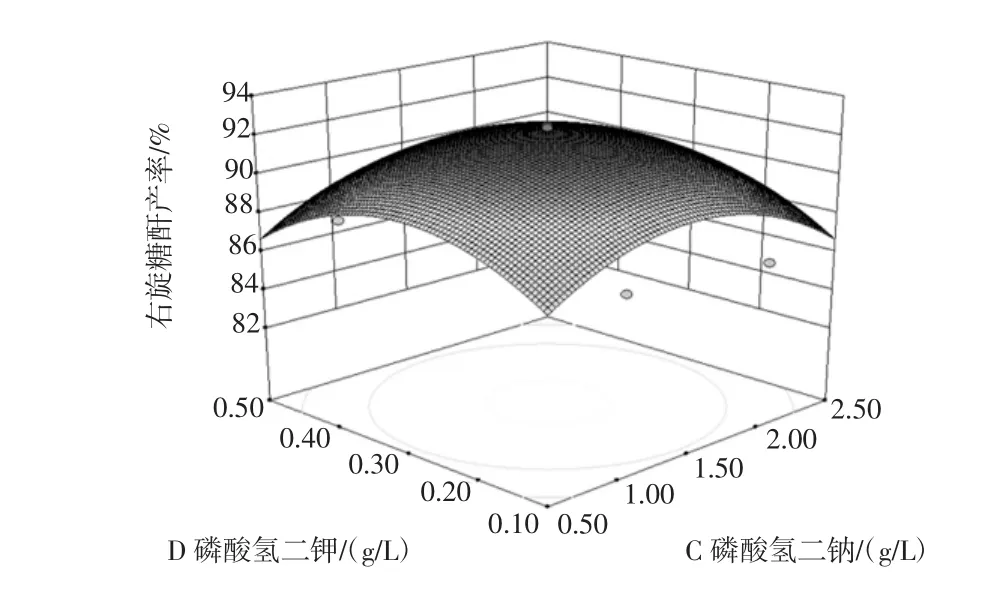
图10 磷酸氢二钠和磷酸二氢钾浓度影响右旋糖酐产率的响应面图Fig.10 Response surface of Na2HPO4and KH2PO4concentration on the influence of dextran yield
由图11可知,在3 700 cm-1~3 100 cm-1处是-OH键的伸缩振动吸收峰,在2 923 cm-1处是C-H键的伸缩振动吸收峰,在1 646 cm-1处是因结合水引起的-OH键的伸缩及弯曲振动吸收峰,在1 419 cm-1和1 368 cm-1处分别为右旋糖酐上CH2和C-H的变形振动吸收峰,在1 152 cm-1和907 cm-1处分别是糖苷键和C-O-C的伸缩振动吸收峰,在1 012 cm-1和845 cm-1处的是右旋糖酐的特征峰,其中845 cm-1处有峰表明发酵产物为α-型右旋糖酐[13-14]。
1H NMR:将肠膜明串珠菌的发酵产物溶于D2O中,分别用600MHz的VMNRS超导核磁共振波谱仪进行检测,结果见图12。
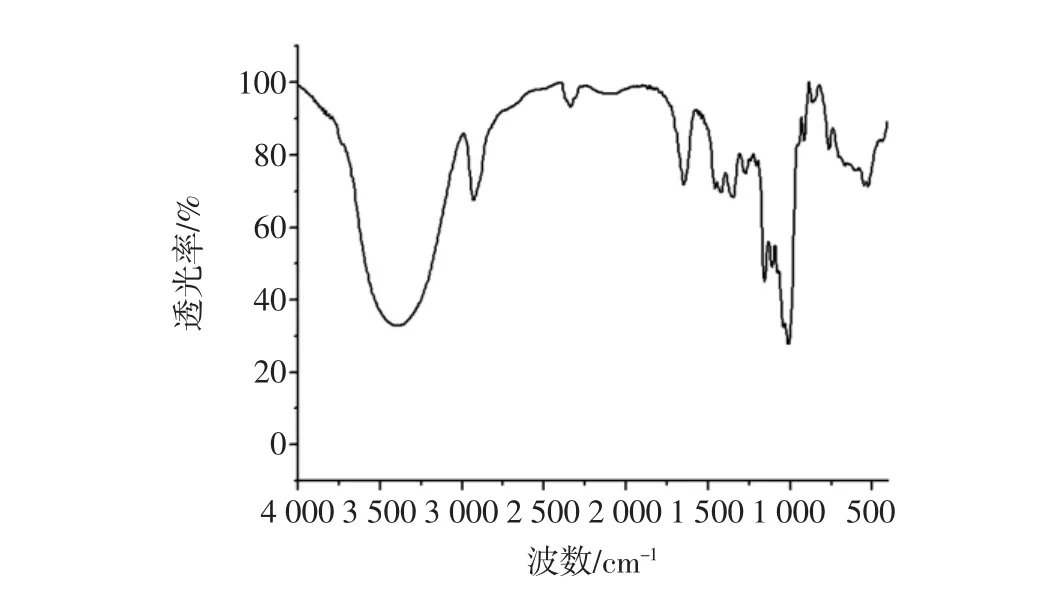
图11 肠膜明串珠菌产物的红外扫描图谱Fig.11 FT-IR spectrum of Leuconostoc Mesenteroides product
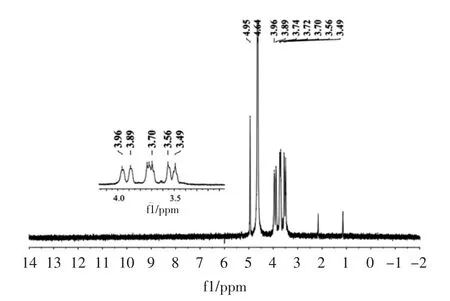
图12 发酵产物的1H NMR图Fig.12 1H NMR spectrum of Leuconostoc Mesenteroides product
由图 12可知,在 4.95 ppm 处的为 α-(1,6)糖苷键 C1 上异头氢 H1 的吸收峰,在 3.96、3.89、3.70、3.56、3.49 ppm 处分别为此单元上 H5、H6、H3、H2、H4 的吸收峰。在大于4.95 ppm处没有其它的异头氢的吸收,说明该产品为α-(1,6)糖苷键连接的直链右旋糖酐[15-16]。
3 结论
通过肠膜明串珠菌(CICC-21725)发酵培养基的单因素试验及Box-Behnken响应面设计试验和分析得到右旋糖酐的最佳发酵培养基组成如下:蔗糖、蛋白胨、Na2HPO4、KH2PO4依次是 80.0、7.0、1.50、0.30 g/L。用优化后的培养液组成调节pH为7.1时,在25℃和150 r/min的摇床中发酵21 h得到右旋糖酐的产率为92.79%,并且分别用傅里叶红外光谱和VMNR1H NMR对产品进行表征,结果表明该产品是由α-(1,6)糖酐键连接的无支链的α右旋糖酐。
[1] Kim D,Robyt J F,Lee S Y.Dextran molecular size and degree of branching as a function of sucrose concentration,pH and temperature of reaction of Leuconstoc mesenteriodes B-512 FMCM dextransucrase[J].Carbohydr Res,2003,338(1):1183-1189
[2] 王修垣.石油微生物学在中国科学院微生物研究所的发展[J].微生物学通报,2008,35(12):1851-1861
[3] 余智涛,高鹏,李鹏胜,等.不同时间窗抗凝治疗对脾切除后继发性血小板升高的临床研究[J].中国临床药理学杂志,2015,31(16):1575-1577
[4] 中华人民共和国药典委员会.中国药典[M].2010版.北京:化学工业出版社,2010:112-113
[5] Mariana Santos,Al'rio Rodrigues,Jos'e A.Teixeira.Production of dextran and fructose from carob pod extract and cheese whey by Leuconostoc mesenteroides NRRL B512(f)[J].Biochemical Engineering Journal,2015,25:1-6
[6] 孙继红,温丽利,吴雁,等.葡聚糖-聚乳酸接枝共聚物的合成及其药物载体输送系统[J].北京工业大学学报,2013,39(8):1269-1274
[7] Damini Kothari,Jagan Mohan,Rao Tingirikari,et al.In vitro analysis of dextran from Leuconostoc mesenteroides NRRLB-1426 for functional food application[J].Bioactive Carbohydrates and Dietary Fibre,2015,6:55-61
[8] 葛崇涛,田星,高莉莉.肠膜明串株菌生长特性研究[J].中国乳品工业,2005(7):72-73
[9] 张洪斌,姚日生,朱慧霞,等.发酵法生产右旋糖酐的工艺研究[J].合肥工业大学学报(自然科学版),2004,27(7):783-787
[10]AFSHEEN A,NADIR N S,SHAH A Ul Q.Characterization and potential applications of high molecular weight dextran produced by Leuconostoc mesenteroides AA1[J].Carbohydrate Polymers,2012,87:910-915
[11]罗靳,杨雅麟,王建华.肠膜明串珠菌右旋糖苷蔗糖酶的研究进展[J].微生物学通报,2007,34(4):787-789
[12]Mariana Santos,Jose Teixeira,Alirio Rodrigues.Production of dextransucrase,dextran and fructose from sucrose using Leuconostoc Mesenteroides NRRL B512(f)[J].Biochemical Engineering Journal,2000(4):177-188
[13]宋丹丹,张洪斌,胡雪芹,等.酶解法替代酸解生产右旋糖酐的新工艺研究[J].安徽化工,2013,39(5):17-22
[14]Afsheen Aman,Nadir Naveed Siddiqui,Shah Ali UI Qader.Characterization and potential applications of high molecular weight dextran produced by Leuconostoc Mesenteroides AA1[J].Carbohydrate Polymers,2012,87:910-915
[15]Yoann Brison,Emeline Fabre,Claire Moulis.et al.Synthesis of dextrans with controlled amounts of α-1,2 linkages using the transglucosidase GBD-CD2[J].ApplMicrobiolBiotechnol,2010,86:545-554
[16]Gregory L Cote,Christopher D Skory,Suzanne M Unser,et al.The production of glucans via glucansucrases from Lactobacillus satsumensis isolated from a fermented beverage starter culture[J].Appl Microbiol Bitechnol,2013,97:7265-7273
Optimization of the Fermentation Medium of Leuconostoc Mesentoroides(CICC-21725)by Response Surface Methodology
LI Mei,ZENG Ping,YUAN Yu,QIN Qin,CHEN Yi-jia,LIAO An-ping*
(School of Chemistry and Chemical Engineering of Guangxi University for Nationalities,Guangxi Key Laboratory Cultivation Base for Polysaccharide Materials and their Modification,Key Laboratory of Chemical and Biological Transformation Process of Guangxi Higher Education Institutes,Nanning 530006,Guangxi,China)
In order to improve the yield of dextran,the fermentation midium of Leuconostoc Mesenteroides CI-CC-21725 had been optimized.On the basis of single factor experiments,according to the principle of design center,the response surface method was adopted to determine the interaction between medium composition and the optimal composition of medium composition.The medium optimized results indicated when sucrose,peptone,disodium hydrogen phosphate and potassium dihydrogen phosphate were 80.0,7.0,1.5 g/L and 0.3 g/L,adjusted pH to 7.1,fermentation 21 h at 25℃ and 150 r/min,dextran yield could reach 92.79%.The dextran yield increased 7.2%compared with the best ruslt after single factor optimization.Infrared spectrum and nuclear magnetic resonance(NMR)analysis showed that the fermentation products was dextran.The dextran yield was also improved after the medium composition had optimized through the response surface method.
Leuconostoc Mesenteroides;dextran;medium optimization;response surface method
2016-08-30
10.3969/j.issn.1005-6521.2017.11.038
广西高校人才小高地建设创新团队项目(桂教人[2011]47);广西科技型中小企业技术创新资金(桂科转13109067);广西民族大学-广西化工研究院研究生联合培养基地专项资金(研究生联合培养机制改-2013年113000100030001)
李媚(1972—),女(壮),副教授,硕士生导师,博士,研究方向:化学与生物过程强化。
*通信作者:廖安平(1964—),男(汉),教授,硕士生导师,博士。

