六盘水苦荞麦黄酮的体外抗氧化活性的研究
方玉梅,谭萍
(六盘水师范学院,贵州六盘水553004)
六盘水苦荞麦黄酮的体外抗氧化活性的研究
方玉梅,谭萍
(六盘水师范学院,贵州六盘水553004)
以苦荞麦为原料,用70%的乙醇通过浸提法提取苦荞麦中的黄酮,并将提取的黄酮进行纯化。采用DPPH、ABTS、羟基自由基3种方法检测纯化前和纯化后苦荞麦黄酮的抗氧化效果。试验表明,纯化前和纯化后苦荞麦黄酮都具有抗氧化能力,并与黄酮浓度呈正相关。对DPPH自由基的清除作用中,纯化前和纯化后黄酮浓度为0.005%时,清除率分别为41.8%和61.6%;对ABTS+自由基的清除作用中,纯化前和纯化后黄酮浓度为0.005%时,清除率分别为54.7%和61.1%;在对OH自由基的清除作用中,纯化前和纯化后黄酮的浓度为0.1%,清除率分别为14.7%和10.3%。对DPPH自由基和ABTS自由基的抗氧化作用,纯化前的黄酮弱于纯化后的黄酮;对羟基自由基,纯化前的黄酮强于纯化后的黄酮。
黄酮;抗氧化;DPPH;ABTS;羟基自由基
苦荞麦[Fagopyrum tataricum(L.)Gaertn.],属蓼科荞麦属植物,俗称苦荞,一年生草本植物。生长在田边、路旁等潮湿地带。苦荞麦是甚少的天然药食两用作物[1]。现代临床医学观察表明,苦荞麦具有防治冠心病、糖尿病、高血压、抗癌、防止内出血、延缓衰老等多种生理功能[2]。研究表明苦荞麦这些生理功能和药用价值与苦荞麦中富含生物类黄酮有十分密切关系[3]。目前关于苦荞麦黄酮类化合物的研究主要以极性较大的混合溶剂提取的粗提取物为对象,但其中成分复杂,不仅含有黄酮,而且含有色素和醇溶性小分子[4]。为了弄清苦荞麦黄酮的性质,本试验主要以六盘水苦荞麦为材料,同时采用DPPH、ABTS、羟基自由基3种方法对纯化前和纯化后的苦荞麦黄酮的抗氧化能力进行评价,对六盘水苦荞麦的进一步开发利用提供一定的理论依据。
1 材料与方法
1.1 试验材料
苦荞麦种子(六苦4号):由六盘水职业技术学院农业工程系苦荞麦育种基地提供。
1.2 试验药品
1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二铵盐(ABTS):Sigma公司;邻苯三酚、七水硫酸亚铁、水杨酸、双氧水、无水乙醇、过硫酸钾:市售分析纯。
1.3 仪器与设备
722S可见分光光度计:上海精密仪器仪表有限公司;JD200-3多功能电子天平:沈阳龙腾电子标量仪器有限公司;H.H.S电热恒温水浴锅:天津市泰斯特仪器有限公司;DFT-200高速万能粉碎机:温岭市林大机械有限公司;60目,孔径0.3毫米标准检验筛:浙江上虞市道墟张兴纱筛厂;HA-BII.402-BS-Ⅱ电热恒温培养箱:上海跃进医疗器械厂;7D25台式低速离心机:湖南赫两仪器装备有限公司。
2 试验方法
2.1 样品处理和样品制备
将采取的苦荞麦置于60℃的烘箱中烘干至恒重,然后将其取出用粉碎机粉碎,过60目的标准检验筛,放在恒温烘箱中备用。
纯化前的黄酮:准确称取5 g苦荞麦粉末于圆底烧瓶中,按料液比1∶30(g/mL)加入70%的乙醇置于65℃水浴锅中水浴提取1.5 h[5],以4 000 r/min离心5 min,取上清液,去残渣,将上清液置于60℃水浴锅中浓缩,干燥后即得样品。
纯化后的黄酮:取洁净的层析柱(底部塞有棉花),按1∶4的径高比加入大孔吸附树脂AB-8,准确量取1 0 mL浓度为0.02%的黄酮上样液加入层析柱中,以2 mL/min的流速过柱,待上样液过柱后,再加入10 mL蒸馏水以相同的流速过柱,待蒸馏水完全过柱后再加入10 mL 50%的乙醇以3 mL/min的流速过柱,收集洗脱液于60℃水浴锅中浓缩,干燥后即得样品。
2.2 纯化前和纯化后苦荞麦黄酮的抗氧化作用
2.2.1 纯化前和纯化后苦荞麦黄酮对DPPH自由基清除作用试验
DPPH·(二苯代苦味酰自由基)是一种合成稳定的自由基,其乙醇溶液显紫色,在517 nm处有最大吸收。当有供氧能力的抗氧化剂存在时,抗氧化剂就会提供氢离子和电子给DPPH自由基,与其发生反应,使D PPH溶液的颜色变浅,吸光度值变小。其褪色程度与其接受的电子数量成定量关系,因而可用分光光度计测得其吸光度值,进行定量分析。
DPPH母液的配制:根据谭萍等[6]报道的方法,准确称取44 mgDPPH,用无水乙醇定容至100 mL,将其配制成120 μmol/LDPPH母液,在0℃~4℃条件下避光放置。
纯化前后黄酮溶液的配制:准确称取0.01 g纯化前的黄酮和纯化后的黄酮,分别用20 mL蒸馏水溶解,配制成浓度为0.05%的样品液,然后分别稀释成浓度为0.001%、0.002%、0.003%、0.004%、0.005%的黄酮溶液。
DPPH工作液的配制:2 mL无水乙醇和4 mL DPPH液加入同一试管中,摇匀,避光放置30 min后,以无水乙醇为参比在517 nm处测吸光值记AX;
样品测定:加入黄酮溶液(0.001%、0.002%、0.003%、0.004%、0.005%)2 mL与4 mLDPPH液于同一比色管中(每个浓度做3次重复试验),摇匀,避光放置30 min后,以无水乙醇为参比在517 nm处测吸光值记AJ;按以下公式计算清除率:
清除率/%=[(AX-AJ)/AX]×100
式中:AX为DPPH与溶剂混合后的吸光值;AJ为DPPH和样液反应后的吸光值。
2.2.2 纯化前和纯化后苦荞麦黄酮对羟基自由基清除作用试验
按照Smirnof的方法[7],利用H2O2与FeSO4混合产生·OH,在体系内加入水杨酸捕捉·OH并产生紫色物质,该物质在510 nm处有最大吸收峰,加入抗氧化剂就可以将羟基自由基清除,使紫色溶液颜色变淡。
纯化前后的黄酮溶液的配制:准确称取0.05 g纯化前的黄酮和纯化后的黄酮,分别用50 mL蒸馏水配置成浓度为0.1%的样品液,然后分别稀释成浓度为0.06%、0.07%、0.08%、0.09%、0.1%的样品液。
反应体系:在同一比色管中加入7.5 mL 6 mmol/L水杨酸-乙醇,2.5 mL6 mmol/L H2O2,2.5 mL 2 mmol/L七水硫酸亚铁(每个浓度做3次重复试验),摇匀,置于37℃的水浴锅中水浴15 min,取5 mL溶液在510 nm波长处测吸光值记A0;再向剩下的溶液中加入0.5 mL不同浓度的样品液(0.06%、0.07%、0.08%、0.09%、0.1%),摇匀,放置在37℃的水浴锅中水浴15 min后在510 nm处测其吸光值记AX。
对照试验:由于黄酮本身含有吸收光值,所以需做一组对照试验。在同一比色管中加入7.5mL6mmol/L水杨酸-乙醇,2.5 mL蒸馏水,2.5 mL 2 mmol/L七水硫酸亚铁(每个浓度做3次重复试验),摇匀,置于37℃的水浴锅中水浴15 min后,取5 mL溶液弃去,向剩下的溶液中加入0.5 mL的样品液后继续水浴15 min,在510 nm处测吸光值记AX0。按以下公式计算清除率:
清除率/%=[A0-(AX-AX0)]/A0×100
式中:A0为未加样品液的吸光值;AX为加样品液的吸光值;AX0样品本身的吸光值。
2.2.3 纯化前和纯化后苦荞麦黄酮对ABTS+·清除作用试验
根据李华等报道的方法[8]进行改进,其原理是ABTS在有氧化剂的作用下会被氧化成蓝绿色阳离子自由基ABTS+·,向其中加入被测物质,如果该物质中存在抗氧化成分,则该物质会与ABTS+·发生反应而使反应体系褪色,在734 nm处测吸光度即可测出并计算出样品的抗氧化能力。
ABTS母液的配置:取5 mL 7 mmol/L的ABTS与88 μL 140 mmol/L的过硫酸钾混合均匀,在常温下避光保存12 h,形成ABTS母液。
工作液的配制:使用前用70%乙醇将ABTS母液稀释120倍,使其在734 nm处的吸光值在0.65~0.75范围内,之后以70%乙醇作为参比在734 nm处测吸光度值。
纯化前后黄酮溶液的配制:准确称取0.025 g纯化前和纯化后的黄酮,分别用50 mL蒸馏水溶解,配成浓度为0.05%的样品液,然后分别稀释成浓度为0.001%、0.002%、0.003%、0.004%、0.005%的样品液。
反应体系:取1 mL的样品液(0.001%、0.002%、0.003%、0.004%、0.005%)与4 mL工作液于同一比色管中(每个浓度做3次重复试验),并同时计时后避光放置反应6 min,在734 nm处以70%乙醇为参比测其吸光值记AX(在测反应物前,先测工作液的吸光值记A0)。按以下公式计算清除率:
清除率/%=(A0-AX)/A0×100
式中:A0为工作液的吸光值;AX为加样品液的吸光值。
3 结果与分析
3.1 纯化前后苦荞麦黄酮对DPPH自由基清除作用
DPPH与溶剂混合后的吸光值AX的值为0.782。因此,根据公式计算清除率,其结果如图1所示。
由图1可以看出,纯化前和纯化后的苦荞麦黄酮均具有清除DPPH自由基的能力,在试验浓度范围内,其清除率随浓度的增加而增加,且黄酮浓度与清除率呈正相关。黄酮浓度为0.005%时,纯化前和纯化后清除率分别达到41.8%和61.1%,由此看出,苦荞麦黄酮纯化后的抗氧化能力明显高于纯化前。原因可能是纯化前黄酮中含有的杂质不具有抗氧化作用,甚至可能抑制黄酮的抗氧化能力;再有苦荞麦黄酮经过大孔树脂纯化后,提取物中的高活性成分有所增加,黄酮纯度也增加,对DPPH自由基的清除效果就会更好,抗氧化能力也就增强,导致纯化后的黄酮比纯化前的黄酮清除效果更好。
3.2 纯化前后苦荞麦黄酮对羟基自由基清除作用
纯化前后苦荞麦黄酮对羟基自由基清除率如图2所示。

图1 纯化前和纯化后苦荞麦黄酮对DPPH自由基的清除率折线图Fig.1 Purified and unpurified of the flavonoids in tartary buckwheat on DPPH free radical clearance line chart
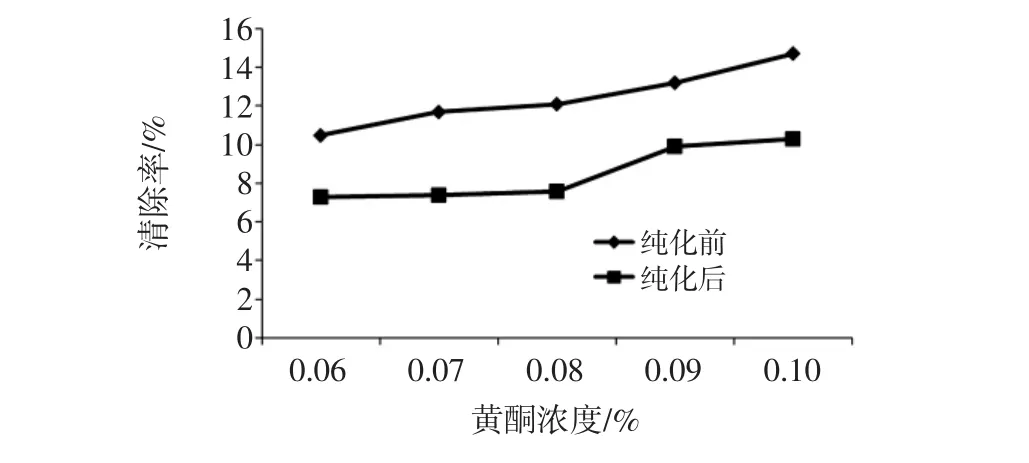
图2 纯化前和纯化后苦荞麦黄酮对羟基自由基的清除率折线图Fig.2 Purified and unpurified of the flavonoids in tartary buckwheat on·OH clearance line chart
由图2可知看出,纯化前和纯化后的苦荞麦黄酮均具有清除羟基自由基的能力,在试验浓度范围内,其清除率随浓度的增加而增加,说明其抗氧化作用逐渐增强,黄酮浓度与清除率呈正相关。黄酮浓度为0.1%时,纯化前和纯化后的清除率分别达到14.7%和10.3%。由此看出,纯化前的苦荞麦黄酮的对羟基自由基的抗氧化能力明显高于纯化后的。可能是因为黄酮在提取过程中,苦荞麦中多数总黄酮已被提取出来,所以对羟基自由基的清除效果好。当对黄酮进行纯化时,把色素中含有的黄酮纯化掉了,所以导致纯化前的黄酮对羟基自由基的清除效果比纯化后的黄酮的清除效果更好。
3.3 纯化前后苦荞麦黄酮对ABTS+自由基清除作用
在使用工作液前测定工作液的吸光值A0,纯前化的吸光度值A0为0.717,纯化后的吸光度值A0为0.725。因此,根据公式计算清除率,其结果如图3所示。
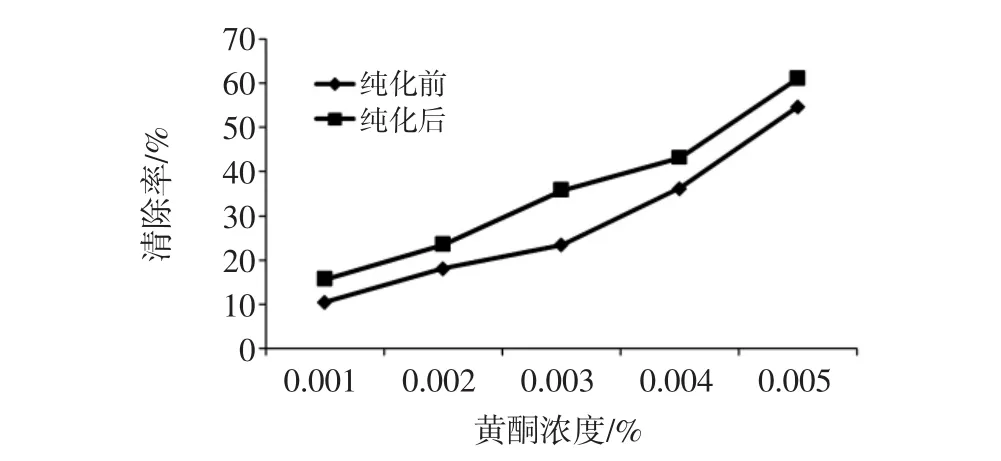
图3 纯化前和纯化后苦荞麦黄酮对ABTS+自由基的清除率折线图Fig.3 Purified and unpurified of the flavonoids in tartary buckwheat on ABTS+free radical clearance line chart
由图3可知看出,纯化前和纯化后的苦荞麦黄酮均具有清除羟基自由基的能力,在试验浓度范围内,其清除率随黄酮浓度的增加而增加,且黄酮浓度与清除率呈正相关。黄酮浓度为0.005%时,纯化前和纯化后黄酮对ABTS+自由基的清除率达到54.7%和61.1%。由此看出,纯化后的苦荞麦黄酮抗氧化能力明显高于纯化前。原因可能是纯化前黄酮中含有的杂质不具有抗氧化作用,甚至可能抑制黄酮的抗氧化能力,当苦荞麦黄酮经过大孔树脂纯化后,其中的杂质被去除,提取物中的高活性成分有所增加,黄酮纯度也增加,其清除率明显增强,抗氧化能力也就增强,所以导致纯化后的黄酮比纯化前的黄酮清除效果更好。
4 结论
通过对3种体系自由基清除作用研究纯化前和纯化后苦荞麦黄酮的抗氧化活性,结果表明,在一定浓度范围内,纯化前和纯化后苦荞麦黄酮对3种自由基都具有清除作用,且清除能力随浓度的增加而增加。当浓度为0.005%时,纯化前和纯化后苦荞麦黄酮对DPPH自由基的清除率分别是41.8%和61.1%,对ABTS+自由基的清除率分别是54.7%和61.1%;当浓度为0.1%时,对羟基自由基的清除率分别为14.7%和10.3%。说明苦荞麦黄酮具有较好的抗氧化能力。
本试验同时采用3种方法对苦荞麦黄酮的抗氧化能力进行评价,所得结果证明纯化前和纯化后的苦荞麦黄酮都具有较好的抗氧化能力。综上所述,黔产苦荞麦黄酮不仅可以作为天然食品着色剂开发,还可以作为天然抗氧化剂开发,本试验为苦荞麦黄酮的高附加值的产品开发提供一条新途径。
[1] 杨政水.苦荞麦的功能特性及其开发利用[J].食品研究与开发,2005,26(1):100-103
[2] 赵志强,王瑞芳,黄凤兰,等.苦荞麦化学成分的药理学作用研究[J].内蒙古民族大学学报(自然科学版),2013,27(3):315-317
[3] 曹纬国,刘志勤,邵云,等.黄酮类化合物药理作用的研究进展[J].西北植物学报,2003,23(12):2241-2247
[4] 朱瑞,高南南,陈建民.苦荞麦的化学成分和药理作用[J].中国野生植物资源,2003(2):7-9
[5] 张萍,王玉珠,李红宁,等.荞麦中生物类黄酮的提取方法研究[J].食品研究与开发,2007,28(2):45-47
[6] 谭萍,方玉梅,王毅红,等.苦荞种子黄酮类化合物清除DPPH自由基的作用[J].食品研究与开发,2008,29(12):20-22
[7] 汪河滨,白红进,王金磊,等.黑果枸杞色素清除自由基活性的研究[J].食品研究与开发,2006,27(11):8-10
[8]邱金东,汤坤.DPPH和ABTS法测定核桃仁的体外抗氧化活性[J].中成药,2008,30(8):1215-1216
Study on the Antioxidant Activity of the Flavonoids from the Tartary Buckwheat in Liupanshui
FANG Yu-mei,TAN Ping
(Liupanshui Normal College,Liupanshui 553004,Guizhou,China)
The flavonoids in tartary buckwheat was extracted by 70%ethanol,and using macroporous resin purified the flavonoids.The antioxidant effect of DPPH,ABTS and hydroxyl free radical three methods were used to detect the effect of the purified and unpurified on the flavonoids from tartary buckwheat.The results showed that purified and unpurified of the flavonoids in tartary buckwheat had the ability of antioxidation,and it was positively correlated with the concentration of flavonoids.In the scavenging action of DPPH free radical,the clearance rates were 41.8%and 61.6%,respectively,when the concentration of purified and unpurified flavonoids was 0.005%;the clearance rate of ABTS was 54.7%and 61.1%,respectively,when the concentration of purified and unpurified flavonoids was 0.005%;in the scavenging effect on OH free radical,the concentration of purified and unpurified flavonoids was 0.1%,and the removal rate was 14.7%and 10.3%respectively.The antioxidation effect for DPPH free radical and ABTS free radical,the purified flavonoids was weaker than the unpurified of flavonoids;to hydroxyl free radical,the purified flavonoids was stronger than the unpurified of flavonoids.
flavonoids;antioxidant free radical;DPPH;ABTS;hydroxyl free radical
2016-08-31
10.3969/j.issn.1005-6521.2017.11.002
贵州省教育厅基金项目(黔教合KY字[2014]257号);贵州省“125计划”重大科技专项(黔教合重大专项字[2014]038号);贵州省科技厅技术基金项目(黔科合J字LKLS[2013]05号);六盘水师范学院科技创新团队(LPSSYKJTD201602)
方玉梅(1982—),女(布依),副教授,研究生,从事植物生理学与分子生物学的教学与研究。

