天然与发酵虫草菌丝体中多糖组份及活性比较
曹昱,李志刚
(1.广州植之元油脂实业有限公司,广东广州511462;2.华南理工大学生物科学与工程学院,广东广州510640)
天然与发酵虫草菌丝体中多糖组份及活性比较
曹昱1,李志刚2
(1.广州植之元油脂实业有限公司,广东广州511462;2.华南理工大学生物科学与工程学院,广东广州510640)
为找出发酵虫草菌丝体与天然虫草菌丝体的差异,对其多糖成分、含量进行比较研究,并利用细胞增殖实验对生物活性进行分析比较。发酵虫草存在两种多糖,分子量分别为3 682 kDa和166 kDa;天然虫草多糖存在3种多糖,分子量分别为400 kDa,215 kDa和127 kDa。细胞活性实验表明,发酵虫草多糖和天然虫草多糖均对脾细胞增殖的具有促进作用,且发酵虫草多糖对脾细胞增殖促进作用稍优于天然虫草多糖。两种多糖均可降低肿瘤上清液对小鼠脾细胞的体外增殖的抑制作用,两者无显著性差异;加入虫草多糖的各种肿瘤上清液的TGFβ1的分泌量明显降低,两种虫草多糖都能够抑制肿瘤细胞的生长增殖,但无显著性差异。说明两种多糖的生物活性没有明显差异。
冬虫夏草;蝙蝠蛾拟青霉;多糖;发酵;生物活性
冬虫夏草具有极其重要的食用和药用价值。随着市场需求日益增大,造就国内外市场货源紧缺且价格高昂,虫草的人工栽培就成为研究热点。为此研究人员从西藏那曲产地的新鲜冬虫夏草菌(Cordyccps sincnsis(Berk.)Sacc.)中分离出了多个菌株,有研究发现其中蝙蝠蛾拟青霉(Paecilomyces Hepiali Chen&Dai)菌株与冬虫夏草的亲缘关系基本相似[1-2]。卫生部于2001年批准了两种冬虫夏草菌丝体用于保健食品,其中之一就为蝙蝠蛾拟青霉。利用其进行液体深层发酵制取的产品已经实现了工业化和商业化产品[3]。目前,以蝙蝠蛾拟青霉为菌株的液体发酵已有大量研究,从其发酵液中分离得到的多糖类物质具有显著的抗氧化、抗肿瘤、免疫调节、抗衰老、保护肝脏等多种生物活性[4-6]。但发酵产物中的多糖含量及活性同天然冬虫夏草的对比鲜见研究报道。本研究利用从蝙蝠蛾拟青霉的深层液体发酵产物中提取的多糖活性物质,同天然虫草多糖进行比较,考察有效成分的差异,对脾细胞增殖的影响,对人体癌细胞的抑制作用差异,同时考察两种来源的多糖组分对小鼠脾细胞增殖的影响及对人体肺癌细胞的抑制效果的差异,最后通过考察他们对免疫抑制因子TGFβ1分泌量的影响来确定对肿瘤细胞的抑制作用差异。通过此研究对比可对以蝙蝠蛾拟青霉深层发酵为基础的产品开发提供数据参考。
1 材料与方法
1.1 试验材料
1.1.1 试验虫草菌
天然虫草:无限极(中国)有限公司。
蝙蝠蛾拟青霉Paecilomyces hepiali:中国科学院广东省微生物研究所。
发酵虫草菌丝体:蝙蝠蛾拟青霉利用经优化的培养基经5 L发酵罐中发酵制得,其温度为25℃,接种量为10%,发酵pH为4、发酵形成的菌丝体经10 000 r/min,4℃下离心10 min后,置于60℃烘箱中24 h至烘干,即制得发酵虫草菌丝体[7]。
1.1.2 肿瘤细胞株和试验动物
4周龄~6周龄昆明小鼠,雌雄各半,18 g~22 g:广东省实验动物中心。
A549细胞株(人肺癌细胞株):中山大学生命科学学院细胞库。
1.1.3 药材与试剂
25 cm2培养瓶、6孔板、96孔板:康宁公司;DMEM高糖培养基、胎牛血清、胰蛋白酶:Gibco公司;30%H2O2、5-二苯基四氮唑溴盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,a tetrazole,MTT)、异丁醇、SDS、盐酸等:广州化学试剂厂;有丝分裂源脂多糖(Lipopolysaccharides,LPS,Cat.no:S1732):碧云天生物技术研究所;TGFβ1(m)ELISA kit(小鼠的转化生长因子β1酶联免疫吸附测定试剂盒,Cat.no:EK0515)、ELISA 用活化剂(Cat.no:AR1102):武汉博士德生物工程有限公司。
1.1.4 主要试验仪器
真空干燥箱DZF-6020型:上海申贤恒温设备厂;酶标仪Anthos Zenyth 200rt:北京伯乐生命科学发展有限公司;Centrifuge5810R高速冷冻离心机:德国Eppendorf公司;高效液相色谱仪:美国Waters公司;HLPHA-1-4真空冻干机:德国Christ公司;二氧化碳培养箱:美国Themro公司。
1.2 试验方法
1.2.1 天然虫草和发酵菌丝体胞内多糖含量测定
将干燥后天然虫草和发酵菌丝体研磨成粉末,精确称取1 g虫草粉或发酵菌丝体,加入20 mL超纯水,置于50 mL具塞三角瓶中,混匀后,放置在磁力加热器上,90℃甘油浴3 h,取出冷却后,定容至50 mL。5 000 r/min,离心10 min,分离菌体与提取液,取上清液1 mL,加入4 mL无水乙醇至醇浓度为80%,4℃条件下放置12 h后,3 000 r/min,离心5 min,沉淀用80%乙醇洗涤两次。沉淀为虫草粗多糖,按照水提-醇沉法提取多糖,采用苯酚硫酸法测定多糖含量[8]。
1.2.2 天然虫草和发酵菌丝体腺苷含量的检测
按水提-醇沉法超声破碎细胞并收集上清液,利用高效液相色谱法(High Performance Liquid Chromatography,HPLC)检测腺苷含量[9]。
1.2.3 天然虫草和发酵菌丝体中多糖的精制
将按照1.2.1的方法制得的粗多糖,用Sevage法去蛋白,并利用分子量为3 000的透析膜透析48 h,透析液经乙醇沉淀12 h,再经无水乙醇洗涤,冷冻干燥,得到虫草精多糖。
1.2.4 天然虫草和发酵菌丝体多糖成分的测定
天然虫草和发酵菌丝体多糖成分测定采用高效凝胶渗透色谱法。色谱条件:TSK-GEL G-5000PWXL column(7.8 mm×300 mm)与 TSK-GEL G-3000PWXL column(7.8 mm×300 mm)串联;流动相0.02 mol/L KH2PO4溶液,pH6.0;流速 0.6 mL/min;柱温 35℃;检测器:示差检测器。
1.2.5 天然虫草和发酵菌丝体中多糖生物活性的测定
1.2.5.1 小鼠脾细胞悬液的制备
小鼠颈椎脱臼处死,75%乙醇浸泡3 min,取出小鼠置于无菌皿上,在小鼠左腹侧中部剪开小口,撕开皮肤,暴露腹壁,取出红色长条状脾脏;放入盛有5 mL Hanks液的培养皿中稍洗涤;将脾脏放置于200目不锈钢网上,用注射器针芯轻轻研压脾脏,获细胞悬液。显微镜下观察脾细胞,进行计数,用含10%胎牛血清的1640培养基重悬脾细胞。
1.2.5.2 虫草多糖对LPS诱导小鼠脾细胞体外增殖的影响
调整脾细胞浓度为3×108/L,在96孔板中每孔加入100 μL脾细胞悬液,实验组每孔加入不同浓度的虫草多糖待测样100 μL和10 μg/mL的LPS,转化对照组加入10 μg/mL的LPS,每组均设6个复孔,37℃、5%CO2培养48 h后,向实验组和对照组每孔加入终浓度为0.5%的MTT,37℃继续孵育4 h,培养时间结束,每孔加入150 μL MTT三联溶解液(10%SDS、5%异丁醇、0.012 mmol/L HCl),置37℃培养箱继续孵育3 h,用酶标仪在570 nm处检测吸光度(OD值)[10]。
1.2.5.3 分析虫草多糖对A549细胞增殖情况的影响
调整细胞浓度为3×107/L,在96孔板中每孔加入100 μL细胞悬液,实验组每孔加入不同浓度的虫草多糖待测样100 μL,空白对照组加入等量的完全培养基,每组均设6个复孔。37℃、5%CO2培养48 h后,向实验组和对照组每孔加入终浓度为0.5%的MTT,37℃继续孵育4 h,培养时间结束,每孔加入150 μL MTT三联溶解液(10%SDS、5%异丁醇、0.012 mmol/L HCl),置37℃培养箱继续孵育3 h,用酶标仪在570 nm处检测吸光度(OD值)[11]。
1.2.5.4 各种肿瘤上清液的制备
调整A549细胞浓度为5×108/L接种于6孔板,各种条件分别培养A549细胞一定时间后,收集以下肿瘤上清液:单纯肿瘤上清液(M0)、含最适天然虫草多糖的培养液培养24 h的上清液(M1)、含最适天然虫草多糖的培养液培养48 h的上清液(M2)、含最适天然虫草多糖的培养液培养24 h,弃去旧培养液,加入新的不含虫草多糖的培养液继续培养24 h的上清液(M3);含最适发酵虫草多糖的培养液培养24 h的上清液(N1)、含最适发酵虫草多糖的培养液培养48 h的上清液(N2)、含最适发酵虫草多糖的培养液培养24 h,弃去旧培养液,加入新的不含虫草多糖的培养液继续培养24 h的上清液(N3)。
1.2.5.5 各种肿瘤上清液对LPS诱导小鼠脾细胞体外增殖的影响
调整脾细胞浓度为3×108/L,在96孔板中每孔加入100 μL脾细胞悬液,实验组每孔加入各种肿瘤上清液100 μL 和 10 μg/mL 的 LPS,转化对照组加入 10 μg/mL的LPS,每组均设3个复孔,37℃、5%CO2培养48 h后,向实验组和对照组每孔加入终浓度为0.5%的MTT,37℃继续孵育4 h,培养时间结束,每孔加入150 μL MTT三联溶解液(10% 十二烷基硫酸钠(sodium dodecyl sulfate,sodium salt,SDS)、5% 异丁醇、0.012 mmol/L HCl),置37℃培养箱继续孵育3 h,用酶标仪在570 nm处检测吸光度(OD值)。
1.2.5.6 ELISA法测定各种肿瘤上清液中TGFβ1的分泌量
ELISA法测定M0-M3、N1-N3肿瘤上清液TGFβ1的含量,按照试剂盒说明书操作,每组设3个复孔。根据样品的OD值可在标准曲线上算出其对应的浓度(pg/mL)。
准备工作:配制 1 000、500、250、125、62.5、31.3、15.6 pg/mL的标准品,将肿瘤上清液进行TGFβ1活化,按照100 μL样品中加活化剂20 μL A液,10 min后再加20 μL B液。
操作步骤:1.确定本次检测所需的已包被抗体的酶标板孔数目,并增加1孔作为空白显色孔。2.将1 000、500、250、125、62.5、31.3、15.6 pg/mL 的标准品各0.1 mL依次加入一排7孔中,1孔只加样品稀释液作为零孔。加入各组已活化的肿瘤上清液各100 μL,每组做3个重复。3.酶标板加上盖,37℃反应90 min。4.反应后甩去酶标板内液体,再对着吸水纸拍几下,不洗。5.将准备好的生物素抗小鼠TGFβ1抗体工作液按每孔0.1 mL依次加入(空白显色孔除外),37℃反应60 min。6.0.01 mol/L PBS洗涤3次,每次浸泡1 min左右。7.将准备好的ABC工作液按每孔0.1 mL依次加入(空白显色孔除外),37℃反应30 min。8.0.01 mol/L PBS 洗涤 5 次,每次浸泡 1 min~2 min。9.按每孔 90 μL依次加入四甲基联苯胺(4,4'-Bi-2,6-xylidine;4,4'-Diamino-3,3',5,5'-tetramethylbiphenyl,TMB)显色液,37℃避光反应25 min~30 min。10.按每次0.1 ml依次加入TMB终止液,此时蓝色立转黄色。11.用酶标板在450 nm测定OD值。
2 结果与讨论
2.1 天然虫草和发酵菌丝体有效成分的比较
天然虫草、发酵菌丝体主要成分见表1。
与天然虫草多糖试验的对照表明,发酵虫草存在两种多糖,分子量为3 682 kDa和166 kDa;天然虫草多糖存在3种多糖,分子量分别为400、215、127 kDa,均在150 kDa~200 kDa区段存在活性多糖。经过优化的发酵虫草中主要的有效活性成分比天然虫草具有明显的提升,其中菌丝体中多糖和腺苷含量比天然虫草增加了2倍和6倍。但和天然虫草相比,发酵虫草的种类比天然虫草少,而且其分子量大小和含量也有较大的差异,可以发现天然虫草多糖与发酵菌丝体多糖的含量和成分差异较大。

表1 天然虫草和发酵菌丝体的主要成分Table 1 The composition of natural cordyceps polysaccharides and the fermentation
2.2 虫草多糖对LPS诱导小鼠脾细胞体外增殖的影响
脾是机体内最大的免疫器官,内含大量的免疫细胞,其中T淋巴细胞约占40%,B淋巴细胞约占60%,在体液免疫中的地位极其重要。因此,研究虫草多糖有效成分对机体免疫器官的作用是研究免疫调节作用的一个重要方面。天然虫草多糖、发酵菌丝体多糖对小鼠脾细胞体外增殖的影响情况见表2。
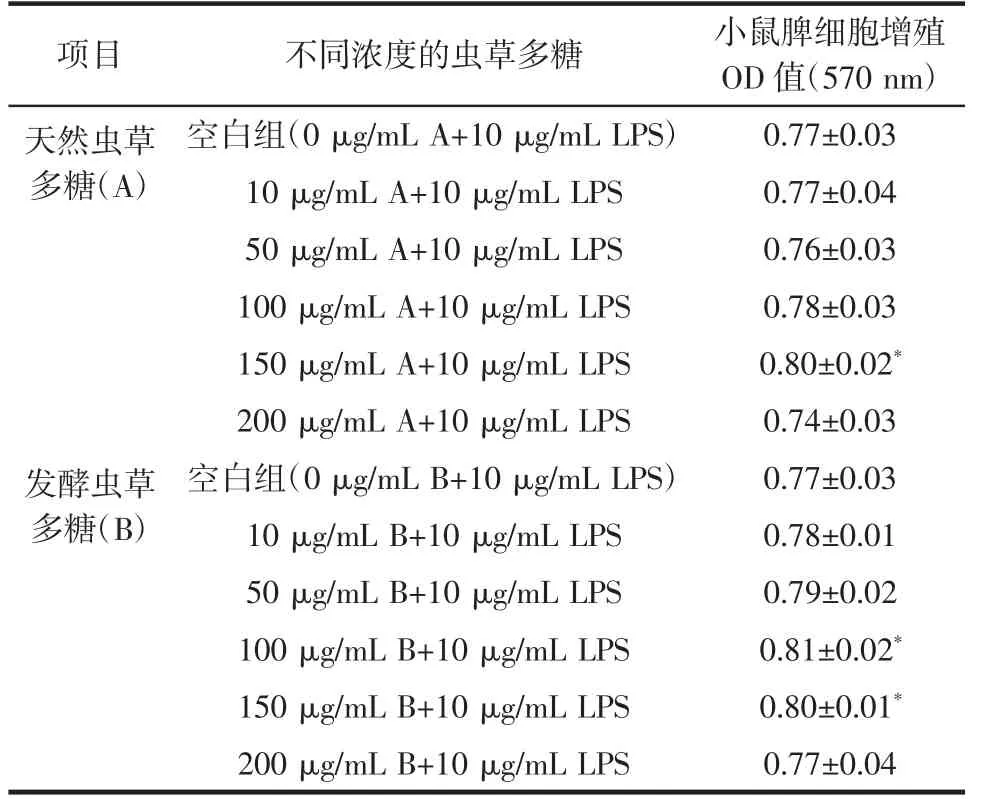
表2 虫草多糖对LPS诱导小鼠脾细胞体外增殖的影响Table 2 Effects of LPS induced mice spleen cells proliferation by cordyceps polysaccharides in vitro
与空白组相比较,天然虫草多糖在10、50、100、200 μg/mL时对LPS诱导转化的小鼠脾细胞的增殖无明显作用,150 μg/mL时有促进小鼠脾细胞增殖的作用。发酵虫草多糖在10、50、200 μg/mL时对LPS诱导转化的小鼠脾细胞的增殖无明显作用,100、150 μg/mL时有促进小鼠脾细胞增殖的作用。且发酵虫草多糖对脾细胞增殖的促进作用稍优于天然虫草多糖。
2.3 虫草多糖对A549细胞增殖情况的影响
虫草多糖对A549细胞增殖情况的影响见表3。
与空白组相比较,随着虫草多糖浓度的增大,A549细胞的抑制率也呈线性增加。其中,当天然虫草多糖、发酵虫草多糖的浓度大于100 μg/mL时,与空白组相比较,对A549细胞具有明显抑制作用。

表3 虫草多糖对A549细胞体外增殖的影响Table 3 Effects of A549 cells proliferation by cordyceps polysaccharides in vitro
由于浓度为100 μg/mL的虫草多糖对A549的细胞抑制作用不明显(P>0.05),对LPS诱导的小鼠脾细胞的体外增殖具有促进作用。本试验选取既对LPS诱导的小鼠脾细胞的体外增殖具有促进作用,同时又对A549细胞无明显毒副作用的浓度作为试验浓度,即100 μg/mL的虫草多糖。
2.4 肿瘤上清液对LPS诱导小鼠脾细胞体外增殖的影响
肿瘤上清液对LPS诱导小鼠脾细胞体外增殖的影响见表4。

表4 各种肿瘤上清液对LPS诱导小鼠脾细胞体外增殖的影响Table 4 Effects of LPS induced mice spleen cells proliferation by various tumor supernatants in vitro
与空白组(不加肿瘤上清液)相比较,单纯的肿瘤上清液M0组明显抑制了小鼠脾细胞的体外增殖,其细胞存活量只有对照组的一半左右。而加入虫草多糖的各种肿瘤上清液能降低这种抑制作用,与对照组相比较没有明显差异(P>0.05)。天然虫草多糖与发酵虫草多糖相比较,二者对小鼠脾细胞体外增殖的影响没有明显差异。
2.5 ELISA法测定各种肿瘤上清液中TGFβ1的分泌量
TGFβ1是免疫系统调节的重要调节因子,对不同的细胞具有不同的作用。通过各肿瘤上清液中的TGFβ1含量可以判断虫草多糖对肿瘤细胞生长增殖的抑制作用[12]。各种肿瘤上清液中TGFβ1的分泌量见表5。
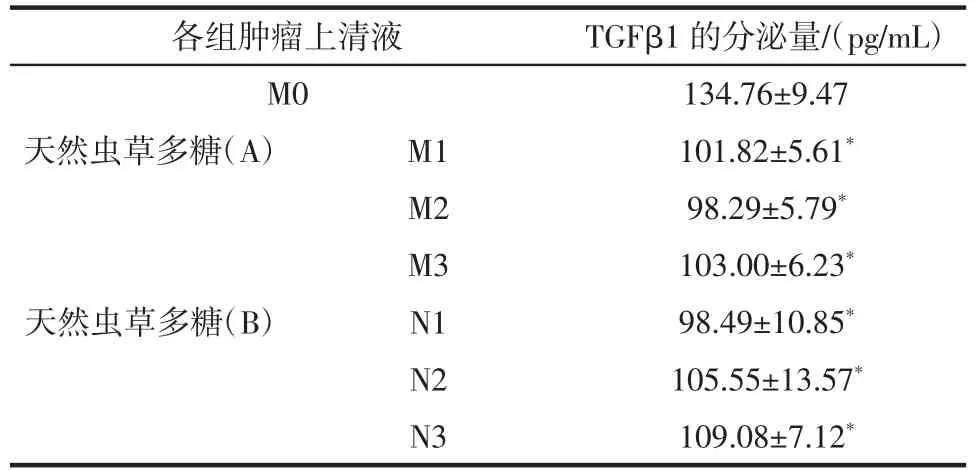
表5 各种肿瘤上清液中TGFβ1的分泌量Table 5 Secretion of TGFβ1 in various tumor supernatant fluid
与单纯肿瘤上清液M0组相比较,加入虫草多糖的各种肿瘤上清液的TGFβ1的分泌量明显降低(P<0.05),说明虫草多糖对肿瘤上清液中的免疫抑制因子有抑制作用,能够抑制肿瘤细胞的生长增殖。但M1、M2、M3,N1、N2、N3 各组之间没有明显差异。推测天然虫草多糖和发酵虫草多糖对肿瘤细胞的抑制在作用24 h就可显现,并且最少可维持48 h,但两种多糖的这种抑制作用没有显著性差异。
3 结论
与然虫草多糖与发酵虫草多糖在组成和含量上都有较大差异,但通过细胞增殖实验发现两种多糖组份均对脾细胞增殖具有促进作用,且发酵虫草多糖对脾细胞增殖的促进作用稍优于天然虫草多糖;两种虫草多糖对人肺癌细胞具有明显抑制作用,且没有显著性差异。两种多糖均可降低肿瘤上清液对小鼠脾细胞的体外增殖的抑制作用,进一步的实验表明,加入虫草多糖的各种肿瘤上清液的TGFβ1的分泌量明显降低,能够抑制肿瘤细胞的生长增殖。结果发现两种多糖组分的生物活性没有显著性差异。
[1] Wang WJ,Li Y,Wang XL,et al.Neotypification of Paecilomyces hepiali(Hypocreales)[J].Taxon,2015,64(1):147-150
[2] 代永东,虞泓,陈自宏,等.云南虫生真菌粉棒束孢遗传分化研究[J].菌物学报,2015,34(1):38-52
[3] 董彩虹,李文佳,李增智,等.我国虫草产业发展现状、问题及展望—虫草产业发展金湖宣言[J].菌物学报,2016,35(1):1-15
[4] Song D,He ZY,Wang CH,et al.Regulation of the exopolysaccharide from an anamorph of Cordyceps sinensis on dendritic cell sarcoma(DCS)cell line[J].European Journal of Nutrition,2013,52(2):687-694
[5] Wu GH,Hu T,Li ZY,et al.In vitro antioxidant activities of the polysaccharides from Pleurotus tuber-regium(Fr.)Sing[J].Food Chemistry,2014,148(4):351-356
[6] Wu ZW,Lu JW,Wang XQ,et al.Optimization for production of exopolysaccharides with antitumor activity in vitrofrom Paecilomyces hepialid[J].Carbohyd Polym,2014,99(1):226-234
[7] 刘元元.蝙蝠蛾拟青霉的液态发酵工艺研究[D].广州:华南理工大学,2012
[8] Chen XL,Wu GH,Huang ZL.Structural analysis and antioxidant activities of polysaccharides from cultured cordyceps militaris[J].International Journal of Biological Macromolecules,2013,58(7):18-22
[9] 张命龙,焦春伟,谢意珍,等.蝙蝠蛾拟青霉液体发酵工艺优化及菌丝体腺苷含量的检测[J].菌物学报,2016,35(2):188-198
[10]胡庭俊,康乐,帅学宏,等.山豆根多糖对小鼠脾脏淋巴细胞体外增殖及分泌一氧化氮的影响 [J].中药药理与临床,2009,25(5):70-72
[11]张超,钟沁,张锡峰,等,虫草素对A549细胞增殖、凋亡及核转录因子NF-κB活性的影响[J].中药材,2015,38(4):786-789
[12]Letterio JJ,Roberts AB.Regulation of immune responses by TGF-beta[J].Annual Review of Immunology,1998,16(16):13-61
Comparison of Polysaccharide Components and Functional Activities of Fermentation and Natural Paecilomyces hepialid
CAO Yu1,LI Zhi-gang2
(1.Guangzhou Green Oil Industrial Co.,Ltd.,Guangzhou 511462,Guangdong,China;2.School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510640,Guangdong,China)
In order to find out the differences between the fermentation mycelium and the natural mycelium of Paecilomyces hepialid,a comparative study on the composition and content of polysaccharide were analyzed.And the bioactivities of polysaccharides from two kinds of mycelium were compared by MTT assay.There were two polysaccharides in fermentation mycelium,molecular weight of 3 682 000 and 166 000.And there were three polysaccharides in natural mycelium,molecular weight of 400 000,215 000 and 127 000.The MTT assay showed that both kinds of polysaccharides had promoting effect to the spleen cell proliferation,and the fermentation polysaccharides were slightly better.Both kinds of polysaccharides could reduce the inhibition of tumor supernatant of murine spleen cell proliferation in vitro,and there was no significant difference between two kinds of polysaccharides.The secretion of TGFβ1 of various tumors supernatant,which added polysaccharides,was significantly reduced.Both kinds of could inhibit the growth of tumor cells,and there was no significant difference between two kinds of polysaccharides.It showed that there were no significant differences between two kinds of polysaccharides in biological activities.
Cordyceps sinensis;Paecilomyces hepialid;polysaccharides;fermentation;biological activities
2017-02-17
10.3969/j.issn.1005-6521.2017.11.006
曹昱(1984—),男(汉),工程师,博士,主要从事食品工程研究。

