CRL4在增殖的肝细胞系中上调乙型肝炎病毒抗原的分泌表达
朱园飞,鱼康康,邓强,高月求
1. 上海中医药大学附属曙光医院细胞免疫研究室,上海 201203; 2. 中国科学院上海巴斯德研究所分子病毒与免疫重点实验室,上海 200032
·论著·
CRL4在增殖的肝细胞系中上调乙型肝炎病毒抗原的分泌表达
朱园飞1,2,鱼康康2,邓强1,2,高月求1
1. 上海中医药大学附属曙光医院细胞免疫研究室,上海 201203; 2. 中国科学院上海巴斯德研究所分子病毒与免疫重点实验室,上海 200032
乙型肝炎病毒(hepatitis B virus,HBV)编码的X蛋白(hepatitis B virus X protein,HBx)对HBV感染的启始和维持至关重要。HBx可能作为病毒来源的接头分子,介导Cullin-RING E3泛素连接酶4(Cullin-RING ubiquitin E3 ligase 4,CRL4)复合物对染色体外DNA限制因子SMC5/6的降解。最近研究发现,CRL4接头分子DNA损伤结合蛋白1(DNA damage-binding protein 1,DDB1)可不依赖与HBx的相互作用而直接上调病毒的表达和复制。本研究基于HBx基因删除(X-null)的HBV重组共价闭合环状DNA(recombinant covalently closed circular DNA,rcccDNA)模型系统,在多种体外培养肝细胞系中证实上述发现。有意思的是,CRL4刺激rcccDNAX-null转染细胞抗原分泌表达的效应能被血清饥饿实验抵消。应用尾静脉高压注射小鼠模型,同样发现CRL4并不上调rcccDNAX-null在非增殖小鼠肝脏细胞中的表达。以上结果提示,细胞增殖特征与CRL4不依赖HBx上调病毒抗原分泌表达的效应密切相关,有助于HBx生物学意义的准确分析和理解。
乙型肝炎病毒;乙型肝炎病毒X蛋白;共价闭合环状DNA;Cullin-RING E3泛素连接酶4;细胞增殖
很多病毒能利用宿主泛素-蛋白酶体系统调控其生命周期[1]。CUL4属Cullin蛋白家族,包括两个同源的CUL4A和CUL4B蛋白,与RING结构域蛋白ROC1及DNA损伤结合蛋白1(DNA damage-binding protein 1,DDB1)组成Cullin-RING E3泛素连接酶4(Cullin-RING ubiquitin E3 ligase 4,CRL4)复合体。其中,DDB1作为接头蛋白连接不同的底物识别亚基DCAF(DDB1-CUL4 associated factor),降解特异性底物[2]。CRL4复合物参与机体内广泛的生理过程,包括细胞周期调控、染色质表观遗传修饰、DNA复制和修复等[2]。
乙型肝炎病毒(hepatitis B virus,HBV)属嗜肝DNA病毒科。在病毒感染肝细胞核内,HBV修复为共价闭合环状DNA(covalently closed circular DNA,cccDNA),是病毒转录复制的模板和中心环节[3]。cccDNA非常稳定,被认为是HBV慢性感染的分子基础[4-5]。在早先研究中,本课题组基于Cre/loxP 介导的位点特异性重组策略,由前体质粒诱导重组cccDNA(recombinant cccDNA,rcccDNA)产生,首次建立了HBV cccDNA的体外培养细胞及小鼠实验模型,获得广泛关注[6]。
HBV X蛋白(HBV X protein,HBx)能显著上调HBV的转录和复制[7]。有研究认为,HBV感染后宿主细胞在表观遗传学水平形成对cccDNA微小染色体的抑制[8]。最近报道显示,HBx通过结合DDB1挟持CRL4,对一种宿主蛋白复合体SMC5/6[9]实现泛素化降解[10-11],后者可能涉及宿主细胞针对染色体外病毒DNA的天然免疫机制。这一研究在HBV领域引起广泛兴趣,也引发了一定争议。例如,Kim等基于HBx的突变分析发现,DDB1可上调HBV在宿主细胞的转录和复制,但并不依赖HBx与DDB1的相互作用[12]。
本研究应用HBx基因删除(X-null)的rcccDNA模型系统,对CRL4调控的HBV抗原分泌表达进行分析,在多种体外培养肝细胞系中证实了Kim等[12]的发现。有意思的是,CRL4不依赖HBx上调病毒抗原分泌表达的效应能被血清饥饿实验抵消,提示可能与体外培养细胞的增殖特征相关。与之一致的是,尾静脉高压注射小鼠模型显示,CRL4并不上调rcccDNAX-null在非增殖小鼠肝脏细胞中的表达。
1 材料与方法
1.1 材料
prcccDNA和pCMV-Cre为本实验室早期构建[6]。人肝癌细胞株Huh-7、HepG2和小鼠胚胎肝细胞BNL CL.2为本实验室保存。噻唑蓝(methylthiazolyldiphenyl-tetrazolium,MTT)细胞增殖及细胞毒性检测试剂盒购自碧云天生物技术研究所。FuGENE®HD 转染试剂和海肾荧光素酶报告载体pRL-TK购自Promega公司。C57BL/6雄性小鼠购自上海灵畅生物科技有限公司。
1.2 方法
1.2.1 质粒构建 通过聚合酶链反应(polymerase chain reaction,PCR),在HBx基因ATG起始码下游第22位引入C→T突变(CAA→TAA),构建HBx基因删除的突变质粒prcccDNAX-null。pCMV-CUL4A、pCMV-CUL4B及pCMV-DDB1基于真核表达载体pcDNA3.1构建,分别表达人CUL4A、CUL4B和DDB1蛋白。短发夹RNA(short hairpin RNA,shRNA)编码质粒基于pLKO.1载体构建,插入序列如表1所示。根据pLKO.1 TRC Cloning Vector Protocol(Addgene)操作流程,在pLKO.1载体中插入相应shRNA编码序列,构建质粒由DNA测序鉴定(上海博尚生物技术有限公司)。
表1 shRNA编码质粒插入序列
Tab.1 Oligonucleotides used for construction of shRNA-encoding plasmids
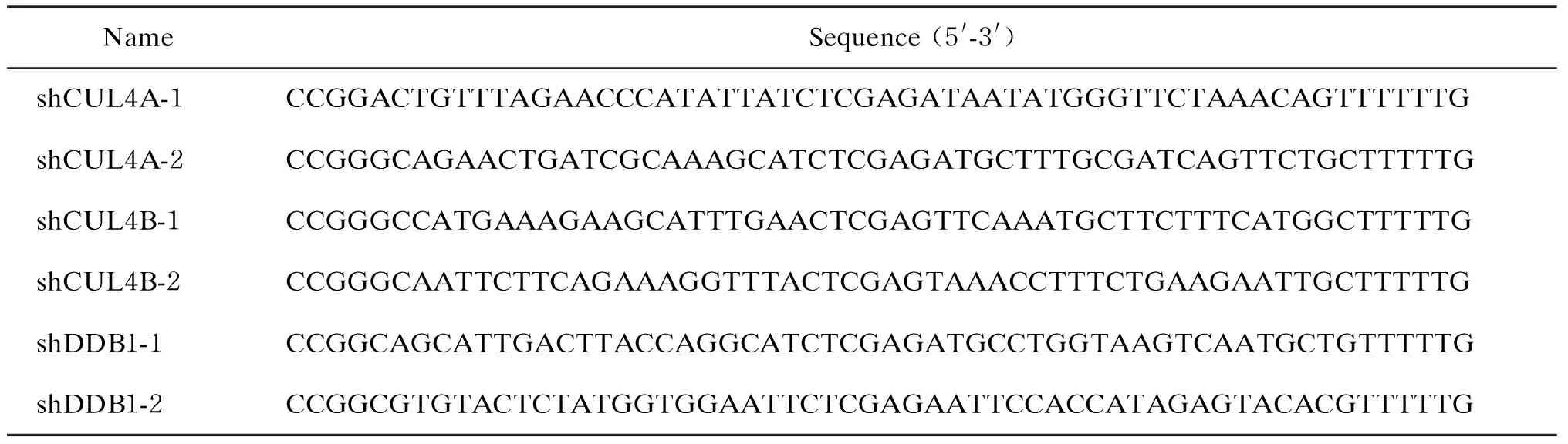
NameSequence(5'-3')shCUL4A-1CCGGACTGTTTAGAACCCATATTATCTCGAGATAATATGGGTTCTAAACAGTTTTTTGshCUL4A-2CCGGGCAGAACTGATCGCAAAGCATCTCGAGATGCTTTGCGATCAGTTCTGCTTTTTGshCUL4B-1CCGGGCCATGAAAGAAGCATTTGAACTCGAGTTCAAATGCTTCTTTCATGGCTTTTTGshCUL4B-2CCGGGCAATTCTTCAGAAAGGTTTACTCGAGTAAACCTTTCTGAAGAATTGCTTTTTGshDDB1-1CCGGCAGCATTGACTTACCAGGCATCTCGAGATGCCTGGTAAGTCAATGCTGTTTTTGshDDB1-2CCGGCGTGTACTCTATGGTGGAATTCTCGAGAATTCCACCATAGAGTACACGTTTTTG
1.2.2 细胞培养和细胞转染 Huh-7、HepG2和BNL CL.2细胞常规培养于含10%胎牛血清、100 U/mL青/链霉素的DMEM培养基(Gibco BRL)。血清饥饿实验中,胎牛血清浓度降至0.2%,每24 h更换培养液。DNA转染采用FuGENE®HD 转染试剂,按厂商提供的指导手册进行。用pRL-TK共转染细胞,转染后3 d收集细胞,检测荧光素酶活性以校正转染效率。
1.2.3 MTT检测 HepG2细胞在正常或血清饥饿条件下培养3 d,胰酶消化后以每孔10 000个细胞的密度接种于96孔板。贴壁后每孔加入10 μL MTT试剂,孵育4 h,加入100 μL甲瓒溶解液,孵育3~4 h至光镜下观察结晶紫全部溶解,在570 nm处测定光密度(optical density,OD)。
1.2.4 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA) 采用上海科华生物工程股份有限公司的ELISA试剂盒,检测细胞培养上清液中HBV e抗原(HBV e antigen,HBeAg)和表面抗原(HBV surface antigen,HBsAg)的表达。用Bench Mark ELISA酶标仪(Bio-Rad)读取450 nm处OD。调整样品稀释度,使OD450为0.4~1.6(线性检测范围),以信噪比(signal/noise)计算相对的抗原浓度。
1.2.5 小鼠尾静脉高压注射 小鼠尾静脉高压注射按文献[6]进行。在4~5周龄C57BL/6雄性小鼠中,共注射4 μg prcccDNAX-null,4 μg pCMV-Cre,以及8 μg真核表达质粒pCMV-CUL4A、pCMV-CUL4B或pCMV-DDB1,4 d后眼眶后静脉丛采血,检测血清HBsAg和HBeAg表达。
2 结果
2.1 CRL4在Huh-7细胞中上调基于rcccDNAX-null的病毒抗原分泌表达
用prcccDNA/pCMV-Cre共转染肝肿瘤细胞系,在细胞核中诱导大量rcccDNA产生,后者含有一段较短的loxP杂合内含子编码序列,能在病毒转录过程被高效移除[6]。通过过表达CRL4组成蛋白,评价CRL4对rcccDNA抗原表达的影响。应用真核表达质粒pCMV-CUL4A、pCMV-CUL4B及pCMV-DDB1,分别与prcccDNA/pCMV-Cre共转染Huh-7细胞,在培养上清液中检测到显著升高的HBeAg和HBsAg(图1A)。进一步通过点突变方法构建prcccDNAX-null突变体,诱导HBx基因删除的rcccDNAX-null。过表达CUL4A或DDB1同样观察到基于rcccDNAX-null病毒抗原表达的上升,但过表达CUL4B未出现相似的结果(图1B)。结果提示,在培养的Huh-7细胞中,CRL4能通过某种HBx不相关机制直接刺激HBV抗原的分泌表达。
2.2 CRL4在HepG2和BNL CL.2细胞中上调基于rcccDNAX-null的病毒抗原分泌表达
以前有研究显示Huh-7细胞不适用于研究HBx相关生物学功能。本研究采用HepG2及BNL CL.2细胞,进一步检验CRL4对rcccDNAX-null抗原表达的影响。与图1B相似,过表达CUL4A或DDB1,而不是CUL4B,能上调基于rcccDNAX-null的HBV抗原表达(图2)。进一步构建shRNA编码质粒,能特异性敲低转染细胞中内源表达的CUL4A、CUL4B或DDB1(数据未列出);分别与prcccDNAX-null/pCMV-Cre共转染HepG2细胞,其中共转染pLKO.1-shCUL4A或pLKO.1-shDDB1能显著下调rcccDNAX-null的抗原表达。 以上结果显示, CRL4 能在多种体外培养细胞系中通过HBx不相关机制调控HBV抗原的分泌表达。
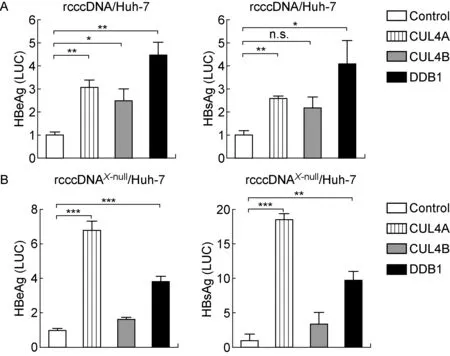
A: Plasmids encoding the core components of CRL4 (pCMV-CUL4A, pCMV-CUL4B, and pCMV-DDB1) were cotransfected, respectively, with prcccDNA and pCMV-Cre, at a 2∶1∶1 ratio. Secretions of HBeAg and HBsAg in the cell culture medium were determined on day 3 after transfection. Results (normalized to luciferase activity) are expressed as fold change over that in the medium of pcDNA3.1-transfected cells. B: An HBx-mutant of prcccDNA was constructed to induce rcccDNAX-null. The effect of CRL4 on rcccDNAX-null-based viral expression was analyzed as described in A.*P<0.05,**P<0.01,***P<0.001. n.s., not significant.
图1 CRL4不依赖HBx刺激Huh-7细胞中基于rcccDNA的HBV抗原分泌表达
Fig.1 CRL4 stimulated rcccDNA-based HBV antigen expression in Huh-7 cells in an HBx-independent manner

A: rcccDNAX-null-based HBV antigen expression in HepG2 and BNL CL.2 cells was determined as described in Fig.1. B: In HepG2 cells, shRNA-encoding plasmids targeting the expressions of human CUL4A, CUL4B, and DDB1 were transfected, respectively, with prcccDNA and pCMV-Cre at a 2∶1∶1 ratio. HBV antigen expression was determined on day 6 after transfection.*P<0.05,**P<0.01. n.s., not significant.
图2 CRL4在HepG2和BNL CL.2细胞中上调基于rcccDNAX-null的HBV抗原分泌表达
Fig.2 CRL4 upregulated rcccDNAX-null-based HBV antigen expression in HepG2 and BNL CL.2 cells
2.3 CRL4不依赖HBx上调HBV抗原分泌表达可能与细胞增殖相关
大量证据表明CRL4调控细胞周期,在DNA复制和修复过程中起重要作用。本研究采用血清饥饿法抑制体外培养细胞的增殖[13],对CRL4调控的rcccDNAX-null抗原分泌表达进行分析。连续应用0.2%胎牛血清体外培养HepG2,直接细胞计数和MTT实验显示能明显延缓细胞增殖(图3A,左图),但仍保持相对健康的细胞活性(图3A,右图)。有意思的是,在此培养条件下,共转染pCMV-CUL4A或pCMV-DDB1均不能显著上调rcccDNAX-null的抗原分泌表达;共转染pCMV-CUL4B明显抑制rcccDNAX-null的抗原分泌表达(图3B)。
生理条件下,体内肝脏细胞的更迭频率极低。鉴于CRL4在人与小鼠之间高度保守,本研究采用尾静脉DNA高压注射小鼠模型,对CRL4调控的rcccDNAX-null抗原表达进行分析。对小鼠血清中HBV分泌抗原的分析表明,共注射pCMV-CUL4A、pCMV-CUL4B或pCMV-DDB1表达质粒, 并不明显影响 rcccDNAX-null在小鼠肝脏中的抗原表达(图3C)。上述培养细胞和小鼠模型实验提示,CRL4不依赖HBx上调HBV抗原分泌表达可能与细胞增殖密切相关。
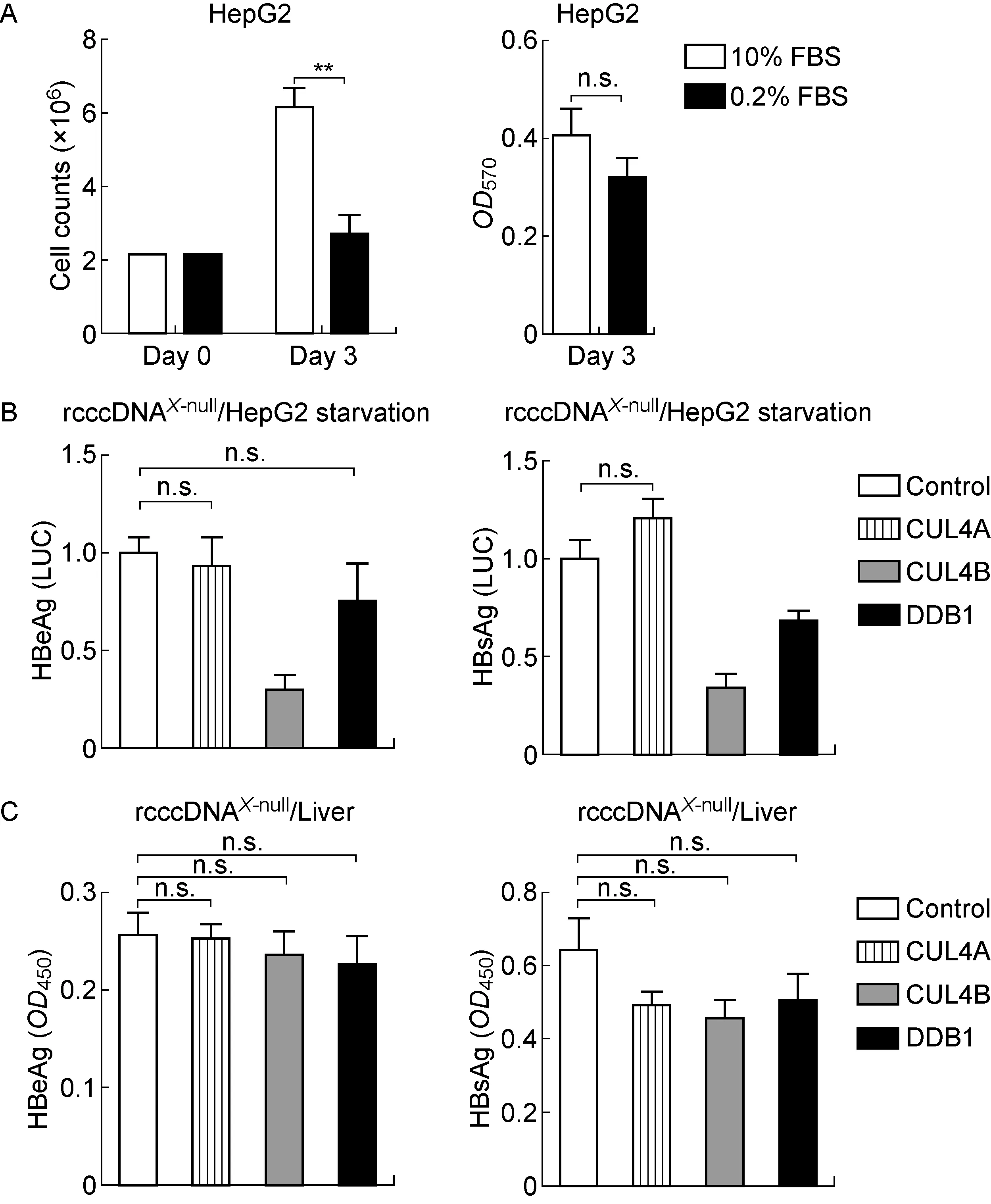
A: HepG2 cells were cultured in the presence of 0.2% or 10% fetal bovine serum (FBS). The cell proliferation and viability were estimated by direct cell counting (left) and MTT assay (right), at indicated time points. B: In the setting of serum starvation (0.2% FBS), the effects of CRL4 on rcccDNAX-nulll-based HBV antigen expression were analyzed as described in Fig.2A. C: pCMV-CUL4A, pCMV-CUL4B or pCMV-DDB1, was hydrodynamically coinjected with prcccDNA and pCMV-Cre at a 2∶1∶1 ratio to C57BL/6 mice (n=8 for each group). pcDNA3.1 was coinjected with prcccDNA and pCMV-Cre as control. HBV antigen production in mouse serum was determined by ELISA on day 4 after injection.**P<0.01. n.s., not significant.
图3 CRL4基于rcccDNAX-null上调HBV抗原表达与快速细胞增殖相关
Fig.3 The upregulation of CRL4 on rcccDNAX-nulll-based HBV antigen expression was related to rapid cell proliferation
3 讨论
HBV编码的非结构蛋白HBx被认为具有多种复杂的调控功能,相关研究在近期获得了一系列重要进展。Lucifora等应用删除HBx的HBV突变株体外感染人原代肝脏细胞或分化的HepaRG细胞,发现HBx对有效HBV感染的启始和维持至关重要,且与cccDNA微小染色体的H3组蛋白乙酰化模式密切相关[14]。基于这一模型,Neuveut研究组报道,删除HBx的病毒突变体通过H3K9二甲基化和三甲基化招募HP1因子,抑制cccDNA微小染色体的转录[8]。来自瑞士的Strubin研究组则报道,HBx可能作为一种病毒来源的DCAF分子,介导CRL4对染色体外DNA限制因子SMC5/6的泛素化降解[10]。
在众多HBx候选结合分子中,DDB1与HBx的相互作用研究得较为确切,最早于1995年由Lee等[15]报道,并被许多实验室证实。DDB1是CRL4复合物中的接头分子,在CUL4家族介导的蛋白泛素化降解过程中扮演重要角色。与Kim等的报道一致,本研究也观察到过表达DDB1能不依赖HBx而直接上调HBV cccDNA的表达。为解释这一现象,本课题组曾试图将CRL4与HBV转录因子(如具有显著转录抑制活性的Prox1[16]等)进行关联,但未获得特别值得关注的发现。另一方面,CRL4的生物学功能主要涉及细胞增殖、DNA复制和修复等方面的精细调控,而HBV自然感染通常发生于静止期的肝脏细胞。本研究设计了血清饥饿体外培养细胞实验及基于体内肝细胞的小鼠尾静脉高压注射实验,均提示CRL4不依赖HBx上调HBV抗原分泌表达与细胞增殖相关。与之相一致的是,尾静脉高压注射小鼠模型中过表达CRL4相关蛋白并不上调野生(未删除HBx)rcccDNA的转录。而生理条件下,小鼠模型中肝细胞基本处于G0期静息状态。
HBx作为重要的转录激活分子,对细胞的影响较为复杂。本研究在HBx氨基酸序列第7位引入终止密码子时参考了很多实验室的通用做法[17-18]。值得注意的是,引入终止密码子并不能终止mRNA的转录,有研究认为HBV mRNA拼接产物能上调病毒的复制[19],而HBV转录产物是否参与CRL4相关机制仍有待研究。
应指出的是,HBV研究领域始终缺乏理想的细胞培养和体内感染实验模型。显然,HBV在非增殖肝细胞和持续增殖的肿瘤细胞系中可能具有不同的病毒学特征。CRL4相关HBx调控机制研究是该领域的前沿和热点,本研究的发现代表了一些不同的认识,有助于对HBV病毒学进行正确分析和理解。
[1] Minor MM, Slagle BL. Hepatitis B virus HBx protein interactions with the ubiquitin proteasome system [J]. Viruses, 2014, 6(11): 4683-4702.
[2] Jackson S, Xiong Y. CRL4s: the CUL4-RING E3 ubiquitin ligases [J]. Trends Biochem Sci, 2009, 34(11): 562-570.
[3] Seeger C, Mason WS. Hepatitis B virus biology [J]. Microbiol Mol Biol Rev, 2000, 64(1): 51-68.
[4] Nassal M. HBV cccDNA: viral persistence reservoir and key obstacle for a cure of chronic hepatitis B [J]. Gut, 2015, 64(12):1972-1984.
[5] Zoulim F, Lebossé F, Levrero M. Current treatments for chronic hepatitis B virus infections [J]. Curr Opin Virol, 2016, 18: 109-116.
[6] Qi Z, Li G, Hu H, Yang C, Zhang X, Leng Q, Xie Y, Yu D, Zhang X, Gao Y, Lan K, Deng Q. Recombinant covalently closed circular hepatitis B virus DNA induces prolonged viral persistence in immunocompetent mice [J]. J Virol, 2014, 88(14): 8045-8056.
[7] Slagle BL, Bouchard MJ. Hepatitis B virus X and regulation of viral gene expression [J]. Cold Spring Harb Perspect Med, 2016, 6(3): a021402.
[8] Rivière L, Gerossier L, Ducroux A, Dion S, Deng Q, Michel ML, Buendia MA, Hantz O, Neuveut C. HBx relieves chromatin-mediated transcriptional repression of hepatitis B viral cccDNA involving SETDB1 histone methyltransferase [J]. J Hepatol, 2015, 63 (5): 1093-1102.
[9] Fernandez-Capetillo O. The (elusive) role of the SMC5/6 complex [J]. Cell Cycle, 2016, 15(6): 775-776.
[10] Decorsière A, Mueller H, van Breugel PC, Abdul F, Gerossier L, Beran RK, Livingston CM, Niu C, Fletcher SP, Hantz O, Strubin M. Hepatitis B virus X protein identifies the Smc5/6 complex as a host restriction factor [J]. Nature, 2016, 531(7594): 386-389.
[11] Murphy CM, Xu Y, Li F, Nio K, Reszka-Blanco N, Li X, Wu Y, Yu Y, Xiong Y, Su L. Hepatitis B virus X protein promotes degradation of SMC5/6 to enhance HBV replication [J]. Cell Rep, 2016, 16(11): 2846-2854.
[12] Kim W, Lee S, Son Y, Ko C, Ryu WS. DDB1 stimulates viral transcription of hepatitis B virus via HBx-independent mechanisms [J]. J Virol, 2016, 90(21): 9644-9653.
[13] Pirkmajer S, Chibalin AV. Serum starvation: caveat emptor [J]. Am J Physiol Cell Physiol, 2011, 301(2): C272-C279.
[14] Lucifora J, Arzberger S, Durantel D, Belloni L, Strubin M, Levrero M, Zoulim F, Hantz O, Protzer U. Hepatitis B virus X protein is essential to initiate and maintain virus replication after infection [J]. J Hepatol, 2011, 55(5): 996-1003.
[15] Lee TH, Elledge SJ, Butel JS. Hepatitis B virus X protein interacts with a probable cellular DNA repair protein [J]. J Virol, 1995, 69(2): 1107-1114.
[16] Qin J, Zhai J, Hong R, Shan S, Kong Y, Wen Y, Wang Y, Liu J, Xie Y. Prospero-related homeobox protein (Prox1) inhibits hepatitis B virus replication through repressing multiple cis regulatory elements [J]. J Gen Virol, 2009, 90(Pt 5): 1246-1255.
[17] Melegari M, Scaglioni PP, Wands JR. Cloning and characterization of a novel hepatitis B virus x binding protein that inhibits viral replication [J]. J Virol, 1998, 72 (3): 1737-1743.
[18] Gearhart TL, Bouchard MJ. The hepatitis B virus X protein modulates hepatocyte proliferation pathways to stimulate viral replication [J]. J Virol, 2010, 84(6): 2675-2686.
[19] Chen WN, Chen JY, Lin WS, Lin JY, Lin X. Hepatitis B doubly spliced protein, generated by a 2.2 kb doubly spliced hepatitis B virus RNA, is a pleiotropic activator protein mediating its effects via activator protein-1- and CCAAT/enhancer-binding protein-binding sites [J]. J Gen Virol, 2010, 91(Pt 10): 2592-2600.
《微生物与感染》征订启事
《微生物与感染》重点介绍国内外微生物学基础研究与临床相结合的研究成果和新进展,内容涉及与人类、动物和植物感染有关的微生物,如病毒、细菌、真菌、立克次体、螺旋体、支原体等的生物学及分子生物学特性、抗感染免疫、实验室诊断技术以及临床感染等方面的研究。主要栏目有特约专稿、论著、病例分析、综述等。可供从事微生物与感染的教学、科研、医疗等工作者参考。欢迎广大读者到当地邮局订阅。
地址:上海市医学院路138号 邮编:200032 电话:021-54237633
电子邮箱:jmi@fudan.edu.cn 网站:http://jmi.fudan.edu.cn
双月25日出版 统一刊号:ISSN 1673-6184 CN31-1966/R 邮发代号:4-341
定价:12.00元/册 全年定价:72.00元/册
《微生物与感染》编辑部
s. GAO Yueqiu, E-mail: gaoyueqiu@hotmail.com;DENG Qiang, E-mail:dengqiang@sibs.ac.cn
CRL4 upregulates secretion of hepatitis B virus antigens in proliferating liver cell lines
ZHU Yuanfei1,2, YU Kangkang2, DENG Qiang1,2, GAO Yueqiu1
1.Laboratory of Cellular Immunity, Shuguang Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China; 2. Key Laboratory of Molecular Virology and Immunology, Institute Pasteur of Shanghai, Chinese Academy of Sciences, Shanghai 200032, China
Hepatitis B virus (HBV) regulatory protein HBx is required to initiate and maintain productive virus replication. HBx is thought to achieve these functions by hijacking Cullin-RING ubiquitin E3 ligase 4 (CRL4) to target the SMC5/6 complex, a restriction factor for extrachromosomal viral DNA degradation. Studies also indicated that DNA damage-binding protein 1 (DDB1), an adaptor protein within CRL4 complex, may stimulate HBV transcription via a mechanism that does not involve an interaction with HBx. In the present study, using a model system of recombinant covalently closed circular DNA (rcccDNA) of HBV, it was confirmed that CRL4 could upregulate the secretion of HBV antigens in the absence of HBx (rcccDNAX-null) in cultured hepatoma cell lines. However, this effect of CRL4 was abolished by serum deprivation in the cell culture. In addition, it was found that CRL4 failed to stimulate the expression of rcccDNAX-nullin non-proliferating hepatocytes in a mouse model with DNA hydrodynamic injection. Thus, the HBx-independent, CRL4-upregulated HBV expression is likely to be closely related to rapid proliferation of cultured hepatoma cell lines. The study thus revealed a previously unappreciated role of CRL4 in HBV virology, and would be helpful for better understanding of the biological significance of HBx.
Hepatitis B virus; Hepatitis B virus X protein; Covalently closed circular DNA; Cullin-RING ubiquitin E3 ligase 4; Cell proliferation
国家自然科学基金(81471950、81672034),上海市科学技术委员会科研计划项目(16401970600)
高月求,邓强
2017-02-28)

