柯萨奇病毒B3型3D蛋白抗体的制备
王玉,徐维祯,穆宇松,王天楹,闫碧莹,颜学勤,赵文然,钟照华
1. 哈尔滨医科大学微生物学教研室及伍连德研究所,哈尔滨 150081; 2. 哈尔滨医科大学细胞生物学教研室,哈尔滨 150081
·论著·
柯萨奇病毒B3型3D蛋白抗体的制备
王玉1,徐维祯1,穆宇松1,王天楹1,闫碧莹1,颜学勤1,赵文然2,钟照华1
1. 哈尔滨医科大学微生物学教研室及伍连德研究所,哈尔滨 150081; 2. 哈尔滨医科大学细胞生物学教研室,哈尔滨 150081
肠道病毒3D蛋白是其RNA聚合酶。柯萨奇病毒B3型(coxsackievirus B3,CVB3)主要感染心脏,其3D蛋白在心肌表达中的时序和分布尚不清楚。本研究将通过聚合酶链反应(polymerase chain reaction,PCR)获得的CVB 3D片段插入pET28a(+)的表达框,获得pET28a(+)-3D重组质粒。异丙基 β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)诱导pET28a(+)-3D表达3D-His蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)后,切胶,获得3D-His蛋白。3D-His蛋白加佐剂免疫新西兰大白兔制备3D蛋白多克隆抗体,蛋白免疫印迹法检测抗体效价及特异性。结果显示,本研究获得了高效价且特异性好的抗CVB3 3D蛋白抗体,可用于CVB3 3D蛋白功能的后续研究。
柯萨奇病毒B3型;3D聚合酶;抗体;原核表达
柯萨奇病毒B组(coxsackievirus B,CVB)属小RNA病毒科肠病毒属,目前已鉴定出6种血清型(CVB1~CVB6)。CVB是人类病毒性心肌炎(viral myocarditis,VMC)的主要病原[1-2]。我国长春地区对近10年来疑似病毒性心肌炎患者的研究[3]显示,成人患者CVB感染阳性率为63.4%,血清型以B3、B4、B5为主;儿童患者CVB感染阳性率为65.8%,血清型以B3、B4为主。在约50%扩张型心肌病患者中发现CVB反应性抗体,而在多达70%的患者中检测到该病毒的基因组成分[4-5]。
CVB颗粒是无包膜20面体结构,直径约30 nm[6]。病毒基因组是一条单股正链RNA(+ssRNA),全长7 396个核苷酸(nucleotide,nt),其5′非编码区(non-coding region,NCR)较长且高度结构化,只有一个较大的开放读码框(open reading frame,ORF)和一较短的3′非编码区,最后以poly(A)尾终止。ORF在宿主细胞胞质中翻译成多聚蛋白后,病毒蛋白酶对其进行加工产生11种蛋白,包括4个衣壳蛋白(VP1~VP4)和7个功能蛋白(2A、2B、2C、3A、3B、3C、3D)[7]。
小RNA病毒基因组编码的多聚蛋白被切割后产生11种蛋白,最后一个是RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,RdRp),被称为3D。3D的结构在过去几十年被广泛研究,包括脊髓灰质炎病毒(poliovirus, PV)、CVB3、肠病毒71型(enterovirus 71,EV71)和人鼻病毒(human rhinovirus,HRV)[8-13]。3D晶体构象如一杯状右手,包括手掌结构域、拇指结构域和手指结构域[14]。手指和拇指结构域穿过蛋白质N端部分相互连接,形成一个完全环绕GDD活性位点的构象[15-16]。3D蛋白主要负责病毒基因组RNA的转录,合成子代病毒基因组,在CVB感染和复制中发挥关键作用[17-19]。CVB感染有组织亲嗜性和时序变化,目前对其3D蛋白在心肌组织中表达的时序与分布了解甚少,因此获得3D抗体有助于从病毒基因组转录的视角理解CVB致病过程,为抗CVB药物的研发提供新思路。
1 材料与方法
1.1 材料
携带嗜心肌CVB3 Woodruff株全长cDNA序列的质粒pMKS1由Lindsay Whitton教授(美国加利福尼亚Scripps Research Institute)惠赠。pET28a(+)载体、大肠埃希菌BL21菌种由本实验室保存。限制性内切酶HindⅢ-HF、限制性内切酶XhoⅠ、T4 DNA连接酶购自纽英伦生物技术有限公司,质粒DNA小量提取试剂盒、DNA凝胶回收试剂盒购自康宁生命科学有限公司,DL15000 DNA Marker、DL5000 DNA Marker、Premix Ex Taq Hot Start Version、6×Loading Buffer购自TaKaRa公司,异丙基 β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)购自Sigma公司,聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)快速制备试剂盒购自EpiZyme公司,PageRuler预染蛋白Marker购自Thermo Fisher公司,考马斯亮蓝快速染液、5×十二烷基硫酸钠(sodium dodecyl sulfate, SDS)-PAGE蛋白上样缓冲液购自上海碧云天生物技术有限公司,His鼠多克隆抗体购自北京傲锐东源生物科技有限公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记兔抗小鼠IgG、HRP标记山羊抗兔IgG购自万类生物科技有限公司,抗VP1抗体购自美国Dako公司,GAPDH兔多克隆抗体购自美国Proteintech公司,超敏增强化学发光(enhanced chemiluminescence,ECL)即用型底物购自武汉博士德生物工程有限公司,聚合酶链反应(polymerase chain reaction,PCR)合成引物购自苏州金维智生物科技有限公司。6~8周龄新西兰大白兔体重(2.5±0.5)kg,购自哈尔滨医科大学附属第二医院动物实验中心。
1.2 方法
1.2.1 pET28a(+)-3D原核表达载体的构建 利用Primer 5.0软件设计带有HindⅢ酶切位点的上游引物5′-GTGAAGCTTTAGGAGAGATCG-AGTTTATTGAGAG-3′,带有XhoⅠ酶切位点的下游引物5′-ATATCTCGAGGAAAGAGTCCAA-CCACTTC-3′。以pMKS1质粒为模板,PCR扩增3D片段,对目的片段与pET28a(+)载体双酶切后,4 ℃连接过夜。次日,将连接产物全部转化至大肠埃希菌 BL21感受态细胞,于电热恒温培养箱(上海一恒科学仪器有限公司)中37 ℃过夜培养,挑选单克隆菌株37 ℃过夜培养,然后冻存菌种并酶切鉴定,同时送博仕生物技术有限公司测序鉴定。
1.2.2 3D-His蛋白的诱导表达、鉴定及表达条件优化 IPTG诱导3D-His蛋白表达,离心后分别取上清液和沉淀,加入蛋白上样缓冲液煮沸10 min,通过SDS-PAGE分析蛋白表达可溶性。获得的蛋白经SDS-PAGE后转至聚偏氟乙烯(polyvinylidenefluoride,PVDF)膜上,5%脱脂奶粉封闭2 h,分别用1∶2 000稀释的抗His鼠多克隆抗体作为一抗孵育2 h和1∶3 000稀释的HRP标记兔抗小鼠IgG作为二抗孵育1 h,用含吐温20的Tris-HCl缓冲盐溶液(Tris buffered saline with Tween 20,TBST)洗膜3次后曝光,蛋白免疫印迹法分析蛋白特异性。分别对诱导浓度(分别设0.05、0.2、0.4、0.6 mmol/L)、温度(分别设25、30、37 ℃)、时间(分别诱导2、4、6 h)进行优化,观察蛋白表达可溶性及表达量变化。
1.2.3 兔多克隆抗血清的制备及检测 每只新西兰大白兔每次注射抗原800 μg,将等体积的3D-His蛋白与佐剂乳化完全,采用脊椎两侧皮下多点免疫注射法进行免疫。首次免疫后,间隔2周进行第2次免疫;再间隔2周进行第3次免疫;第4次和第5次免疫分别间隔1周。免疫3次后,每次继续免疫前抽取血液,分离血清并检测效价。最后一次免疫1周后心脏采血,分离血清,分装,保存于-80 ℃冰箱备用。分别用TBST 1∶2 000、1∶3 000、1∶4 000稀释的多克隆抗血清行蛋白免疫印迹法检测3D-His蛋白,从而确定多克隆抗血清效价。通过蛋白免疫印迹法检测其是否能识别原核表达的3D-His蛋白、CVB3感染细胞中的3D蛋白及其特异性。
2 结果
2.1 3D-His蛋白的表达
以pMKS1质粒为模板,PCR扩增出含有HindⅢ和XhoⅠ酶切位点的3D片段,将目的片段与载体分别双酶切后进行连接并转化入大肠埃希菌BL21感受态细胞中, 获得原核表达质粒pET28a(+)-3D。经HindⅢ-HF和XhoⅠ双酶切后,电泳出现5 369 bp和1 400 bp两条带,与pET28a(+)载体和3D-His基因片段大小一致。测序结果也与目的序列完全相同,表明载体构建成功(图1)。在37 ℃、1 mmol/L IPTG、诱导2 h条件下,分别对超声后的上清液及沉淀进行SDS-PAGE,结果发现58 000左右处存在高表达的蛋白条带,该位置与3D-His蛋白的理论位置相同,可见3D-His蛋白主要以包涵体形式表达(图2A)。蛋白免疫印迹结果显示,在58 000左右处可见目的蛋白条带(图2B)。
2.2 3D-His蛋白表达条件的优化
在37 ℃条件下,经不同浓度IPTG诱导后,取菌体超声后的沉淀及上清液进行SDS-PAGE,发现诱导浓度对蛋白表达影响不大。IPTG终浓度为0.05 mmol/L就足以促使目的蛋白高效表达且以包涵体形式为主(图3A、3B)。在37 ℃条件下,以0.05 mmol/L IPTG对目的蛋白进行不同时间诱导后,取菌体超声后的沉淀及上清液进行SDS-PAGE,发现诱导时间对蛋白表达量有明显影响。诱导时间与表达量成正比,蛋白在诱导6 h表达量较高且以包涵体形式为主(图3C、3D)。在不同温度下,以0.05 mmol/L IPTG对目的蛋白诱导6 h后,取菌体超声后的沉淀及上清液进行SDS-PAGE,发现随温度的升高表达量升高,37 ℃时表达量较高且以包涵体形式为主(图3E、3F)。
2.3 3D抗体的效价
新西兰大白兔第4次免疫1周后,心脏取血5 mL。以免疫前血清为阴性对照,用3D-His蛋白免疫印迹法测定抗血清效价,最高可达1∶4 000(图4)。
2.4 3D抗体的特异性
利用多克隆抗血清蛋白免疫印迹法检测大肠埃希菌中表达的3D-His蛋白(图5A),以大肠埃希菌表达的空载体pET28a(+)为阴性对照,表明制备的抗血清能特异性识别3D-His蛋白。利用多克隆抗血清蛋白免疫印迹法检测CVB3感染HeLa细胞16 h后总蛋白中的3D蛋白,以制备的抗血清为一抗,以磷酸盐缓冲液(phosphate buffered saline,PBS)假感染的HeLa细胞总蛋白为阴性对照。结果显示,制备的抗血清能特异性识别CVB3 3D蛋白(58 000)。在CVB生物合成过程中,首先翻译出大前体蛋白(polyprotein),然后在2A蛋白酶的作用下降解为P1、P2、P3共3个前体蛋白,P3在3C蛋白酶作用下进一步降解为3A、3B、3CD、3C、3D。有趣的是,本研究制备的抗体在3D上方还出现3个条带,从相对分子质量推测,由上至下依次可能为P2+P3蛋白(146 000)、P3蛋白(83 000)、3CD蛋白(70 000)(图5B)。
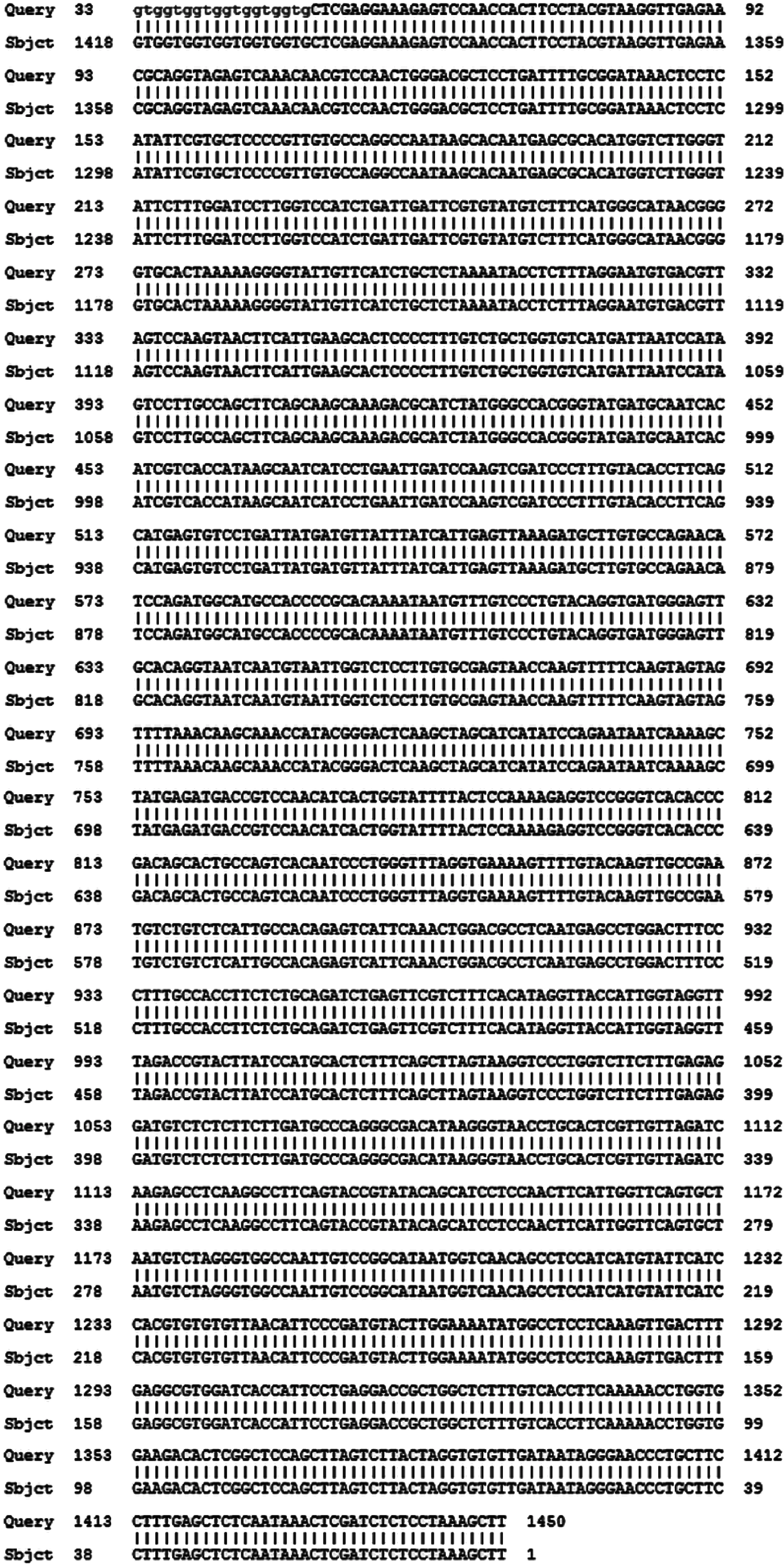
图1 重组质粒pET28a (+)-3D的BLAST比对结果
Fig.1 BLAST comparison of recombinant plasmid pET28a (+)-3D
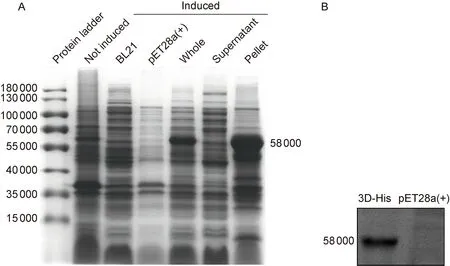
A: Expression of 3D-His inE.coliBL21/pET28a(+)-3D after induction was analyzed by SDS-PAGE. Protein ladder: PageRuler Prestained Protein Ladder. Not induced: Not induced pET28a(+)-3D. B: Expression of 3D-His inE.coliBL21/pET28a(+)-3D after induction was subjected to Western blotting analysis with a monoclonal antibody to His tag.
图2 3D-His融合蛋白的诱导表达及鉴定
Fig.2 Induced expression and identification of 3D-His protein

Protein ladder: PageRuler Prestained Protein Ladder. Not induced: Not induced pET28a(+)-3D.
图3 3D-His融合蛋白表达条件的优化
Fig.3 Optimization of expression conditions for 3D-His protein

NC: Preimmune serum.
图4 蛋白免疫印迹法检测3D抗血清效价
Fig.4 The titers of anti-3D antibody determined by Western blotting
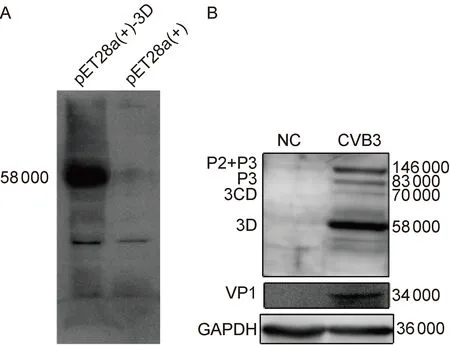
A: Western blotting analysis for 3D-His protein inE.coliBL21/pET28a(+)-3D. Total protein was extracted after induction with IPTG. B: Western blotting analysis for 3D protein in HeLa cells infected with CVB3. NC: protein in HeLa cells infected with PBS.
图5 蛋白免疫印迹法检测抗CVB3 3D抗体的特异性
Fig.5 Specificity of anti-3D antibody determined by Western blotting
3 讨论
多克隆抗体是一种有效的蛋白检测工具,目前市场上只有针对EV71的3D蛋白抗体,没有针对CVB3的3D蛋白抗体。因此,为便于后期对CVB3 3D蛋白的研究,本研究利用构建的重组质粒pET28a(+)-3D转化大肠埃希菌BL21,成功诱导3D-His蛋白表达,并以此作为免疫注射抗原,制备多克隆抗体。
本研究中,原核表达的3D-His蛋白以包涵体形式存在。表达时间短、缺乏某些蛋白折叠辅助因子、无法形成正确的次级键等原因均可导致包涵体的形成;而延长时间、降低温度、降低IPTG浓度可增加蛋白的可溶性表达。因此,本研究分别对IPTG诱导浓度、诱导时间、诱导温度等条件进行摸索,发现IPTG诱导浓度对蛋白表达影响不大,终浓度为0.05 mmol/L时蛋白即有较高表达;诱导时间对3D蛋白的表达有明显影响,随着时间的延长蛋白表达量增多;诱导温度对3D蛋白也有一定影响,随着温度的升高蛋白表达量增多。但无论条件如何变化,3D蛋白均以包涵体的形式存在。该方法的缺点是不易分离和纯化,且摸索变性、复性的最适条件较繁琐;优点是可使细胞内表达的外源蛋白不易被细菌蛋白酶降解,且包涵体含重组蛋白量大,可经SDS-PAGE分离目的蛋白,切下目的蛋白加佐剂,可直接用于免疫注射。本研究利用新西兰大白兔免疫4次后的多克隆抗血清行蛋白免疫印迹法来检测3D-His蛋白,发现所制备的多克隆抗血清效价可达1∶4 000,且特异性好。为避免假阳性,用该多克隆抗体对CVB3感染HeLa细胞16 h后提取的总蛋白进行检测,发现可检测到3D蛋白,且特异性好。因此,本研究所制备的CVB3 3D抗体可用于3D蛋白的相关研究。
[1] Massilamany C, Gangaplara A, Reddy J. Intricacies of cardiac damage in coxsackievirus B3 infection: implications for therapy [J]. Int J Cardiol, 2014, 177(2): 330-339.
[2] Norder H, De Palma AM, Selisko B, Costenaro L, Papageorgiou N, Arnan C, Coutard B, Lantez V, De Lamballerie X, Baronti C, Solà M, Tan J, Neyts J, Canard B, Coll M, Gorbalenya AE, Hilgenfeld R. Picornavirus non-structural proteins as targets for new anti-virals with broad activity [J]. Antivir Res, 2011, 89(3): 204-218.
[3] 张淑芹,刘志屹,戴璐,张福明. 长春地区病毒性心肌炎患儿柯萨奇B组病毒感染的流行病学分析 [J]. 中国妇幼保健, 2014, 29(1): 75-77.
[4] Cihakova D, Rose NR. Pathogenesis of myocarditis and dilated cardiomyopathy [J]. Adv Immunol, 2008, 99: 95-114.
[5] Chapman NM, Kim KS. Persistent coxsackievirus infection: enterovirus persistence in chronic myocarditis and dilated cardiomyopathy [J]. Curr Top Microbiol Immunol, 2008, 323: 275-292.
[6] Garmaroudi FS, Marchant D, Hendry R, Luo H, Yang D, Ye X, Shi J, McManus BM. Coxsackievirus B3 replication and pathogenesis [J]. Fut Microbiol, 2015, 10(4): 629-653.
[7] Lindberg AM, Stålhandske PO, Pettersson U. Genome of coxsackievirus B3 [J]. Virology, 1987, 156(1): 50-63.
[8] Gong P, Kortus MG, Nix JC, Davis RE, Peersen OB. Structures of coxsackievirus, rhinovirus, and poliovirus polymerase elongation complexes solved by engineering RNA mediated crystal contacts [J]. PLoS One, 2013, 8(5): e60272.
[9] Shen H, Li G. Bridging the missing link between structure and fidelity of the RNA-dependent RNA polymerase from poliovirus through free energy simulations [J]. J Chem Theory Comput, 2014, 10(11): 5195-5205.
[10] Shatskaya GS, Dmitrieva TM. Structural organization of viral RNA-dependent RNA polymerases [J]. Biochemistry (Mosc), 2013, 78(3): 231-235.
[11] Holien JK, Gazina EV, Elliott RW, Jarrott B, Cameron CE, Williams SJ, Parker MW, Petrou S. Computational analysis of amiloride analogue inhibitors of coxsackievirus B3 RNA polymerase [J]. J Proteomics Bioinform, 2014. doi: 10.4172/jpb.S9-004.
[12] Chen C, Wang Y, Shan C, Sun Y, Xu P, Zhou H, Yang C, Shi PY, Rao Z, Zhang B, Lou Z. Crystal structure of enterovirus 71 RNA-dependent RNA polymerase complexed with its protein primer VPg: implication for a trans mechanism of VPg uridylylation [J]. J Virol, 2013, 87(10): 5755-5768.
[13] Appleby TC, Luecke H, Shim JH, Wu JZ, Cheney IW, Zhong W, Vogeley L, Hong Z, Yao N. Crystal structure of complete rhinovirus RNA polymerase suggests front loading of protein primer [J]. J Virol, 2005, 79(1): 277-288.
[14] Kempf BJ, Barton DJ. Picornavirus RNA polyadenylation by 3Dpol, the viral RNA-dependent RNA polymerase [J]. Virus Res, 2015, 206: 3-11.
[15] Mönttinen HA, Ravantti JJ, Stuart DI, Poranen MM. Automated structural comparisons clarify the phylogeny of the right-hand-shaped polymerases [J]. Mol Biol Evol, 2014, 31(10): 2741-2752.
[17] Ferrer-Orta C, Ferrero D, Verdaguer N. RNA-dependent RNA polymerases of picornaviruses: from the structure to regulatory mechanisms [J]. Viruses, 2015, 7(8): 4438-4460.
[18] van Dijk AA, Makeyev EV, Bamford DH. Initiation of viral RNA-dependent RNA polymerization [J]. J Gen Virol, 2004, 85(Pt 5): 1077-1093.
[19] Campagnola G, Weygandt M, Scoggin K, Peersen O. Crystal structure of coxsackievirus B3 3Dpolhighlights the functional importance of residue 5 in picornavirus polymerases [J]. J Virol, 2008, 82(19): 9458-9464.
敬请关注《微生物与感染》微信公众号
. ZHONG Zhaohua, E-mail: zhongzh@hrbmu.edu.cn
Preparation of coxsackievirus B3 3D protein polyclonal antibody
WANG Yu1, XU Weizhen1, MU Yusong1, WANG Tianying1, YAN Biying1, YAN Xueqin1, ZHAO Wenran2, ZHONG Zhaohua1
1. Department of Microbiology and Wu Lien-Teh Institute, Harbin Medical University, Harbin 150081, China; 2. Department of Cytobiology, Harbin Medical University, Harbin 150081, China
Coxsackievirus B3 (CVB3) mainly infects the heart, and the timing and distribution of viral RNA polymerase (3D protein) expression in the myocardium are currently unclear. In this study, the CVB3 3D gene was obtained by polymerase chain reaction (PCR) and cloned into the prokaryotic expression vector pET28a(+). The expression of 3D was induced by isopropyl β-D-1-thiogalactopyranoside (IPTG), and the 3D-His protein was purified and used to immunize New Zealand white rabbits for antiserum against the 3D protein. An anti-CVB3 3D antibody with high titer and specificity was obtained, and it can be used for future functional study of CVB3 3D protein.
Coxsackievirus B3; 3D polymerase; Antibody; Prokaryotic expression

国家自然科学基金(81571999、81672007、31300144)
钟照华
2017-03-13)

