肺癌合并肺栓塞危险因素及预后的临床分析
唐开华
肺癌合并肺栓塞危险因素及预后的临床分析
唐开华
目的 本研究通过患者临床资料和治疗详细记录等分析探讨肺癌合并肺栓塞的相关危险因素并分析预后 。方法 通过我院收治的32例肺癌且合并肺栓塞患者(作为研究组)的临床资料进行分析,另外64例肺癌但没有患肺栓塞的患者作对照组。先经过单因素分析,再通过logistic回归分析危险因素。最后用Kaplan-Meier进行生存分析患者的预后情况。结果 单因素分析结果为血红蛋白>150g/L、癌症处于Ⅲ-Ⅳ期即中晚期、血氧分压<70mmHg、腺癌四个因素。预后结果则显示,肺癌合并肺栓塞患者(研究组)的生存时间明显比不伴有肺栓塞的患者(对照组)更短。结论 腺癌、血红蛋白、血氧分压以及Ⅲ-Ⅳ期是肺癌合并肺栓塞的危险因素。并且肺癌伴有肺栓塞的患者生存时间更短。
肺癌;合并肺栓塞;预后;危险因素
静脉血栓栓塞(VTE)症包括深静脉血栓栓塞(DVT)和肺血栓栓塞(PTE)[1],但是两者的差异很明显,其中DVT会导致静脉炎后综合症[2],然而PTE则影响更为剧烈,会导致肺动脉高压甚至致死[3]。现今, 由于越来越多的研究报道肺栓塞是癌症的常见并发症之一,对人体伤害巨大,并且以肺癌合并肺栓塞患者居多。肺栓塞的主要因素是下肢静脉血栓,肿瘤进展以及化疗次数和肺部感染。因此通过以往的临床资料和数据分析找出与之相关的信息非常有必要。并且在很早就有报道发现静脉血栓的形成原因与肿瘤也有一定关系。恶性肿瘤患者发生血栓栓塞的概率较之常人高达数倍[4]。为了更清楚地认识肺栓塞,我们将从32例肺癌合并肺栓塞(以下用LC&PTE表示)患者与64例肺癌不伴有肺栓塞患者(以下用LC表示)的临床资料的详细分析相关危险因素以及预后结果,现报道如下。
资料与方法
一、 研究对象
本院7年间收集802例各类癌症患者的临床资料,经筛选出肺癌患者共96例,再经确诊,其中有32例肺癌患者合并有肺栓塞,作为研究组,剩余的64例肺癌患者就为对照组。每1位研究对象均有2位同期对照。对这96名患者的性别、年龄、既往患病和治疗史、吸烟饮酒习惯,以及血常规、肿瘤标记物、肝肾功能、心电图,确诊记录和病理类型及临床分期证据、末次随访和死亡时间等资料采集、记录、后续分析。
二、纳入标准
肺癌诊断标准为:经组织细胞学证实为肺癌。肺癌合并肺栓塞诊断标准为:① 存在危险因素。② 临床体征有晕厥休克、不明原因呼吸困难或者胸痛。③ 实行D-Dimer检测并结合心电图和动脉血气及X线胸片作排除性诊断[6]。④ 磁共振肺动脉造影、螺旋CT肺动脉造影等确诊。以往有过血栓栓塞病史的患者排除。肺癌的分期采用国际抗癌联盟(UICC)制定的肺癌分期标准进行详细准确分期[5]。对照组64名患者均符合病例标准予纳入。
三、统计学分析方法

结 果
一、 一般信息记录分析
患者的一般资料统计结果(见表1)。符合标准并参与本研究的32名肺癌合并肺栓塞患者,其中男性18例,女性14例,年龄范围42-73岁,平均年龄60.03岁。64名肺癌不伴有肺栓塞患者当中,男性41例,女性23例,年龄跨度从35岁至69岁,平均年龄为58.94岁。三期至四期患者数众多,研究组高达81.2%,实验组52.5%。腺癌占研究组65.6%。此两项因素P值均小于0.2,我们将对其进行进一步的分析处理。32例研究组病患,30例通过影像学资料确诊,其余2例通过D-Dimer和血气分析确诊。可信度达到研究所需标准。
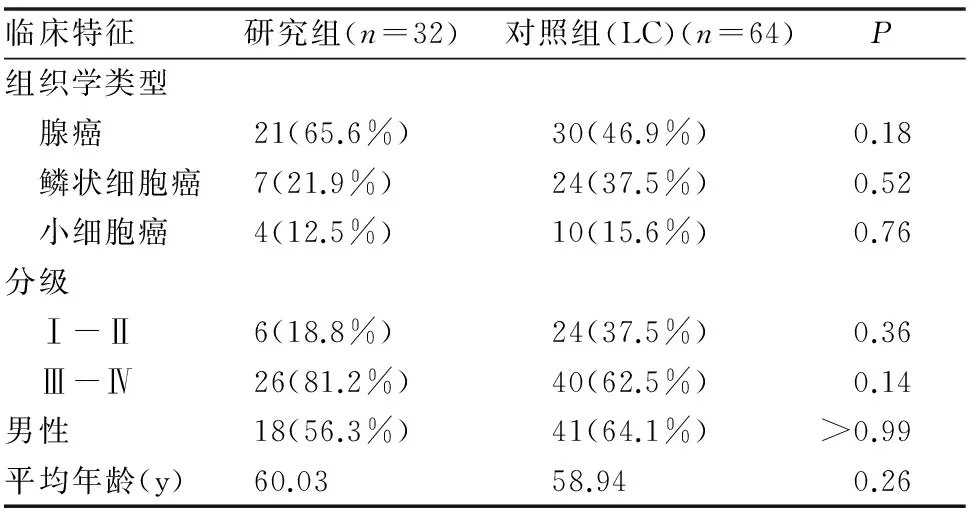
表1 所有患者的一般资料
二、 不同临床表现分析
根据患者的临床症状和体征的记录分析结果来看,在研究组患者中,不明原因的呼吸困难以及咳嗽是最常见的,分别达到78.1%和71.9%。而在对照组患者中,咳嗽依然是最流行症状,但是不明原因的呼吸困难却不如咳血的症状常见。咳血症状高达39.1%。除此之外,肺癌合并肺栓塞患者组中,还有胸痛、心悸和烦躁不安等。(见表2)。
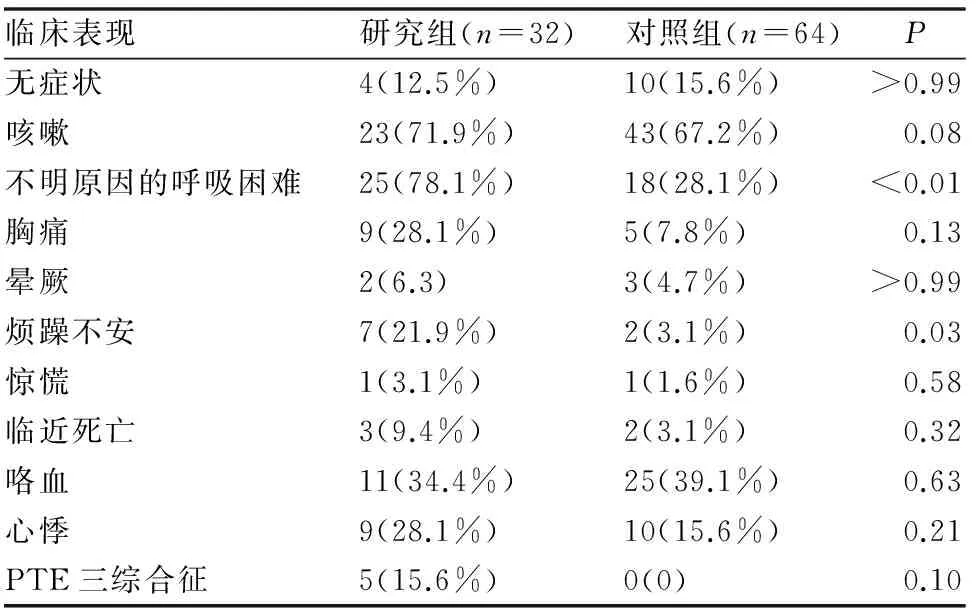
表2 患者的临床表现
三、 实验室和影像学指标
影像学检查主要是强化胸部CT,提示肺动脉内密度充盈不够,有一定缺损,包含32例患者当中的30例(93.8%)。剩余2例通过肺通气时的血流灌注进行扫描,结果提示双肺叶的多发血流灌注有很显著的降低。此外,心电图检查结果窦性心动过速6位(18.8%)患者。Ⅲ导联当中出现Q波和T波的形状倒置,并且在I导联观察到S波过于宽大的患者有3例(9.4%)。并且15例(46.9%)患者合并有下肢的深静脉血栓栓塞(DVT)。
实验室检查的结果:由于结果当中有服从正态分布的计量资料和不服从正态分布的计量资料,因此对不同性质的资料采取了不同的表示方法,但最终结果均选择P<0.2的单因素作进一步的logistic回归分析。(见表3)。
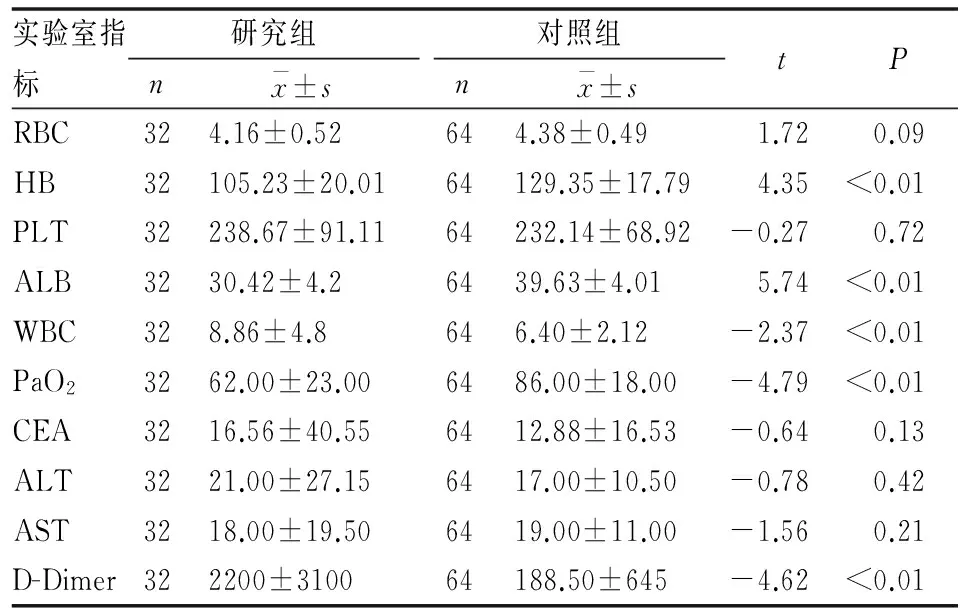
表3 所有患者的实验室指标
RBC:红细胞;HB:血红蛋白;PLTB:血小板计数;ALB:白蛋白;WBC:白细胞;PaO2:氧分压;CEA:癌胚抗原;ALT:丙氨酸转移酶; AST:谷草转氨酶; D-Dimer:D-二聚体。
四、PTE确诊时间
肺栓塞确诊时间距离肺癌确诊时间前后的中位数是4.02个月。32例患者中,5例(15.6%)确诊肺栓塞后24小时内死亡,被界定为急性高危肺癌合并肺栓塞,20例生存时间在2个月内,生存时间最长仅有10.2个月。在本研究的确诊时间结果显示,仅有1例患者在确诊肺癌之前就已经发现了肺栓塞,其余31例均发生在确诊肺癌之后,时间长短不定,最长甚至超过30个月。在临床资料详细记录分析的时候发现甚至有的患者在尸检时才发现,不过因不符合本研究标准,暂时不纳入分析。
五、 危险因素单因素法以及logistic分析
纳入单因素分析的因素主要是有合并症中的糖尿病和慢性阻塞性肺病,生活方式中的吸烟、饮酒,治疗类型中的化疗,组织学类型中的腺癌,实验室数据中的血红蛋白(Hemoglobin>150g/L)、癌胚抗原(CEA>10ng/mL)、白细胞(WBC>11×109/L)、D-二聚体检测(D-Dimer>500 ng/mL)、血氧分压(PaO2<70 mmHg)、以及肿瘤分期中的Ⅲ-Ⅳ期等因素纳入单因素分析。单因素分析的结果我们选取了P<0.2的因素用logistic回归多变量检验,作进一步的分析确认,结果显示与单因素分析结果大致相当,说明高白细胞血症、高D-Dimer、以及高白蛋白等症状都会使得肺癌合并肺栓塞的患病风险大大增高。血红蛋白高于150g/L、血氧分压低于70mm/Hg、组织学类型为腺癌以及Ⅲ-Ⅳ这四个因素是最明显的危险因素。暂时没有发现慢阻肺、吸烟饮酒史、糖尿病等其他指标的危险系数具有统计学意义。(见表4)。

表4 对所有患者PTE发生的相关危险因素的单因素分析
六、LC患者和LC&PTE患者生存分析
采用Kaplan-Meier方法对两组患者进行生存分析,其中LC患者的生存时间为489天(95%CI 为271-703 days), LC&PTE患者的生存时间为246天(95%CI为189-386 days),经比较,肺癌合并肺栓塞患者的生存时间显著低于不伴有肺栓塞肺癌患者的生存时间,P<0.05,差异具有统计学意义。(见图1)。

图1 生存分析
讨 论
隐形癌或者某种癌常常会引起静脉血栓栓塞并发症的出现[7],但是静脉栓塞同样也可以发生在其他疾病的治疗过程中,比如住院期间,外科手术后等时期。而肺栓塞为其中危害性最大的一种,是癌症患者住院期间死亡的除癌症本身以外的第二大原因。栓塞不仅影响抗肿瘤治疗,抗凝治疗也会引起大出血[8],因此,需增加对肺栓塞危险因素的了解和认识,特别是诊治过程中提早预防,及时发现,就显得格外重要。肺癌合并肺栓塞的病理成因在很大程度上是因为机体的血凝状态非常高而导致的。具体如下:① 癌变的肿瘤细胞可分泌表达促凝素,刺激因子X, 使得因子X在不需要依赖于其他凝血成分的同时,将血液中的纤维蛋白相关产物升高,从而出现了血液的高凝状态[8]。② 肿瘤细胞通过激活淋巴细胞介导,从而在最大程度上激活凝血系统。③ 化疗、深静脉置管以及外科手术等会不同程度地破坏血管内皮,凝血途径可能在不经意间被触发[9]。④ 在抗癌治疗的药物中含有促血红蛋白生成素以及促粒细胞集中脱落等行为也会刺激凝血因子发挥功能作用等[10]。
本研究中,发现类似胰腺癌等腺癌中栓塞并发症相比较其他组织学类型的肿瘤明显更易出现,并且肺癌也是增加肺栓塞发生的危险因素。早前有研究报道,认为腺癌可分泌一种不明机理的黏蛋白成分,从而激活促凝因子,使得血液长期处于高凝状态,从而引发血栓[11]。并且随着肿瘤的扩散和转移,使得分泌蛋白量增加,栓塞的发病风险也就随之增加。而血红蛋白高则会改变血液的血流动力学,使血液更加粘稠、流动阻力增大,速度缓慢,凝血异常,进而发展为血栓栓塞。
本研究进行的生存分析结果显示,合并肺栓塞的患者,生存时间远远低于不伴有栓塞患者的生存时间。并且肺栓塞一旦发现,难治愈、成本高、生存时间短,死亡率高、病残率高等问题都仍未解决[12]。所以,最理想的方法仍然是以预防为主。例如在药物或化疗以及手术治疗肿瘤的过程当中增加预防性抗凝治疗[13]。而且癌症患者尤其是腺癌类型应该多掌握相关知识,多自我观察,例如发现烦躁不安、不明原因呼吸困难,咳嗽或者心悸等症状,及时返院做血液常规或影像学检查,提高肺栓塞的诊疗意识,早发现早治疗。
本研究详细阐述了肺癌合并肺栓塞患者的危险因素以及预后生存分析,旨在能够为今后的临床治疗提供参考,也为患者全面展现肺栓塞并发症的原理、危险因素,提高患者的诊疗意识,为更好地治疗肿瘤合并症具有积极的意义。
[1] 王峻,周卫华,许林,等.肺癌合并肺栓塞危险因素及预后的临床分析[J].中国肺癌杂志,2011,14(10):780-784.
[2] 李娜,王燕.23例肺癌并发肺栓塞的临床分析[J].中国肺癌杂志,2014,17(3):254-259.
[3] 卿国忠,肖文莲,刘卫星.多层螺旋CT血管成像与超声心动图、MRA在急性主动脉夹层诊断中的对比研究[J].中国现代医学杂志,2007,17(16):1997-2000.
[4] 闫瑞玲,常虹,左思阳,等.超声、MR、CT、X线诊断主动脉夹层的比较[J].西北国防医学杂志,2009,30(4):265-267.
[5] 朱丹,郭丽君,高炜.主动脉瘤和 (或) 主动脉夹层患者的临床特征及预后分析[J].中国急救医学,2008,28(4):309-312.
[6] 陈刚,刘继伟,李德生,等.主动脉夹层的螺旋CT、MRI与DSA影像对比分析[J].中国医疗前沿(上半月),2009,4(1):86-87.
[7] Trimarchi S,Nienaber C,Rampoldi V,et al.Contemporary results of surgery in acute type A aortic dissection:the International Registry of Acute Aortic Dissection experience[J].J Thorac Cardiovasc Surg,2005,129(1):112-122.
[8] Heit JA,Silverstein MD,Mohr DN,et al.Risk factors for deep vein thrombosis and pulmonary embolism: a population-based case-control study[J].Arch Intern Med,2000,160(6):809-815.
[9] Cushman M.Epidemiology and risk factors for venous thrombosis[J].Semin Hematol,2007,44(2):62-69.
[10] Blom JW,Doggen CJ,Osanto S,et al.Malignancies, prothrombotic mutations, and the risk of venous thrombosis[J].JAMA,2005,293(6):715-722.
[11] Chuang YM,Yu CJ.Clinical characteristics and outcomes of lung cancer with pulmonary embolism[J].Oncology,2009,77(2):100-106.
[12] Khorana AA,Francis CW,Culakova E,et al.Thromboembolism is a leading cause of death in cancer patients receiving outpatient chemotherapy[J].J Thromb Haemost,2007,5(3):632-634.
[13] Scarvelis D,Anderson J,Davis L,et al.Hospital mortality due to pulmonary embolism and an evaluation of the usefulness of preventative interventions[J].Thromb Res,2010,125(2):166-170.
Risk Factors and prognosis of lung cancer complicated with pulmonary embolism
TANG Kai-hua
Department of Respiratory Medicine, Liugang Hospital, Liuzhou, Guangxi 545002, China
Objective To investigate the risk factors associated with pulmonary embolism in patients with lung cancer by analyzing clinical data and treatment details. Methods The clinical data of 32 patients with lung cancer and pulmonary embolism (as the treatment group) were analyzed with statistics, and at the same period, 64 patients only with lung cancer were treated as the control group. First, it used univariate factor analysis to identify some high risk factors. Then, conditional logistic regression analysis was applied to filter out the related risk factors. Finally, their prognosis was also compared with matched controls via Kaplan-Meier survival analysis. Results The results of univariate factor analysis included serum hemoglobin> 150g/L, stage Ⅲ-Ⅳ, partial pressure of oxygen< 70mmHg, respectively. The survival time in patients with pulmonary embolism was remarkably lower than that in patients without pulmonary embolism. The survival time in patients undergoing chemotherapy was longer than without undergoing chemotherapy. Conclusion Adenocarcinoma, late stage disease and high serum hemoglobin are important risk factors for lung cancer patients with concomitant pulmonary embolism. The survival time in patients without chemotherapy is lower.
lung neoplasms; pulmonary thromboembolism; risk factor; prognosis
10.3969/j.issn.1009-6663.2017.08.035
545002 广西 柳州,柳州市柳钢医院呼吸内科
2017-01-12]

