无创正压通气治疗时机对慢阻肺合并呼吸衰竭者疗效及骨骼肌泛素-蛋白酶体表达的影响
张敬浩 武焱旻
无创正压通气治疗时机对慢阻肺合并呼吸衰竭者疗效及骨骼肌泛素-蛋白酶体表达的影响
张敬浩 武焱旻
目的 分析无创正压通气治疗时机对慢阻肺合并呼吸衰竭者骨骼肌泛素-蛋白酶体表达的影响。方法 选取2014年2月-2016年2月收入我院的156例慢阻肺合并呼吸衰竭患者,根据患者意愿分为早期治疗的A组65例,延迟治疗的B组52例,另选择同期常规对症支持治疗的39例患者设为对照组C组。C组患者在入院后,采取基础治疗。A组和B组患者在此基础上采取NPPV治疗。观察三组患者的疗效、预后、炎症指标和骨豁肌内基因表达水平。结果 与治疗前相比,A组、B组和C组患者的pH、PaO2明显升高,呼吸和HR明显降低,对比分析后,差异有统计学意义(P<0.05),与B组患者相比,治疗后A组患者的pH、PaO2明显更高,呼吸和HR明显更低,对比分析后,差异有统计学意义(t=2.890、2.052、5.708、2.638,P<0.05)。与治疗前相比,A组、B组和C组患者痰液、血液中的IL-6、IL-8和TNF-α指标明显改善,与B组患者相比,治疗后A组患者痰液、血液中的IL-6、IL-8和TNF-α明显更低,差异有统计学意义(P<0.05)。A组骨骼肌内核糖体蛋白S21、泛素、E2及E3的mRNA表达最低,其次为B组,C组患者的RPS21、泛素、E2及E3表达最高,对比分析后,差异有统计学意义(F=8.302、5.346、5.093、4.783,P<0.05)。结论 NPPV对于慢阻肺合并呼吸衰竭患者可有效纠正缺氧,减少住院时间,降低死亡率,并且早期接受治疗,患者的疗效更好,可有效降低患者的呼吸肌肉负荷,完善骨骼肌蛋白酶体途径,减少骨骼肌蛋白质丢失,进而提高慢阻肺合并呼吸衰竭患者的通气、氧合状态。
无创正压通气;治疗时机;慢阻肺合并呼吸衰竭;骨骼肌泛素-蛋白酶体表达
慢性阻塞性肺病(慢阻肺)是一种常见的慢性肺部疾病,其主要特征为进行性的呼出气流受限[1]。近几年,慢阻肺患者的发生率逐年增高,死亡率也逐年增加[2]。慢阻肺患者多合并营养不良,而营养不良的主要特征为骨豁肌的消耗以及萎缩。呼吸肌是一种骨骼肌,而骨豁肌的消耗及萎缩会相应的影响呼吸肌功能,造成呼吸肌出现疲劳,发生呼吸衰竭,疾病恶化,严重时患者可能会出现死亡。因此,为降低慢阻肺患者死亡率时,需要先改善患者的呼吸衰竭情况。有研究发现骨骼肌蛋白的降解与泛素-蛋白酶体途径之间具有紧密的联系[3]。无创正压通气(NPPV)具有不需插管治疗,易被患者接受等优势,被广泛应用于呼吸衰竭疾病。有研究表明,与常规治疗相比,NPPV治疗呼吸衰竭的成功率高达80%-85%[4]。为此,本组研究即探讨无创正压通气治疗时机对慢阻肺合并呼吸衰竭者疗效及骨骼肌泛素-蛋白酶体表达的影响,以期为临床合理采用无创正压通气治疗慢阻肺合并呼吸衰竭提供指导,现报道如下。
资料与方法
一、研究对象
选取2014年2月-2016年2月收入我院的156例慢阻肺合并呼吸衰竭患者为研究对象。纳入标准如下:① 患者均符合中华医学会呼吸病学分会慢阻肺学组制定的慢阻肺诊治指南的相关诊断标准,且合并呼吸衰竭[5];② 患者的神志清醒,可自主呼吸,能与呼吸机配合,具有排痰能力;③ 患者未出现通气禁忌证;④ 本次研究均获得患者及其家属签署知情同意书,经医院医学伦理委员会同意。排除标准如下:① 患者无法排痰;② 患者出现心、肾等重要脏器功能衰竭;③ 患者出现严重的心律失常、感染性休克。其中男90例,女66例,年龄分布为45-87岁,平均年龄为(59.2±5.08)岁,平均病程为(11.12±2.90)年。根据患者意愿分为早期治疗的A组65例,延迟治疗的B组52例,延迟治疗的主要原因是在告知患者及家属病情后,患者及家属要求先观察一段时间。另选择同期常规对症支持治疗的39例患者设为对照组C组(患者及家属拒绝NPPV治疗)。对三组患者的年龄、性别、病程对比后,无统计学差异,具有可比性同,P>0.05。(见表1)。
二、方法
C组患者在入院后,采取低流量鼻导管吸氧、止咳、化痰、营养支持和纠正水电解质紊乱等基础治疗。A组患者在此基础上采取NPPV治疗,B组患者在观察一段时间病情后采取NPPV治疗,观察病情期间采取基础治疗。NPPV治疗方法如下:双水平呼吸机的呼吸模式、吸气压先控制为8cmH2O,并考虑患者自身病情,逐步提高吸气压为12-22cmH2O。呼气压、氧浓度和呼吸频率分布控制为4-8cmH2O、35%-80%和12-16次/min。每天对患者使用8-12h,控制氧饱和浓度达到90%以上。在治疗的过程中,观察患者的病情变化,调节呼吸机相应的控制参数,直至患者结束治疗。
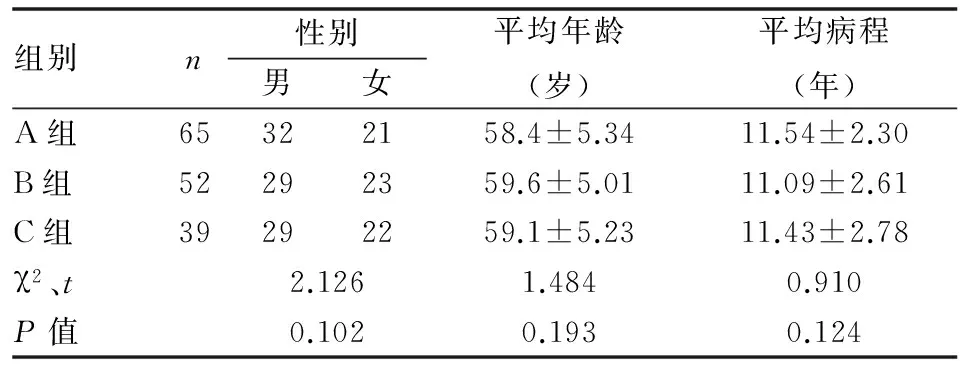
表1 三组患者的一般资料对比分析
三、 观察指标
1. 对三组患者的疗效、预后进行观察,分别记录治疗前、治疗3d后的呼吸频率、心率,并检测动脉血的pH、PaO2等指标,对三组患者的住院时间、死亡率进行记录。
2. 炎性因子:对三组患者的痰液、血液中的IL-6、IL-8和TNF-α进行检测。按照ELISA试剂盒(北京达科为生物技术有限公司)步骤进行检测。
3. RT-PCR检测骨骼肌内基因表达:①提取肌组织的总DNA:将股外肌组织放置于美国Gibco公司生产的0.6mL Trizol溶液中,经离心后将上层清液取出,并加入氯仿0.3mL,离心后再取上清液,加入0.3mL异丙醇后充分混匀,沉淀后,再次离心,并将上层清液丢弃后,加入300uL的75%乙醇溶液,离心后,再次丢弃上清液,重复上一步骤,RNA沉淀晾干后加入50uL的0.01%的焦碳酸二乙酷。取1uL的RNA溶液加入到焦碳酸二乙酷中,测定RNA的纯度及含量。②逆转录合成cDNA:样本均以1ug的RNA加入,根据RT-PCR试剂盒的步骤进行逆转录,每个样本转录体系为10uL体系。③PCR反应:PCR反应体系为50uL,上游和下游引物均为0.5uL、逆转录产物cDNA10uL、5×PCR缓冲液10uL、5U/uL、灭菌去离子水为28.75uL和Taq酶0.25uL。④PCR产物电泳:灌制1.5%的琼脂糖凝胶,其方法与RNA鉴定方法相同。电泳约40分钟,然后取出凝胶,并观察。
四、统计学分析

结 果
一、三组患者的疗效及预后
与治疗前相比,A组、B组和C组患者的pH、PaO2明显升高,呼吸和HR明显降低,对比分析后,差异有统计学意义(P<0.05),但与C组患者相比,治疗后A组、B组患者的pH、PaO2明显更高,呼吸和HR明显更低,对比分析后,差异有统计学意义(P<0.05)。与B组患者相比,治疗后A组患者的pH、PaO2明显更高,呼吸和HR明显更低,对比分析后,差异有统计学意义(t=2.890、2.052、5.708、2.638,P<0.05),(见表2)。
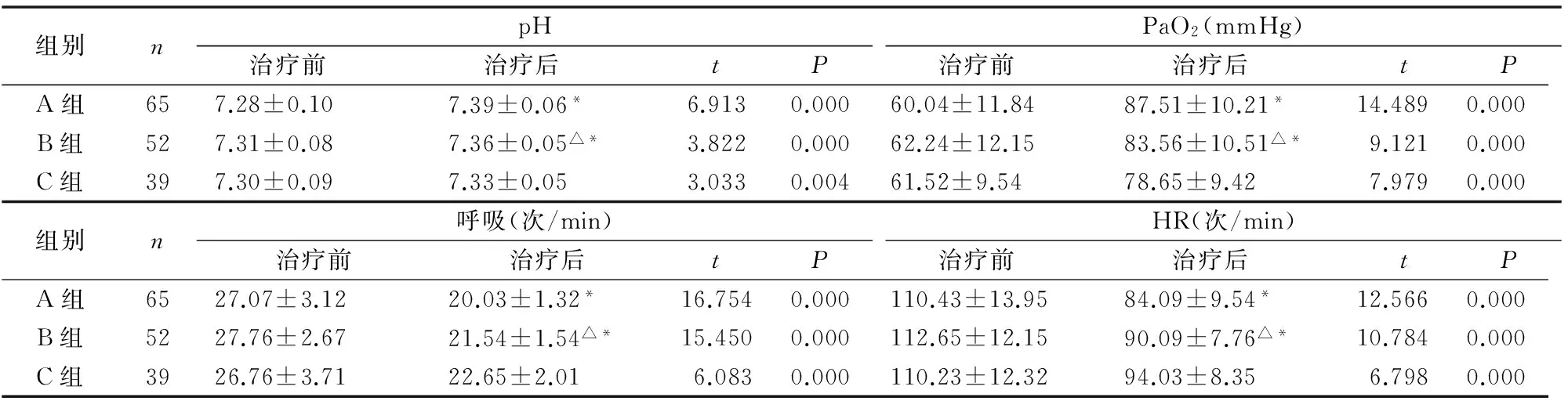
表2 三组患者的疗效对比
与C组相比,△P<0.05,与B组相比,*P<0.05
与C组患者相比,A组患者的住院时间更短,为(12.87±5.12)d,死亡率更低,为1.54%,差异有统计学意义(t=5.131,χ2=8.062,P<0.05),B组患者的逐渐时间更短,差异有统计学意义(t=2.569,P<0.05),而在死亡率上差异不明显(χ2=1.903,P>0.05)。与B组相比,A组患者的住院时间更短,差异有统计学意义(t=4.293,P<0.05),(见表3)。
二、三组患者的炎症指标比较
与治疗前相比,A组、B组和C组患者痰液中的IL-6、IL-8和TNF-α指标明显改善,对比分析后,差异有统计学意义(t=25.922、21.913、23.977,17.448、16.105、19.220,P<0.05),但与C组患者相比,治疗后A组、B组患者痰液中的IL-6、IL-8和TNF-α明显更低,对比分析后,差异有统计学意义(t=6.006、2.178,4.309、7.176,7.255、11.497,P<0.05)。与B组患者相比,治疗后A组患者痰液中的IL-6、IL-8和TNF-α明显更低,对比分析后,差异有统计学意义(t=5.138、4.319、6.010,P<0.05),(见表4)。

表3 三组患者的住院天数与死亡人数对比
表示与C组相比,△P<0.05,表示与B组相比,*P<0.05
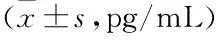
表4 三组患者痰液中的炎症指标对比
与治疗前相比,▲P<0.05,表示与C组相比:△P<0.05,与B组相比,*P<0.05
与治疗前相比,A组、B组和C组患者痰液血液IL-6、IL-8和TNF-α指标明显改善,对比分析后,差异有统计学意义(t=15.845、16.625、9.388,14.189、17.033、6.484,9.770、12.420、4.799,P<0.05),但与C组患者相比,治疗后A组、B组患者血液中的IL-6、IL-8和TNF-α明显更低,对比分析后,差异有统计学意义(t=2.620、13.061,3.930、15.839,7.767、3.058,P<0.05)。与B组患者相比,治疗后A组患者血液中的IL-6、IL-8和TNF-α明显更低,对比分析后,差异有统计学意义(t=5.231、4.707、3.706,P<0.05),(见表5)。
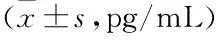
表5 三组患者血液中的炎症指标对比
与治疗前相比:▲P<0.05,与C组相比:△P<0.05,与B组相比:*P<0.05
三、三组患者的骨豁肌内基因表达水平对比
A组骨骼肌内核糖体蛋白S21、泛素、E2及E3的mRNA表达最低,其次为B组,C组患者的RPS21、泛素、E2及E3表达最高,对比分析后,差异有统计学意义(F=8.302、5.346、5.093、4.783,P<0.05),对比分析后(见表6)。

表6 三组患者的骨豁肌内基因表达水平对比
讨 论
近几年,慢阻肺的发生率逐年增加,其中气流受限为主要临床特征,患者多因呼吸衰竭而死亡[6]。目前,慢阻肺的病因尚不清晰。慢阻肺合并呼吸衰竭将会导致患者出现缺氧、二氧化碳潴留[7-8],患者容易出现呼吸肌疲劳,此时需要采取相应的机械通气治疗措施,可以有效缓解患者的临床症状,为采取其他对症治疗提供时间,但机械通气多造成患者的并发症发生率增加,痛苦增加等问题。NPPV是通过鼻(面)罩等方法连接患者和呼吸机的辅助通气方式,不需插管或气管切开,可防止患者出现并发症,利于临床应用[4]。NPPV的治疗慢阻肺合并呼吸缓解患者死,可以通过呼吸机输送吸气正压,缓解患者的呼吸阻力,改善肺部的气体不均匀情况,同时NPPV还可防止上气道软组织塌陷,提高动脉血氧分压等功能[9]。本次研究中,A组、B组患者的pH、PaO2明显更高,呼吸频率、心率明显降低,住院时间更短,表明经NPPV治疗后,不管早期或者延迟接受治疗,患者均能获得改善。与延迟治疗组相比,早期接受治疗组患者的疗效及预后更优,表明慢阻肺合并呼吸衰竭患者应该尽早接受NPPV治疗。
慢阻肺疾病发病机制复杂,但有研究认为,慢阻肺与多种细胞因子、炎症介质的相互作用相关[10]。IL-6、IL-8被认为是参与慢阻肺气道炎症的重要细胞因子,在慢阻肺患者诱导痰中浓度显著增加,且其水平与患者气流阻塞程度呈正比,可反映气道炎症的严重程度。TNF-α是强效的炎症介质,通过直接和间接机制发挥促炎作用,损伤气道。在本次研究中,三组患者的炎症指标在治疗后均出现了降低,而A组更为明显,表明下调气道及全身炎症因子水平可能为NPPV改善慢阻肺合并呼吸衰竭患者的机制之一。
临床研究表明,骨骼肌功能障碍是慢阻肺的重要并发症,严重影响患者的预后,而在人体中,骨骼肌细胞占机体细胞干重的50%左右[11]。骨骼肌损失主要在腿部、手臂部位。由于骨骼肌功能障碍,慢阻肺患者容易出现疲劳、呼吸困难等症状。若骨骼肌细胞未及时保持正常水平,将会造成骨骼肌出现萎缩、功能性障碍,影响着患者的预后及康复。因此,抑制蛋白质的高分解代谢,对于慢阻肺患者的治疗及预后具有重要的意义。蛋白质底物降解时,首先泛素激活酶E1激活泛素,与泛素结合酶E2会互相结合,其次泛素连接酶E3会完成蛋白泛素化过程,在蛋白酶体催化下进而降解蛋白质。慢阻肺患者的出现骨骼肌功能障碍的重要原因为泛素-蛋白酶途径被激活,流经UPP的骨骼肌蛋白底物明显增高,增肌蛋白的降解,造成骨骼肌出现消耗和萎缩[12]。RPS21与蛋白质的合成以及细胞生长的调节有关。有氧运动会降低RPS21的表达水平,从而会有效抑制慢阻肺患者的炎症细胞生长,并降低编程性细胞死亡基因表达水平,促进正常细胞的活性以及寿命。在本次研究中,A组慢阻肺患者泛素、E2及E3的mRNA表达明显降低,表明NPPV可缓解骨骼肌蛋白降解,提高正常细胞的活性以及生命周期。而RPS21表达的降低,表明抑制了患者的炎症细胞生长,提高了骨骼肌细胞的生命活性。
综上所述,NPPV对于慢阻肺合并呼吸衰竭患者可有效纠正缺氧,减少住院时间,降低死亡率,并且早期接受治疗,患者的疗效更好,可有效降低患者的呼吸肌肉负荷,完善骨骼肌蛋白酶体途径,减少骨骼肌蛋白质丢失,进而提高慢阻肺合并呼吸衰竭患者的通气、氧合状态。
[1] 秦茵茵,吴国锋,黎锐发,等.吸入噻托溴铵对老年慢性阻塞性肺病患者肺功能与气道炎症的影响[J].中国老年学杂志,2013,33(2):249-251.
[2] 于美玲,张中和.慢性阻塞性肺疾病研究进展[J].中国临床研究,2013,26(1):82-85.
[3] 朱荣,马延超,王瑞元.一次大强度运动对大鼠骨骼肌泛素蛋白酶体途径基因表达及蛋白质降解的影响[J].中国运动医学杂志,2012,31(5):414-419.
[4] 詹庆元,黄絮.无创正压通气治疗急性低氧性呼吸衰竭的指征[J].中华医学杂志,2014,94(38):2966-2967.
[5] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)[J].中华结核和呼吸杂志,2007,30(1):8-17.
[6] Burki NK,Mani RK,Herth FJ,et al.A novel extracorporeal CO2removal system: results of a pilot study of hypercapnic respiratory failure in patients with COPD[J].Chest,2013,143(3):678-686.
[7] Struik FM,Sprooten RT,Kerstjens HA,et al.Nocturnal non-invasive ventilation in COPD patients with prolonged hypercapnia after ventilatory support for acute respiratory failure: a randomised, controlled, parallel-group study[J].Thorax,2014,69(9):826-834.
[8] Galli JA,Krahnke JS,James Mamary A,et al.Home non-invasive ventilation use following acute hypercapnic respiratory failure in COPD[J].Respir Med,2014,108(5):722-728.
[9] 刘海涛,何敬堂,邱志红,等.无创正压机械通气治疗支气管扩张症合并呼吸衰竭的回顾性分析[J].中国呼吸与危重监护杂志,2014,13(1):84-86.
[10] 屈磊,龚传明,章涛,等.孟鲁司特钠对 COPD 急性发作患者肺功能及炎性介质的影响[J].西南国防医药,2015,25(10):1058-1061.
[11] Hussain SN,Sandri M.Role of autophagy in COPD skeletal muscle dysfunction[J].J Appl Physiol(1985), 2013,114(9):1273-1281.
[12] Remels AH,Gosker HR,Langen RC,et al.The mechanisms of cachexia underlying muscle dysfunction in COPD[J].J Appl Physiol(1985),2013,114(9):1253-1262.
Effect of non-invasive positive pressure ventilation on skeletal ubiquitin-proteasome expression of patients with COPD and respiratory failure
ZHANG Jing-hao, WU Yan-min.
the Central Hospital of Xuzhou, Xuzhou, Jiangsu 221009, China
Objective To analyze the effect of non-invasive positive pressure ventilation on skeletal ubiquitin-proteasome expression of patients with COPD and respiratory failure. Methods 156 cases of patients with COPD and respiratory failure were selected in our hospital from February 2014 to February 2016. According to the patient's wishes, 65 cases were divided into the group A (n=52) and the group B (n=52). The other 39 cases who were treated by conventional symptomatic support were selected as the control group. The group C was given basic treatment after admission, and the group A and the group B were treated with NPPV. The curative effect, prognosis, inflammation index and gene expression level were observed in the three groups. Results The value of pH and PaO2was significantly higher, and respiration and HR were lower after treatment in the three groups (P<0.05). The value of pH and PaO2was significantly higher, and respiration and HR were significantly lower in the group A than in the group B (t=2.890, 2.052, 5.708, 2.638,P<0.05). The levels of IL-6, IL-8 and TNF-α in sputum and blood improved significantly after treatment, and they were significantly lower in the group A than in the group B (P<0.05). The mRNA expression of S22, ubiquitin, E2 and E3 in skeletal muscle of the group A was the lowest, followed by the group B and the group C (F=8.302, 5.346, 5.093, 4.783,P<0.05). Conclusion NPPV can effectively reduce hypoxia, hospitalization time and mortality in patients with COPD complicated with respiratory failure. The early treatment can get better efficacy, effectively reduce the patient's respiratory muscle load, improve the skeletal muscle proteasome pathway, reduce bone Muscle protein loss and improve COPD patients and respiratory failure in the ventilation, oxygenation status.
non-invasive positive pressure ventilation; treatment time; COPD with respiratory failure; skeletal ubiquitin-proteasome expression
10.3969/j.issn.1009-6663.2017.08.031
221009 江苏 徐州,徐州市中心医院
武焱旻,E-mail:merer2140@163.com
2016-11-28]

