影响香蕉酒中甲醇和高级醇形成的主要因素分析
杨东升,曾凯
(海南大学材料与化工学院生物工程系,海南海口570228)
影响香蕉酒中甲醇和高级醇形成的主要因素分析
杨东升,曾凯
(海南大学材料与化工学院生物工程系,海南海口570228)
利用气相色谱方法检测香蕉酒中甲醇和高级醇,并运用单因素试验和主成分分析法研究了酶解和发酵工艺条件对香蕉酒中甲醇和高级醇含量的影响。甲醇和高级醇总量在不同工艺条件下的差别分别为:半熟香蕉中甲醇和高级醇类的含量分别比全熟香蕉高9.5%和22.7%;未经酶解比酶解低57.0%和20.6%;起始发酵糖度20%比22%的工艺高10.1%和19.0%;带渣发酵比液态发酵分别低8.5%和高16.8%;甲醇含量在发酵温度32℃时达到最高193.60 mg/L,高级醇含量在28℃时达到最高584.00 mg/L。主成分分析结果表明,香蕉酶解工艺的特征醇正丙醇、异戊醇和甲醇,与酶解工艺密切相关。香蕉酒发酵工艺的特征醇类是异戊醇、正丙醇。
香蕉酒;甲醇;高级醇;主成分分析
香蕉酒是以香蕉为发酵原料,经打浆、压榨、发酵、澄清、灭菌制成,酒色金黄或淡黄,澄清透明,具有香蕉果香和酒香,滋味甘醇[1]。
香蕉酒中的醇类包括甲醇、乙醇和高级醇。甲醇具有毒性且不易排出体外,食用少量的甲醇后,轻则致人头晕、头痛,重则致人失明或死亡[2]。香蕉酒中甲醇主要来源于原料,并不是发酵的直接产物,主要由原料中的果胶质水解产生。香蕉中果胶含量较高,其中香蕉皮中果胶提取率即达鲜果皮2.9%左右[3]。高级醇是指含有3个碳及以上的一元醇的统称。发酵副产物高级醇是香蕉酒主要风味物质之一[4]。适量的高级醇能赋予酒体丰满的口感和香味,含量过低会使其风味淡薄,过量会产生明显的高级醇臭味和不愉快的苦味,且具有一定毒性,其中异丁醇和异戊醇毒性最大[5]。高级醇主要由原料中的蛋白质、氨基酸分解和糖类代谢生成[6]。目前还没有香蕉酒的国家标准,本研究借鉴红葡萄酒和配制酒的国标GB 15037—2006《葡萄酒》中的规定,红葡萄酒甲醇含量≤400 mg/L,本研究依此作为香蕉酒中甲醇检出量的安全评判标准。GB/T 5009.48—2003《蒸馏酒与配制酒卫生标准的分析方法》规定,蒸馏酒或配制酒每100 mL中高级醇≤0.030 g(以异丁醇与异戊醇计),本研究以300 mg/L(以异丁醇与异戊醇计)为高级醇检出含量的限定标准。
减少香蕉酒中甲醇和高级醇的方法主要有采用果胶和蛋白质含量低的原料、添加适量的果胶酶、选择适合的酵母及接种量、选择恰当的发酵温度等发酵工艺条件[1-5]。为了解香蕉酒酿造过程中酶解工艺和发酵工艺对生成甲醇和高级醇的影响,本研究采用单因素试验并运用Unscrambler软件中的主成分分析(principal component analysis,PCA)功能,对影响甲醇和高级醇生成的香蕉酶解和发酵的单因素进行了主成分分析[7]。主成分分析是对于原先提出的所有变量,将重复的变量(关系紧密的变量)删去,建立尽可能少的新变量,而且这些新变量在反映课题的信息方面尽可能保持原有的信息。运用主成分分析法研究全果或果肉、成熟度、加水比例、果胶酶种类、酶解方式、起始糖度、带渣或液态发酵、加压或常压发酵、发酵温度、酵母种类、接种量等工艺条件对香蕉酒甲醇和高级醇含量的影响,以期为香蕉酒的开发和生产提供理论依据。
1 材料与方法
1.1 材料与试剂
香蕉:海南大学北门南国超市;葡萄酒高活性干酵母(A)和酒用高活性干酵母(B):安琪酵母股份有限公司;果胶酶1(30万U/g):和氏壁生物技术有限公司;果胶酶2(30万U/g):山东隆科特酶制剂有限公司;果胶酶3(30万U/g):上海锐阳生物科技有限公司;α-淀粉酶(5万U/g):河南亿航化工产品有限公司;甲醇(优级纯):上海星可生化有限公司;正丙醇、正丁醇、异戊醇、异丁醇、β-苯乙醇(均为优级纯):阿拉丁试剂(上海)有限公司;柠檬酸(分析级):天津恒兴化学公司;亚硫酸氢钠(食品级):珠海市泛海生物技术有限公司;葡萄糖(分析级):天津市北辰方正试剂厂。1.2仪器与设备
6890N气相色谱(gas chromatography,GC)仪:美国Agilent公司;TU-1810紫外可见光分光光度计:北京普析通用仪器有限责任公司;MLS-3780高压蒸汽灭菌锅:三洋电机株式会社;SBA-40E生物传感分析仪:山东省科学院生物研究所;LRH生化培养箱:上海一恒科学仪器有限公司;ATY224岛津电子天平:日本岛津制作所。
1.3 方法
1.3.1 工艺流程及操作要点[8]

操作要点:
热烫护色:香蕉切成1 cm小段,置于100℃含0.25%柠檬酸溶液的沸水中热烫30 s;打浆:加入一定量的蒸馏水打浆,加入80 mg/L亚硫酸氢钠,调节pH值至4.0;酶解:分别取果胶酶1 g和α-淀粉酶1 g,加水定容至100 mL备用,每100 g果肉添加果胶酶液0.5 mL和α-淀粉酶液1 mL,于45~50℃水浴,酶解2 h;过滤:选用400目的滤布过滤;调整成分:分别加入蔗糖,调节糖度,用柠檬酸调节pH值至4.0;灭酶及灭菌:85~90℃水浴10 min。活化干酵母:称取6 g葡萄糖溶于300 mL蒸馏水中,配制成2%葡萄糖溶液,于120℃灭菌15 min;称取高活性果酒干酵母6 g于冷却至室温的无菌2%葡萄糖溶液中,摇匀,使菌体分散,置于28℃恒温水浴锅中复水活化2 h,每隔30 min摇晃一次。发酵:起始糖度20%,接种量5%,敞口28℃发酵5 d。
1.3.2 单因素试验
考察香蕉果肉、全果、成熟半熟、料水比(1∶1.0、1∶1.5(g∶mL))、果胶酶种类(果胶酶1、2、3)、酶解处理方式(不酶解、酶解并灭酶、酶解不灭酶)、起始糖度(18%、20%、22%、24%)、液态发酵、带渣发酵、敞口发酵、密封发酵、发酵温度(20℃、24℃、28℃、32℃)、酵母种类(A、B)、接种量(1%、5%、10%)对香蕉酒中甲醇和高级醇含量的影响,确定香蕉酒发酵工艺参数。
1.3.3 香蕉酒样品处理
取50mL样品(液温20℃)于150mL蒸馏瓶中,再加几颗沸石,连接冷凝器,以洁净、干燥的量筒或容量瓶作接收器(外加冰浴)。开启冷却水,缓慢加热蒸馏。收集馏分约48mL。于20℃水浴保温30 min,补水至50 mL,混匀,备用。
1.3.4 气相色谱条件
采用气相色谱测定香蕉酒中甲醇和高级醇[9],色谱条件:进样口温度:200℃;检测器温度:250℃;色谱柱:DB-1701毛细管气相色谱柱(30 m×0.32 mm×1.0 μm);程序升温:40℃、2min→10℃/min→270℃、1min;载气氮气(N2)流速:1.0mL/min;分流比:100∶1;尾吹(N2)流速:25mL/min,进样量:0.5 μL。
1.3.5 定性定量分析方法
定性:以各组分保留时间定性。吸取标准使用液和样液各0.5 μL,分别测得保留时间,试样与标准出峰时间对照而定性。
定量:分别吸取0.5 μL标准使用液和样液,绘制得色谱图,量取各组分峰面积。通过比较样品中各组分的峰面积与标准使用液中各组分的峰面积,计算样品中各组分的含量。
1.3.6 数据分析
运用Unscrambler软件,对香蕉酒酶解工艺和发酵工艺所涉及的主要参数和水平进行影响甲醇和高级醇的主成分分析。
2 结果与分析
2.1 酶解工艺对香蕉酒中甲醇和高级醇含量的影响
考察不同酶解工艺对香蕉酒中甲醇和高级醇含量的影响,结果见表1。由表1可知,选用香蕉果肉发酵生产的香蕉酒中甲醇的含量比全果发酵高10.0%,但全果发酵时毒性较大的异丁醇与异戊醇含量之和达到300.31 mg/L。全果发酵时β-苯乙醇的含量高出78.9%;果肉发酵时正丙醇含量明显高于全果发酵,约为全果发酵的2倍;高级醇总量也比全果发酵高出22.7%,达到584 mg/L。
半熟香蕉发酵产生的甲醇含量明显高于成熟的香蕉,达9.5%,半熟和成熟的香蕉发酵后高级醇总量均>500 mg/L;成熟香蕉发酵产生的正丙醇和异戊醇比半熟的分别高12.6%、16.4%。异丁醇和异戊醇含量之和在国家限定标准内。半熟香蕉不容易过滤,酶解汁呈淡紫色,氧化严重,发酵后起泡很高,容易染菌。成熟香蕉香气浓郁,发酵后的酒体醇厚。选择全熟的香蕉为原料,不仅能提高产量,还能降低甲醇含量[10]。

表1 不同酶解工艺对香蕉酒中甲醇和高级醇含量的影响Table 1 Effect of different enzymatic process on the contents of methanol and higher alcohols in banana wine mg/L
果胶酶能分解香蕉中的果胶,提高出汁率,却会造成酒中甲醇含量的提高[11]。不酶解发酵后甲醇含量只有80.13 mg/L,与酶解并灭酶工艺相比低57.0%,与前人的研究结果一致[12]。李艳松等[13-14]研究发现,葡萄酒中甲醇含量随着果胶酶添加量的增加而增加。说明果胶酶对甲醇的产生有影响,香蕉酶解时酶用量应当进一步探讨。从果胶酶的结构看,它是一种由四种酶构成的复杂酶系,用量的大小,会直接影响原料中蛋白质的总含量,使后续发酵过程由于蛋白质降解生成氨基酸,进而脱氨生产高级醇[15-16]。不灭酶时正丙醇含量较高,比灭酶后发酵高出13.1%,但异戊醇含量低了23.9%。
由表1还可知,三种酶对甲醇的产生量影响较大,使用果胶酶2比用果胶酶1发酵产生的甲醇低了16.2%,比果胶酶3低29.8%。果胶酶1和果胶酶2对高级醇总量产生的影响差异不大,最大比果胶酶3低13.8%。因此选用甲醇产生少的果胶酶2更好。
酶解时加水少,产品的甲醇含量也少,料水比为1∶1.0(g∶mL)比料水比1∶1.5(g∶mL)时产品中甲醇含量少10.9%。两个料水比产品的甲醇含量均<200 mg/L。料水比1∶1.0(g∶mL)时,产品中异丁醇+异戊醇含量为312.72 mg/L,其中异戊醇比料水比1∶1.5(g∶mL)时高出12.2%,而料水比1∶1.5(g∶mL)时正丙醇含量是料水比1∶1.0(g∶mL)时的2倍,且总高级醇含量较高。综上所述,选择料水比1∶1.0(g∶mL)打浆更安全。
2.2 不同发酵工艺对香蕉酒中甲醇和高级醇含量的影响
考察不同发酵工艺对香蕉酒中甲醇和高级醇含量的影响,结果见表2。由表2可知,当起始糖度为18%时,甲醇含量为170.98 mg/L;当起始糖度增加至20%时,甲醇和异丁醇+异戊醇含量同时增加至最大值,分别为186.12 mg/L和278.20 mg/L。起始糖度增加至22%和24%时,甲醇和异丁醇+异戊醇含量均减少后有所回升。起始糖度对甲醇含量波动影响较小,对异丁醇+异戊醇含量影响较大。高级醇含量过大具有一定毒性,而适量的高级醇能使香蕉酒体丰满的口感和香味,含量过低会使其风味淡薄[5]。不同香蕉酒工艺采用的起始糖度8%~24%不等,越南的Musa香蕉酒起始糖度8%,偏低,口感偏淡[17]。为了使香蕉酒更加适口,起始糖度不宜过低。因此,选择起始糖度22%为宜。
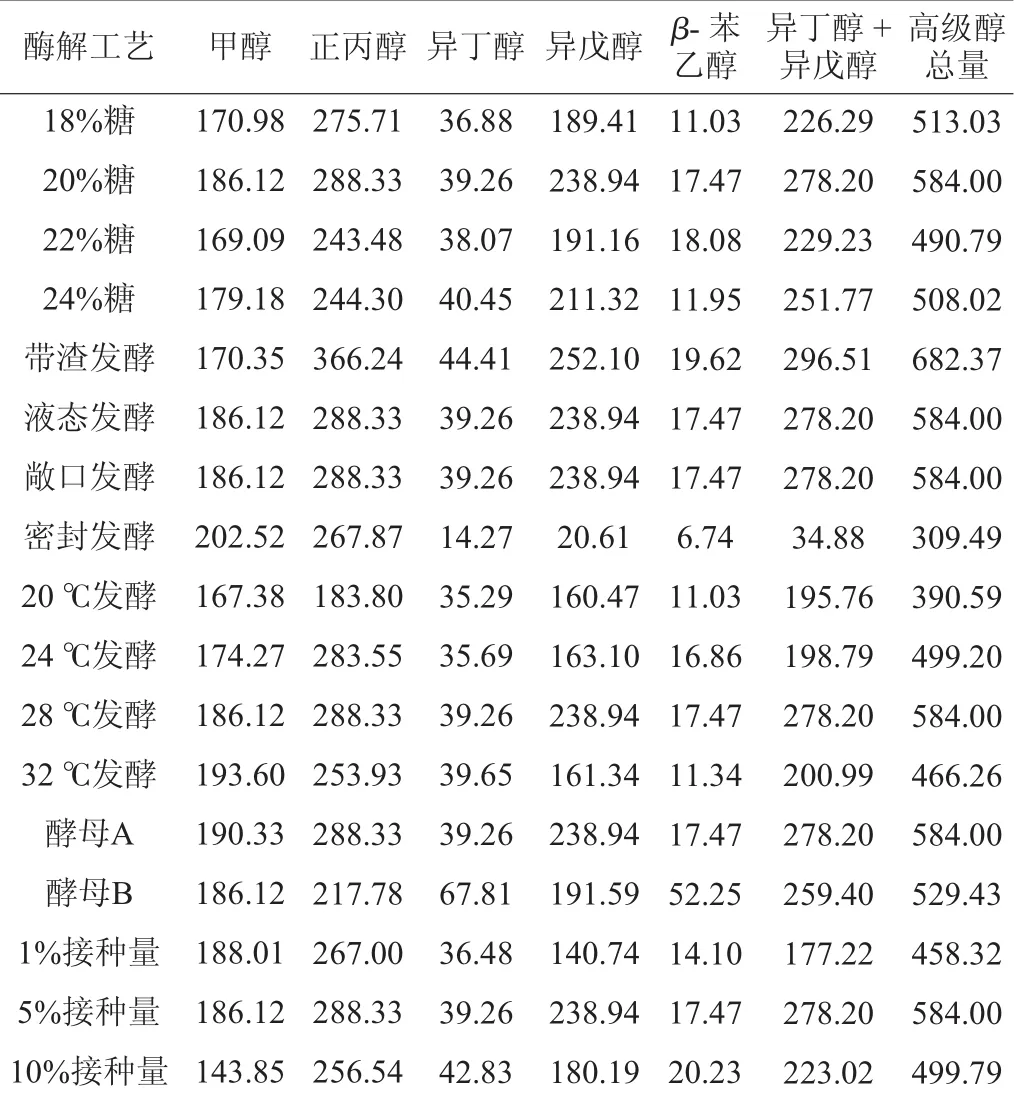
表2 不同发酵工艺对香蕉酒中甲醇和高级醇含量的影响Table 2 Effect of different fermentation process on the contents of methanol and higher alcohols in banana wine mg/L
由表2可知,酶解之后不过滤,即选择带渣发酵工艺生成的甲醇含量较低,比液态发酵低8.5%,而带渣发酵时正丙醇的含量较高,达到366.24 mg/L,比液态发酵高27.0%,异丁醇和异戊醇产生量也接近限定标准,且发酵产生的高级醇总量高出了16.8%,达到682.37 mg/L。试验发现,带渣发酵后,酒体酸味较重,口味欠佳,且不容易调整成分,液态发酵更容易自动化生产,容易控制。因此,选择过滤后采用液态发酵更好[17-18]。
在密封发酵时甲醇的含量略高,为202.52 mg/L,且高级醇总量比敞口发酵低47.0%,正丙醇含量较接近,异丁醇和异戊醇含量较少,为34.88mg/L,异戊醇降低了91.37%,为20.61 mg/L。高浓度的CO2降低了酿酒酵母的发酵活力,影响了香蕉酒的发酵度[19],进而影响了香蕉原料的利用率。研究发现,低浓度的CO2可以刺激酵母的生长,密封发酵过程中,容器内背压上升,当压力上升至0.25~0.3 MPa时,酵母的生长被完全抑制[20]。压力和温度是啤酒发酵的物理参数,温度提高可以缩短发酵时间,而增加压力可以改善由于升温引起的负面风味物质的影响[21]。均衡考虑密封发酵与敞口发酵的优劣,宜采用敞口发酵。
研究表明,温度对甲醇的含量影响是正相关的,对高级醇含量的影响显著[22]。通过调节发酵温度,可以对酵母生长、高级醇的最终含量和生产动力学产生一定的影响,形成一个和谐统一的发酵条件,使酿造酒具有特殊的香气[23]。表2显示,随发酵温度的上升,甲醇含量呈上升趋势,最高达到193.60 mg/L。当温度为28℃时,高级醇含量最高,为584.00 mg/L;单从甲醇和高级醇含量来看,温度较低(20℃)时,甲醇产生量少,但温度低不利于酒精发酵,会延长发酵时间[24]。较高发酵温度使发酵时间相应缩短,同时会促进甲醇的产生[25],而且使高级醇含量偏高,酯含量却下降,酒味醇而不香[26],因此选择发酵温度28℃为宜。
由表2还可知,酵母B发酵产生的β-苯乙醇较多,是酵母A产生的3倍,但酵母B的正丙醇和异戊醇产生量比酵母A分别降低了24.5%和19.8%。且酵母B的异丁醇+异戊醇含量和高级醇总量比酵母A均低,因此,选择酵母B较适合。表2显示,接种量为1%时,甲醇含量最高,为188.01 mg/L,随着接种量增加至10%时,甲醇含量减少至143.85 mg/L,而异丁醇+异戊醇含量为223.02 mg/L。因此,选择酵母接种量5%为宜。
2.3 主成分分析结果
以8个单因素酶解并发酵后生成甲醇和高级醇的含量为变量进行分析,取两个主成分(principal component,PC),结果见图1。由图1可知,其中主因子1解释了总变异的69%,主因子2解释了总变异的27%。从各因素试验样本位置分布的聚类情况可知,酶解不灭酶样本单独为一组,料水比1∶1.0(g∶mL)和全果酶解样本聚为一组,标准、半熟、果胶酶1和果胶酶2样本聚为一组,不酶解工艺单独为一组。
每一个主成分都是原变量的线性组合,这些组合的系数称为载荷,用X-loading表示,载荷反映的是变量与主成分的相关性,它代表了在主成分中,原来各个变量的权重,载荷的大小可以表明各变量的影响程度,把全部载荷用一个图形表示出来则组成载荷图[27]。由图2可知,正丙醇在主因子1上的载荷最大,结合图1可得,正丙醇、甲醇与采用酶解不灭酶和标准工艺呈正相关,与料水比1∶1.0(g∶mL)和全果酶解工艺呈负相关。甲醇在主因子2上的载荷最大,异戊醇次之,结合图1可知,甲醇和异戊醇与料水比1∶1.0(g∶mL)和全果酶解工艺呈正相关,与果胶酶2和不酶解工艺呈负相关。说明8个因素试验样本的主要差异在正丙醇、异戊醇和甲醇上。其中的甲醇是重点关注的特征醇,因为在原料的预处理环节,可以避免主要的甲醇生成,这在苹果酒的研究中也有相同的发现[28]。

图1 香蕉酶解工艺主成分分析得分图Fig.1 PCA scores plot of banana enzymatic process

图2 香蕉酶解工艺主成分分析载荷图Fig.2 PCA loading plot of banana enzymatic process

图3 香蕉酒发酵工艺主成分分析得分图Fig.3 PCA scores plot of banana wine fermentation process
对12个发酵因素改变水平或工艺,以香蕉酒发酵后生成甲醇和高级醇的含量为变量进行分析,取两个主成分,结果见图3。由图3可知,其中主因子1解释了总变异的70%,主因子2解释了总变异的26%。除了带渣发酵、密封发酵和20℃发酵工艺外,其他工艺均显示了较好的聚类。说明这三种工艺生成的醇类物质含量与其他工艺存在较大差异。
对各变量在主因子的载荷进行分析,结果见图4。由图4可知,第一主成分在异戊醇上有较大的载荷系数,说明不同发酵工艺生成的异戊醇差异最大。第二主成分主要与正丙醇有关,在其他高级醇和甲醇的载荷上没有明显差异。因为总方差超过50%的贡献来自第一和第二主成分,异戊醇、正丙醇是香蕉酒发酵工艺的特征醇类。甲醇在第一、二主成分上的载荷系数较小,说明不同发酵工艺对甲醇生成影响较小。

图4 香蕉发酵工艺主成分分析载荷图Fig.4 PCA loading plot of banana wine fermentation process
综合分析香蕉酶解工艺和发酵工艺,正丙醇、异戊醇是二者共同的特征醇类,而甲醇则是酶解工艺所独有的特征醇。因此,甲醇的生成主要与香蕉原料的酶解工艺有关,与发酵工艺关系不大。由于异丁醇含量低,且通过主成分分析并未显示其特征,所以异丁醇+异戊醇的含量主要由异戊醇决定。
3 结论
本研究采用单因素试验和主成分分析方法研究了香蕉酒酿造过程中酶解工艺和发酵工艺对生成甲醇和高级醇的影响。结果表明,香蕉酒酿造最优工艺为以全熟果肉为原料,加水比例1∶1.0,经果胶酶2酶解并灭酶处理后得到香蕉汁,以22%起始糖度,添加5%酵母B,28℃敞口发酵。不同香蕉酶解和发酵工艺对香蕉酒中甲醇和高级醇含量的影响相差较大。经主成分分析,香蕉酶解工艺的特征醇是正丙醇、异戊醇和甲醇,与酶解工艺密切相关,而甲醇是酶解工艺独有的特征醇。甲醇的生成主要与香蕉原料的酶解工艺有关,与发酵工艺关系不大,而香蕉酒中异戊醇和正丙醇的生成与酶解和发酵工艺均有关系。为香蕉酒的工业化生产提供指导和依据。
[1]王天陆,钟秋平,杨颖,等.香蕉果酒酿造工艺研究[J].中国酿造,2010,29(6):175-177.
[2]杨辉,黄丽梅,罗建华.海红果酒中甲醇比色测定条件优化[J].陕西科技大学学报,2013,31(6):114-117.
[3]夏娜,张双霞,张莉,等.香梨酒中甲醇产生的原因及控制方法研究[J].中国食品与营养,2011,17(9):59-62.
[4]STYGER G,PRIOR B,BAUER F.Wine flavor and aroma[J].J Ind Microbiol Biot,2011,38:1145-1159.
[5]罗惠波,江文涛,卫春会,等.桑椹酒酿造过程中高级醇生成的影响因素研究[J].中国酿造,2012,31(5):131-135.
[6]李艳松.果胶酶对葡萄酒酿制过程中甲醇及杂醇油含量的影响[D].南宁:广西大学,2012.
[7]RODRIGUEZ-NOGALES J M,FERNÁNDEZ-FERNÁNDEZ E,VILACRESPO J,et al.Effect of the addition of β-glucanase and commercial yeast preparations on the chemical and sensorial characteristics of traditional sparkling wine[J].Eur Food Res Technol,2012,235:729-744.
[8]钟秋平,赵新河.海南9个香蕉品种的酿酒性能探讨[J].中国酿造,2008,27(7):44-46.
[9]CARUSO R,GAMBINO G L,SCORDINO M,et al.Gas chromatographic quantitative analysis of methanol in wine:Operative conditions,optimization and calibration model choice[J].Nat Prod Commun,2011,6: 1939-1943.
[10]康效宁,戴萍,吉建邦,等.成熟度对香蕉出汁率的影响及其酶解工艺优化[J].食品工业科技,2014,35(24):182-189.
[11]王卫东,孙月娥.果胶酶及其在果蔬汁加工中的应用[J].食品研究与开发,2006,27(11):222-227.
[12]BYARUGABA-BAZIRAKE G W,VAN RENSBURG P,KYAMUHANGIRE W.The influence of commercial enzymes on wine clarification and on the sensory characteristics of wines made from three banana cultivars[J].Am J Biotechnol Mol Sci,2013,3:41-62.
[13]李艳松,文良娟.果胶酶对葡萄酒酿制过程中甲醇含量的影响[J].食品工业,2012(9):17-20.
[14]胡云峰,刘维维,张轲,等.不同前处理对玫瑰香葡萄酒香气成分的影响[J].食品科技,2010,35(9):97-101.
[15]LILLY M,BAUER F F,STYGER G,et al.The effect of increased branched-chain amino acid transaminase activity in yeast on the production of higher alcohols and on the flavour profiles of wine and distillates[J].FEMS Yeast Res,2006,6:726-743.
[16]谭秀山.CXJZ95-198菌株分泌果胶酶和半纤维素酶的活性研究及果胶酶的分离纯化[D].乌鲁木齐:新疆农业大学,2004.
[17]MINH N P.Investigation of factors affecting to banana wine(Musa chiliocarpa&Musa basjoosieb)fermentation[J].Int J Multidiscip Res Dev,2014,1(3):118-124.
[18]YANG D S,LUO X Q,WANG X G.Characteristics of traditional Chineseshanlanwinefermentation[J].J Biosci Bioeng,2014,117:203-207.
[19]单祖华.完全密闭发酵条件下酿酒酵母的生长代谢及其代谢通量分析[D].杨凌:西北农林科技大学,2008.
[20]SLAUGHTER J C,FLINT P W N,KULAR K S.The effect of CO2on the absorption of amino acids from a malt extract medium bySaccharomyces cerevisiae[J].FEMS Microbiol Lett,1987,40:239-243.
[21]KUMADA J,NAKAJIMA S,TAKAHASHI T.et al.Effect of fermenta-tion temperature and pressure on yeast metabolism and beer quality[C]// Nice:Proceedings of the 15th Congress of the European Brewery Convention,1975:615-623.
[22]LETICIA P,MIGUEL C,HUMBERTO G,et al.Fermentation parameters influencing higher alcohol production in the tequila process[J]. Biotechnol Lett,1997,19(1):45-47.
[23]VAN G C Z,CHEN E,VALYI Z.Factors affecting the formation of fusel alcohols during fermentation[J].Tech Q,1975,12:169-175.
[24]张宝善,陈锦屏,杨莉,等.甲醇和杂醇油在红枣发酵酒中的变化及其控制研究[J].西北农林科技大学学报,2004,32(4):24-27.
[25]李晓娟,吴枭锜,叶翌冬.发酵杨梅酒陈酿过程中的甲醇及杂醇油变化[J].福建农业学报,2015,30(1):69-74.
[26]杨东升,罗先群,王新广.CO2对啤酒发酵过程中酵母生长代谢及酯的形成影响[J].中国酿造,2013,32(4):70-74.
[27]TSCHIERSCH C,NIKFARDJAM M P,SCHMIDT O,et al.Degree of hydrolysis of some vegetable proteins used as fining agents and its influence on polyphenol removal from red wine[J].Eur Food Res Technol,2010,231:65-74.
[28]WON S Y,SEO J S,KWAK H S,et al.Quality characteristics and quantification of acetaldehyde and methanol in apple wine fermentation byvarious pre-treatments of mash[J].Prev Nutr Food Sci,2015,20(4): 292-297.
Analysis of main influencing factors on methanol and higher alcohols formation in banana wine
YANG Dongsheng,ZENG Kai
(Department of Bioengineering,College of Materials and Chemical Engineering,Hainan University,Haikou 570228,China)
The methanol and higher alcohols in banana wine were determined by GC method.The effects of enzymolysis and fermentation processes conditions on the contents of methanol and higher alcohols in banana wine were researched by single factor experiments and principal component analysis(PCA).The differences of methanol and higher alcohols contents under different process conditions were as followed:the contents of methanol and higher alcohols in half ripe bananas were 9.5%and 22.7%higher than that of in ripe bananas,respectively.The contents of methanol and higher alcohols by non-enzymatic process were 57.0%and 20.6%lower than that of by enzymatic process,respectively.The contents of methanol and higher alcohols under the condition of initial sugar content 20%were 10.1%and 19.0%higher than that of under the 22%initial sugar,respectively.The contents of methanol and higher alcohols by fermentation with pomace were 8.5%lower and 16.8%higher than that of by liquid fermentation,respectively.The content of methanol was increased to the maximum of 193.60 mg/L at fermentation temperature 32℃and the higher alcohols content was increased to the maximum of 584.00 mg/L at 28℃.The results of PCA indicated that the characteristic alcohols(n-propyl alcohol,isoamyl alcohol and methanol)in banana by enzymolysis process were closely related to the enzymatic process.The characteristic alcohols in banana wine by fermentation processes were isoamyl alcohol and n-propyl alcohol.
banana wine;methanol;higher alcohols;principal component analysis
TS26
0254-5071(2017)06-0089-06
10.11882/j.issn.0254-5071.2017.06.018
2017-02-04
海南省科技厅科研基金(317006)
杨东升(1966-),男,副研究员,本科,主要从事生物化工研究工作。

