百草枯诱导的SH-SY5Y细胞中核连蛋白2基因的表达变化
田小菲 张 晓 张经一 王 芳 张亚星 张国徽 庞 灏
(河北北方学院法医教研室,河北 张家口 075000)
百草枯诱导的SH-SY5Y细胞中核连蛋白2基因的表达变化
田小菲 张 晓1张经一1王 芳1张亚星1张国徽 庞 灏2
(河北北方学院法医教研室,河北 张家口 075000)
目的 检测核连蛋白(NUCB)2在百草枯(PQ)诱导的SH-SY5Y细胞中的表达变化,分析NUCB2在PQ引起的SH-SY5Y细胞凋亡中的作用机制。方法 采用MTT法进行SH-SY5Y细胞毒性分析。选择PQ作用的最佳浓度和时间点,进一步收取经PQ处理后的SH-SY5Y总RNA,首先采用RT-PCR方法观察NUCB2的表达趋势,然后采用real-time PCR方法进行NUCB2基因进行表达变化检测,采用ΔΔCt法进行定量比较分析。结果 MTT方法在酶标仪490 nm波长下,分析得到PQ的最佳作用浓度和时间是0.5 mmol/L作用24 h,此时细胞活力较对照组低约41.67%;采用ΔΔCt法进行定量比较分析,发现NUCB2在mRNA水平的表达量明显降低(P=0.001 6);Western印迹检测发现SH-SY5Y细胞经PQ诱导后引起了caspase-3酶原形式的表达量降低(P<0.05)。结论 NUCB2基因在经PQ诱导后的SH-SY5Y细胞中表达量明显降低,分析其可能在神经细胞的凋亡机制中发挥重要作用。
核连蛋白(NUCB)2;PQ;SH-SY5Y;凋亡
SH-SY5Y细胞系是帕金森病(PD)发病机制研究中一种常见的体外模型,因其有多巴胺能神经元的一些特性〔1〕,此细胞可分泌酪氨酸羟化酶、β-多巴胺羟化酶和多巴胺转运蛋白。百草枯(PQ)可为活性氧种属产生的激活因素之一〔2,3〕,位于细胞膜上的这些小叶状活性氧簇(ROS)不饱和脂类的相互作用,将对细胞器造成一定损坏,进而导致细胞死亡的发生〔4〕。细胞凋亡涉及众多凋亡相关基因和多种信号通道,核连蛋白(NUCB)2也称为非酯化脂肪酸(NEFA)蛋白,此蛋白与1型肿瘤坏死因子(TNF)受体(TNFR)脱落氨肽酶调控因子(ARTS-1)形成的复合物能对TNFR1的释放进行调节,从而影响TNFα-TNFR1系统介导的细胞凋亡的过程〔5〕,同时凋亡发生过程中的半胱氨酸蛋白酶(caspase)能对NUCB2进行裂解〔6〕。目前国内外还没有NUCB2所参与的神经细胞死亡机制的相关报道,本研究拟采用PQ诱导SH-SY5Y细胞建立PD的发病机制模型,以探讨NUCB2在经PQ诱导后的神经细胞中的表达变化。
1 材料与方法
1.1 实验材料 神经母细胞瘤细胞(SH-SY5Y)购于中科院细胞中心(源自美国ATCC);胎牛血清(FBS)和DMEM/F12培养基,Hyclone公司;噻唑蓝(MTT),凯基公司;PQ,Sigma公司;Ex-Taq试剂盒,RT-PCR试剂盒和SYBR试剂盒,TaKaRa公司;TRIZOL试剂,Millpore公司。
1.2 细胞培养 人神经母细胞瘤细胞SH-SY5Y用含有10% FBS的DMEM/F12培养液(青霉素100 U/ml、链霉素100 μg/ml)悬浮,以大约5×106个/ml的密度接种于直径10 cm的培养皿,置于细胞培养箱中,在37℃,5%CO2,湿化条件下培养,待细胞覆盖率达90%左右时,常规胰酶消化传代。
1.3 MTT进行细胞毒性分析 选用不同浓度的PQ(0.025,0.05,0.1,0.25,0.5,1.0,1.5 mmol/L)作用浓度作用于SH-SY5Y细胞不同时间(6,18,24,48 h)后,采用MTT方法进行细胞毒性分析,选择最佳的PQ作用浓度和时间。
1.4 NUCB2 mRNA水平的表达变化检测 根据1.3中的结果选择PQ作用的最佳浓度和时间点,收取SH-SY5Y细胞总RNA,反转录成cDNA。设计NUCB2的特异性引物,β-actin上游引物5′-AGATGACCCAGATCATGTTTG-3′,下游引物5′-ATCACGATGCCAGTGGTA-3′;NUCB2上游引物5′-AGGCAGATGAGCTTCAGA-3′,下游引物5′-TCTGCTGTATGACCTGATGA-3′。采用RT-PCR和real-time方法对处理前后的SH-SY5Y细胞中NUCB2在mRNA水平的表达进行检测。采用ΔΔCt法对实验组与对照组之间NUCB2基因表达量变化进行定量分析,三组样品分别进行分析3次。
1.5 caspase-3的检测 根据1.3中的结果选择PQ作用的最佳浓度和时间点,收取SH-SY5Y细胞总蛋白,采用Western印迹方法进行caspase-3激活情况的检测。用凝胶自动分析成像软件FluorChem V2.0进行蛋白灰度值(分别以caspase-3的整合密度值比内参β-actin的整合密度值)分析,进而做定量比较,三组样品分别进行分析3次。
1.6 统计学方法 采用Excel2007进行t检验。
2 结 果
2.1 PQ作用最佳浓度及时间选择 MTT方法在酶标仪490 nm波长下,分析得到的细胞经不同浓度处理6、18、24、48 h的生存活力,因6、18 h细胞活性无明显差异,48 h细胞死亡太多,故仅对24 h进行分析,见图1,0.5 mmol/L PQ作用24 h后,细胞活力相对于未经PQ作用组比较降低了约41.67%,标准偏差为0.033;虽然随着PQ浓度的增大,细胞生存活力降低越明显,但是当PQ浓度大于0.5 mmol/L以后,显微镜下观察SH-SY5Y细胞即出现皱缩,呈现出明显的病理形态,所以不宜选择大于0.5 mmol/L的PQ浓度进行后续分析。
2.2 caspase-3表达检测 SH-SY5Y细胞经PQ诱导后活性明显降低,进一步收取SH-SY5Y细胞经0.5 mmol/L PQ作用24 h后的总蛋白,进行caspase-3酶原形式的表达量变化检测。SH-SY5Y经PQ作用后,导致了caspase-3酶原形式的表达量降低(P<0.05)。见图2。
2.3 NUCB2 mRNA表达检测 SH-SY5Y细胞经0.5 mmol/L PQ作用24 h后,PQ组NUCB2 mRNA水平的表达量(1.452 715±0.038 37)明显低于对照组(1.519 701±0.057 78)(P<0.05)。见图3。
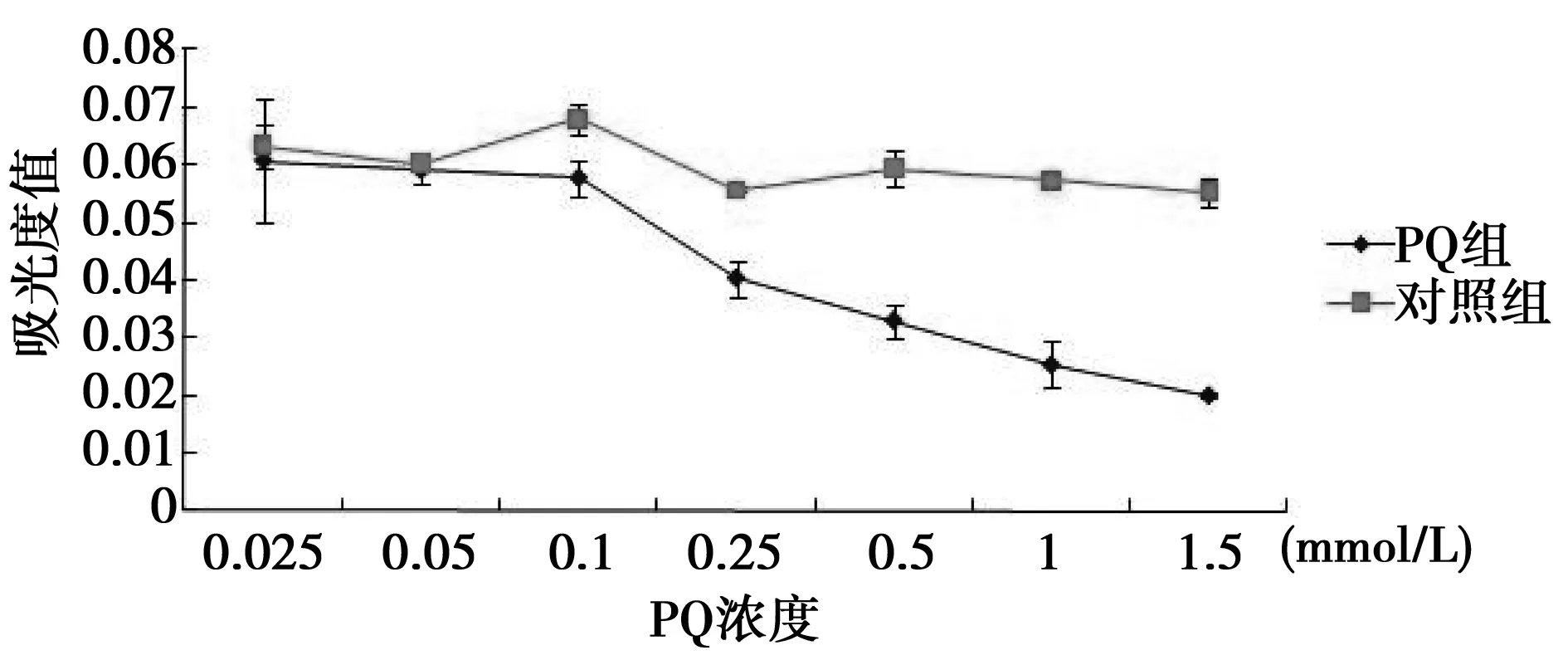
图1 PQ作用于SH-SY5Y 24 h后MTT分析图

图2 caspase-3表达检测

图3 NUCB2 mRNA表达水平
3 讨 论
有报道SH-SY5Y细胞经凋亡诱导剂作用后,将导致此细胞各种凋亡现象的发生〔7〕,因其有多巴胺能神经元的一些特性,因此SH-SY5Y细胞模型已在由PQ引起的PD发病机制的研究中得到了广泛认可。流行病学报道显示,经常接触PQ的人群患PD的概率明显增高〔8,9〕。有报道在经PQ作用后的神经细胞,亦有线粒体膜电位发生改变,进而引起细胞色素C的释放,caspase凋亡途径的激活等的相关报道〔10〕。内环境中Ca2+的紊乱,也是细胞凋亡的一个主要诱因。正常情况下,胞外液中Ca2+的浓度为1 mmol/L水平,而胞质内游离Ca2+的浓度为0.1 mmol/L。当经1-甲基-4-苯基-吡啶(MPP+)作用后,可引起机体Ca2+内环境稳态的紊乱,进而诱发细胞色素C的释放,激活caspase-3调控的凋亡途径的发生,进而引起细胞死亡的发生〔11〕,而PQ的化学结构与其极其相似〔12〕,本研究显示caspase-3酶原形式的表达量经PQ作用之后明显降低。
NUCB2可参与TNFα-TNFR1系统介导的细胞凋亡的过程〔5〕,参与调节细胞内外 Ca2+的内环境稳定。NUCB2可调节神经元胞质内Ca2+的稳态〔13〕。胞外TNFR1与NUCB2-Arts1结合形成复合物,进而影响其与TNF-α的结合,从而影响TNFα-TNFR1系统介导的程序性细胞死亡过程的发生〔14〕。当TNFα与TNFR1结合后,激活细胞凋亡信号,启动细胞内半胱氨酸天冬氨酸酶的级联反应过程,诱导细胞凋亡的发生〔15〕,又有报道,细胞凋亡发生过程中的caspase能对NUCB2进行裂解〔6〕。本研究发现,当PQ作用于SH-SY5Y细胞后,神经细胞的存活率明显降低,同时发现,细胞凋亡过程中涉及的重要蛋白酶caspase-3酶原形式的表达量经PQ作用之后亦明显降低。PQ作用于SH-SY5Y细胞之后引起了细胞凋亡的发生,进一步发现经PQ处理组NUCB2的表达量明显低于对照组。
综上,可得NUCB2的表达变化参与了TNFα-TNFR1系统介导的细胞凋亡的过程,但是又因为细胞凋亡激活信号引起的caspase的激活可能导致了NUCB2的降解。即在整个过程中NUCB2既参与了TNFα-TNFR1系统介导的细胞凋亡途径的激活,又可能是caspase-3的作用底物。因此,NUCB2在PQ引起的神经细胞凋亡过程中的具体机制还需进一步研究探讨。
1 Chade AR,Kasten M,Tanner CM.Nongenetic causes of Parkinson′s disease〔J〕.J Neural Transm Suppl,2006;26(70):147-51.
2 Bus JS,Gibson JE.Paraquat:model for oxidant-initiated toxicity〔J〕.Environ Health Perspect,1984;55:37-46.
3 Shimizu K,Matsubara K,Ohtaki K,etal.Paraquat induces long-lasting dopamine overflow through the excitotoxic pathway in the striatum of freely moving rats〔J〕.Brain Res,2003;976(2):243-52.
4 Hertzman C,Wiens M,Bowering D,etal.Parkinson′s disease:a case-control study of occupational and environmental risk factors〔J〕.Am J Industr Med,1990;17(3):349-55.
5 Roy DN,Mandal S,Sen G,etal.14-deoxyandrographolide desensitizes hepatocytes to tumour necrosis factor-alpha-induced apoptosis through calcium-dependent tumour necrosis factor receptor superfamily member 1A release via the NO/cGMP pathway〔J〕.Br J Pharmacol,2010;160(7):1823-43.
6 Islam A,Adamik B,Hawari FI,etal.Extracellular TNFR1 release requires the calcium-dependent formation of a nucleobindin 2-ARTS-1 complex〔J〕.J Biol Chem,2006;281(10):6860-73.
7 Tazik S,Johnson S,Lu D,etal.Comparative neuroprotective effects of rasagiline and aminoindan with selegiline on dexamethasone-induced brain cell apoptosis〔J〕.Neurotox Res,2009;15(3):284-90.
8 Bredesen DE,Rao RV,Mehlen P.Cell death in the nervous system〔J〕.Nature,2006;443(7113):796-802.
9 Schulz JB.Update on the pathogenesis of Parkinson′s disease〔J〕.J Neurol,2008;255(5):3-7.
10 Fei Q,McCormack AL,Di Monte DA,etal.Paraquat neurotoxicity is mediated by a Bak-dependent mechanism〔J〕.J Biol Chem,2008;283(6):3357-64.
11 Selvaraj S,Watt JA,Singh BB.TRPC1 inhibits apoptotic cell degeneration induced by dopaminergic neurotoxin MPTP/MPP(+)〔J〕.Cell Calcium,2009;46(3):209-18.
12 González-Polo RA,Rodríguez-Martín A,Morán JM,etal.Paraquat-induced apoptotic cell death in cerebellar granule cells〔J〕.Brain Res,2004;1011(2):170-6.
13 Taniguchi N,Taniura H,Niinobe M,etal.The postmitotic growth suppressor necdin interacts witha calcium-binding protein (NEFA) in neuronal cytoplasm〔J〕.J Biol Chem,2000;275(41):1674-8.
14 Aebischer J,Sturny R,Andrieu D,etal.Necdin protects embryonic motoneurons from programmed cell death〔J〕.PLoS One,2011;6(9):e23764.
15 宋红丽,吕 飒,刘 沛.肿瘤坏死因子致暴发性肝功能衰竭小鼠肠上皮细胞凋亡的作用〔J〕.中华肝脏病杂志,2005;13(4):290-3.
〔2016-02-24修回〕
(编辑 苑云杰/曹梦园)
河北省教育厅青年指导项目(Z2017027)
庞 灏(1962-),男,教授,博士生导师,主要从事法医物证学研究。
田小菲(1983-),女,讲师,主要从事法医学研究。
R285
A
1005-9202(2017)13-3158-03;
10.3969/j.issn.1005-9202.2017.13.016
1 河北北方学院2012级法医学本科1班
2 中国医科大学法医学院法医血清教研室

