银杏叶提取物对大鼠心肌缺血再灌注损伤的作用及其机制
鄢晓平 黄 煜 彭亚飞 陈良龙 吴黎明
(福建医科大学附属协和医院心内科,福建 福州 350001)
银杏叶提取物对大鼠心肌缺血再灌注损伤的作用及其机制
鄢晓平 黄 煜 彭亚飞 陈良龙 吴黎明
(福建医科大学附属协和医院心内科,福建 福州 350001)
目的 探讨银杏叶提取物对大鼠心肌缺血再灌注损伤(MIRI)的作用及其可能的抗氧化机制。方法 30只Wistar 雄性大鼠随机分为假手术组(Sham组)、缺血再灌注组(I/R组)、银杏叶药物组(GBE组),每组10只,银杏叶灌胃1 w后制备心肌缺血模型。苏木素-伊红(HE)染色观察各组大鼠形态学改变;心肌梗死面积利用TTC染色测定;根据试剂盒说明测定血清超氧化物歧化酶(SOD)、丙二醛(MDA)及谷胱甘肽过氧化物酶(GSH-Px)含量。结果 Sham组可见心肌细胞排列整齐,各结构完整,细胞核均匀分布;模型组部分心肌细胞坏死,细胞之间界限欠清,细胞水肿,排列紊乱;GBE组细胞小部分结构模糊,细胞界限尚清晰,轻度水肿。GBE组大鼠心肌梗死面积明显低于I/R组。同时,I/R组SOD活力及GSH-Px含量显著低于Sham组,MDA水平高于I/R组(均P<0.05),GBE组血清SOD、GSH-Px含量明显高于I/R组,MDA水平低于I/R组(P<0.05)。结论 GBE对大鼠MIRI具有明显的保护作用,其可能与抑制氧化应激作用有关。
银杏叶提取物;心肌缺血再灌注损伤;超氧化物歧化酶;丙二醛
心肌缺血再灌注损伤(MIRI)在血流恢复重建的再灌注过程加剧代谢紊乱,引起心肌超微结构破坏的损伤过程〔1〕。关于MIRI的病理生理及机制较为复杂,包括氧自由基机制,炎症反应浸润,能量代谢障碍、微血管通透性机制等。
银杏叶提取物(GBE)是较为安全的草药补充剂,研究表明其可明显改善外周及脑的微循环〔2〕,甚至在MIRI过程中具有明显的保护作用。目前标准化的GBE为银杏761,其成分包括大约24%黄酮苷、6%萜烯内酯和其他化学物质〔3〕。其主要生物活性组件的主要药理作用包括清除氧自由基、抑制血小板聚集和因子和保护微血管内皮细胞。但是GBE是否对大鼠MIRI具有保护作用及其具可能的机制目前尚未研究,本文依据参考文献建立大鼠MIRI模型,并利用超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)来反映机体氧化还原水平,探讨银杏叶提取物对大鼠MIRI的作用及可能的抗氧化应激机制。
1 材料及方法
1.1 实验动物 健康成年雄性SD大鼠30只,体重(220±20)g,由北京维通利华实验动物技术有限公司提供。
1.2 药品、试剂及仪器 GBE购自中国药品生物鉴定研究所(纯度99%);羧甲基纤维素钠(CMC-Na)、伊文思蓝、三苯基氯化四氮唑购于sigma公司;由TaKaRa大连宝生物有限公司提供Trizol试剂、荧光定量检测试剂盒、逆转录试剂盒;由上海生工生物工程有限公司完成引物设计与合成。由厦门慧嘉生物有限公司提供SOD、MDA、GSH-Px试剂盒。
1.3 分组 应用随机数字表法将30只健康Wistar雄性大鼠随机分为假手术组(Sham),缺血再管组(I/R组),GBE组,每组10只。GBE组:造模前1 w给予0.5% GBE 50 mg/kg灌胃,而对Sham组及I/R组给予灌服0.5%CMC-Na 10 ml/kg。
1.4 MIRI模型制备 参考文献〔4〕的方法建立MIRI模型。各组大鼠术前禁食6 h。对大鼠实施腹腔注射麻醉(20%乌拉坦按8 ml/kg),仰卧位固定,利用Medlab采集系统记录Ⅱ导联心电图。正中切口切开颈部后气管插管,并连接小动物呼吸机进行机械通气,选择频率65次/min,呼∶吸比为2∶1,选择潮气量为8 ml/kg。剪开胸部皮肤后暴露3~4肋间肌肉,剪断第4肋骨,刺破胸膜进入胸腔,暴露心脏,将心包膜剪开后将心脏挤出胸腔,结扎冠脉左前降支,造成急性心肌缺血模型。心电图提示心率减慢,并出现宽大畸形的QRS波群,大鼠左室前壁出现充血、发绀,表示结扎成功。缺血30 min后给予恢复血流,心电图提示QRS波群回落,提示再灌注成功。给予再灌注120 min。Sham组只穿线不结扎冠脉,其余操作均与余两组相同。再灌注结束后,从腹主动脉取血,离心,冻存,进行后期血清学检测。
1.5 利用氯化三苯基四氮唑(TTC)染色测定心肌梗死面积 再灌注结束时,注入2 ml 2%伊文蓝向左心室,离体取标本后冻存,横向切片后,置于1%TTC磷酸盐缓冲液中浸泡,37℃条件下孵化染色20 min,4%多聚甲醛中固定,采用图像分析软件image-proplus6.0测定蓝色、红色、白色区域面积。蓝红白的面积之和为左心室面积(LV),红白之和为缺血面积(AAR),白色面积为梗死面积(IS)。AAR百分比=AAR/LV;IS百分比=IS/AAR。
1.6 血清SOD、MDA含量的检测 采用硫代巴比妥酸法测定血清中MDA 的含量;采用黄嘌呤氧化酶法测SOD含量;采用二硫代二硝基甲苯胺法测定血中GSH-Px含量。操作步骤严格按照说明书进行。
1.7 统计学方法 应用SPSS17.0软件进行单因素方差分析、LSD-t检验。
2 结 果
2.1 各组大鼠形态学比较 Sham组可见心肌细胞排列整齐,各结构完整,细胞核均匀分布;I/R组部分心肌细胞坏死,细胞之间界限欠清,细胞水肿,排列紊乱;GBE组细胞小部分结构模糊,细胞界限尚清晰,轻度水肿。见图1。I/R组、GBE组大鼠心肌梗死面积〔(22.130 5±2.023 9)%、(13.721 1±0.766 2)%〕,显著高于Sham组(0%),且GBE组低于I/R组(均P<0.01)。
2.2 各组大鼠血清SOD、MDA及GSH-Px水平比较 与Sham组比较,I/R组SOD活力及GSH-Px含量显著降低,MDA水平显著增高,GBE组与I/R组比较,血清SOD、GSH-Px含量升高,MDA水平降低(均P<0.05);GBE与Sham组相比较差异均无统计学意义(P>0.05)。见表1。
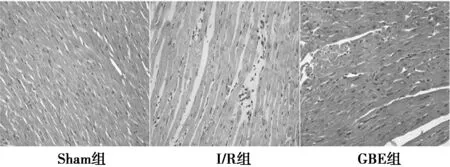
图1 各组大鼠心肌组织组织形态学比较(×400)
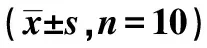
表1 各组大鼠血清SOD、MDA和 GSH-Px水平比较
与Sham组比较:1)P<0.05;与I/R组比较:2)P<0.05
3 讨 论
目前关于MIRI的病理生理及机制较为复杂,包括氧自由基机制、炎症反应浸润、能量代谢障碍、微血管通透性机制等。近来微血管通透机制方面成为研究热点,成为预防MIRI损伤性疾病新的治疗方向。
最近研究发现,在MIRI过程,氧化应激是心脏内皮细胞障碍的主要原因,氧化应激引起活性氧簇(ROS)增加,从而导致脂质过氧化反应,氧化蛋白质失活及DNA损伤等〔5〕,同时亦可刺激下游信号通路诱导各种生物效应,如促发凋亡、促发炎症反应等。既往体外实验研究证实〔6〕,细胞低氧复氧后也有发生这一病理生理反应。人们已经发现,由ROS诱导的DNA损伤可以通过增加自身磷酸化激活毛细血管扩张共济失调症突变蛋白(ATM)激酶〔1〕,反过来触发的磷酸化启动后磷酸化p53基质蛋白〔7~9〕。从而抑制氧化应激的损伤。缺血再灌注激活了ROS相关的酶,从而激活腺嘌呤——次黄嘌呤代谢途径,增加氧自由基的病理产生含量异常。而氧自由基对组成生物膜的不饱和脂肪酸具有很高的亲和力,从而激发链式脂质过氧化反应,细胞膜性结构等发生脂类过氧化反应,引起线粒体酶活性降低,而细胞膜、溶酶体膜的通透性升高,引起细胞膨胀破裂。当这一反应遇到抗氧化物时,损伤效应就会终止。MDA是一种在缺血再灌注损伤病理过程中产生的脂质过氧化物,其含量高低可直接反映机体内脂质过氧化程度。而SOD是清除氧自由基的最主要物质,其高低可反映机体清除氧自由基的能力。GSH-Px可以清除由活性氧和·OH诱发的脂质过氧化物,保护细胞膜结构和功能的完整性,其活力大小可以反映机体氧化还原反应。GBE是一种草药补充剂,可明显改善外周及脑的微循环,甚至在MIRI过程中,具有明显的保护作用。目前标准化的GBE为银杏761,其成分包括大约24%黄酮苷、6%萜烯内酯和其他化学物质〔3〕。其主要生物活性组件的主要药理作用包括清除氧自由基、抑制血小板聚集和因子和保护微血管内皮细胞〔10~12〕。但是GBE是否对大鼠MIRI具有保护作用及其对机体抗氧化反应目前尚未研究。本研究结果表明,GBE 761对大鼠MIRI具有明显保护作用。血清学结果表明,GBE可明显抑制大鼠体内的氧化应激反应,并提高大鼠血清中SOD活性。
1 Bencokova Z,Kaufmann MR,Pires IM,etal.ATM activation and signaling under hypoxic conditions〔J〕.Mol Cell Biol,2009;29(2):526-37.
2 Ribatti D,Nico B,Vacca A,etal.Endothelial cell heterogeneity and organ specificity〔J〕.J Hematother Stem Cell Res,2002;11(1):81-90.
3 〔No authors listed〕.EGb 761:ginkgo biloba extract,Ginkor〔J〕.Drugs,2003;4(3):188-93.
4 Gerritsen ME.Functional heterogeneity of vascular endothelial cells〔J〕.Biochem Pharmacol,1987;36(17):2701-11.
5 Holt RR,Actis-Goretta L,Momma TY,etal.Dietary flavanols and platelet reactivity〔J〕.J Cardiovasc Pharmacol,2006;47(2):S187-96.
6 Kawano H,Hayashida T,Ohtani H,etal.Histopathological findings of the no-reflow 309phenomenon following coronary intervention for acute coronary syndrome〔J〕.Int Heart J,2005;46(2):327-32.
7 Makovski A,Yaffe E,Shpungin S,etal.Down-regulation of Fer induces ROS levels accompanied by ATM and p53 activation in colon carcinoma cells〔J〕.Cell Signal,2012;24(7):1369-74.
8 Maulik SK,Kumari R,Maulik M,etal.Effect of flavone in a canine model of myocardial stunning〔J〕.Indian J Exp Biol,1999;37(10):965-70.
9 McDouall RM,Batten P,McCormack A,etal.MHC class Ⅱ expression on human heart microvascular endothelial cells:exquisite sensitivity to interferon-gamma and natural killer cells〔J〕.Transplantation,1997;64(8):1175-80.
10 Miyashita T,Reed JC.Tumor suppressor p53 is a direct transcriptional activator of the human bax gene〔J〕.Cell,1995;80(2):293-9.
11 Ning XH,Chi EY,Buroker NE,etal.Moderate hypothermia (30 degrees C) maintains myocardial integrity and modifies response of cell survival proteins after reperfusion〔J〕.Am J Physiol Heart Circ Physiol,2007;293(4):H2119-28.
12 Olmez I,Ozyurt H.Reactive oxygen species and ischemic cerebrovascular disease〔J〕.Neurochem Int,2012;60(2):208-12.
〔2017-04-11修回〕
(编辑 袁左鸣/滕欣航)
吴黎明(1956-),男,主任医师,硕士生导师,主要从事心脏内科疾病研究。
鄢晓平(1972-),女,副主任医师,主要从事临床医学研究。
R54
A
1005-9202(2017)13-3177-03;
10.3969/j.issn.1005-9202.2017.13.023

