微小核糖核酸592调控神经胶质瘤细胞株U251细胞凋亡
陈照亮刘红杨会利高玉凯张娟吉文玉
·论著·
微小核糖核酸592调控神经胶质瘤细胞株U251细胞凋亡
陈照亮*○☆刘红*杨会利*高玉凯*张娟*吉文玉△
目的研究微小核糖核酸592(miR-592)对神经胶质瘤细胞株U251凋亡的影响。方法首先通过定量聚合酶链反应分析miR-592在神经胶质瘤组织和癌旁组织中的表达变化;随后向U251细胞转染miR-592的拟合物,并通过流式细胞技术分析miR-592过表达对U251细胞凋亡的影响;通过生物信息学分析,找到miR-592的潜在靶分子,并通过荧光素酶双报告实验以及蛋白免疫印迹法等进行验证;进一步,转染U251细胞Runx2的下调siRNA,绘制细胞的生长曲线,并对U251细胞的凋亡进行分析。结果定量PCR结果分析发现,miR-592在肿瘤组织中明显低表达(t=2.752,P=0.013);miR-592过表达能明显抑制U251细胞的生长,与对照组比较,培养36 h、48 h后存在统计学差异(t=2.127,P=0.031;t=2.284,P=0.026);流式细胞分析结果显示,miR-592显著促进U251细胞凋亡:对照组晚期凋亡率为7.2%±0.68%,而转染miR-592组晚期凋亡率为17.47%±1.45%,存在统计学差异(t= 3.294,P=0.007);荧光素酶双报告实验以及蛋白免疫印迹法实验结果发现miR-592直接靶向Runx2的3’-UTR来抑制Runx2蛋白的水平;检测下调Runx2对U251细胞生长的影响,结果显示转染了Runx2 siRNA的细胞生长明显比对照组低(t=3.124,P=0.011),流式细胞技术对周期的检测显示,Runx2下调表达上调U251细胞的凋亡率。通过绘制肿瘤生长曲线,发现miR-592过表达明显抑制肿瘤的生长。同时,Runx2的下调表达也明显抑制肿瘤的生长。结论miR-592通过直接靶向Runx2来诱导神经胶质瘤细胞凋亡,进而抑制细胞的生长。
神经胶质瘤U251 miR-592凋亡Runx2
神经胶质瘤是最为常见的原发性中枢神经系统肿瘤。50%~60%的脑部恶性肿瘤都是胶质瘤[1]。对神经胶质瘤现有的治疗策略主要是手术治疗、放射治疗、化学治疗或其他方式的辅助性治疗[2-4]。然而,高转移率和对放化疗的耐受性使得胶质瘤的预后效果都很差[5-7]。我们的研究发现,微小核糖核酸592(miR-592)在胶质瘤组织中相对于癌旁组织明显表达降低。为了进一步探究miR-592在胶质瘤细胞中作用机制,我们应用miR-592 mimics上调miR-592在胶质瘤细胞中U251中表达水平,研究其对胶质瘤细胞生长和凋亡的影响,并进一步通过实验寻找miR-592的靶分子。
1 材料与方法
1.1 细胞培养人胶质瘤细胞U251(新疆医科大学第一附属医院中心实验室自有)以10%的胎牛血清RPMI-1640(美国Gibco公司)或DMEM培养基,在37℃、5%CO2、相对湿度为90%的培养箱中培养。用0.25%的胰酶消化,每两天换液传代。
1.2 细胞增殖实验(噻唑蓝)以每孔10 000个细胞接种于96孔板中,每组设3个复孔。细胞贴壁后,向细胞转染100 nmol/L的miR-592mimics或者Runx2的siRNA(上海吉凯基因公司),以随机序列的mimic作为实验对照,Runx2的siRNA序列:5′-GCACGCUAUUAAAUCCAAATT-3′。12 h后进行第一次检测:每孔加入5g/L的噻唑蓝液(美国Sigma公司)20μL,继续培养到4 h后,去掉培养基,加入DMSO(美国Sigma公司)150μL,用酶标仪在490 nm检测吸光度。分别于转染后12 h、24 h、36 h和48 h测定吸光度(A)值。根据测得的A值绘制生长曲线。
1.3 RNA提取及实时定量聚合酶链反应(qRTPCR)分析miR-592在神经胶质瘤组织和癌旁组织中的表达变化。所有样本用液氮在研钵中研磨,用TRzol(美国Invitrogen公司)提取总RNA,并通过酶标仪测RNA浓度,A260/A280为1.8~2.0。将RNA样本稀释成2 ng/μL,按照说明书配置成15μL的逆转录体系进行逆转。取其中2μL作为模板配置成20μL体系进行定量PCR验证。反应条件为95℃10min预变性,95℃15 s→60℃30 s进行40个循环,反应结束后得到各个标本和内参GAPDH的Ct值。计算公式:ΔCt=Ct-CtGAPDH,ΔΔCt=ΔCt(T)-ΔCt(N),相对表达计算公式为2-ΔΔCt。定量引物均购自QIAGEN公司,序列如下:Runx2上游引物5′-GACCAGTCTTACCCCTCCTACC-3′, Runx2下游引物5′-CTGCCTGGCTCTTCTTACTGAG-3′;GAPDH上游引物5′-GAGAGACCCCACTTGCTGCCA-3′,GAPDH下游引物5′-CTCACACTGCCCCTCCCTGGT-3′。
1.4 流式细胞技术检测细胞凋亡率以每孔10 000个细胞接种于96孔板中,每组设3个复孔。向细胞转染100 nmol/L的miR-592mimics或100 nmol/L的Runx2 siRNA,以随机的mimic作为实验对照,序列如前所述。48 h后,用胰酶消化制成单细胞悬液,PBS洗涤3次。按说明书操作进行PI/Annexin V染色细胞,避光染色20min,流式细胞仪检测各组细胞的凋亡率,实验重复3次,每次3个复孔。细胞凋亡率分别测定早期凋亡率及晚期凋亡率,早期凋亡细胞普遍有细胞膜磷脂酰丝氨酸(PS)外翻现象,晚期凋亡细胞胞膜完整性遭到破坏,流式细胞术检测结果呈现3个细胞群,即正常细胞(双阴性)、早期凋亡细胞(Annexin V阳性,PI阳性)和晚期细胞(双阳性)。
1.5 蛋白免疫印迹实验加入200μLRIPA缓冲液冰上20min裂解细胞。加入50μL 5×SDS-PAGE上样缓冲液,煮沸10min后进行SDS-PAGE。转膜,10%BSA溶液封闭,加入稀释好的抗体工作液,4℃过夜孵育,TBST洗膜3次。再加入HRP标记的抗人IgG二抗,TBST洗膜3次后,加上化学发光底物,于暗室内压片、曝光、显影和定影。
1.6 荧光素酶双报告实验以每孔2.0×105个293T细胞接种于24孔板。培养24 h后,用lipofectamine2000将报告质粒和miR-592过表达质粒共转染于293T细胞,并同步共转入pRL-TK作为对照质粒,用量分别为:报告质粒0.4μg;miR-592过表达质粒0.4μg;pRL-TK质粒0.05μg。转染后6 h换完全培养基。48 h后去上清,用PBS洗去未去干净的上清,随后用lysis buffer冰上裂解细胞,收集上清用于荧光素酶活性检测(试剂盒购自于Promega)。计算方法为:荧光素酶活性=萤火虫荧光素酶读值/海肾荧光读值。
1.7 裸鼠肿瘤模型建立购买8周龄的BALB/c (nu/nu)裸鼠(上海斯莱克),随机分成3组,每组5只。分别皮下接种miR-592稳定表达的U251细胞、Runx2 siRNA稳定表达的U251细胞(细胞系均由上海吉凯基因公司制备),以正常U251细胞作为实验对照,细胞接种量均为6.0×106/只。于接种后每隔5 d游标卡尺测定肿瘤大小,以1/3×长径×短径2计算肿瘤体积,并于接种后第50天处死小鼠,绘制肿瘤生长曲线。
1.8 统计学方法各组数据均采用SPSS17.0进行统计学处理。连续变量以均值±标准差(±s)表示。两组变量之间的比较采用t检验,检验水准α=0.05。
2 结果
2.1 m iR-592促进U251细胞凋亡PCR结果显示,miR-592在U251中的相对表达明显下降(图1A)。脂质体转染U251细胞后,与对照组(4.73± 0.67)比较,miR-592相对表达量(16.87±2.43)明显升高(t=2.752,P=0.013)(图1B)。miR-592明显抑制U251细胞增殖,与对照组相比,培养36 h、48 h后存在统计学差异(t=2.127,P=0.031;t= 2.284,P=0.026)(图1C)。流式细胞实验显示,miR-592组早期凋亡率(12.94%±1.66%)与对照组(13.71%±0.80%)无统计学差异(t=1.047,P= 0.113);miR-592组晚期凋亡率(17.47%±1.45%)与对照组(7.20%±0.68%)存在统计学差异(t= 3.294,P=0.007),miR-592能显著性上调U251细胞凋亡率(图1D)。
2.2 m iR-592抑制带有Runx2的荧光素酶活性及蛋白水平荧光素酶双报告实验显示,miR-592显著抑制带有Runx2的3’-UTR的荧光素酶的活性(图2A)。定量PCR检测Runx2表达结果显示,与癌旁组织(23.64±4.39)比较Runx2的相对表达在肿瘤组织中(16.31±2.27)明显下调(t=5.647,P= 0.002)。western blot转染miR-592后U251细胞Runx2蛋白的表达结果显示,miR-592抑制Runx2的蛋白水平(图2B)。

图1 mi R-592促进U251细胞凋亡。A:mi R-592在肿瘤和癌旁组织中的表达;B:转染mimi c s后mi R-592的表达水平;C:M TT检测U251细胞生长;D:流式细胞仪检测mi R-592过表达后U251细胞周期。**P<0.05,与对照组比较;##P<0.05,与癌旁组织比较;**P<0.01,与对照组比较
2.3 下调Runx2表达水平抑制U251细胞生长并促进细胞凋亡转染U251细胞后,western blot实验验证Runx2的表达(图3A)。下调Runx2对U251细胞生长的影响结果显示,转染了Runx2 siRNA的细胞生长明显比对照组低(表2)。流式细胞技术对周期的检测显示,Runx2下调表达上调U251细胞的凋亡率,对照组与siRunx2组晚期凋亡率分别为1.58±0.25、4.57±0.36,存在统计学差异(t=3.248,P=0.035)(图3B)。
2.4 m iR-592通过靶向Runx2调控U251的肿瘤的生长建立裸鼠模型,通过绘制肿瘤的生长曲线,发现miR-592过表达明显抑制肿瘤的生长(图4)。同时,Runx2的下调表达也明显抑制肿瘤的生长(图4)。
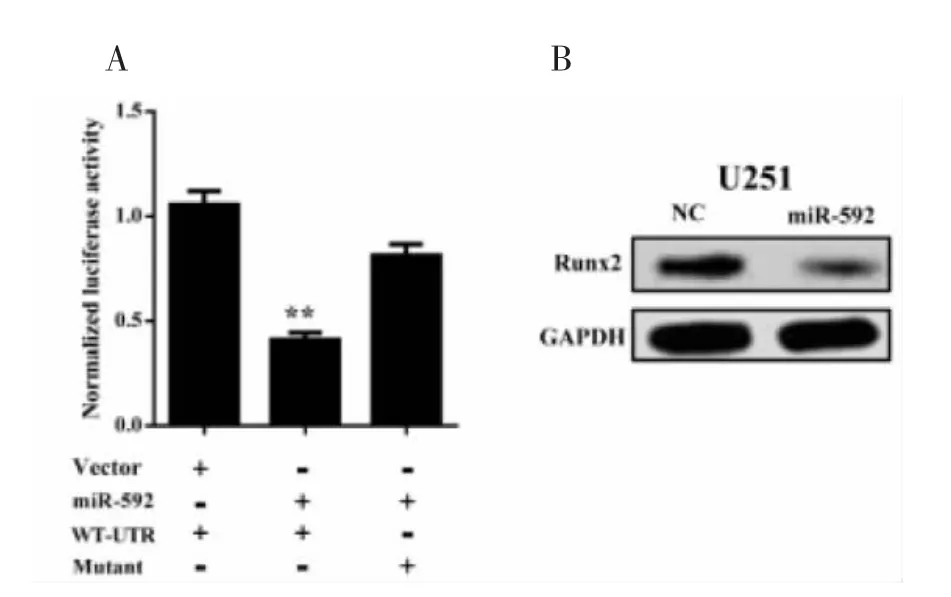
图2 R u n x2是mi R-592在U251细胞中的直接靶蛋白。A:荧光素酶双报告实验;B:R u n x2在转染mi R-592和空白对照组(N C)后U251细胞中的表达。**P<0.01,与对照组比较;##P<0.01,与癌旁组织比较
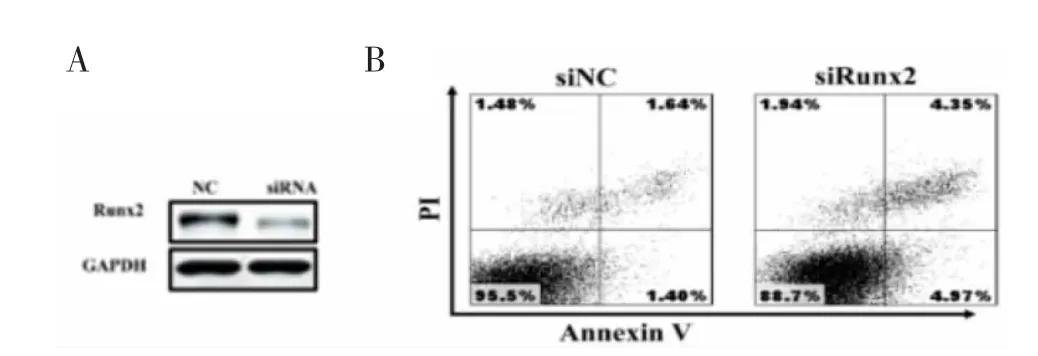
图3 下调R u n x2促进U251细胞凋亡。A:w e s t e r n b lo t验证si R N A下调效率;B:流式细胞仪分析R u n x2下调后细胞凋亡率。**P<0.01,与0 h比较
3 讨论
microRNA是一类长度约为22个碱基的非编码RNA。虽然microRNA在哺乳动物细胞中的总体数量很少,但是它们却调节了大约30%的基因。microRNA通过靶向目的分子的3’-UTR来调节mRNA的水平从而进一步调节蛋白的水平[8-9]。诸多文献报道指出microRNA在肿瘤的发生发展过程中起着各种各样非常重要的作用[10-13]。我们发现,miR-592在神经胶质瘤组织中的表达显著下调。合成miR-592的mimics并转染U251细胞来过表达miR-592,MTT实验结果显示过表达miR-592显著性的抑制细胞生长。流式细胞检测表明,过表达miR-592上调U251细胞的凋亡率。这些结果表明,miR-592在神经胶质瘤细胞中发挥着肿瘤抑制基因的功能。
Runx2是Runt相关转录因子家族的重要成员[14]。它可以形成核心结合因子(CBF)复合物结合到DNA序列上,从而达到对基因表达的调控作用[15]。越来越多的研究表明Runx2在包括胶质瘤在内的多种肿瘤中都有表达。Runx2的高表达能促进肿瘤的生长、转移和浸润[16]。下调Runx2的表达又可以抑制肿瘤的生长和发生发展[17]。这些结果表明Runx2发挥着肿瘤抑制因子的功能。应用荧光素酶双报告实验,发现miR-592能直接和Runx2的UTR结合。而在肿瘤组织中Runx2的表达也明显上调,western blot实验结果也显示过表达miR-592的U251细胞的Runx2的表达明显下调。以上结果表明,Runx2是miR-592在U251细胞中的直接靶分子。

图4 mi R-592靶向R u n x2抑制U251肿瘤的生长
表2 Runx2下调后细胞生长情况±s)

表2 Runx2下调后细胞生长情况±s)
1)经t检验,与对照组比较,P<0.01
组别对照组siRunx2组n33 0 h 0.27±0.09 0.25±0.11 12 h 0.41±0.11 0.37±0.10 24 h 0.50±0.16 0.48±0.13 36 h 1.61±0.21 0.94±0.221)48 h 2.28±0.23 1.46±0.211)
为了进一步研究Runx2是否是miR-592在U251细胞中的功能性靶分子,我们通过siRNA特异性的沉默Runx2的表达。MTT实验结果表明,下调Runx2显著性的抑制U251细胞的生长,其凋亡水平也明显上调。这个结果表明,Runx2是miR-592在U251细胞中的功能性靶蛋白。
综上所述,我们得出以下结论:miR-592通过直接靶向Runx2促进凋亡来抑制U251细胞生长。
[1]SHIPMAN L.Glioma:Tumour cell teamwork[J].Nature reviews Cancer,2016,16(1):2-4.
[2]FURNARIB,FENTON T,Bachoo R M,et al.Malignant astrocytic glioma:genetics,biology,and paths to treatment[J].Genes &Development,2007,21(21):2683-2710.
[3]郝俊海,常永凯,杨军.神经胶质瘤相关长链非编码RNA的研究进展[J].中华神经外科杂志,2016,32(1):94-96.
[4]王伟民.重视神经胶质瘤手术治疗的方法研究[J].中华神经外科杂志,2008,24(4):312-313.
[5]CASTRO M G,LOWENSTEIN P R.Neuro-oncology:The long and winding road--gene therapy for glioma[J].Nature Reviews Neurology,2013,9(11):609-610.
[6]HASHIZUME R,ANDOR N,IHARA Y,et al.Pharmacologic inhibition of histone demethylation as a therapy for pediatric brainstem glioma[J].NatureMedicine,2014,20(12):1394-1396.
[7]REARDON DA,WEN PY.Glioma in 2014:unravelling tumour heterogeneity-implications for therapy[J].Nature Reviews Clinical Oncology,2015,12(2):69-70.
[8]IORIO MV,CROCE CM.MicroRNA dysregulation in cancer: diagnostics,monitoring and therapeutics.A comprehensive review[J].EMBOMolecular Medicine,2012,4(3):143-159.
[9]WANG C,JIB,CHENG B,et al.Neuroprotection ofmicroRNA in neurological disorders(Review)[J].Biomedical Reports,2014, 2(5):611-619.
[10]DADIANIM,BOSSEL BEN-MOSHE N,Paluch-Shimon S,et al.Tumor Evolution Inferred by Patterns ofmicroRNA Expression through the Course of Disease,Therapy,and Recurrence in Breast Cancer[J].Clinical Cancer Research,2016,14(5):132-135.
[11]GONG X,ZHOU W,CHAI Y,et al.MicroRNA-induced cascaded and catalytic self-assembly of DNA nanostructures for enzyme-free and sensitive fluorescence detection ofmicroRNA from tumor cells[J].Chemical Communications,2016,52(12): 2501-2504.
[12]KUNINTY P R,SCHNITTERT J,STORM G,et al.MicroRNA Targeting to Modulate Tumor Microenvironment[J].Frontiers in Oncology,2016,6(3):112-114.
[13]ZHANG L,YANG C S,VAREL X,et al.Altered RNA editing in 3'UTR perturbsmicroRNA-mediated regulation of oncogenes and tumor-suppressors[J].Scientific Reports,2016,6(2):32-34.
[14]VLADIMIROVA V,WAHA A,LUCKERATH K,et al.Runx2 is expressed in human glioma cells and mediates the expression of galectin-3[J].Journal of Neuroscience Research,2008,86(11): 2450-2461.
[15]NIU D F,KONDO T,NAKAZAWA T,et al.Transcription factor Runx2 is a regulator of epithelial-mesenchymal transition and invasion in thyroid carcinomas[J].Laboratory Investigation,2012, 92(8):1181-1190.
[16]TAKAJASHI T.Overexpression of Runx2 and MKP-1 stimulates transdifferentiation of 3T3-L1 preadipocytes into boneforming osteoblasts in vitro[J].Calcified Tissue International, 2011,88(4):336-347.
[17]WANGGW,CHEN B,ZOUR,etal.Codonolactone,a sesquiterpene lactone isolated from Chloranthus henryi Hemsl,inhibits breast cancer cell invasion,migration and metastasis by downregulating the transcriptional activity of Runx2[J].International Journal of Oncology,2014,45(5):1891-1900.
m iR-592 induces apoptotic cell death in human U251 cells.
CHEN Zhaoliang,LIU Hong,YANG Huili,GAO Yukai,ZHANG Juan,JIWenyu.Department of Oncology,Binzhou City Center Hospital,Binzhou 251700.Tel: 0543-5322880.
Objective To investigate the role ofmiR-592 in the Glioma.M ethods We first analyzed the expression ofmiR-592 in Glioma tissues from patients by quantitative PCR.We transfected U251 cells with miR-592 mimics and then detected the growth of cells by MTT assay.We performed dual-luciferase reporter assay and western blot assay to examine whether Runx2 was the direct target ofmiR-592 in U251 cells.In order to test whether Runx2 was the functional target ofmiR-592,we determined the cell growth curve by down-regulating the level of Runx2.Moreover,we also detected the apoptosis of U251 after Runx2 knockdown.Results The expression of miR-592 was significantly reduced in glioma tissues(t=2.752,P=0.013).Over-expressionmiR-592 remarkably increased the apoptotic rate of U251 cells compared with the control group(t=2.127,P=0.031;t=2.284,P=0.026).Flow cytometry analysis showed that MiR-592 significantly promoted apoptotic cell death of U251 cells Apoptosis rate was 7.2%±0.68%in miR-592 group and 17.47%±1.45%in control group(t=3.294,P=0.007).The results of double luciferase assay and Western blot assayshowed thatmiR-592 directly targeted the 3'Runx2 of-UTR to inhibit the level of Runx2 protein.The effect of downregulation of Runx2 on the growth of U251 cells was detected,the results showed that growth was significantly slower in the cells transfected with Runx2 siRNA than in those without Runx2 siRNA(t=3.124,P=0.011).Detection of cycle by flow cytometry showed that runx2 down-regulated the apoptosis rate of U251 cells.Tumor growth curve showed that overexpression ofmiR-592 significantly inhibited tumor growth and the down regulation of Runx2 expresssion also significantly inhibited tumor growth.Conclusion miR-592 suppresses the growth and promotes the apoptotic rate of U251 cells by targeting Runx2.
Glioma U251 miR-592 Apoptotic Runx2
R651
A
2016-11-28)
(责任编辑:甘章平)
10.3969/j.issn.1002-0152.2017.04.009
*滨州市中心医院肿瘤科(滨州251700)
△新疆医科大学第一附属医院儿外一科
○☆通信作者(E-mail:jxjai002@163.com)

