单中心25例隐匿性乳腺癌的临床病理特征及预后分析
蒋莉, 田廷伦, 钟晓蓉, 罗婷, 鄢希
610041成都,四川大学华西医院 肿瘤科一病房(蒋莉,田廷伦, 钟晓蓉, 罗婷, 鄢希)
单中心25例隐匿性乳腺癌的临床病理特征及预后分析
蒋莉, 田廷伦, 钟晓蓉, 罗婷, 鄢希△
610041成都,四川大学华西医院 肿瘤科一病房(蒋莉,田廷伦, 钟晓蓉, 罗婷, 鄢希)
目的: 回顾性分析隐匿性乳腺癌(occult breast cancer,OBC )患者的资料,初步探讨其临床病理特征及影响患者预后的因素。方法:收集四川大学华西医院肿瘤中心2001年10月至2016年6月收治的25例隐匿性乳腺癌的临床病理及治疗资料,采用Kaplan-Meier法计算生存率并绘制生存曲线,log-rank检验及COX回归分别进行单因素及多因素生存分析。结果:本组患者5年总生存率(overall survival,OS)为57.8%。雌激素受体(estrogen receptor,ER)阳性率48%,孕激素受体(progesterone receptor,PR)阳性率52%,人表皮生长因子受体2(human epithelial growth factor receptor 2, HER2)阳性率32%。单因素分析结果显示:PR状态、放疗、内分泌治疗及远处转移是可能影响预后的因素。多因素分析结果显示远处转移是唯一影响预后的因素,降低了患者总生存率(HR=0.131;95%CI,0.020~0.835;P=0.031)。结论:隐匿性乳腺癌发病率低,诊断困难,远处转移是影响预后的重要因素。手术、化疗、放疗、内分泌治疗和靶向治疗的综合治疗是提高隐匿性乳腺癌患者生存率的重要措施。
隐匿性乳腺癌;临床病理;预后
隐匿性乳腺癌(occult breast cancer,OBC )为临床罕见的一种特殊类型乳腺癌,通常以腋窝淋巴结肿大为主要症状,临床查体及常用的影像学诊断方法均难以发现乳腺内原发病灶。隐匿性乳腺癌的概念由Halsted于1907年首次提出,多见于50~55岁女性,其发病率仅占乳腺癌总发病率的0.3%~1.0%[1-2]。因发病率低,相关研究都是基于小样本的单中心回顾性研究。
目前的诊疗经验主要来源于有限的回顾性研究的结果,因此OBC患者的准确诊断及治疗面临不小的挑战,其预后相关因素仍不明确。本研究回顾性分析了我院25例OBC患者的临床资料,初步探讨患者的临床病理特征和预后相关因素。
1 对象与方法
1.1 研究对象
以2001年10月至2016年6月于四川大学华西医院肿瘤中心收治的OBC患者为研究对象,共25例。所有患者均为女性,诊断年龄分布于37~73岁。
1.2 诊断方法
1)经查体、乳腺彩超、钼靶或乳腺CT、MRI、PET-CT等检查均未发现乳腺原发占位性病变或发现乳腺可疑原发灶但术后病理阴性;2)经胃镜、肠镜、全身CT、MRI或PET-CT等检查排除乳腺外其他器官原发肿瘤可能。3)腋窝淋巴结针吸活检或切除活检病理证实为转移性癌,组织形态及免疫组织化学法提示为乳腺来源,和(或)术后病理找到乳腺原发恶性病灶;4)对所有患者均按照《AJCC 癌症分期手册》(第7版)进行TNM 分期[3]。
1.3 随访情况
采用电话或门诊随访,随访截止日期2016年10月,随访间隔时间3个月。随访中有3例患者失访。总生存时间(OS)指从明确诊断至患者死亡或末次随访的时间。终点事件为患者发生死亡。
1.4 统计分析
采用SPSS 20.0 统计学软件进行数据分析。采用Kaplan-Meier法计算生存率并绘制生存曲线,各亚组间生存率的比较采用log-rank检验,临床预后的多因素分析采用Cox 回归分析。P<0.05认为差异有统计学意义。
2 结 果
2.1 临床病理特征
25例OBC患者占我中心同期确诊乳腺癌患者的0.24%(25/10 496)。患者随访时间为4个月~144个月,中位随访时间为45个月,5年OS为57.8%(见图1)。患者中位诊断年龄51岁,其中≤50岁11例(44.0%),>50岁14例(56.0%);平均病程(6.4±9.5)个月;1例(4.0% )患者有肿瘤家族史。腋窝转移淋巴结平均最大径(3.3±1.4)cm;12例(48.0%)患者淋巴结分期为N1,13例(52.0%)≥N2;6例(24.0%)患者确诊时即有远处转移(IV期)。病理确诊之前,8例(32.0%)患者发现乳腺可疑癌灶(乳腺B超4例,乳腺钼靶1例,乳腺MRI 3例),但上述病例经术后病理连续切片证实均未发现乳腺原发癌灶。7例(28.0%)患者行PET/CT,全身未发现可疑原发灶。

图1 25例隐匿性乳腺癌患者总生存(OS)曲线
所有患者均由腋窝淋巴结空芯针穿刺或切除活检病理确诊,组织形态及免疫组织化学法提示为乳腺来源,其中3例(12.0%)患者经术后标本连续病理切片发现乳腺癌原发灶,病理类型均为浸润性癌。25例OBC患者的腋窝淋巴结病检结果显示,22例(88.0%)为腺癌转移,2例(8.0%)为乳腺小叶癌转移,1例(4.0%)为鳞状细胞癌转移。经免疫组化指标ER、PR、HER2、GATA-3、GCDFP-15、CK7、CK20、TTF-1等表达情况判断为乳腺来源。本组患者中,免疫组化检测ER阳性和PR阳性分别为12例(48.0%)、13例(52.0%);HER2 阳性(免疫组化法“+++”或荧光原位杂交(fluorescence in situ hybridization,FISH)基因扩增)的患者8例(32.0%)(见图2)。
2.2 治疗方式
本组25例患者中,24例(96.0%)接受了化疗,化疗方案主要为含紫杉和蒽环类方案及其他方案(主要为紫杉类±铂类方案)。18例(72.0%)接受手术治疗(15例行改良根治术,3例仅行腋窝淋巴结清扫术),7例(28.0%)患者未行手术治疗。9例(36.0%)行胸壁及区域淋巴结放疗,13例(52.0%)行内分泌治疗。HER2阳性8例患者中,37.5%(3/8)的患者行抗HER2的曲妥珠单抗靶向治疗(见表1)。

图2 隐匿性乳腺癌转移淋巴结HE染色及免疫组化染色(×400)结果示例
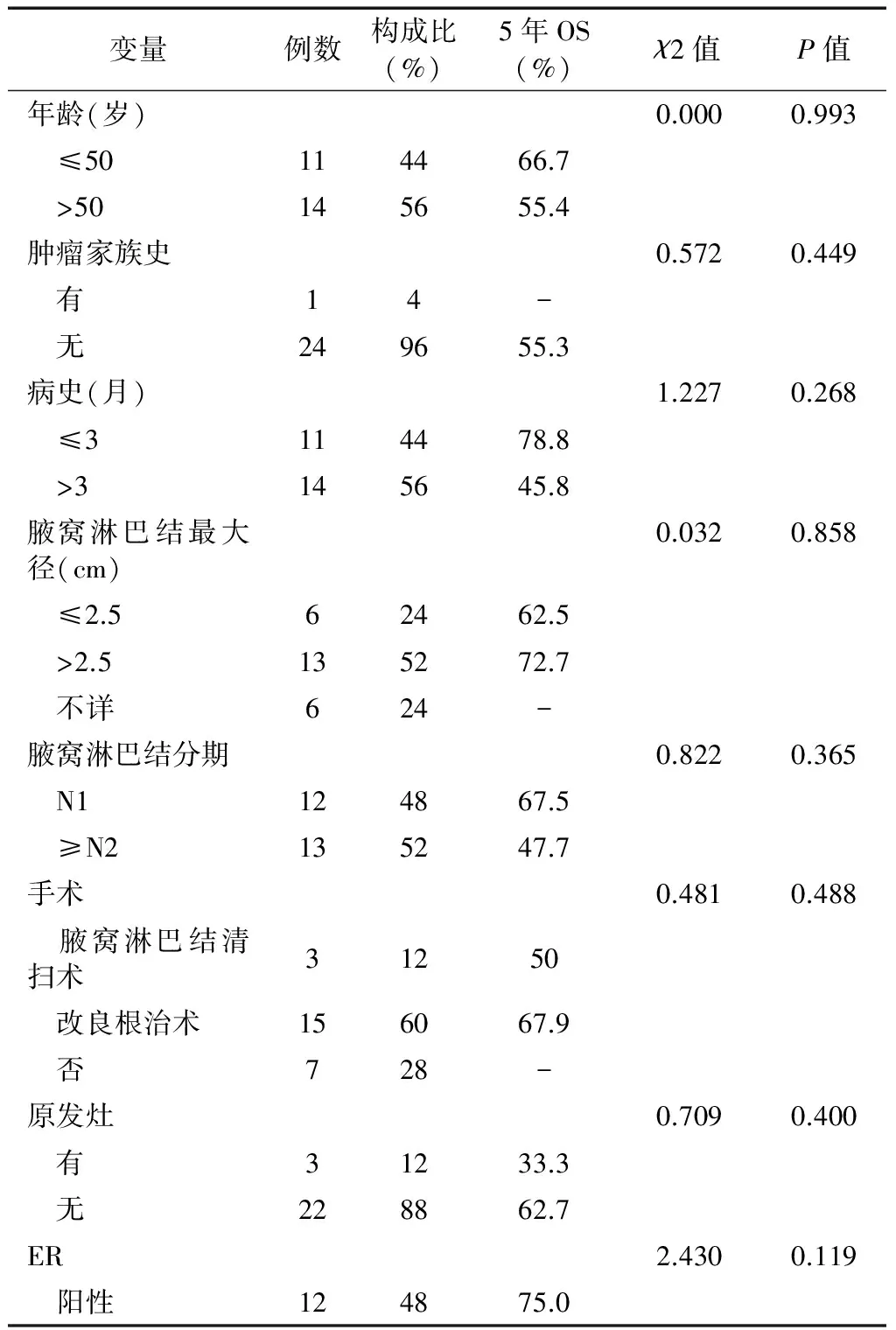
表1 25例隐匿性乳腺癌患者临床病理特征及单因素分析结果
(续右表)
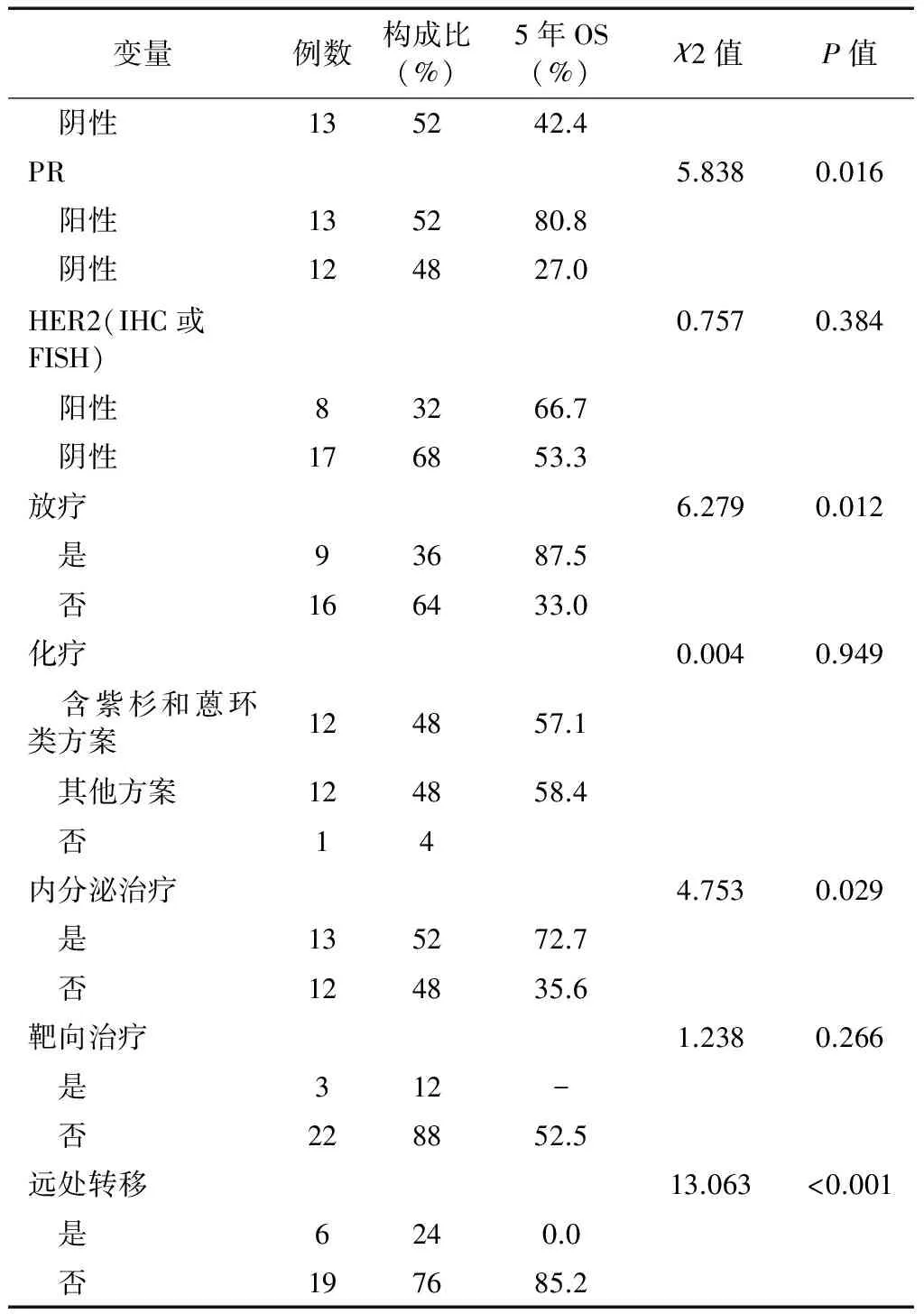
(接左表)
ER:雌激素受体;PR:孕激素受体;HER2:人类表皮生长因子受体2;“-”指由于该亚组患者病史及随访时间均不足5年,无法计算5年总生存率。
2.3 单因素分析
25例患者均纳入统计分析,选择年龄、病史、淋巴结最大径、淋巴结分期、ER、PR及HER2的状态(阳性和阴性)、远处转移(是/否)、化疗方案(含紫杉和蒽环类方案/其他方案)、手术方式(改良根治术、腋窝淋巴结清扫术)、放疗(是/否)、内分泌治疗(是/否)等指标采用log-rank检验进行单因素分析。结果显示:PR表达状态(P=0.016)、放疗(P=0.012)、内分泌治疗(P=0.029)、远处转移(P<0.001)组间5年生存率差异有统计学意义(见表1)。结果提示PR阳性,放疗、内分泌治疗和无远处转移患者预后较好,而年龄、淋巴结最大径、淋巴结分期、ER及HER2的状态、手术方式、化疗方案可能与预后无关。
2.4 多因素分析
从单因素分析中选择P≤0.10的因素采用COX回归进行多因素分析。将远处转移、PR阳性、放疗、内分泌治疗的变量赋值为1;无远处转移、PR阴性、未放疗、未内分泌治疗的变量赋值为0纳入分析。结果显示:是否发生远处转移是唯一对OS影响有统计学意义的因素,发生远处转移降低了患者总生存率(HR=0.131;95%CI,0.020~0.835;P=0.031)(见表2)。
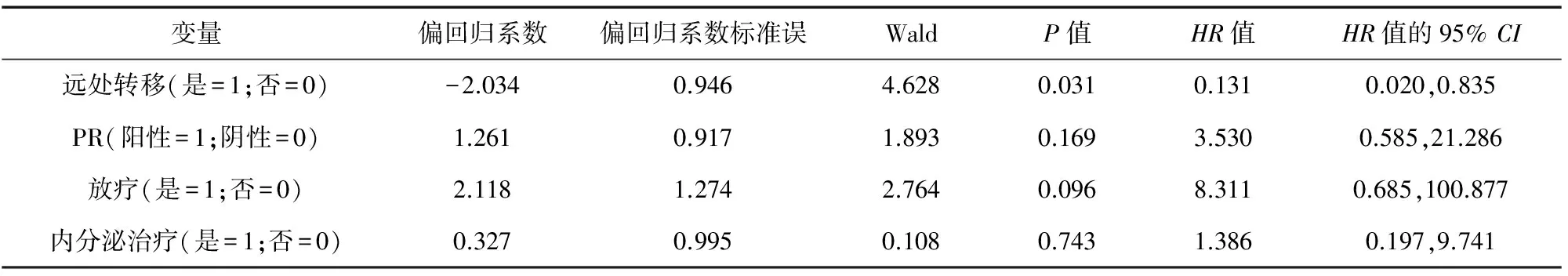
表2 隐匿性乳腺癌多因素分析结果
3 讨 论
隐匿性乳腺癌发病率低,本组报道25例,约占同期乳腺癌的的0.24%,其发病率略低于文献报道。
OBC的起病隐匿,原发病灶微小不易发现,主要以腋窝淋巴结长大为首发症状,早期常难以诊断[4]。乳腺彩超、钼靶和MRI是筛查乳腺原发灶的重要手段[5]。有研究报道MRI可发现75%~86% OBC患者的乳腺原发病灶,具有明显的优越性,有助于患者的诊断及治疗[6-7]。此外,正电子发射体断层摄影术( positron emission tomography,PET) 可显示肿瘤的功能和代谢,而肿瘤的代谢变化通常早于解剖形态的变化,与CT结合也可用于搜寻原发病灶。在常规检查结果难以判断时,特别是在局部晚期或转移性患者中,PET-CT可以有效地协助诊断。尽管有报道采用PET技术成功检出OBC,但是OBC的病灶微小,PET/CT的应用空间仍然受限[8]。本研究有7例患者行PET/CT,均未检出包括乳腺在内的可疑原发病灶。8例患者经乳腺B超、钼靶和MRI发现乳腺可疑癌灶,但是术后病理连续切片均未发现乳腺原发癌灶。国内文献报道乳腺隐匿病灶的病理检出率为50%~56%,国外报告为45%~80%[9]。本研究术后原发灶检出率为12%,远低于文献报道,这可能与OBC原发灶不明或太小,病理连续切片难以发现有关,同时也说明近年来影像学技术和诊断技术提高,原发灶漏诊率较低。本研究25例患者均通过淋巴结空芯针穿刺或切除活检的病理诊断为转移性癌,组织形态结合免疫组化分析ER、PR、HER2等指标判断肿瘤来源。由于OBC原发灶难以在乳腺组织中找到,进行免疫组化分析较困难,因此,腋窝淋巴结的病理情况和免疫组化分析就成为诊治和判断预后的重要依据。
国外报道隐匿性乳腺癌激素受体阳性率为75%左右[10],本研究激素受体阳性率低于该报道,也低于非隐匿性乳腺癌;同时本研究HER2阳性患者32%,高于非隐匿性乳腺癌的25%~30%[11]。本组患者较差的分子分型的比例较高,恶性程度更高,5年OS仅为57.8%,低于非隐匿性乳腺癌,预后相对较差。
OBC患者的治疗在手术方式上目前仍存在争议,据2017年NCCN指南推荐,目前对于分期为T0N1M0患者,可选择改良根治术或腋窝淋巴结清扫术+全乳放疗(加或不加腋窝淋巴结放疗);对于分期为T0N2~N3M0患者,需选择改良根治术,同时根据患者具体情况辅以化疗、靶向治疗或者内分泌治疗[12]。秦宗阁等[13-14]的研究推荐改良根治术联合辅助治疗,可获得较好的预后。同时也有研究报道OBC患者行腋窝淋巴结清扫+全乳放疗,也可取得理想的治疗效果[15-17]。本研究中18例(72%)接受手术治疗,15例行改良根治术,3例行腋窝淋巴结清扫术。单因素分析显示,不同手术方式患者的预后差异不存在统计学意义(P=0.488),与杨雪等[18]的研究结果一致。
化疗和术后放疗是乳腺癌综合治疗的重要组成部分。本研究所有患者中,24例(96%)接受了化疗,9例(36%)行胸壁及区域淋巴结放疗,13例(52%)行内分泌治疗。单因素分析显示,不同类型化疗方案对预后的影响差异没有统计学意义(P=0.949)。放疗能改善局部控制率,是影响乳腺癌患者的预后因素之一。内分泌治疗作为一种全身治疗手段,是影响激素受体阳性乳腺癌患者预后的重要因素[10]。在本研究中,单因素分析显示放疗及内分泌治疗可能与患者预后相关,但进一步多因素分析显示,放疗和内分泌治疗对预后的影响差异没有统计学意义。可能与本研究样本量较少有关,需要扩大样本量进一步分析来证实。
分期是影响乳腺癌患者的重要预后因素,发生远处转移的患者预后差。本研究多因素分析结果显示,远处转移是影响预后的唯一因素,发生远处转移的患者生存期下降,与相关文献报道一致[19]。本研究5年总生存率为57.8%,低于同期非隐匿性乳腺癌[20],这与OBC确诊时已经有腋窝淋巴结转移,临床分期偏晚有关;同时本研究IV期患者比重较大, 影响了患者的总体生存率。
综上,隐匿性乳腺癌发病率低,确诊困难,发生远处转移是影响预后的重要因素。目前对于这类罕见的乳腺癌诊治经验有限,其相关预后因素尚需进一步探索。由于本研究是单中心、回顾性研究,病例数较少,需进一步随访并累积更多病例来明确其临床病理特征及预后。总之,对OBC患者应充分考虑个体情况,结合患者病理分型和分期,给予包括手术、化疗、放疗、内分泌治疗、靶向治疗等多种手段在内的综合治疗。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] 张博.隐匿性乳腺癌的诊断及治疗[J].中国肿瘤临床与康复,2015,22(3):380-381.
[2] 牛昀,范宇,傅西林.隐性乳腺癌的全乳腺次连续大切片检查[J].中华肿瘤杂志,1995,17(4):298-300.
[3] Dawood S,Merajver SD,Viens P,et al.International expert panel on inflammatory breast cancer: consensus statement for standardized diagnosis and treatment[J].Ann Oncol,2011,22(3):515-523.
[4] 彭永强.隐匿性乳腺癌的诊疗进展[J].医学临床研究,2014,31(9):1843-1845.
[5] 黄灵潇.乳腺癌筛查和预防措施研究进展[J].肿瘤预防与治疗,2013,26(1):38-44.
[6] Olson JA,Morris EA,Zee KJV,et al.Magnetic resonance imaging facilitates breast conservation for occult breast cancer.[J].Ann Surg Oncol,2000,7(7):411-415.
[7] Schelfout K,Kersschot E,Van GM,et al.Breast MR imaging in a patient with unilateral axillary lymphadenopathy and unknown primary malignancy[J].Eur Radiol,2003,13(9):2128-2132.
[8] Townsend DW.Combined positron emission tomography-computed tomography:the historical perspective[J].Semin Ultrasound CT,2008,29(4):232-235.
[9] Li T,Mello-Thoms C,Brennan PC.Descriptive epidemiology of breast cancer in China: incidence, mortality, survival and prevalence.[J].Breast Cancer Res Tr,2016,159(3):1-12.
[10]Adnan A,Abdullah I,Atilla S.Breast Disease[M].Switzerland:Springer,2016:353-363.
[11]Rubin I,Yarden Y.The basic biology of HER2[J].Ann Oncol, 2001,12 (suppl_1):S3-8.
[12]Rashmi K,Dorothy AS.NCCN Clinical Practice Guidelines in Oncology:Breast Cancer(version2.2017)[EB/OL].https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf,2017-04-06/2017-05-22.
[13]秦宗阁.隐匿性乳腺癌10例诊治体会[J].医学理论与实践,2014,27(21):2883-2884.
[14]孙云芸,张卫东,杜亚如,等.以腋窝肿块为首发症状的隐性乳腺癌23例报道[J].中国现代医学杂志,2016,26(10):142-144.
[15]Kim Y,Kim H,Cho J,et al.The Results of occult breast carcinoma treated with axillary node dissection only: five cases reports[J].J Breast Dis,2016,4(1):24-27.
[16]He M,Tang LC,Yu KD,et al.Treatment outcomes and unfavorable prognostic factors in patients with occult breast cancer[J].EJSO-Eur J Surg Onc,2012,38(11):1022-1028.
[17]Varadarajan R,Edge SB,Yu J,et al.Prognosis of occult breast carcinoma presenting as isolated axillary nodal metastasis[J].Oncology,2006,71(5-6):456-459.
[18]杨雪,王靖,张业繁,等.隐匿性乳腺癌的治疗选择及预后因素分析[J].中国肿瘤临床,2015,42(10):509-512.
[19]Sohn G,Son BH,Lee SJ,et al.Treatment and survival of patients with occult breast cancer with axillary lymph node metastasis: a nationwide retrospective study[J].J Surg Oncol,2014,110(3):270-274.
[20]Siegel RL,Miller KD,Jemal A.Cancer statistics,2016[J].CA-Cancer J Clin,2016,66(1):10-29.
ClinicopathologicalFeaturesandPrognosisof25OccultBreastCancerCases:ASingleCenterStudy
Jiang Li, Tian Tinglun, Zhong Xiaorong, Luo Ting, Yan Xi△
(OncologyDepartment,WestChinaHospital,SichuanUniversity,Chengdu610041,Sichuan,China)
Objective: Retrospective analysis of occult breast cancer(OBC) patients with a preliminary study of clinical and pathological characteristics as well as prognostic factors.Methods: Twenty-five cases of OBC were collected in the Oncology Center of West China Hospital, Sichuan University, from October 2001 to June 2016.Kaplan-Meier method was used to calculate the survival rate and create survival curve. Log-rank test and COX regression model were separately utilized for univariate and multivariate analysis of overall survival (OS).Results: The 5-year OS was 57.8%. The positive rate of estrogen receptor (ER) was 48%, the progesterone receptor (PR) 52% and the human epithelial growth factor receptor 2 (HER2) 32%. Univariate analysis showed that PR status, radiotherapy, endocrine therapy and distant metastasis were potential prognostic factors. Multivariate analysis showed that the occurrence of distant metastasis was the only statistically significant factor which reduced the overall survival rate(HR=0.131;95%CI,0.020~0.835;P=0.031).Conclusion: The incidence of occult breast cancer is low and the diagnosis is difficult. Distant metastasis is an important prognostic factor. Combination therapy including surgery, chemotherapy, radiotherapy,endocrine therapy and targeted therapy is an important strategy to improve the overall survival of patients with occult breast cancer.
Occult Breast Cancer; Clinicalpathology; Prognosis
•临床经验与技术交流•
2016- 11- 14 [
] 2017- 02- 22
△鄢希,E-mail:852143552@qq.com
R737.9;R730.5
A
10.3969/j.issn.1674- 0904.2017.03.007
Jiang L,Tian TL,Zhong XR, et al. Clinicopathological features and prognosis of 25 occult breast cancer cases:A Single center study [J]. J Cancer Control Treat, 2017,30(3):186-190.[ 蒋莉,田廷伦,钟晓蓉,等. 单中心25例隐匿性乳腺癌的临床病理特征及预后分析 [J].肿瘤预防与治疗,2017,30(3):186-190.]

