新辅助化疗联合同步放化疗对局部晚期鼻咽癌预后影响的Meta分析
杨健筌, 郭文, 文世民, 李德智, 郭翠华, 张欣平, 别俊, 胡欣, 李光明
637000四川 南充,南充市中心医院肿瘤中心(杨健筌, 文世民, 李德智, 郭翠华, 张欣平, 别俊, 胡欣, 李光明);637000四川 南充,四川省南充卫生学校(郭文)
•临床研究•
新辅助化疗联合同步放化疗对局部晚期鼻咽癌预后影响的Meta分析
杨健筌, 郭文, 文世民, 李德智, 郭翠华, 张欣平, 别俊, 胡欣, 李光明△
637000四川 南充,南充市中心医院肿瘤中心(杨健筌, 文世民, 李德智, 郭翠华, 张欣平, 别俊, 胡欣, 李光明);637000四川 南充,四川省南充卫生学校(郭文)
目的: 评价新辅助化疗联合同步放化疗对比同步放化疗治疗局部晚期鼻咽癌的远期疗效。方法: 计算机检索The Cochrane Library(2016年2期)、Pubmed、Embase、中国生物医学文献数据库(CBM)、中国期刊全文数据库(CNKI)、维普中文科技期刊全文数据库(VIP)和万方数据库,对符合纳入标准的研究进行方法学质量评价,采用RevMan5.3进行Meta分析。结果: 共纳入11个研究1 521名患者,结果显示,新辅助化疗联合同步放化疗在5年无远处转移生存率,优于同步放化疗[OR=1.70,95%CI(1.14,2.55),P=0.009],两组的3年生存率,3年无远处转移生存率、3年无进展生存率、3年复发生存率、5年生存率、5年无进展生存率和5年复发生存率无差别(P>0.05)。结论: 现有证据表明,与同步放化疗相比,新辅助化疗联合同步放化疗提高了局部晚期鼻咽癌患者的无远处转移生存率,但未提高患者的总生存率。
鼻咽癌; 新辅助化疗; 同步放化疗; Meta分析
鼻咽癌(nasopharyngeal carcinoma,NPC)对放疗敏感,放射治疗是首选治疗方法[1],针对早期患者,单纯放疗即可取得较好的临床疗效[2],但局部晚期患者的疗效却不理想,其主要原因是局部复发和远处转移[3-8]。近年来,同步放化疗成为局部晚期鼻咽癌的标准治疗方案,但该方案未有效解决远处转移的问题[9],为进一步提高临床疗效,部分学者将新辅助化疗加入其中,荟萃分析显示[10-11]:诱导化疗联合同步放化疗能提高近期疗效,未能提高2年生存率。针对远期疗效,各研究报道不一致,且存在争议,因此,我们采用Meta分析的方法评价现有的研究中新辅助化疗联合同步放化疗在局部晚期鼻咽癌患者中的远期疗效,以期为临床治疗提供参考。
1 资料与方法
1.1 文献纳入及排除标准
研究类型纳入已发表的随机对照试验或回顾性研究 ,语种为中文和英文,无论是否采用盲法均纳入。
研究对象:(1)经病理确诊为鼻咽癌的初治患者;(2)临床分期为局部晚期的患者;(3)无放化疗禁忌症;(4)随访时间≥3年,且随访资料为计数资料;
干预措施观察组为新辅助化疗联合同步放化疗,对照组为同步放化疗。
结局指标:(1)总生存率;(2)无进展生存率;(3)无复发生存率;(4)无远处转移生存率。
排除标准:(1) 远处转移;(2)肝肾功、血常规异常者;(3)曾行手术、放化疗等;(4)无随访时间或随访时间≤3年;(5)随访资料为计量资料;(6)研究数据不完整;(7)经验总结;(8)理论探讨;(9)综述。
1.2 检索策略
计算机检Pubmed、Embase、The Cochrane Library(2016年第2期)、中国刊全文数据库(CNKI)、维普中文科技期刊全文数据库(VIP)、中国生物医学文献数据库(CBM)及万方数据库,检索时限均为从建库至2016年02月。如遇资料不全,通过邮件等方式联系原作者获得。
采用主题词、关键词检索。中文检索词包括鼻咽癌、鼻咽肿瘤、新辅助化疗、诱导化疗、同步放化疗、同期放化疗;英文检索词包括nasopharyngeal carcinoma、 NPC、nasopharyngeal cancer、induction chemotherapy、induced chemotherapy 、neoadjuvant chemotherapy、 NACT 、concurrent chemoradiotherapy、CCRT、sequential chemoradiotherapy、SCRT。以Pubmed为例,其具体检索策略见框1。
#1 nasopharyngeal carcinoma OR NPC OR nasopharyngeal cancer
#2 induction chemotherapy OR induced chemotherapy OR neoadjuvant chemotherapy OR NACT
#3 concurrent chemoradiotherapy OR CCRT、
#4 #1 AND #2 AND #3
框1 Pubmed检索策略
1.3 数据提取与资料提取
由2名研究者(杨健筌和郭文)按照制定的文献纳入、排除标准筛选文献、提取相关数据。如有分歧,则通过第三方(李光明)解决 。数据提取的主要内容:第一作者、发表日期、病例数、干预措施、疗程及结局指标。
1.4 纳入研究的方法学质量评价
随机对照研究的方法学质量评价采用Jadad评分系统进行,评价项目包括[12-13]盲法、分配隐藏 、意向治疗分析、失访情况;回顾性研究的方法学质量评价采用The Newcastal-Ottawa Scale(NOS)进行,评价项目包括[14]研究人群选择、组间可比性、结果测量。
1.5 统计方法
采用 Cochrane协作网提供的RevMan 5.3 版软件完成 。采用卡方检验检验各研究间的异质性, 检验水准定α=0.1。当P>0.10且I2<50%时,说明各研究之间存在同质性,采用固定效应模型分析;当P<0.10且,I2>50%时,各研究之间有较大异质性,则应分析异质性来源,如临床异质性或方法学异质性等,若去除后异质性仍然存在,则采用随机效应模型分析。对潜在的发表偏倚采用“漏斗图”分析。
2 结 果
2.1 文献检索结果
根据确定的检索策略进行文献检索,共检出文献1 449篇,排除研究对象不符合、干预措施不符、排除综述、非随机对照试验、随访资料不符合等。最终筛选出可能符合制定的纳入标准的文章11篇,其中,许婷婷等[15]将研究分为3组:同步放化疗、新辅助化疗联合同步放化疗、同步放化疗联合辅助化疗,我们选取前两组纳入研究;周琦超等[16]将研究分为四组:单纯放疗、同步放化疗、新辅助化疗(PF方案)联合同步放化疗、新辅助化疗(TC方案)联合和同步放化疗,我们选取后两组分别与同步放化疗组比较,分别定义为周琦超(A)和周琦超(B);何坊等[17]将研究分为三组:单纯放疗、同步放化疗、新辅助+同步放化疗,我们选取后两组作为对照而纳入研究。文献筛选流程及结果见图1。
2.2 纳入研究的基本特征及方法学文献质量评价
纳入研究的基本特征及方法学文献质量评价详见表1、2。

图1 文献筛选流程

表1 回顾性对照研究的基本特征
注:T:实验组;C:对照组;①总生存率;②局部无进展生存率;③无复发生存率;④无远程转移生存率;DDP:顺铂;5-FU:氟尿嘧啶;PTX:紫杉醇;CBP:卡铂
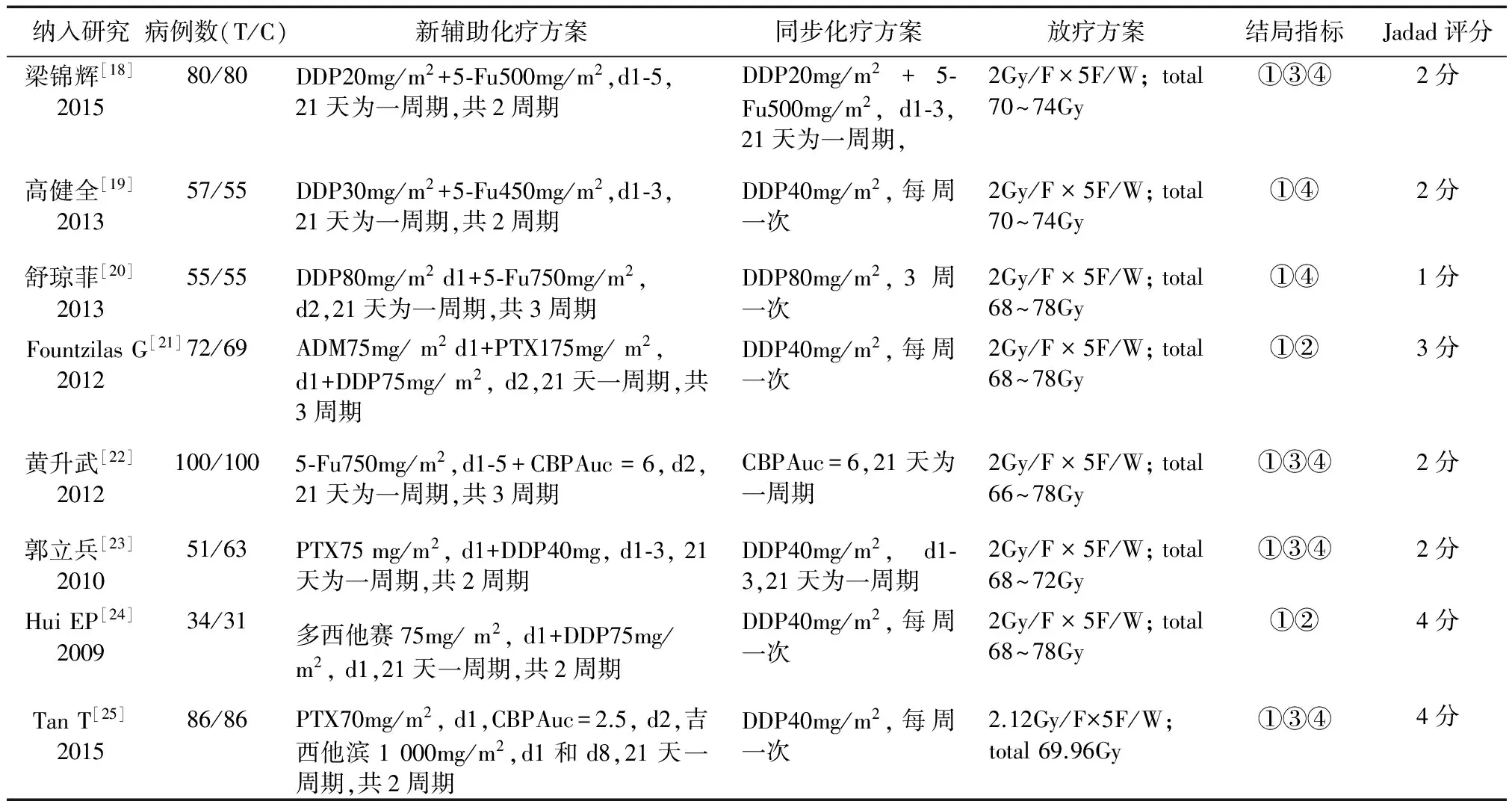
表2 随机对照性对照研究的基本特征
注:T:实验组;C:对照组;①总生存率;②局部无进展生存率;③无复发生存率;④无远程转移生存率;DDP:顺铂;5-Fu:氟尿嘧啶;ADM:表柔比星;PTX:紫杉醇;CBP:卡铂。

图2 两组3年预后观察指标比较的Meta分析
2.3 Meta分析结果
2.3.1 3年生存率 7个研究[19-25]共计906名患者报道了3年总生存率,各研究间无统计学异质性(P=0.31,I2=16%),采用固定效应模型分析,结果显示,两组在3年总生存率方面差异无统计学意义[OR=1.29,95%CI(0.88,1.89),P=0.18](图2)。
2.3.2 3年无进展生存率 2个研究[21,24]共计206名患者报道了3年无进展生存率,各研究间有统计学异质性(P=0.03.,I2=78%),采用随机效应模型分析,结果显示,两组在3年无进展生存率方面差异无统计学意义[OR=2.26,95%CI(0.49,10.35),P=0.29](图2)。
2.3.3 3年无复发生存率 4个研究[19,20,22,,25]共计594名患者报道了3年无复发生存率,各研究间无统计学异质性(P=0.91,I2=0%),采用固定效应模型分析,结果显示,两组在3年无复发生存率方面差异无统计学意义[OR=1.34,95%CI(0.90,1.99),P=0.15](图2)。
2.3.4 3年无远处转移生存率 4个研究[19,20,22,25]共计4 594名患者报道了3年无远处转移生存率,各研究间无统计学异质性(P=0.98,I2=0%),采用固定效应模型分析,结果显示,两组在3年无远处转移生存率方面差异无统计学意义[OR=1.22,95%CI(0.82,1.82),P=0.33](图2)。
2.3.5 5年生存率 4个研究[15-18]共计615名患者报道了5年生存率,各研究间无统计学异质性(P=0.37,I2=6%),采用固定效应模型分析,结果显示,两组在5年生存率方面差异无统计学意义[OR=1.37,95%CI(0.96,1.96),P=0.08](图3)。

图3 两组5年预后观察指标比较的Meta分析
2.3.6 5年无进展生存率 2个研究[17-18]共计319名患者报道了5年无进展生存率,各研究间无统计学异质性(P=0.25,I2=23%),采用固定效应模型分析,结果显示,两组在5年无进展生存率方面差异无统计学意义[OR=1.53,95%CI(0.95,2.45),P=0.08](图3)。
2.3.7 5年无复发生存率 4个研究[15-18]共计615名患者报道了5年无复发生存率,各研究间无统计学异质性(P=0.46,I2=0%),采用固定效应模型分析,结果显示,两组在5年无复发生存率方面差异无统计学意义[OR=1.32,95%CI(0.81,2.16),P=0.26](图3)。
2.3.8 5年无远处转移生存率 4个研究[15-18]共计615名患者报道了5年无远处转移生存率,各研究间无统计学异质性(P=0.74,I2=0%),采用固定效应模型分析,结果显示,两组在5年无远处转移生存率方面差异有统计学意义[OR=1.70,95%CI(1.14,2.55),P=0.009](图3)。
2.4 敏感性分析
通过逐一剔除单项研究的方法观察该研究对合并效应量的影响。发现剔除某项研究后的合并效应量和未剔除该研究的效应量接近,且结论一致,说明合并的研究结果稳定性较好。
2.5 发表偏倚
基于5年观察指标绘制漏斗图,结果显示(图4)漏斗图对称性可,提示研究结果存在发表偏倚可能性较小。
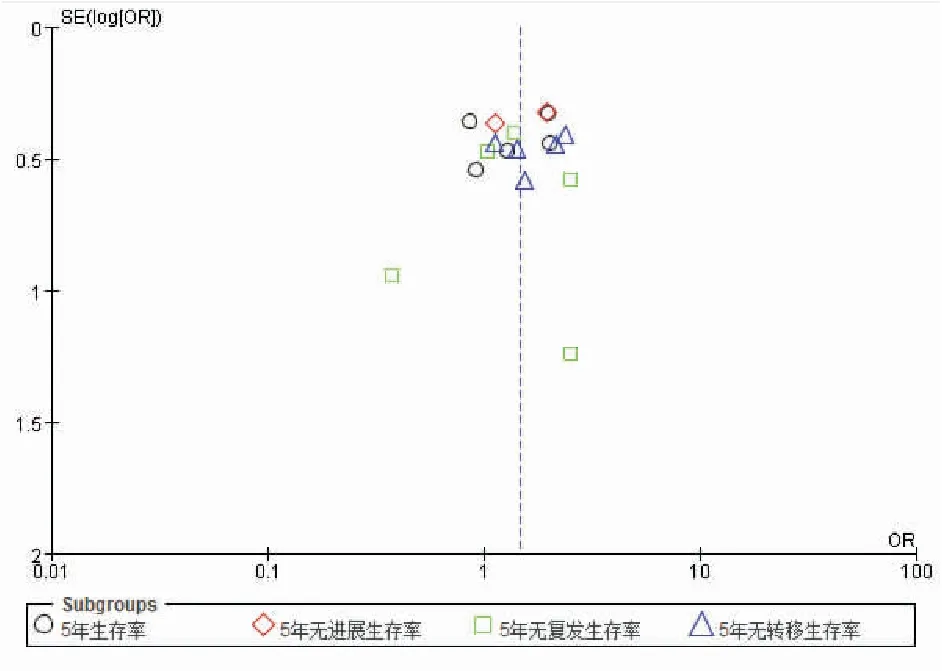
图4 两组5年预后观察指标的漏斗图分析
3 讨 论
鼻咽癌由于特殊的解剖位置使得难以经手术进行根治。放射治疗作为鼻咽癌的主要治疗手段,其单纯放疗的5年生存率约50%,其中局部晚期患者生存率在20%~40%。局部晚期患者治疗失败的主要原因是局部复发和远处转移。为了提高局部晚期鼻咽癌的生存率、降低复发及远处转移,放疗与化疗的结合一直是学者们的研究热点,目前放化联合的治疗模式主要有:新辅助化疗、同步化疗、辅助化疗。经过大量的随机对照试验[26-30]和系统评价[31]确立同步放化疗为局部晚期鼻咽癌的标准治疗。同步放化疗提高了患者的生存率,多是依赖局部控制率的提高,远处转移并未明显减少[8,27]。而 Lee等[27]研究结果显示,同步放化疗联合辅助化疗并未提高鼻咽癌患者的远处转移率和总生存率。Chen等[32]也得到了相似的结果。Chen等[33]进行的荟萃分析显示,与同步放化疗相比,同步放化疗联合辅助化疗未能提高局部晚期患者的生存率 。既然同步放化疗后使用化疗(即辅助化疗)未能提高患者的生存率,那么在同步放化疗之前使用化疗(即新辅助化疗)能否使局部晚期鼻咽癌患者生存获益成为研究的热点。荟萃分析显示[10,11,34],新辅助化疗联合同步放化疗并未提高患者的2年、3年生存率,同时毒副反应较同步放化疗增加,主要是骨髓抑制和胃肠道反应。但既往的Meta分析缺乏更长时间的观察指标,同时有新的研究结果报道,故本研究着重评价新辅助化疗联合同步放化疗的3年及3年以上的临床疗效。
有学者认为,新辅助化疗能较早地杀灭亚临床转移床灶,进一步减少远处转移的发生率,同时化疗后的肿瘤体积缩小,肿瘤靶区减小,故在同期放化疗基础上加入新辅助化疗理论上可进一步提高中晚期鼻咽癌的治疗效果,但同时可能带来毒副反应的显著增加[35]。但在本研究中,对国内外的11个研究进行Meta分析,结果显示,与同步放化疗相比,新辅助联合同步放化疗未能提高局部晚期鼻咽癌患者的生存率。可能的原因:1、各研究的化疗方案、剂量及化疗周期不一致[25,36],双药还是三药联合?是2周期还是3周期?本研究所纳入的文献中有2周期,也有3周期,有学者认为[37]鼻咽癌的新辅助化疗至少是3周期,究竟何种方案、剂量、疗程是新辅助化疗的最佳选择,还需继续深入研究;2、随着放疗开始时间的推迟,肿瘤细胞加速再增殖?3、化疗不良反应所致的放疗耐受性降低[38]?4、肿瘤靶区的勾画,放疗计划中GTV是按照新辅助化疗前还是化疗后?国外的共识是[39],肿瘤靶区(gross tumor volume,GTV)是按照新辅助化疗前进行勾画,但国内的学者[40]按化疗后肿瘤勾画GTV使高剂量区体积减少,同时具有较好的近期治疗效果,但缺乏长期疗效的观察。
本研究的局限性:①所纳入的文章质量参差不齐,在纳入的11篇文献中,3篇文献[15-17]为回顾性分析;②纳入的11 篇文献未提及是否对研究人员 、受试者及结果测量人员设盲 ,可能存在实施偏倚风险;③纳入研究的具体化疗方案不全相同,这可能会影Meta分析结果的可靠性。
综上所述,现有的证据表明:新辅助化疗联合同步放化疗治疗提高了局部晚期鼻咽癌患者的5年无转移生存率,但未提高患者的总生存率。上述结论尚需更多的随机对照研究、更长的随访等来支持,为临床治疗提供可靠的依据。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] Ho FC, Tham IW, Earnest A, et al. Patterns of regional lymph node Metastasis of nasopharyngeal carcinoma: a Meta-analysis of clinical evidence[J]. BMC Cancer,2012, 21(12):98-108.
[2] Chua DT, Sham JS, Kwong DL, et al. Treatment outcome after radiotherapy alone for patients with Stage I-II nasopharyngeal carcinoma[J]. Cancer,2003,98(1):74-80.
[3] Lee AW, Sze WM, Au JS, et al. Treatment results for nasopharyngeal carcinoma in the modern era: the Hong Kong experience[J]. Int J Radiat Oncol Biol Phys,2005,61(4):1107-1116.
[4] Le QT, Tate D, Koong A, et al. Improved local control with stereotactic radiosurgical boost in patients with nasopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys,2003,56(4):1046-1054.
[5] Chow E, Payne D, O’Sullivan B, et al. Radiotherapy alone in patients with advanced nasopharyngeal cancer: comparison with an intergroup study. Is combined modality treatment really necessary?[J]. Radiother Oncol,2002,63(3):269-274.
[6] Lee N, Xia P, Quivey JM, et al. Intensity-modulated radiotherapy in the treatment of nasopharyngeal carcinoma: an update of the UCSF experience[J]. Int J Radiat Oncol Biol Phys,2002,53(1):12-22.
[7] Chua DT, Sham JS, Wei WI , et al. The predictive value of the 1997 American Joint Committee on cancer stage classification in determining failure patterns in nasopharyngeal carcinoma[J]. Cancer,2001,92(11):2845-2855.
[8] Kong F, Cai BZ, Chen XZ, et al.Prognostic factors for survival of patients with nasopharyngeal carcinoma following conventional fractionation radiotherapy[J]. Exp Ther Med, 2013, 6(1): 57-60.
[9] 韩淑红,于兰,张佩娟,等.局部晚期鼻咽癌诱导化疗后调强放疗同期化疗疗效评价[J].中华放射肿瘤学杂志,2013,22(1):47-51.
[10]林建芳. 新辅助化疗联合同期放化疗对中晚期鼻咽癌疗效及毒性的Meta分析[J]. 现代肿瘤医学,2013(12):2695-2699.
[11]徐媛媛,曾泉,洪苏玲,等.新辅助化疗联合同期放化疗与同期放化疗单独治疗鼻咽癌疗效及安全性的Meta分析[J]. 山东大学耳鼻喉眼学报,2013,4(5):8-14.
[12]Jadad AR, Moore RA, Carroll D, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary?[J]. Control Clin Trials,1996,17(1):1-12.
[13]高颖,吴艺君,曾蕊,等.羊膜在小梁切除术中应用的Meta分析[J].中华实验眼科杂志,2013,31(3):275-281.
[14]曾宪涛,刘慧,陈曦,等.Meta分析系列之四:观察性研究的质量评价工具[J].中国循证心血管医学杂志,2012,8(4):297-299.
[15]许婷婷,胡超苏,王孝深.放化疗中不同化疗方式对N3期鼻咽癌预后影响[J].中华放射肿瘤学杂志,2011,20(3):181-185.
[16]周琦超,罗伟,余湛,等.不同方案化疗结合调强放疗治疗局部晚期鼻咽癌临床病理回顾性分析[J]. 中华肿瘤防治杂志, 2010,17(14):1096-1099.
[17]何妨,罗伟,张群,等.单纯调强放射治疗或结合化疗对局部区域晚期鼻咽癌的疗效观察[J].中华医学杂志,2013,93(29):2292-2295.
[18]梁锦辉,雷章华,邓滨,等.晚期鼻咽癌诱导加同期化放疗与同期化放疗的疗效比较[J]. 现代肿瘤医学,2015,23(3):323-326.
[19]高健全,高天生,董智荣,等.诱导化疗加同期放化疗治疗T3-4N2-3M0期鼻咽癌的前瞻性随机对照研究[J].肿瘤学杂志,2013,19(3):161-165
[20]苏琼菲,彭苗,刘晓清,等.诱导化疗联合同期放化疗与同期放化疗治疗局部晚期鼻咽癌的对比研究[J].吉林医学,2013,34(36):7633.
[21]Fountzilas G, Ciuleanu E, Bobos M, et al. Induction chemotherapy followed by concomitant radiotherapy and weekly cisplatin versus the same concomitant chemoradiotherapy in patients with nasopharyngeal carcinoma: a randomized phase II study conducted by the Hellenic Cooperative Oncology Group (HeCOG) with biomarker evaluation[J]. Ann Oncol,2012,23(2):427-435.
[22]黄升武,邓柑雀,黄广优.诱导化疗序贯同期化放疗治疗局部晚期鼻咽癌[J].中国肿瘤临床,2012,29(11):788-791.
[23]郭立兵,宋维舒.TP方案诱导化疗后同期放化疗在中晚期鼻咽癌中的临床应用[J].广州医药,2010,41(2):9-10.
[24]Hui EP, Ma BB, Leung SF, et al. Randomized phase II trial of concurrent cisplatin-radiotherapy with or without neoadjuvant docetaxel and cisplatin in advanced nasopharyngeal carcinoma[J]. J Clin Oncol,2009,27(2):242-249.
[25]Tan T, Lim W, Fong K, et al. Concurrent chemo-radiation with or without induction gemcitabine, carboplatin, and paclitaxel: a randomized, phase 2/3 trial in locally advanced nasopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys,2015,91(5):952-960.
[26]Chen Y, Liu MZ, Liang SB, et al. Preliminary results of a prospective randomized trial comparing concurrent chemoradiotherapy plus adjuvant chemotherapy with radiotherapy alone in patients with locoregionally advanced nasopharyngeal carcinoma in endemic regions of china[J]. Int J Radiat Oncol Biol Phys,2008,71(5):1356-1364.
[27]Lee AW, Lau WH, Tung SY, et al. Preliminary results of a randomized study on therapeutic gain by concurrent chemotherapy for regionally-advanced nasopharyngeal carcinoma: NPC-9901 Trial by the Hong Kong Nasopharyngeal Cancer Study Group[J]. J Clin Oncol,2005,23(28):6966-6975.
[28]Cooper JS, Ang KK. Concomitant chemotherapy and radiation therapy certainly improves local control[J]. Int J Radiat Oncol Biol Phys,2005,61(1):7-9.
[29]Wee J, Tan EH, Tai BC, et al. Randomized trial of radiotherapy versus concurrent chemoradiotherapy followed by adjuvant chemotherapy in patients with American Joint Committee on Cancer/International Union against cancer stage III and IV nasopharyngeal cancer of the endemic variety[J]. J Clin Oncol,2005,23(27):6730-6738.
[30]Lee AW, Tung SY, Chua DT, et al. Randomized trial of radiotherapy plus concurrent-adjuvant chemotherapy vs radiotherapy alone for regionally advanced nasopharyngeal carcinoma[J]. J Natl Cancer Inst,2010,102(15):1188-1198.
[31]Zhang L, Zhao C, Ghimire B, et al. The role of concurrent chemoradiotherapy in the treatment of locoregionally advanced nasopharyngeal carcinoma among endemic population: a Meta-analysis of the phase III randomized trials[J]. BMC Cancer, 2010,15(10):558-568.
[32]Chen L, Hu CS, Chen XZ, et al. Concurrent chemoradiotherapy plus adjuvant chemotherapy versus concurrent chemoradiotherapy alone in patients with locoregionally advanced nasopharyngeal carcinoma: a phase 3 multicentre randomised controlled trial[J]. Lancet Oncol,2012,13(2):163-171.
[33]Chen YP, Wang ZX, Chen L, et al. A Bayesian network Meta-analysis comparing concurrent chemoradiotherapy followed by adjuvant chemotherapy, concurrent chemoradiotherapy alone and radiotherapy alone in patients with locoregionally advanced nasopharyngeal carcinoma[J]. Ann Oncol,2015,26(1):205-211.
[34]Liang ZG, Zhu XD, Tan AH, et al. Induction chemotherapy followed by concurrent chemoradiotherapy versus concurrent chemoradiotherapy with or without adjuvant chemotherapy for locoregionally advanced nasopharyngeal carcinoma: Meta-analysis of 1,096 patients from 11 randomized controlled trials[J]. Asian Pac J Cancer Prev,2013,14(1):515-521.
[35]Kong L, Hu C, Niu X, et al. Neoadjuvant chemotherapy followed by concurrent chemoradiation for locoregionally advanced nasopharyngeal carcinoma: interim results from 2 prospective phase 2 clinical trials[J]. Cancer,2013,119(23):4111-4118.
[36]Fountzilas G, Ciuleanu E, Bobos M, et al. Induction chemotherapy followed by concomitant radiotherapy and weekly cisplatin versus the same concomitant chemoradiotherapy in patients with nasopharyngeal carcinoma: a randomized phase II study conducted by the Hellenic Cooperative Oncology Group (HeCOG) with biomarker evaluation[J]. Ann Oncol,2012,23(2):427-435.
[37]El-Weshi A, Khafaga Y, Allam A, et al. Neoadjuvant chemotherapy plus conventional radiotherapy or accelerated hyperfractionation in stage III and IV nasopharyngeal carcinoma-a phase II study[J]. Acta Oncol,2001,40(5):574-581.
[38]Davis AJ, Tannock JF. Repopulation of tumour cells between cycles of chemotherapy: a neglected factor[J]. Lancet Oncol,2000,115(1):86-93.
[39]Salama JK, Haddad RI, Kies MS, et al. Clinical practice guidance for radiotherapy planning after induction chemotherapy in locoregionally advanced head-and-neck cancer[J]. Int J Radiat Oncol Biol Phys,2009,75(3):725-733.
[40]黄璐,郎锦义. 局部晚期鼻咽癌综合治疗的现状[J]. 肿瘤预防与治疗,2016,24(2):109-114.
NeoadjuvantChemotherapyfollowedbyConcurrentChemoradiotherapyforthePrognosisofLocallyAdvancedNasopharyngealCarcinoma:AMeta-analysis
Yang Jianquan1, Guo Wen2, Wen Shimin1, Li Dezhi1,Guo Cuihua1, Zhang Xinping1, Bie Jun1, Hu xin1, Li Guangming1△
(1.OncologyCenter,NanchongCentralHospital,Nanchong637000,Sichuan,China; 2.NanchongMedicalSchool,Nanchong637000,Sichuan,China)
Objective: To evaluate the survival of patients with locally advanced nasopharyngeal carcinoma treated with neoadjuvant chemotherapy followed by concurrent chemoradiotherapy compared with concurrent chemoradiotherapy alone.Methods: Seven databases were searched, including the Cochrane Library(Issue 2, 2016), Pubmed, Embase, CBM, CNKI, VIP and Wanfang Database. The methodological quality assessment of eligible researches was conducted according to the Jadad scale and The Newcastal-Ottawa Scale.The Meta-analysis was performed by the Revman 5.3 software.Results: Eleven researches containing 1 521 patients were finally included.The 5-year distant metastasis-free survival of patients treated with neoadjuvant chemotherapy followed by concurrent chemoradiotherapy was significantly higher than that of those treated with concurrent chemoradiotherapy alone[OR=1.70,95%CI(1.14,2.55),P=0.009] .There were no significant difference in 3-year overall survival, 3-year distant metastasis-free survival, 3-year progression-free survival, 3-year recurrence free survival, 5-year overall survival, 5-year progression-free survival and 5-year recurrence free survival (P>0.05) respectively between these two regimens.Conclusion: Current evidence shows that compared with concurrent chemoradiotherapy alone, neoadjuvant chemotherapy followed by concurrent chemoradiotherapy could improve distant metastasis-free survival in locally advanced nasopharyngeal carcinoma, while no difference was found of the total survival between these two regimens.
Nasopharyngeal Carcinoma; Neoadjuvant Chemotherapy; Concurrent Chemoradiotherapy; Meta Analysis
2016- 01- 13 [
] 2016- 09- 09
△李光明,E-mail:ligm9999@163.com
R739.63;R730.53
A
10.3969/j.issn.1674- 0904.2017.03.005
Yang JQ, Guo W, Wen SM, et al.Neoadjuvant chemotherapy followed by concurrent chemoradiotherapy for the prognosis of locally advanced nasopharyngeal carcinoma:A Meta-analysis[J]. J Cancer Control Treat, 2017,30(3):174-181.[杨健筌, 郭文, 文世民, 等. 新辅助化疗联合同步放化疗对局部晚期鼻咽癌预后影响的Meta分析[J].肿瘤预防与治疗,2017,30(3):174-181.]

