鱼类肠道外源乳酸杆菌DNA提取样品前处理优化
张雯

摘 要:优化鱼类肠道外源乳酸杆菌DNA提取的方法。样本匀浆后加入PEG8000(40%)1000rpm离心10min,可以沉淀并去除影响DNA提取质量及抑制Real-timePCR反应的杂质。平板计数结果显示,对比未处理前样品,离心上清保留90%以上的菌液,同时杂质的去除大幅度地降低了样本的背景值。本研究为优化鱼类肠道外源乳酸杆菌定量分析体系提供理论依据。
关键词:DNA提取;前处理;微生物多样性定性定量
目前国内外对肠道乳酸杆菌的定量方法主要有培养法和免培养法。培养法主要采用对肠内容物样本平板计数法,是最原始的计数方法,易操作好掌握,成本低,但耗时长,且只能检测活菌数量。在多种免培养法中,Real-time PCR技术已广泛运用于各个领域的微生物定量中,一般步骤包括样本前处理、DNA提取、PCR计数,该方法最主要的优势为不仅可以计数活菌还可以计数死菌量,大量研究表明,死菌同样具有益生功效,通过特异性引物的设计可以达到绝对定量。
本研究旨在优化肠道外源添加乳酸杆菌定量方法体系,确定针对于鱼类肠道样本前处理的最佳方法,解决快速、准确定量鱼类肠道外源添加乳酸杆菌的计数方法。为以后深入研究菌群代谢提供技术依据。
一、材料与方法
1.材料
(1) 试验动物。
罗非鱼1.5~2.5g(贵州省罗甸罗非鱼养殖场),斑马鱼0.3~0.5g(贵州省都匀市观赏鱼市场)。正式试验进行前,试验动物均在适宜条件下暂养,确保其健康。
(2) 试验菌株。
菌株来源于中国农业科学院饲料研究所水产研究室保存菌株。在MRS培养基中静置37℃培养12 h。
(3) 试剂耗材。
PEG8000,MRS液体培养基,MRS固体培养基(oxide),溶菌酶粉末,溶菌酶缓冲液,5M NaCl,CTAB/NaCl,氯仿,异戊醇,tris饱和酚,乙醇,20×TE缓冲液,10%SDS,蛋白酶K,100μm、40μm细胞过滤器(Biologix,美国),DNA小提试剂盒(Qiagen,德国)。
(4) 主要仪器。
T10匀浆器(IKA,德国),TDZ5-WS 多管架台式离心机(湖南湘仪),SPX-80生化培养箱(宁波江南仪器厂),Gel Doc XR+凝胶成像仪(Bio-rad,美国)等。
2.方法
(1)样本前处理优化。
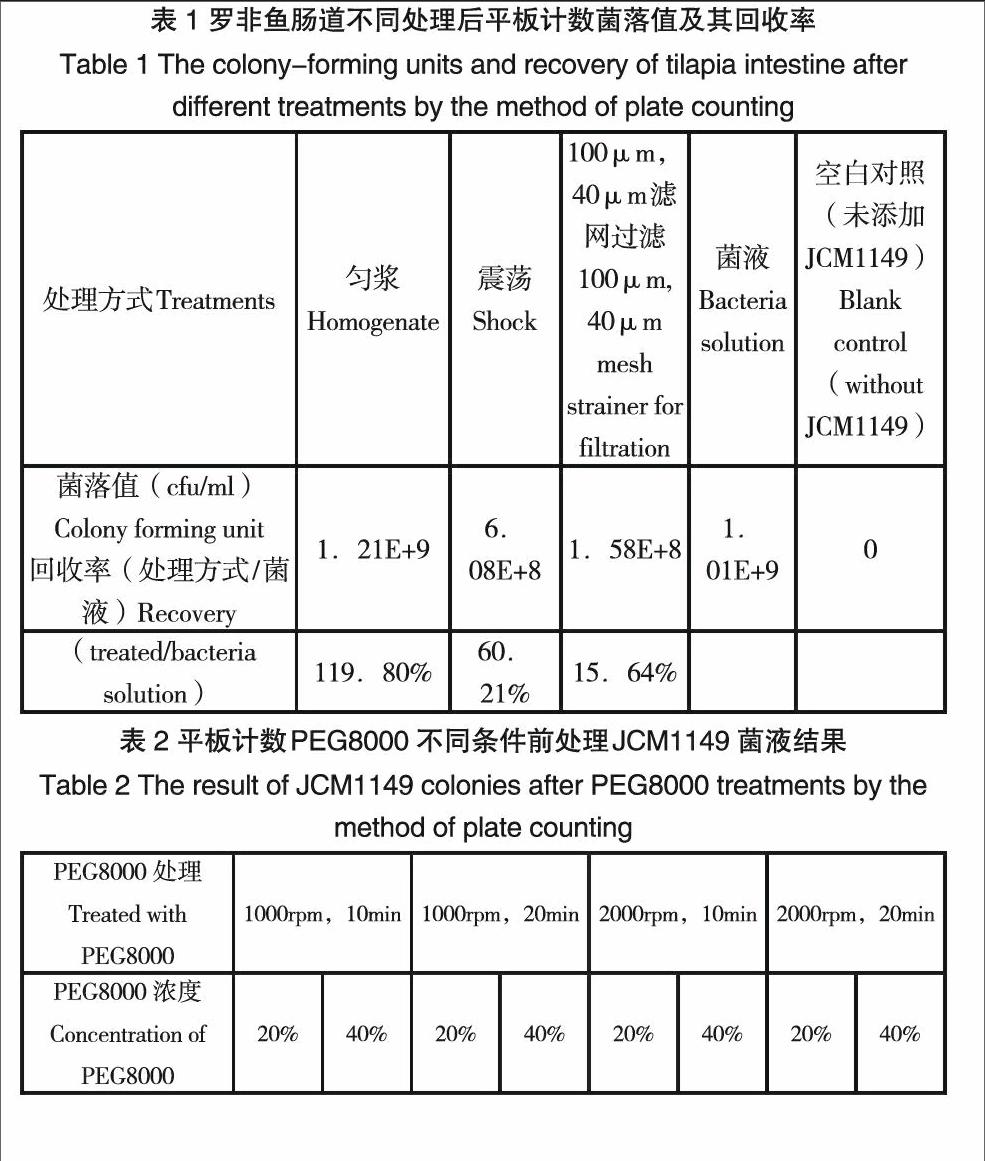
JCM1149为MRS卡纳抗性,卡纳浓度12.5ng/ml。对于方法A和方法B,选取罗非鱼12条,上午10点喂食,下午2点肠道取样。其中11条每条肠道均添加JCM1149菌液1ml。1条罗非鱼肠道直接匀浆稀释涂板。菌液稀释涂板计数。
方法A:震荡静止取上清法对比常规匀浆处理。4条剪开肠道较为强烈的震荡(1200rpm/min),静止,取上清,4条为全肠匀浆,处理后五个重复梯度稀释涂板(卡纳抗性MRS板),剩余样本12000rpm,5min离心,留沉淀于-80℃,用于DNA提取。
方法B:3条匀浆后再加入MRS1ml,100um滤网过滤,滤液经过40um滤网再次过滤,留滤液2ml梯度稀释涂板。涂板后,12000rpm,5min离心,沉淀于-80℃。
方法C:在10ml,20%,40%PEG8000中分别加入2ml菌液,1000rpm离心10min,20min后取上清2ml,上清下1ml,剩余9ml混匀后稀释涂板,梯度稀释,3个重复。计数经过不同浓度的PE8000,不同离心时间前处理后的菌落数,比对未经处理JCM1149纯菌数,计算此方法的回收率。
方法D:將JCM1149菌液,加入9ml灭菌后的MRS中,终体积10ml;取2条罗非鱼肠道,于上一步10ml含JCM1149菌液的PBS中,充分匀浆,混匀。取4个15ml细胞离心管分别加入10ml40%PEG8000,于上层分别缓慢加入2ml匀浆后样本,分别以不同转速(1000rpm,1500rpm),不同时间(10min,20min)离心;取离心后上清,上清下1ml,剩余液体9ml混匀分别梯度稀释,3个重复,涂板计数;JCM1149原液梯度稀释涂板计数。涂板稀释后剩余样本均12000rpm,5min离心,留沉淀于-80℃,用于DNA提取。
二、结果与分析
1.样本前处理优化结果
不同方法前处理罗非鱼肠道,比较回收率,可见震荡静止取上清方法获取的目的菌约为原始匀浆方法的50%,而100μm,40μm滤网过滤只占添加菌液的15.64%(表1)。当PEG80000浓度是40%,且离心时间为1000rpm,10min时JCM1149菌液回收率最高,高达91.04%(表2),进一步摸索对于罗非鱼肠道PEG8000前处理的最佳离心转速和时间,结果当PEG80000浓度是40%,且离心时间为1000rpm,10min时回收率最高(表3),这与之前试验结果相符,且PEG8000处理,可沉淀大量杂质(图1)。因此,后面试验均使用40%PEG8000,1000rpm,10min离心作为DNA提取前处理样品。
三、讨论
罗非鱼属于杂食性,肠道菌群多样化(Saravanan and Geurden et al. 2012),匀浆方式前处理肠道样本回收率最高,且大于100%,分析是复杂的肠道菌群结构,含有部分适应该浓度卡纳抗性的菌群所致。而震荡取上清方法,对于沉淀的时间较难把握,过短则不能沉淀大量杂质,过长则使大量细菌沉淀,降低回收率。过滤法,二次过滤,滤网孔径较小,由于杂质的存在,容易堵塞滤孔,所需时间冗长,更换滤网造成更大损失,但扩大滤网孔径,则不能很好的除去杂质。
PEG(polyethylene glycol,聚乙二醇)是一种高分子渗压剂,用于对样本的沉淀,分离纯化作用,可用来沉淀蛋白质等(Matsuda and Waldo et al. 1988)。有研究用PEG处理对云南松种子,研究其对种族发芽及生理生化特性的影响。结果表明, PEG处理种子发芽率、可溶性糖、可溶性蛋白含量均有显著变化(王晓丽与曹子林等, 2012)。不同分子量的PEG聚乙二醇,分子量的大小会影响PEG在粒子上的吸附牢固程度及粒子的相互作用,PEG链长过短,粒子易脱落,过长则使粒子不易脱落(施一鸣与单国荣, 2013)。聚乙二醇沉淀(PEG8000)可以沉淀小球藻病毒FJ-1,最佳使用量为 PEG8000 7%和4%氯化钠,但PEG8000的沉淀效率低于超速离心法(Han and Kang et al. 2000)。免疫学上,对于循环免疫复合物的沉淀,PEG也有好的结果(Herreman and Godeau et al. 1978)。研究疾病时,从血浆中获得的沉淀物用PEG重悬纯化,得到的在PEG中的沉淀物再次重悬,进行后续研究,有很好的纯化作用(Ristol and Gensana et al. 1996)。20%PEG8000浓度过低,不足以阻止含所需样本的MRS层停留在上清,导致目的菌沉入上清以下的部分。
对比纯菌涂板结果,40%PEG8000处理后回收率最高,可以初步确定PEG8000用于样本前处理的可行性,但随着离心转速和离心时间的增长,回收率显著降低,表明离心转速与回收率高低密切相关。为了进一步确定合适的离心时间和离心转速,因此降低增大的离心转速,由2000rpm改为1500rpm,再次验证,结果仍然为1000rpm,10min回收率最高,且1500rpm,20min回收率显著降低。MRS上清于PEG8000分界线不显著,出现弥散现象,结果证明随着离心转速增大和离心时间的增长,使大量目的菌离开含MRS上清,向PEG8000层移动,导致回收率降低。
参考文献:
[1] 任大勇, 曹婧, 章检明, 等. 6种乳酸菌计数方法比较[J]. 农业机械, 2012, 27: 1-4.
[2] 戴方伟, 宋晓明, 周莎桑, 等. 大鼠肠内容物细菌基因组DNA提取方法的比较[J]. 中国实验动物学报, 2011, 19(3): 246-249.
[3] 陈蓓, 黄瑞. 粪便标本中细菌DNA提取方法的比较[J]. 中国血液流变学杂志, 2007, 17(2): 210-212.
[4] 何夙旭, 周志刚, 姚斌, 等. 3 种DNA 提取方法对养殖池塘不同生境菌群PCR-DGGE 分析的影响[J ] . 中国农业科技导报,2009 ,11 (1) :73279.
[5] Matthew Jemielita, Michael J. Taormina, Adam R. Burns, et al. Spatial and Temporal Features of the Growth of a Bacterial Species Colonizing the Zebrafish Gut[J]. RESEARCH ARTICLE, 2014, 5(6): 1-8.

