miR-34a对结肠癌细胞SW480增殖、迁移和侵袭能力的影响及机制探讨
郝小军 王传卓 赵相轩 辛 鹤 刘兆玉
·基础研究·
miR-34a对结肠癌细胞SW480增殖、迁移和侵袭能力的影响及机制探讨
郝小军 王传卓 赵相轩 辛 鹤 刘兆玉
目的 探讨miR-34a对结肠癌细胞株SW480增殖、侵袭和迁移能力的影响及可能的作用机制。方法 将miR-34a过表达慢病毒、空病毒载体转染SW480细胞,未做处理细胞作为空白对照组。Real-time PCR检测各组细胞内miR-34a的表达;CCK8法检测细胞增殖能力;划痕实验、Transwell小室实验检测细胞迁移和侵袭能力;Western blot实验检测细胞内E-cadherin和Vimentin蛋白表达。结果 与空病毒载体组及空白对照组相比,转染组细胞中miR-34a的表达增高,且细胞增殖效率、侵袭和迁移能力降低(P<0.05),miR-34a使E-cadherin蛋白表达增加、Vimentin蛋白表达降低。结论 miR-34a可抑制结肠癌细胞SW480增殖、侵袭和迁移能力,并能影响E-cadherin和Vimentin的表达,miR-34a有望成为干预结肠癌转移和复发的分子靶点。
结直肠癌;miR-34a;EMT;增殖;侵袭
结直肠癌是消化道最常见的恶性肿瘤之一,近年来,其在我国的发病率和死亡率呈上升趋势[1],转移和复发是其预后差的重要原因。miRNA是一类内源性非编码小RNA分子,在转录后水平调控基因的表达,参与众多生理及病理过程。大量研究表明,miRNA在肿瘤发生发展中发挥重要作用,包括调控肿瘤细胞的增殖、凋亡、分化、侵袭和转移等生物学过程[2]。结直肠癌发生转移的分子机制复杂,文献报道上皮-间质转化(Epithelial-mesenchymal transition,EMT)是肿瘤转移的关键步骤之一,机制在于细胞间的黏附性下降,细胞获得更强的运动、侵袭迁移能力[3]。研究表明,相对比正常结肠组织,miR-34a在结肠癌组织中表达下调[4]。但miR-34a在结肠癌转移复发中的作用机制并未研究透彻。miR-34a与EMT相关蛋白上皮钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)研究尚少。本研究拟通过慢病毒转染技术,研究miR-34a的过表达对结肠癌细胞SW480增殖、迁移和侵袭的影响及细胞中EMT相关蛋白表达的变化,探讨可能的作用机制。
1 材料与方法
1.1 细胞与试剂
结肠癌细胞SW480(上海中科院细胞库),RPMI1640培养基、胎牛血清(Gbico公司),miR-34a过表达慢病毒、空载慢病毒(上海吉凯基因公司),Matrigel基质胶、Transwell小室(Corning公司),CCK8试剂(北京碧云天公司),miRNA提取分离、cDNA合成及荧光定量检测试剂盒(北京天根公司),miR-34a和U6引物(上海生工公司),E-cadherin、Vimentin及β-actin抗体(Santa cruz公司)。
1.2 方法
1.2.1 细胞培养 用含10%胎牛血清和1%青-链霉素双抗的RPMI 1640在37℃、5% CO2的培养箱中培养,常规换液、传代。
1.2.2 细胞转染 按照慢病毒操作手册进行预实验,确定转染的最佳MOI值,然后正式转染。具体为:选取对数生长且状态良好的细胞,以1×105/孔的细胞数接种到六孔板中,待细胞融合20%~30%时,将miR-34a过表达慢病毒、空载慢病毒按照预实验确定的MOI值感染细胞,加入polybrene增强感染效率,12 h后换液,感染72~96 h后,观察GFP荧光。待细胞生长状态良好,且荧光率≥90%时,对细胞收集、扩大培养,用于后续试验。转染率(%)=荧光视野绿色细胞数/对应白光视野细胞总数×100%。
1.2.3 RT-PCR 按照试剂盒说明书提取各组细胞总RNA、合成cDNA,进行RT-PCR反应。RT-PCR反应条件:94℃起始模板变性2 min,94℃循环中模板变性20 s,60℃退火、延伸34s,共40个循环,以U6为内参。miR-34a引物序列:上游5′-CCCACATTTCCTTCTTATCAACAG-3′,下游5′-TGGCAGTGTCTTAGCTGGTTGTG-3′。U6引物序列:上游5′-CGCTTCGGCAGCACATATACTA-3′,下游5′-CGCTTCACGAATTTGCGTGTCA-3′。得到各样本的Ct值,以2-ΔΔCt法计算每组细胞miR-34a的相对表达量,每组设3个复孔。
1.2.4 CCK-8实验 将细胞以5×103个/孔接种到96孔板上,连续培养4d,每孔加入10 μL CCK8试剂与90 μL培养液,培养箱内反应2 h后,酶标仪测定在490 nm处波长的吸光度(A),每组设6个复孔,取平均值,实验重复3次。
1.2.5 划痕实验 将细胞以5×105/孔接种到6孔板中,待细胞汇合90%时,用10 μL移液枪枪头垂直于每孔中轴线划直线,PBS洗3次,加入无血清培养液,并拍照(0 h),继续培养48 h后观察各组细胞迁移情况并拍照,实验重复3次。
1.2.6 Transwell侵袭实验 用无血清培养基稀释Matrigel胶,以50 μL/孔的体积铺于Transwell小室聚碳酸酯膜上,37℃放置4 h,使Matrigel聚合成胶。细胞饥饿24 h后调整浓度为5×105个/mL,上室加入200 μL细胞悬液,下室加入600 μL含20%FBS的培养液。孵箱中培养24 h后取出小室,用湿棉签擦去上室Matrigel胶和未穿过膜的细胞,4%多聚甲醛固定15 min,0.1%结晶紫染色15 min,PBS清洗3次、干燥,取下微孔滤膜,倒置显微镜下随机选取5个视野计数穿过膜的细胞并拍照,取平均数,实验重复3次。
1.2.7 Western blot实验 细胞长满后,提取总蛋白,BCA法蛋白定量,电泳、转膜、脱脂奶粉封闭后,分别加入各目标蛋白一抗4℃孵育过夜,与辣根过氧化酶标记二抗室温反应、孵育后,利用胶片曝光、显影、定影,图像分析仪行胶片扫描,分析灰度值。
1.3 统计学分析

2 结果
2.1 转染及各组miR-34a的表达
当MOI值为50 TU/mL,转染SW480细胞72 h后,miR-34a转染组与空病毒载体组均可观察到GFP绿色荧光,转染率达90%以上(图1)。RT-PCR检测各组细胞miR-34a的表达,假设空白对照组表达为1,转染组miR-34a的相对表达量为9.29±0.48,空病毒载体组相对表达量为1.13±0.06,转染组miR-34a的表达高于其他两组,差异有统计学意义(P<0.01),而空载体组与空白对照组比较无统计学差异(P>0.05)(图2)。
2.2 miR-34a对细胞增殖能力影响
CCK8法结果显示随培养时间的延长,过表达miR-34a组细胞的增殖能力从第3天后开始比空载体组和空白对照组下降,差异有统计学意义(P<0.05),提示miR-34a具有抑制结肠癌细胞SW480增殖的能力(图3)。

图1 SW480细胞转染后的细胞状态及GFP绿色荧光表达(200×)Figure 1 W480 cells were transfected with miR-34a and observed cell morphology with white bright(left)and green fluorescence(right)(200×)

图2 RT-PCR检测转染后miR-34a的相对表达量Figure 2 Relative expression levels of miR-34a in blank,empty virus vector and transfected cells were detected by RT-PCR.Note:Compared with blank group and vector group,*P<0.05.

图3 CCK-8检测miR-34a对结肠癌SW480增殖能力的影响Figure 3 Effect of miR-34a on proliferation SW480 cellsNote:*P<0.05,compared to the blank and vector group.
2.3 划痕实验检测miR-34a对细胞迁移能力影响
划痕实验结果显示,划痕48 h后,空白对照组、空病毒载体组及miR-34a转染组划痕区域相对宽度分别为(57.33±2.85)%、(52.54±1.77)%、(70.79±3.35)%。miR-34a转染组划痕细胞两端距离较其他两组宽,差异有统计学意义(P<0.05)(图4),而空白对照和空病毒载体组无统计学差异(P>0.05),表明miR-34a可抑制SW480细胞的迁移能力。
2.4 Transwell小室检测miR-34a对细胞侵袭能力影响
Transwell小室结果显示,miR-34a转染组穿过滤膜的数量(83.00±7.44个),较空白对照组(116.20±9.58个)、空病毒载体组(113.20±6.28个)减少,差异有统计学意义(P<0.05),而空白对照组与空病毒载体组差异无统计学意义(P>0.05),表明miR-34a可以抑制结肠癌SW480的侵袭能力(图5)。
2.5 各组细胞E-cadherin和Vimentin蛋白表达
Western blot结果显示,上调miR-34a水平后,与空病毒载体组及空白对照相比,转染组E-cadherin的表达增加,而Vimentin表达降低(P<0.05),而空病毒载体组及空白对照则无统计学差异(P>0.05)(图6)。

图4 划痕实验检测miR-34a对SW480迁移能力影响Figure 4 Effects of miR-34a on the mobility in SW480 cells
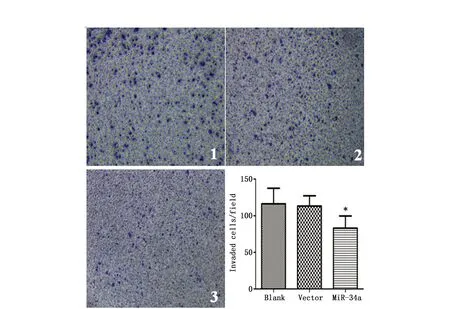
图5 Transwell小室检测miR-34a对SW480侵袭能力影响Figure 5 Effect of miR-34a on invasion ability of SW480 cellsNote:1.Blank group;2.Vector group;3.MiR-34a group;*P<0.05 compared with vector and blank group
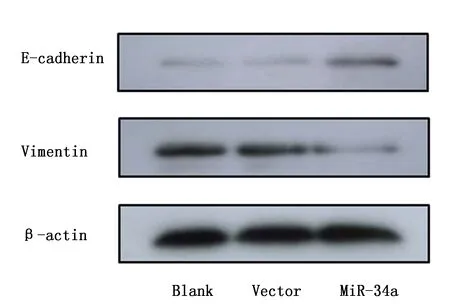
图6 Western blot检测E-cadherin和Vimentin的表达Figure 6 The expression of E-cadherin and Vimentin protein in SW480 cells
3 讨论
结直肠癌是全球范围内致死性最高的恶性肿瘤之一,复发和转移是患者预后不良的重要原因,其中远处转移以肝转移最常见,文献报道约有30%的患者会发生肝转移[5]。结直肠癌的转移分子机制复杂,它是一个多步骤、多阶段、多途径、多个因素共同调控的生物学过程。miRNA是一类高度保守的非编码小RNA分子,可与下游靶基因3′UTR区序列互补配对,引起靶基因的降解或抑制靶基因的翻译。miRNA的表达异常与肿瘤的发生、侵袭转移及复发密切相关,扮演抑癌基因或致癌基因的角色[6]。因此miRNA可能是复杂基因调控网络中的关键节点,是肿瘤诊断、治疗新的分子标志及作用靶点。
miR-34a是一个受抑癌基因p53调节的小分子RNA,研究显示miR-34a在多种恶性肿瘤组织中呈低表达,参与调控多种肿瘤细胞的生物学行为,如抑制胃癌、乳腺癌、肝癌等细胞的增殖及迁移侵袭[7-9],miR-34a也与结直肠癌的临床分期、分化和浸润程度、淋巴结转移及复发密切有关[11]。本研究通过慢病毒技术,成功构建了miR-34a稳定过表达的结肠癌SW480细胞系,应用CCK8法、划痕实验及Transwell侵袭实验证实miR-34a可抑制SW480细胞的增殖、迁移及侵袭。
EMT指上皮细胞在特定环境下,失去上皮特性而获得间质细胞特性的生物学现象。EMT在个体发育、伤口修复、组织再生、干细胞分化及器官纤维化等过程中起着重要作用[11]。近年来,研究发现EMT是肿瘤细胞发生侵袭和转移的机制之一。当细胞发生EMT时,细胞的骨架发生重组,上皮细胞表型缺失,增强细胞间黏附的蛋白如E-cadherin表达减少,间质细胞的分子标志如Vimentin、基质金属蛋白酶(Matrix metalloproteinase,MMPs)及N-钙黏蛋白(N-cadherin)表达增加,导致细胞间黏附能力下降或丧失、连接松散、失去极性,获得更强的游走、抗凋亡及降解细胞外基质的能力,这是肿瘤发生周围侵袭及远处转移的重要生物学过程[12]。近年来,多个miRNA被发现参与调控EMT过程从而影响肿瘤的侵袭转移,其中以miR-200家族最为经典。miR-200家族可与E-cadherin的转录抑制因子ZEB1和ZEB2的3′UTR互补序列结合,增强E-cadherin的表达,抑制细胞的侵袭能力[13]。本研究结果表明过表达的miR-34a能促进SW480细胞E-cadherin的表达,抑制Vimentin的表达。
综上所述,上调结肠癌SW480细胞miR-34a表达后,细胞的增殖、迁移和侵袭能力下降,miR-34a可抑制间质细胞相关蛋白Vimentin的表达,促进细胞间黏附蛋白E-cadherin的表达。由此推断miR-34a抑制结肠癌细胞SW480增殖、迁移及侵袭的机制可能是通过抑制EMT过程实现的。由此提示我们,miR-34a的低表达很可能存在高转移及复发风险,miR-34a可能成为结肠直肠癌治疗新的分子靶点。
1 Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
2 Berindan Neagoe I,Monroig PC,Pasculli B,et al.MicroRNAome genome:a treasure for cancer diagnosis and therapy[J].Cancer J Clinicians,2014,64(5):311-336.
3 Kouso H,Yano T,Maruyama R,et al.Differences in the expression of epithelial-mesenchymal transition related molecules between primary tumors and pulmonary metastatic tumors in colorectal cancer[J].Surgery Today,2012,43(1):73-80.
4 Zhang D,Zhou J,Ming D.Dysregulation of microRNA-34a expression in colorectal cancer inhibits the phosphorylation of FAK via VEGF[J].Digest Dis Sci,2014,59(5):958-967.
5 Sahani DV,Bajwa MA,Andrabi Y,et al.Current status of imaging and emerging techniques to evaluate liver metastases from colorectal carcinoma[J].Annal Surgery,2014,259(5):861-872.
6 Lu J,Getz G,Miska EA,et al.MicroRNA expression profiles classify human cancers[J].Nature,2005,435(7043):834-838.
7 Cao W,Fan R,Wang L,et al.Expression and regulatory function of miRNA-34a in targeting survivin in gastric cancer cells[J].Tumor Biology,2013,34(2):963-971.
8 Si W,Li Y,Shao H,et al.MiR-34a inhibits breast cancer proliferation and progression by targeting Wnt1 in Wnt/β-catenin signaling pathway[J].Am J Med Sci,2016,352(2):191-199.
9 Li N,Fu H,Tie Y,et al.miR-34a inhibits migration and invasion by down-regulation of c-Met expression in human hepatocellular carcinoma cells[J].Cancer Letters,2009,275(1):44-53.
10 Gao J,Li N,Dong Y,et al.miR-34a-5p suppresses colorectal cancer metastasis and predicts recurrence in patients with stage Ⅱ/Ⅲ colorectal cancer[J].Oncogene,2015,34(31):4142-4152.
11 Nieto MA.Epithelial plasticity:a common theme in embryonic and cancer cells[J].Science,2013,342(6159):1234850.
12 Wrighton KH.Cell migration:EMT promotes contact inhibition of locomotion[J].Nat Rev Mol Cell Biol,2015,16(9):518.
13 Davalos V,Moutinho C,Villanueva A,et al.Dynamic epigenetic regulation of the microRNA-200 family mediates epithelial and mesenchymal transitions in human tumorigenesis[J].Oncogene,2012,31(16):2062-2074.
(收稿:2016-12-29)
Effects of miR-34a on proliferation,migration and invasion of colon cancer SW480 cell and its possible mechanism
HAOXiaojun,WANGChuanzhuo,ZHAOXiangxuan,XINhe,LIUZhaoyu
Department of Radiology,Shengjing Hospital of China Medical University,Shenyang 110004,China
Objective The objective of this study was to investigate effects of miR-34a on the proliferation,invasion and migration of colon cancer SW480 cell and its possible mechanism.Methods miR-34a overexpressed lentivirus and empty virus vector were transfected into SW480 cells and untreated cells were used as blank control group.Real-time PCR was used to detect the expression of miR-34a in each group.The cell proliferation was detected by CCK8 assay.The cell migration and invasion ability were detected by wound healing and transwell assays.The expression of E-cadherin and Vimentin protein was detected by Western blotting.Results Compared with the empty virus vector group and the blank control group,the expression of miR-34a was increased in the transfected cells,and the cell proliferation efficiency,invasion and migration ability were decreased in the transfected cells(P<0.05).miR-34a significantly increased the expression of E-cadherin protein and decreased Vimentin protein expression in the transfected cells.Conclusion miR-34a can inhibit the proliferation,invasion and migration of colon cancer SW480 cells,and affect the expression of E-cadherin and Vimentin.MR-34a is expected to be a potential molecular target for the metastasis and recurrence of colorectal cancer.
Colorectal cancer;miR-34a;EMT;Proliferation;Invasion
国家自然科学基金(81470086)
中国医科大学附属盛京医院放射科(沈阳 110004)
郝小军,男,(1990-),硕士研究生,从事肿瘤介入治疗和影像诊断的研究。
刘兆玉,E-mail:liuzy@sj-hospital.org
R735.3
A
10.11904/j.issn.1002-3070.2017.03.001

