高压均质法制备甘薯纳米淀粉及其表征
,,,,
(山东农业大学食品科学与工程学院,山东泰安 271018)
高压均质法制备甘薯纳米淀粉及其表征
侯淑瑶,代养勇,刘传富*,李沛达,董海洲
(山东农业大学食品科学与工程学院,山东泰安 271018)
以甘薯淀粉为原料,采用高压均质法制备甘薯纳米淀粉。研究高压均质过程中均质压力、均质次数、淀粉乳的浓度对甘薯纳米淀粉得率的影响,并进行正交实验优化。采用扫描电镜、粒度分析仪、红外光谱仪、X-射线衍射仪、热失重分析仪以及Zeta电位仪对纳米淀粉颗粒的形貌和微观结构进行表征,结果表明:在均质压力80 MPa、均质次数25次、淀粉浓度3.2 g/100 mL的条件下制备的甘薯纳米淀粉的得率达到46.12%,所得甘薯纳米淀粉呈椭圆形,平均粒径为214.3 nm,与原淀粉相比基本化学结构未发生改变,但结晶度、热分解初始温度降低;悬浮液的Zeta电位绝对值增大,在介质中的稳定性增强。
高压均质,制备,甘薯纳米淀粉,表征
纳米淀粉是指粒径小于1000 nm的淀粉微球[1-2]。近年来淀粉因其无毒[3]、价格低廉[4]、来源广泛[5]、生物相容性好等优点在药物载体应用方面得到广泛的关注[6-9]。与原淀粉相比,纳米淀粉具有粒径小、比表面积大[10-11]、无免疫原性、储存稳定等优点[12-13],作为药物载体能够提高载药量和吸附速度[14-15]、能够穿过组织间隙并被细胞吸收、实现缓释[16]。同时纳米淀粉在人体内能够避免吞噬细胞的清除,从而延长在循环系统的停留时间并提高对药物的利用率[17]。纳米淀粉不仅应用于医药领域,还广泛用于催化、色谱分析、食品、化妆品和精细化工等行业[18]。
目前,纳米淀粉的制备方法主要有酸水解法、酶解法、反相微乳液法等[19]化学方法。Angellier[20]等用H2SO4酸水解糯玉米淀粉5 d后制得得率为15%的纳米淀粉,存在得率低、耗时长,对设备的耐酸性要求较高的缺点;Kim[21]用酶解回生法制备得率为12%~15%的纳米淀粉;黄银娟[22]用微乳液法制备了粒径为100~600 nm的纳米淀粉,但使用了表面活性剂及有机溶剂,不利于环境保护。涂宗财[23]等研究了高压均质对大米淀粉的影响,结果表明,高压均质可使其粒度有效减小。高压均质通过高速运动及高压能的释放粉碎物料使淀粉颗粒达到纳米级,具有操作简单、得率高、节能、环保等优势,但是国内目前对该方法的研究较少,本文首次以甘薯淀粉为原料,采用高压均质方法制备甘薯纳米淀粉,并对其形貌及结构进行表征和相关分析,旨在为甘薯淀粉的进一步利用及纳米淀粉的制备提供一定的理论依据。
1 材料与方法
1.1材料与仪器
甘薯淀粉 威海乳山华美淀粉制品有限公司;溴化钾(AR) 国药集团化学试剂有限公司;水 实验室自制去离子水。
HH-2数显恒温水浴锅江 苏金坛市荣华仪器制造有限公司;AY220电子分析天平 日本岛津公司;Scientz-150高压均质机 宁波新芝生物科技股份有限公司;TG 1650-WS系列台式高速离心机 上海卢湘仪离心机仪器有限公司;Scientz-10N冷冻干燥机 宁波新芝生物科技股份有限公司;Nicolet iS5傅立叶变换红外光谱仪 美国Thermo Fisher Scientificg公司;D-8 ADVANCE型X-射线衍射仪 美国BRUKER-AXS有限公司;TA-60热重分析仪 日本岛津公司;KQ-250DE型数控超声波清洗器 昆山市超声仪器有限公司;KYKY-2800B型扫描电子显微镜 中科院北京中科科仪公司;90Plus Zeta型Zeta电位及粒度分析仪 美国布鲁克海文仪器公司。
1.2实验方法
1.2.1 甘薯纳米淀粉的制备 称取适量的甘薯淀粉置于烧杯中,用去离子水配制成一定浓度的淀粉溶液。将淀粉溶液置于高压均质机的喂料斗中,调节一定压力进行均质,用烧杯收集均质完的混合液,将收集的混合液再次均质,循环均质一定次数得到最终混合液。将混合液在转速10000 r/min条件下离心10 min,收集离心得到的上层乳白色悬浮液,继续加等量去离子水并在相同条件下离心至不再出现乳白色悬浮液时停止收集。取下层沉淀和上层悬浮液进行粒径测试,下层淀粉未达到纳米级别。将所得纳米淀粉悬浮液进行冷冻干燥,得到的样品密封保存。
1.2.2 单因素实验 采用1.2.1的甘薯纳米淀粉制备方法,制备条件为:固定淀粉浓度2 g/100 mL,均质次数20次,考察不同均质压力(20、40、60、80、100 MPa)对甘薯纳米淀粉得率的影响;固定淀粉浓度2 g/100 mL,均质压力80 MPa,考察不同均质次数(10、15、20、25、30次)对甘薯纳米淀粉得率的影响;固定均质压力80 MPa,均质次数25次,考察不同淀粉浓度(2、2.5、3、3.5、4 g/100 mL)对甘薯纳米淀粉得率的影响。
1.2.3 正交实验 在单因素实验基础上,利用正交实验优化甘薯纳米淀粉的制备条件。正交实验因素水平设计见表1。

表1 甘薯纳米淀粉正交实验因素与水平设计表Table 1 Factors and levels table of orthogonal experiment of nano sweet potato starch
1.2.4 甘薯纳米淀粉得率的测定 测量纳米淀粉悬浮液的总体积,用移液管吸取20 mL于已称量过的称量瓶中,真空冷冻干燥至恒重,然后在分析天平上称重。
式(1)
式中:m1为冷冻干燥后样品与称量瓶的质量(g);m2为称量瓶的质量(g);m为原料的质量(g);v2为纳米淀粉悬浮液的总体积(mL);v1为移取纳米淀粉的体积(mL)。
1.2.5 甘薯纳米淀粉的粒径分析 通过粒度分析仪测定所得甘薯纳米淀粉的粒径大小及分布状况。将10 mg冻干得到的甘薯纳米淀粉分散到10 mL去离子水中,超声分散10 min以避免淀粉颗粒团聚,平行测定三次。
1.2.6 扫描电镜分析(SEM) 采用扫描电子显微镜观察样品的形貌。取检测样品并进行喷金处理,进行观测。
1.2.7 红外光谱分析(FTIR) 取1 mg冻干的样品与200 mg溴化钾混合后压膜制片,通过红外光谱扫描仪对压片进行测定和分析,扫描波长范围是400~4000 cm-1,扫描次数32次。
1.2.8 X-射线衍射分析(XRD) 通过X-射线衍射仪研究甘薯纳米淀粉的结晶结构。样品测试的衍射角2θ范围是5°~40°,测试速度为0.02°/s。结晶度计算公式[24]如下:

式(2)
其中:XC为相对结晶度;Ac为晶区部分面积;Aa为非晶区部分面积。
1.2.9 热失重分析(TGA) 采用热失重分析仪对甘薯纳米淀粉的稳定性进行测定与分析。样品测试温度25~500 ℃,升温速率10 ℃/min,N2为保护气体。
1.2.10 Zeta电位测定 测试条件:配制0.1 mol/L悬浮液,使用Zetaplus电位仪在室温(25 ℃)中性条件下测定甘薯淀粉及不同条件处理下得到的甘薯纳米淀粉的电位值,分析其电化学性质。
1.3数据分析
每个样品设3个平行,采用Origin 8.5和SPSS 20.0软件进行数据分析。测定结果以平均值±标准差表示。实验数据采用ANOVA进行邓肯氏(Duncan’s)差异分析,图和表内不同的字母表示具有显著性差异(p<0.05)。
2 结果与分析
2.1单因素实验
2.1.1 均质压力对甘薯纳米淀粉得率的影响 由图1可以看出,当均质压力在20~80 MPa之间时,随着均质压力的增大,纳米淀粉的得率呈递增的趋势(p<0.05)。当均质压力为80 MPa时,纳米淀粉的得率达到最大值(45.28%),继续增大均质压力超过80 MPa时,纳米淀粉的得率有所降低。这是因为加载压力越高,高压均质机内部均质阀间隙越小,淀粉通过时获得的速度越快,所受到的剪切等机械作用力更强[25],淀粉更易被破碎成小颗粒,从而提高了纳米淀粉的得率;但当压力超过80 MPa时,由于淀粉颗粒粒径变小,在机械力作用下处于激活状态,颗粒表面的范德华力和静电引力增大,一部分高表面能和表面活性的颗粒易相互吸引,出现团聚现象[26],从而使颗粒变大,产生沉降,导致纳米淀粉的得率有一定程度的降低(p>0.05)。因此,在本实验条件下最佳的均质压力为80 MPa。
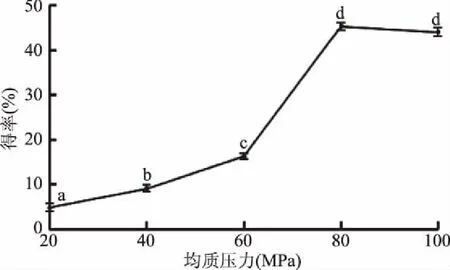
图1 均质压力对甘薯纳米淀粉得率的影响Fig.1 Effect of homogenization pressure on yield of nano sweet potato starch注:不同小写字母代表差异显著(p<0.05);图2、图3、表3同。
2.1.2 均质次数对甘薯纳米淀粉得率的影响 由图2可以看出,纳米淀粉得率随着均质次数的增加而增加,均质次数在15~25次之间时,甘薯纳米淀粉的得率增加显著(p<0.05),均质次数超过25次时,纳米淀粉得率增加不显著(p>0.05)。这是由于淀粉颗粒在高压均质处理过程中,均质阀中产生的能量并不完全均匀,增加均质次数可以增加颗粒通过“高能区”的概率,使淀粉颗粒受机械力作用的时间更长,淀粉得到充分润胀,结构变得松散,更容易破碎而形成纳米淀粉颗粒,提高纳米淀粉得率。但由于高压均质对不同大小的颗粒作用效果不同,粒径大的颗粒较容易破碎,当颗粒破碎到一定程度时,均质压力机己不足以抗衡物料更高的断裂强度,只能用于维持粉碎动态平衡,要继续破碎必须输入更高的能量[27],所以在均质压力一定的条件下,继续增加均质次数(超过25次)对减小颗粒粒径没有明显效果,纳米淀粉得率不再提高。因此,在本实验条件下最佳的均质次数为25次。
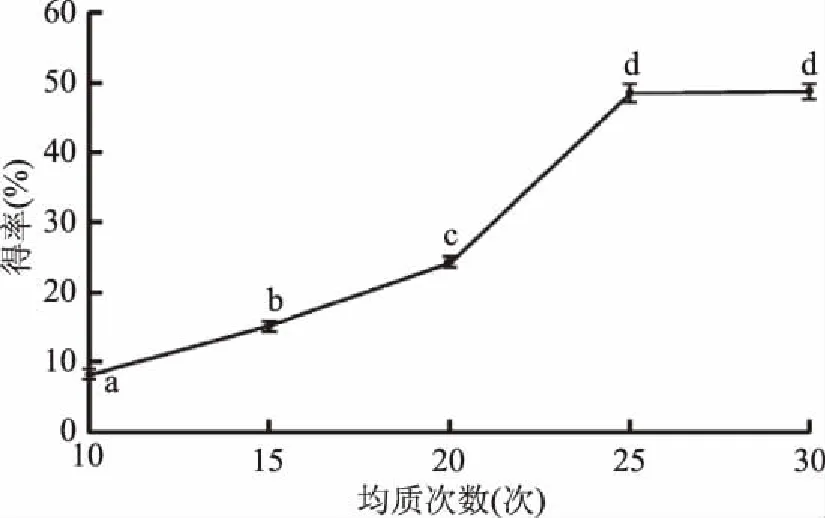
图2 均质次数对甘薯纳米淀粉得率的影响Fig.2 Effect of homogenization times on yield of nano sweet potato starch
2.1.3 淀粉浓度对甘薯纳米淀粉得率的影响 由图3可以看出,当淀粉浓度在2~3 g/100 mL之间时,甘薯纳米淀粉的得率随淀粉浓度的增大呈递增趋势(p<0.05),在淀粉浓度为3 g/100 mL时,甘薯纳米淀粉的得率达到最大值(45.76%)。淀粉浓度超过3 g/100 mL时,纳米淀粉的得率略有降低,但差异不显著(p>0.05)。这是因为淀粉浓度在2~3 g/100 mL范围内,随着淀粉浓度的增大,更多的淀粉颗粒受到高压均质过程中机械力的作用,从而形成更多的淀粉小颗粒;当继续增大淀粉浓度(超过3 g/100 mL)时,由于淀粉颗粒密度大,在水中分散不均匀,单个淀粉颗粒所受作用力减少,削弱了对淀粉的破碎作用,同时,均质腔的体积有限,淀粉浓度提高会降低均质的速度[28],使淀粉破坏程度略有下降,所以得率略有降低。因此,在本实验条件下最佳的淀粉浓度为3 g/100 mL。
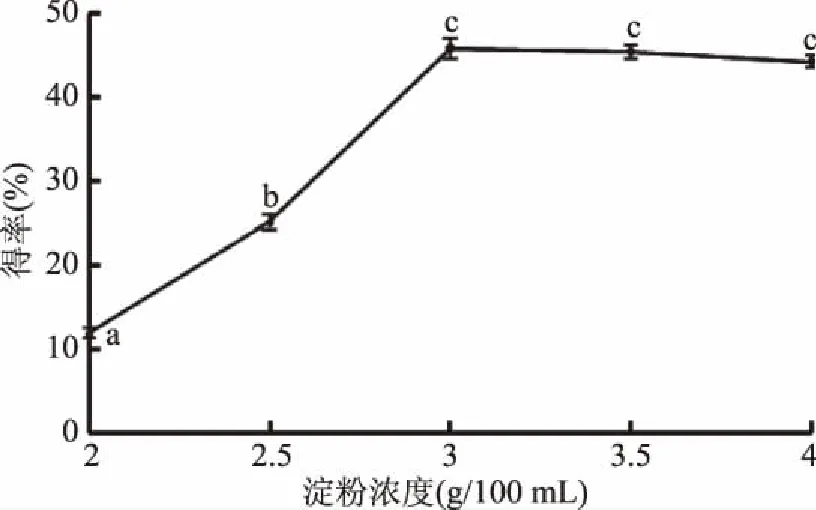
图3 淀粉浓度对甘薯纳米淀粉得率的影响Fig.3 Effect of starch concentration on yield of nano sweet potato starch
2.2正交实验
在单因素实验的基础上,以甘薯纳米淀粉得率作为指标,对影响甘薯纳米淀粉得率的3个因素,包括均质压力、均质次数、淀粉浓度,采用L9(34)正交实验设计对甘薯纳米淀粉制备条件进行了优化,正交实验设计及结果如表2所示。
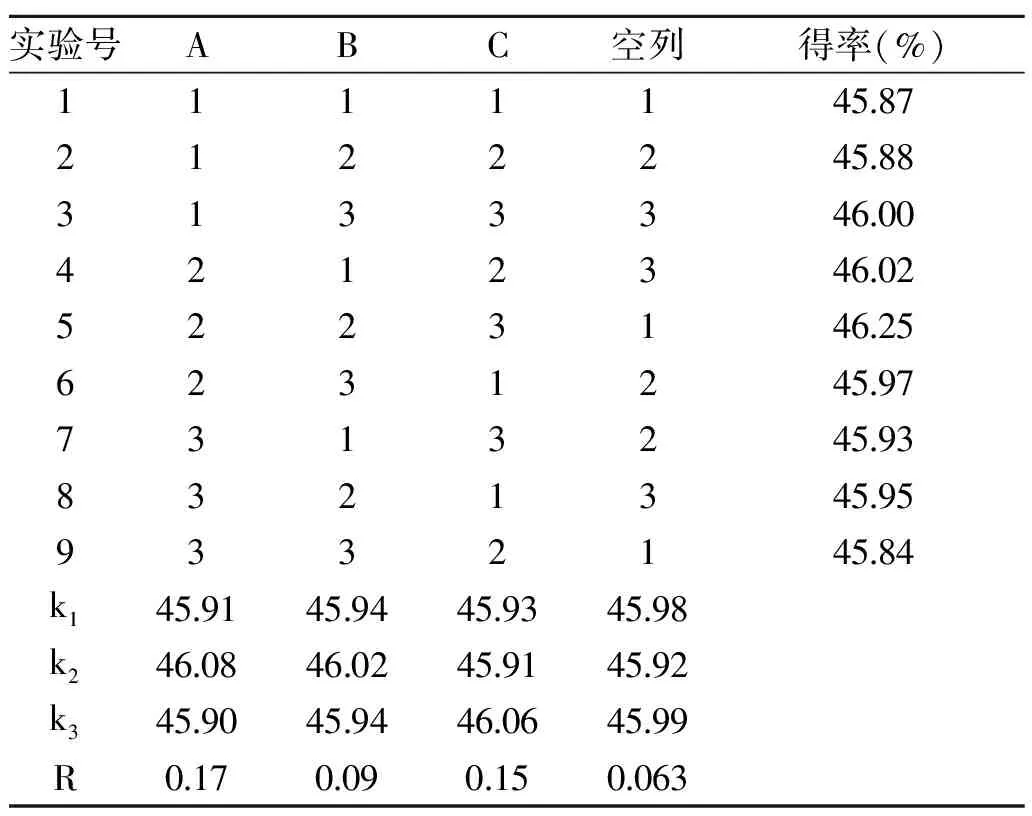
表2 正交实验结果与分析Table 2 Orthogonal experimental results and analysis
从表2可以看出,影响甘薯纳米淀粉得率的各个因素,主次顺序为A>C>B,即均质压力>淀粉浓度>均质次数。甘薯纳米淀粉制备的最优组合为A2B2C3,即均质压力80 MPa,均质次数为25次,淀粉浓度3.2 g/100 mL。经验证在最优制备条件下,甘薯纳米淀粉得率为46.12%。
2.3甘薯纳米淀粉的表征
2.3.1 粒径分析 用激光粒度仪测试颗粒粒径时,散射光的角度和颗粒直径呈反比,散射光的能量分布与颗粒直径分布相关,通过散射光的能量分布可得到颗粒的粒度分布特征[29]。由图4(a)可以看出,原甘薯淀粉粒度主要分布于1~94 μm之间,粒径大于33.58 μm的淀粉颗粒所占比例很小,平均粒径为11.89 μm;由图4(b)可以看出,制备的甘薯纳米淀粉粒径呈正态分布,与Lin Z X[30]的研究结果一致,其粒径主要分布在126.6~362.7 nm范围内,平均粒径为214.3 nm。因此可以得出,高压均质处理可以有效减小甘薯淀粉的粒径,制备出粒径分布相对均匀的甘薯纳米淀粉。

图4 甘薯淀粉(a)和甘薯纳米淀粉(b)的粒径分布图Fig.4 Particle size distribution of sweet potato starch(a)and nano sweet potato starch(b)
2.3.2 扫描电镜分析(SEM) 通过扫描电镜观察甘薯淀粉和甘薯纳米淀粉的微观形貌,从图5(a)中可以观察到,甘薯原淀粉颗粒大多数为球形,少数为不规则的多面体,且表面有凹陷处,粒径约为2~20 μm,分布较宽。图5(b)为高压均质制得的甘薯纳米淀粉,可以看出纳米淀粉的粒径约为50~350 nm,与原甘薯淀粉相比颗粒明显减小且粒径分布变窄,纳米淀粉由于受到剪切等机械力作用,表面变得相对圆滑,而且出现团聚现象,这可能是因为淀粉颗粒高的表面活化能以及颗粒之间氢键、范德华力、静电引力的作用使其容易聚集[31],这同时可以解释图4粒径测试结果偏大的现象。从图5中还可以看出一部分颗粒粘连在一起,其原因是高压均质过程中,淀粉结构疏松,易吸水,使淀粉颗粒部分发生糊化,呈现凝胶化状态,这与Wang[32]和Li[33]的报道相一致。

图5 甘薯淀粉和甘薯纳米淀粉的扫描电镜图Fig.5 SEM micrographs of sweet potato starch and nano sweet potato starch
2.3.3 红外光谱分析(FTIR) 采用红外光谱研究高压均质对甘薯淀粉化学结构的影响,图6为甘薯淀粉及甘薯纳米淀粉的红外光谱图。图6中3340 cm-1左右是淀粉-OH的缔合伸缩振动峰[33],经高压均质处理后,淀粉的-OH缔合伸缩振动峰与原淀粉相比明显变窄且发生红移。这是因为在高压均质过程中,淀粉颗粒受到机械力的作用,破坏了淀粉的结晶区,淀粉分子间的缔合氢键被打开,游离羟基数目增加[34],因此吸收峰变窄并红移。在2920 cm-1附近的是-CH2-的伸缩与反伸缩振动吸收峰;在1650 cm-1处存在的吸收峰可能是淀粉吸附的水造成的。在577、763和854 cm-1处有淀粉的-CH2的摇摆吸收峰,且550~850 cm-1为D-吡喃葡萄糖的吸收带;波数在1000 cm-1附近的是由C-OH伸缩振动引起的吸收峰;波数为1153 cm-1的峰则为C-O-C的伸缩振动吸收峰,这些都是淀粉的特征吸收峰。由图6可以看出,与甘薯原淀粉相比,经高压均质处理得到的甘薯纳米淀粉没有出现新的吸收峰,说明在高压均质处理过程中没有新的化学基团生成,仍保持淀粉原有的基本化学结构。

表3 甘薯淀粉和甘薯纳米淀粉悬浮液的Zeta电位Table 3 Zeta potential of sweet potato starch and nano sweet potato starch
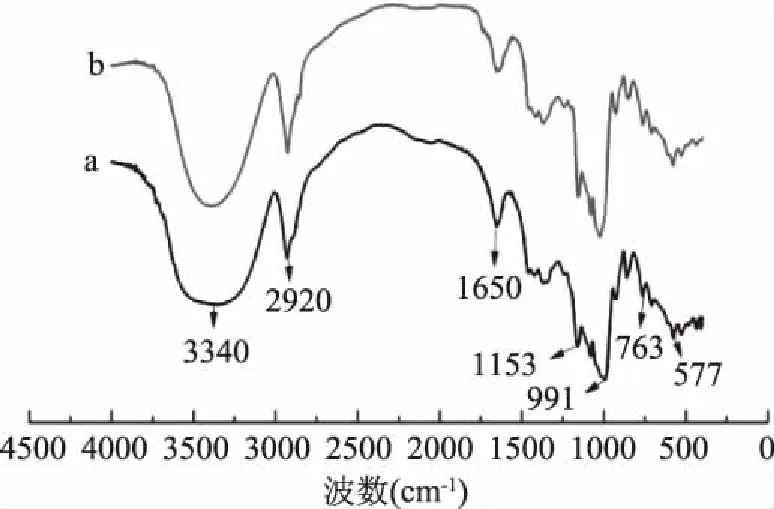
图6 甘薯淀粉(a)和甘薯纳米淀粉(b)的红外光谱Fig.6 FTIR spectra of sweet potato starch(a) and nano sweet potato starch(b)
2.3.4 X-射线衍射(XRD)分析 淀粉的X-射线衍射图谱有三种:A型淀粉在衍射角15.3°、17.1°、23.5°有较强衍射峰;B型淀粉在2θ=18°出现明显的衍射峰,在2θ=20°、22°和24°附近出现较弱的衍射峰;C型淀粉为含A型和B型结晶混合结构的淀粉[35]。
由图7看出,甘薯淀粉在2θ=14.9°、17.0°、17.8°、23.0°出现衍射峰,但是只有17°处是强衍射峰,所以甘薯淀粉属于包含A型和B型的C型结构。在40 MPa和80 MPa压力下制得的甘薯纳米淀粉的特征衍射峰消失,这说明淀粉的结晶结构被破坏。由结晶度计算公式根据X-射线衍射图谱计算出甘薯淀粉、40 MPa甘薯纳米淀粉、80 MPa甘薯纳米淀粉的结晶度逐渐降低,分别是30.5%、12.1%、11.8%,与衍射峰逐渐消失的现象相符合。这是因为在挤压、剪切、高压释放等机械力的作用下,首先是结构较为松散的无定形区受到破坏,随着压力的增大,水分快速地进入结晶区域,破坏淀粉分子之间的氢键,结晶区域溶胀和重排,导致结晶度降低。与酸解法制备纳米淀粉相比,机械处理不会导致化学分解和热分解,最后无定形区和结晶区域都以纳米级的形态存在淀粉中,而酸解法只保留了结晶区。

图7 甘薯淀粉(a)、40 MPa甘薯纳米淀粉(b)、80 MPa甘薯纳米淀粉(c)的X-射线衍射图Fig.7 XRD patterns of sweet potato starch(a), 40 MPa nano sweet potato starch(b), 80 MPa nano sweet potato starch(c)
2.3.5 热失重分析 图8为甘薯淀粉、甘薯纳米淀粉的TG曲线。如图8所示,甘薯淀粉和甘薯纳米淀粉的热分解都经历了三个阶段:第一阶段表现为100 ℃之前的少量失重,这主要是由于淀粉表面的游离水和样品中结合水的蒸发;第二阶段和第三阶段为分子主链断裂阶段和焦炭最后热分解阶段。由图8可以看出,甘薯淀粉的起始分解温度为267 ℃,甘薯纳米淀粉的起始热分解温度为243 ℃,低于甘薯淀粉,这是因为淀粉颗粒受到挤压、剪切、压力释放等强烈的机械作用,淀粉的分子链变短,且淀粉分子之间的氢键被破坏,结晶区域晶格缺陷、晶粒尺寸变小,分子内的网状结构几乎消失,因此甘薯纳米淀粉抵抗热分解作用的能力较弱,其起始分解温度较低。而甘薯淀粉的分子质量较大,有分子链相互交叉、相互缠绕形成的稳定凝胶网状结构,所以其起始分解温度较高。甘薯淀粉和甘薯纳米淀粉均在331 ℃左右热失重速率达到最大,且两者在315 ℃和420 ℃(热分解结束温度)时的热失重率没有明显区别。

图8 甘薯淀粉(a)和甘薯纳米淀粉(b)的TG曲线Fig.8 TG curves of sweet potato starch(a) and nano sweet potato starch(b)
2.3.6 Zeta电位测定 由表3可知,制备的纳米甘薯淀粉悬浮液的Zeta电位绝对值比原甘薯淀粉大,而且随着均质压力的增大,Zeta电位的绝对值也增大。这表明经过高压均质处理后,纳米甘薯淀粉在介质中的稳定性增加。这主要是由于淀粉属于高分子聚合物,机械活化作用使淀粉分子的缔合氢键断裂,游离羟基数量增加,而且随着尺寸的减小会有体积效应和表面效应产生,表现在纳米淀粉的表面积增加,官能团密度增大,因而其Zeta电位绝对值增大。这表明经过高压均质处理后,淀粉在水中的稳定性增强。
3 结论
3.1 影响甘薯纳米淀粉得率的最主要因素是均质压力,其次是淀粉浓度,均质次数影响最小。最佳的制备条件是:均质压力80 MPa,淀粉浓度3.2 g/100 mL,均质次数为25次。在最优制备条件下,甘薯纳米淀粉得率为46.12%。
3.2 通过对相关表征进行分析,所制备的甘薯纳米淀粉呈椭圆形,平均粒径为214.3 nm,粒径较小且分布均匀;纳米淀粉的结晶度下降,但其基本化学结构没有发生改变,热稳定性有所降低;Zeta电位的绝对值大于原淀粉,表明纳米淀粉颗粒在水中有较好的稳定性,因此其有望在功能性物质载体中得到应用。
3.3 高压均质法制备的甘薯纳米淀粉得率较高,且环境友好,可为纳米淀粉的绿色、高效制备提供理论依据,提高甘薯淀粉的附加值。
[1]Shi A,Li D,Wang L,et al. Preparation of starch-based nanoparticles through high-pressure homogenization and miniemulsion cross-linking:Influence of various process parameters on particle size and stability[J]. Carbohydrate Polymers,2011,83(4):1604-1610.
[2]Zhou G,Luo Z,Fu X. Preparation and characterization of starch nanoparticles in ionic liquid-in-oil microemulsions system[J]. Industrial Crops and Products,2014,52:105-110.
[3]Xie W,Shao L,Liu Y. Synthesis of starch esters in ionic liquids[J]. Journal of Applied Polymer Science,2010,116(1):218-224.
[4]Raina C S,Singh S,Bawa A S,et al. Some characteristics of acetylated,cross-linked and dual modified Indian rice starches[J]. European Food Research and Technology,2006,223(4):561-570.
[5]刘娅梅,周贵凤,李超,等. 淀粉材料的改性与应用[J]. 材料导报,2015,29(17):73-78.
[6]Yang J,Huang Y,Gao C,et al. Fabrication and evaluation of the novel reduction-sensitive starch nanoparticles for controlled drug release[J]. Colloids and Surfaces B:Biointerfaces,2014,115:368-376.
[7]王艳玲. 一种新型淀粉基止血材料的制备及其性能表征[D]. 上海:华东师范大学,2015:10-11.
[8]Rodrigues A,Emeje M. Recent applications of starch derivatives in nanodrug delivery[J]. Carbohydrate Polymers,2012,87(2):987-994.
[9]Haaj S B,Thielemans W,Magnin A,et al. Starch nanocrystals and starch nanoparticles from waxy maize as nanoreinforcement:A comparative study[J]. Carbohydrate Polymers,2016,143:310-317.
[10]董琰. 直链淀粉纳米颗粒的制备及性质研究[D]. 长春:吉林大学,2014:10-11.
[11]Ghaeb M,Tavanai H,Kadivar M. Electrosprayed maize starch and its constituents(amylose and amylopectin)nanoparticles[J]. Polymers for Advanced Technologies,2015,26(8):917-923.
[12]赵雪娜. 木薯淀粉微球的制备及性能研究[D]. 海口:海南大学,2012:5-6.
[13]杨金龙,高春梅,吕少瑜,等. 淀粉基聚合物胶束用作药物载体[J]. 高分子学报,2015(6):617-623.
[14]Minimol P F,Paul W,Sharma C P. PEGylated starch acetate nanoparticles and its potential use for oral insulin delivery[J]. Carbohydrate Polymers,2013,95(1):1-8.
[15]Rodrigues A,Emeje M. Recent applications of starch derivatives in nanodrug delivery[J]. Carbohydrate Polymers,2012,87(2):987-994.
[16]Simi C K,Abraham T E. Hydrophobic grafted and cross-linked starch nanoparticles for drug delivery[J]. Bioprocess and Biosystems Engineering,2007,30(3):173-180.
[17]Da Fonseca C O,Landeiro J A,Clark S S,et al. Recent advances in the molecular genetics of malignant gliomas disclose targets for antitumor agent perillyl alcohol[J]. Surgical Neurology,2006,65:S2-S8.
[18]吴聪. 纳米大米淀粉的制备及作为药物载体的研究[D]. 天津:天津科技大学,2010:9-11.
[19]Dufresne A. Starch and nanoparticle[J]. Polysaccharides:Bioactivity and Biotechnology,2015:417-449.
[20]Angellier H,Choisnard L,Molina-Boisseau S,et al. Optimization of the preparation of aqueous suspensions of waxy maize starch nanocrystals using a response surface methodology[J]. Biomacromolecules,2004,5(4):1545-1551.
[21]Kim J Y,Lim S T,Kim J Y,et al. Preparation of nano-sized starch particles by complex formation with n -butanol[J]. Carbohydrate Polymers,2009,76(1):110-116.
[22]黄银娟. 淀粉基纳米颗粒的制备及其与纳豆激酶的作用机理研究[D]. 兰州:兰州大学,2013:23-24.
[23]涂宗财,任维,刘成梅,等. 纳米级大米淀粉的制备及性质[J]. 农业工程学报,2008,24(1):250-253.
[24]Nara S,Komiya T. Studies on the relationship between water-satured state and crystallinity by the diffraction method for moistened potato starch[J]. Starch-Stärke,1983,35(12):407-410.
[25]李秉正,毛志怀. W/O细乳液的制备及淀粉纳米微球的合成[J]. 中国农业大学学报,2012,17(2):150-155.
[26]尹月斌. 动态高压微射流技术对直链淀粉性质和结构的影响[D]. 南昌:南昌大学,2013:40-41.
[27]Bilgili E,Scarlett B. Population balance modeling of non-linear effects in milling processes[J]. Journal of Computational Physics,2005,153(1):59-71.
[28]张威. 球磨-交联改性玉米淀粉的制备及载药性研究[D]. 无锡:江南大学,2009:6-7.
[29]Bernal V,Jelen P. Thermal stability of whey proteins-a calorimetric study[J]. Journal of Dairy Science,1985,68(11):2847-2852.
[30]Chang L,Li J. Determination of As in industrial wastewater by laser-induced breakdown spectroscopy[J]. Spectroscopy and Spectral Analysis,2009,29(6):1675-1677.
[31]Bao W,Dong L,Wang L,et al. Effect of high-pressure homogenization on the structure and thermal properties of maize starch[J]. Journal of Food Engineering,2008,87(3):436-444.
[32]Li W,Zhang F,Liu P,et al. Effect of high hydrostatic pressure on physicochemical,thermal and morphological properties of mung bean(VignaradiataL.)starch[J]. Journal of Food Engineering,2011,103(4):388-393.
[33]刘延奇,徐银龙. 直链淀粉磷脂复合物的制备及表征[J]. 食品科学,2013,34(22):336-340.
[34]孙丹丹,张宏伟. 机械活化木薯淀粉的光谱分析[J]. 造纸化学品,2012(3):4.
[35]王玉忠,汪秀丽,宋飞.淀粉基新材料[M].北京:化学工业出版社,2015:52-53.
Preparationandcharacterizationofsweetpotatostarchnanoparticlesbyhighpressurehomogenization
HOUShu-yao,DAIYang-yong,LIUChuan-fu*,LIPei-da,DONGHai-zhou
(College of Food Science,Shandong Agricultural University,Taian 271018,China)
Starch nanoparticles were prepared from sweet potato starch using a purely physical method of high pressure homogenization. The effects of homogenization pressure,homogenization times,starch concentration on the yield of starch nanoparticles had been analyzed,then the orthogonal test was carried out. Scanning electron microscopy,particle size analyzer,fourier transform infrared spectroscopy,X-ray diffraction,and thermogravimetric analysis were used to characterize the morphological,electrochemical,spectroscopic,crystal and thermal properties of starch nanoparticles. The results showed that under the condition of homogenization pressure 80 MPa,homogenization passes 25 times,starch concentration 3.2 g/100 mL,the yield of starch nanoparticles reached 46.12%.The starch prepared nanoparticles were spheric shape of average diameter of 214.3 nm,and the basic chemical structure of starch nanoparticles didn’t change,but the crystallinity and initial resolution temperature decreased. What’s more,the absolute zeta potential of starch nanoparticles increased,so it had better capacity of dispersion in water.
high pressure homogenization;preparation;sweet potato starch nanoparticles;characterization
2016-11-30
侯淑瑶(1991-),女,硕士研究生,研究方向:食品科学,E-mail:hsyshipin1213@sina.com。
*通讯作者:刘传富(1962-),男,硕士,高级实验员,研究方向:农产品加工,E-mail:lchf@sdau.edu.cn。
国家自然科学基金项目(31471619);山东省自然科学基金项目(ZR2014JL020)。
TS231
:B
:1002-0306(2017)12-0233-07
10.13386/j.issn1002-0306.2017.12.042

