发酵豆粕蛋白提取工艺及其品质的研究
,容旭, ,, ,,,2,*
(1.东北农业大学食品学院,黑龙江哈尔滨 150030; 2.黑龙江省绿色食品科学研究院,黑龙江哈尔滨 150028)
发酵豆粕蛋白提取工艺及其品质的研究
刘冬1,刘容旭1,吴溪1,刁予希1,王琳1,崔石阳1,韩建春1,2,*
(1.东北农业大学食品学院,黑龙江哈尔滨 150030; 2.黑龙江省绿色食品科学研究院,黑龙江哈尔滨 150028)
采用单因素实验,考察不同碱溶pH、碱溶时间、碱溶温度和料液比对发酵豆粕乳中蛋白提取率的影响;通过响应面优化实验,建立了发酵豆粕乳中蛋白的最佳提取工艺;并测定了提取蛋白的主要品质指标。结果表明,不同因素对蛋白提取率的影响强弱顺序为:碱溶时间>碱溶pH>碱溶温度>料液比。优化后的最佳工艺为碱溶pH 9.4、碱溶时间56 min、碱溶温度41 ℃、料液比1∶12,在此条件下,蛋白的提取率达60.36%。经实验表明,植物乳杆菌发酵豆粕中提取的大豆分离蛋白(SPI)溶解性、体外消化率、酸溶蛋白含量较未发酵豆粕均有显著提高(p<0.05)。应用本文所得工艺参数提取发酵豆粕蛋白,方法经济易行,SPI品质良好,可为豆粕蛋白的开发利用提供参考。
发酵豆粕,响应面,蛋白,提取,蛋白质品质
大豆分离蛋白(Soybean Protein Isolate,简称SPI)是以低温脱脂豆粕为原料制备的蛋白质含量高达90%以上的产品。SPI中氨基酸组成合理,消化率高,具有很好的功能特性,在食品制造、加工和保藏过程中起着重要作用[1]。传统方法提取的SPI往往存在异味大、生物利用率低等问题,不利于其在食品中的应用,通过特定手段对其品质的改良就显得尤为重要[2]。
改善SPI品质的方法主要有物理法、化学法、发酵和酶解等。通过微生物发酵的方式改善脱脂豆粕中的蛋白品质,因其安全可行,成本低廉,近年来逐渐成为一个新热点,其中以植物乳杆菌发酵尤为常见。国内外学者对发酵豆粕的研究发现,植物乳杆菌可以提高发酵风味,降低大豆抗营养因子含量,改善蛋白的营养品质等[3-4]。Frias等[5]研究发现SPI经植物乳杆菌发酵后,能降低机体96%~98%的免疫原性。崔宪等[6]研究发现以脱脂豆粕为原料,经植物乳杆菌液态发酵后制备的SPI,其溶解性、乳化性、凝胶强度、持水性和持油性均显著提高(p<0.05),可以有效改善SPI的功能性质。但是文章中并没有介绍发酵豆粕中大豆分离蛋白的具体提取过程以及发酵豆粕中蛋白提取工艺的最优条件。
对于SPI的提取,传统的碱溶酸沉法具有成本低、易操作等特点[7-9]。虽然碱溶酸沉基本条件早已明确,但是经过发酵后的豆粕中蛋白,其功能特性发生了很大变化,由于等电点、溶解性等因素的改变,碱溶酸沉的最佳条件也随之变化,而此条件下蛋白的提取工艺参数尚缺乏足够研究。为给发酵豆粕蛋白提取提供参考,本文利用响应面法优化植物乳杆菌发酵豆粕乳的蛋白提取条件,并将其品质与未发酵的蛋白相比较,以期获得具有良好功能性质大豆分离蛋白的最优提取工艺参数。
1 材料与方法
1.1材料与仪器
植物乳杆菌(Lactobacillusplantarum,ATCC8014) 东北农业大学食品学院实验室保存的菌种;脱脂豆粕 哈尔滨高科技(集团)股份有限公司;牛血清蛋白(BSA) 购自天津鼎国生物技术有限公司;MRS培养基 天津市津东天正精细化学试剂厂;盐酸、氢氧化钠、三氯乙酸等实验用试剂 均为分析纯。
PB-10型精密酸度计 上海仪电科学仪器股份有限公司;SPX-250B型生化培养箱 上海跃进医疗器械厂;手提式压力蒸汽灭菌锅 上海华线医用核子仪器有限公司;Allegra X-22型台式高速冷冻离心机 德国BACKMAN公司;AH-100D型高压均质机 ATS工业系统有限公司;HZQ-X100振荡培养箱 哈尔滨市东联电子技术开发有限公司;SW-CJ-1D型单人净化工作台 苏州净化设备有限公司;Alphal-2 LDplus冷冻干燥机 德国Martin Christ公司;UV-8000A紫外分光光度计 上海市元析仪器有限公司。
1.2实验方法
1.2.1 菌种的活化 将保存的植物乳杆菌接种于试管液体MRS培养基中,在37 ℃培养箱中培养10~12 h,活化3次。将试管液体MRS菌液按5%(体积比)接种于脱脂豆粕乳培养基(脱脂豆粕质量与蒸馏水体积比为1∶10,冲调成脱脂豆粕乳)中,37 ℃培养8~10 h凝乳后即为母发酵剂。
1.2.2 发酵豆粕乳制备工艺流程 脱脂豆粕→粉碎→过筛(100目)→调配→剪切匀浆→灭菌(90 ℃,10 min)→冷却→接种母发酵剂(5%体积比接菌量)→培养(37 ℃)→终止发酵(pH4.5)→后熟(4 ℃,24 h)[10]。
1.2.3 蛋白提取方法 取后熟好的发酵豆粕乳,使用2 mol/L NaOH调整到pH至9.5,温度控制在40 ℃,搅拌60 min,4500×g 4 ℃离心20 min移除不溶解物质,然后将上清液用2 mol/L HCl调整到pH至4.5,4500×g 4 ℃离心10 min获取沉淀,沉淀使用5倍蒸馏水复溶,使用2 mol/L NaOH调整pH至9.5。经3500 Da孔径透析袋透析除盐24 h后,冷冻保存于-18 ℃,冻干,提取后的蛋白沉淀存于聚乙烯盒中,4 ℃,40%相对湿度保存待用。
1.2.4 单因素实验
1.2.4.1 碱溶pH对蛋白质提取率的影响 在料液比为1∶12,碱溶温度为40 ℃,碱溶时间为60 min,酸沉pH为4.5的条件下,将碱溶pH分别调整至pH8.5、9.0、9.5、10.0、10.5进行大豆蛋白的提取,用凯氏定氮法测定蛋白质含量,计算蛋白提取率。
1.2.4.2 碱溶时间对蛋白质提取率的影响 在料液比为1∶12,碱溶pH9.5,碱溶温度为40 ℃,酸沉pH4.5的条件下,按碱溶时间分别调整至30、45、60、75、90 min进行大豆蛋白的提取,用凯氏定氮法测定蛋白质含量,计算蛋白质提取率。
1.2.4.3 碱溶温度对蛋白质提取率的影响 在料液比为1∶12,碱溶pH9.5,碱溶时间为60 min,酸沉pH4.5的条件下,将碱溶温度分别调整至35、40、45、50、55 ℃进行蛋白的提取,用凯氏定氮法测定蛋白质含量,计算蛋白质提取率。
1.2.4.4 料液比对蛋白质提取率的影响 在碱溶pH9.5,碱溶温度为40 ℃,碱溶时间为60 min,酸沉pH4.5的条件下,将料液比分别设为1∶6、1∶8、1∶10、1∶12、1∶14进行大豆蛋白的提取,用凯氏定氮法测定蛋白质含量,计算蛋白质提取率。
1.2.4.5 酸沉pH对蛋白质提取率的影响 在料液比为1∶12,碱溶pH为9.5,碱溶温度为40 ℃、碱溶时间为60 min的条件下,将酸沉pH分别设为pH 4.1、4.3、4.5、4.7、4.9进行蛋白的提取,用凯氏定氮法测定蛋白质含量,计算蛋白质提取率。
1.2.5 响应面分析 在单因素的实验基础之上,以蛋白质得率为响应值,选取碱溶pH、碱溶时间、碱溶温度、料液比为影响因素,采用Box-Behnken实验设计,进行四因素三水平的响应面分析。其因素水平表设计如表1所示。

表1 Box-Behnken设计实验因素水平及编码Table 1 Levels and codes of variables for Box-Behnken design
1.2.6 计算公式 蛋白质含量采用凯氏定氮法测定[11]。
蛋白质含量计算公式如下:
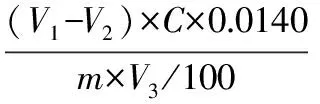
式中,V1:试样消耗HCl标准滴定液的体积,mL;V2:试剂空白消耗HCl的体积,mL;V3:吸取消化液的体积,mL;C:HCl标准滴定液的浓度,mol/L;m:试样的质量,g;F:氮转换系数,一般为6.25。
蛋白提取率计算公式:
1.2.7 大豆蛋白溶解性测定 采用双缩脲法测定,并稍作修改[12]。将冻干后的蛋白粉20 mg 溶解于10 mL去离子水中,室温下充分振荡溶解,10000×g离心20 min,1 mL上清液在试管中,加入4 mL双缩脲试剂,振荡摇匀后放置30 min,在540 nm处比色测定吸光值。同理用双缩脲法测定总蛋白浓度,溶解度表示为上清液中蛋白浓度与总蛋白浓度的比值。
1.2.8 大豆蛋白体外消化率测定 取200 mg经发酵前后提取的大豆蛋白样品,添加15 mL 0.1 mol/L HCl(含1.5 mg胃蛋白酶)于37 ℃水浴3 h,然后添加3.3 mL 0.5 mol/L磷酸缓冲溶液和7.5 mL 0.2 mol/L的磷酸缓冲溶液(pH8.0,含4 mg胰酶),混合液与37 ℃水浴振荡24 min后,添加10 mL 10%的三氯乙酸终止反应,在室温下5000×g离心20 min,得到上清液[13]。
1.2.9 大豆蛋白酸溶蛋白含量测定 参照大豆肽粉标准(QB/T 2653-2004)中酸溶蛋白质含量的测定[14],准确称取待测样品3 g置于50 mL容量瓶中,加入15%三氯乙酸全部溶解并定容到50 mL,混匀静置2 h。将溶液定量转移,10000×g 离心10 min,取全部上清液。采用凯氏定氮法测量样品总氮和上清液中氮含量。
1.3统计分析
所有实验重复3次,结果表示为均值±标准偏差。本实验采用Origin 8.0对其单因素实验作折线图和SPSS 16.0软件对实验数据进行统计学分析,3组数据间的比较采用单因素方差分析(One-way ANOVA)的Duncan’s法进行两两比较分析,显著性水平同样设定为0.05。最后运用Design-Expert 8.0.6软件进行响应面分析。
2 结果与讨论
2.1单因素实验
2.1.1 碱溶pH对蛋白质提取率的影响 由图1可知,随着碱溶pH的提高,蛋白的提取率也随之提高;当pH9.5时,蛋白质的提取率最高,显著高于其他组(p<0.05);随pH进一步提高,蛋白提取率开始下降,原因可能是碱性的增强会引起蛋白质极端变性[15],且部分蛋白质会发生水解,生成低分子量、低密度产品,反而使得蛋白提取率下降。这与刘明美等[16]的研究结果相似。另外,从食品安全的角度来看,在强碱条件下,大豆蛋白的7S和11S组分因碱水解引起消旋作用[17],且生成具有特异毒性物质而丧失食用价值。所以,选择碱溶pH为9、9.5、10进行响应面分析。

图1 碱溶pH对蛋白质提取率的影响Fig.1 The influence of alkali solution pH value on the protein extraction注:不同小写字母表示差异显著,p<0.05;图1~图5同。
2.1.2 碱溶时间对蛋白质提取率的影响 由图2可知,随着碱溶时间的延长,大豆蛋白的提取率呈现先升高后稳定基本不变的趋势。原因可能是蛋白从发酵豆粕中溶出,需要与溶剂进行充分的接触,因此在30~60 min范围内,碱溶时间越长,越利于豆粕蛋白的浸出,即碱溶时间为60 min时,蛋白质提取率最高。当时间大于60 min时,蛋白的提取率随着时间的延长无明显变化,蛋白的溶出率已达到动态平衡。从节省时间和能耗的角度考虑,选择碱溶时间45、60、75 min进行响应面分析。
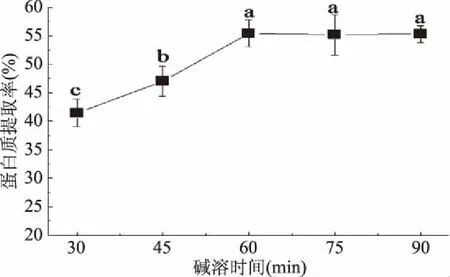
图2 碱溶时间对蛋白质提取率的影响Fig.2 The influence of alkali solution time on the protein extraction rate
2.1.3 碱溶温度对蛋白质提取率的影响 由图3可知,随着碱溶温度的上升,大豆蛋白提取率受温度的影响变化较大,当温度达到40 ℃时蛋白提取率达到最高,显著高于其他组(p<0.05);温度超过40 ℃时,蛋白提取率下降。原因可能是当提取率达到最高值后,继续增加温度基质黏度有所增加,分离蛋白相对困难。因此选择碱溶温度35、40、45 ℃进行响应面分析。
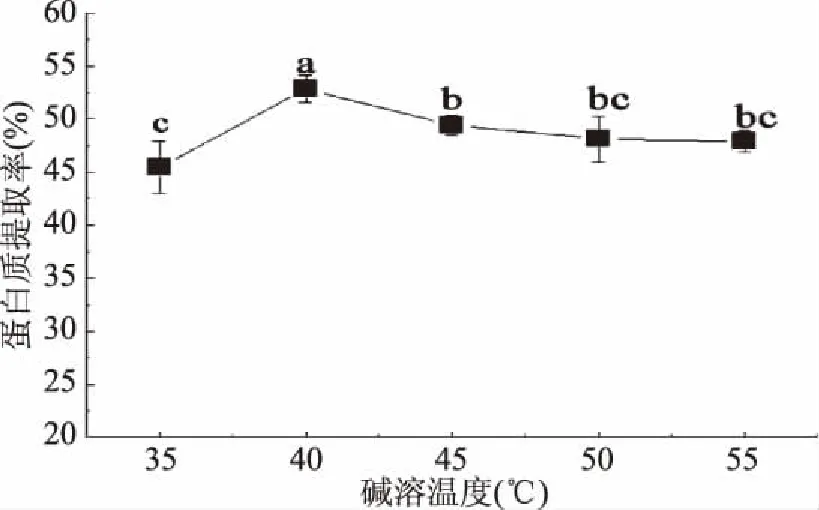
图3 碱溶温度对蛋白质提取率的影响Fig.3 The influence of alkali solution tempreture on the protein extraction rate

图4 料液比对蛋白质提取率的影响Fig.4 The influence of solid material ratio on the protein extraction rate
2.1.4 料液比对蛋白质提取率的影响 图4可知,随着料液比的增加,蛋白质提取率呈现先上升后稳定的趋势。当料液比达到1∶12时,蛋白提取率达到最大值为60.45%,并逐渐趋于平衡。一般来说,加水量过少,碱提液浓度高,体系粘度大,蛋白不易溶出,所以随着料液比的增加,蛋白溶出率会增加[18]。但是当料液比增加到一定程度豆渣蛋白提取率不再升高,相反,由于酸沉蛋白时会有部分蛋白仍溶解于提取液中而被丢弃,料液比的增加会加剧这一部分蛋白的损失。因此,从经济和减少工业废水角度考虑,选择料液比1∶10、1∶12、1∶14进行响应面分析。
2.1.5 酸沉pH对蛋白值提取率的影响 图5可知,随着酸沉pH的增加,蛋白提取率呈先升高后降低的趋势。在酸沉pH为4.5时,蛋白提取率达到最高值,判定发酵豆粕乳中蛋白的等电点为4.5,这与章宝等[19]所得结果类似。由于蛋白质等电点与蛋白本身结构性质有关,在酸沉提取过程中,较温和的条件不会造成蛋白质的变性,因此碱溶时不同因素对等电点影响不大,故不将酸沉pH纳入响应面分析,直接选择pH4.5作为最佳酸沉pH。
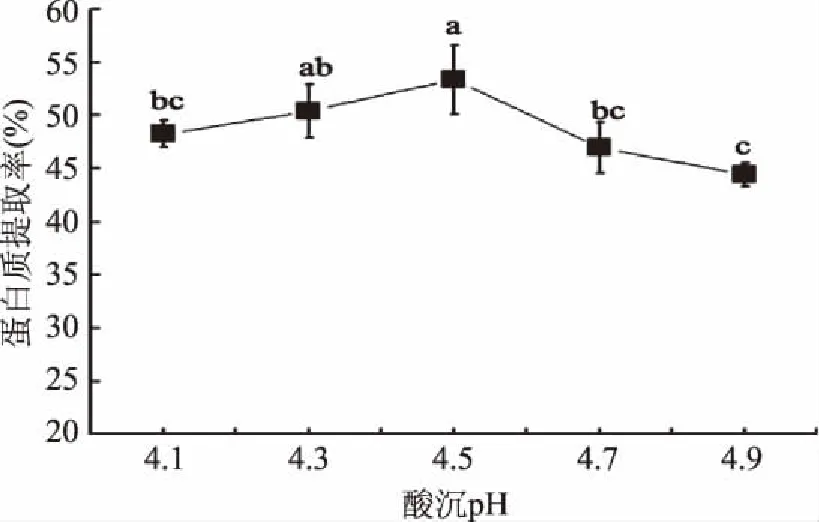
图5 酸沉pH对蛋白质提取率的影响Fig.5 The influence of acid precipitation pH value on the protein extraction rate
2.2响应面实验分析
2.2.1 响应面优化实验与方差分析 在单因素的实验基础上,采用Box-Behnken中心组合实验设计原理,以蛋白质提取率为响应值,选用碱溶pH(A)、碱溶时间(B)、碱溶温度(C)、料液比(D)为影响因素,进行四因素三水平的提取实验。结果见表2。
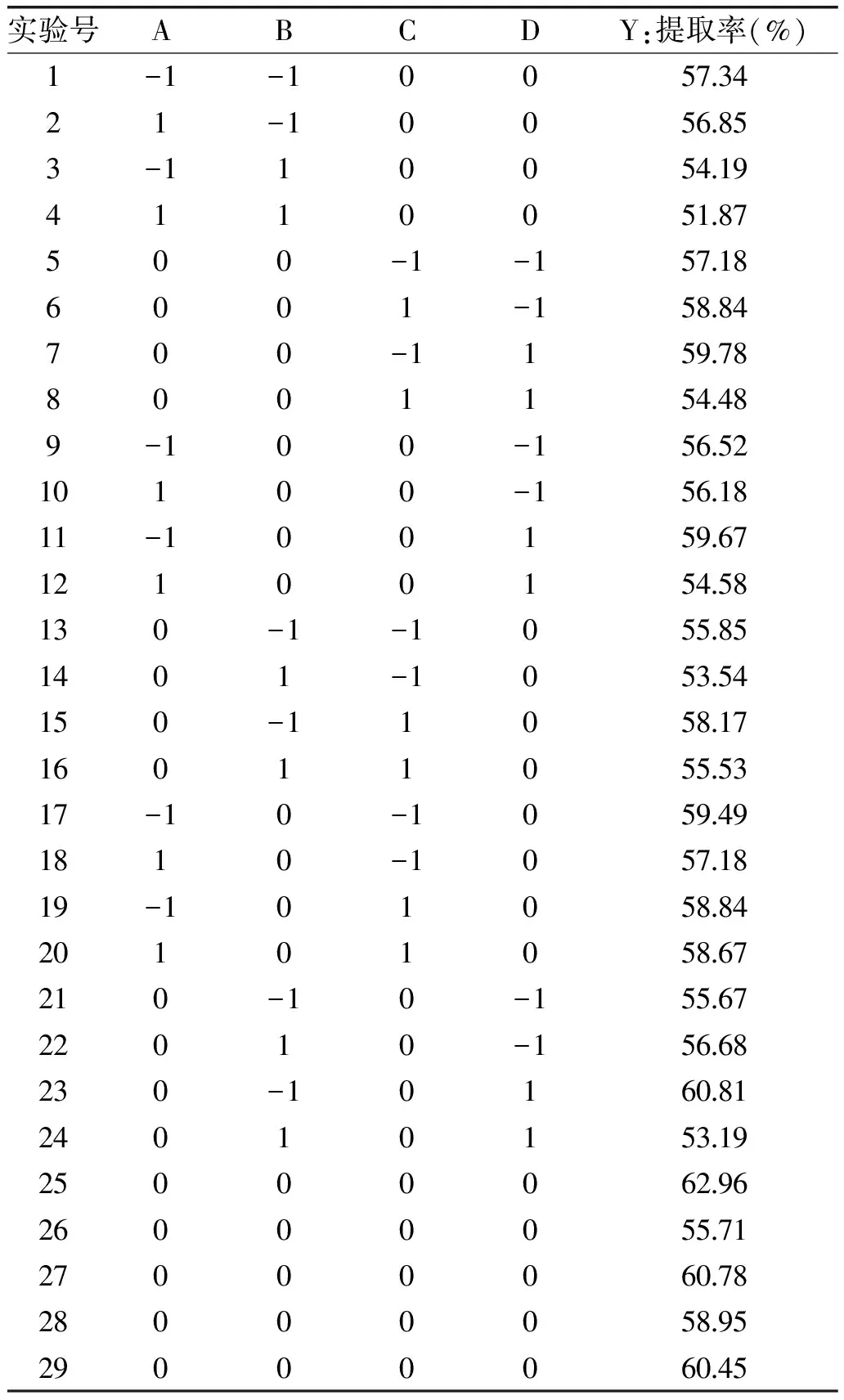
表2 Box-Behnken实验设计及结果Table 2 Box-Benhnken design and results
利用Design-Expert 8.0.6软件对表2中的实验结果进行非线性回归的二次多项式拟合,以蛋白质提取率为响应值Y得到预测模型如下:
Y=62.29-0.89A-1.64B+0.71C+0.70D-0.46AB+0.54AC-0.19AD-0.0082BC-2.16BD+1.000E-0.02CD-2.98A2-4.44A2-1.33C2-1.83D2
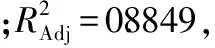
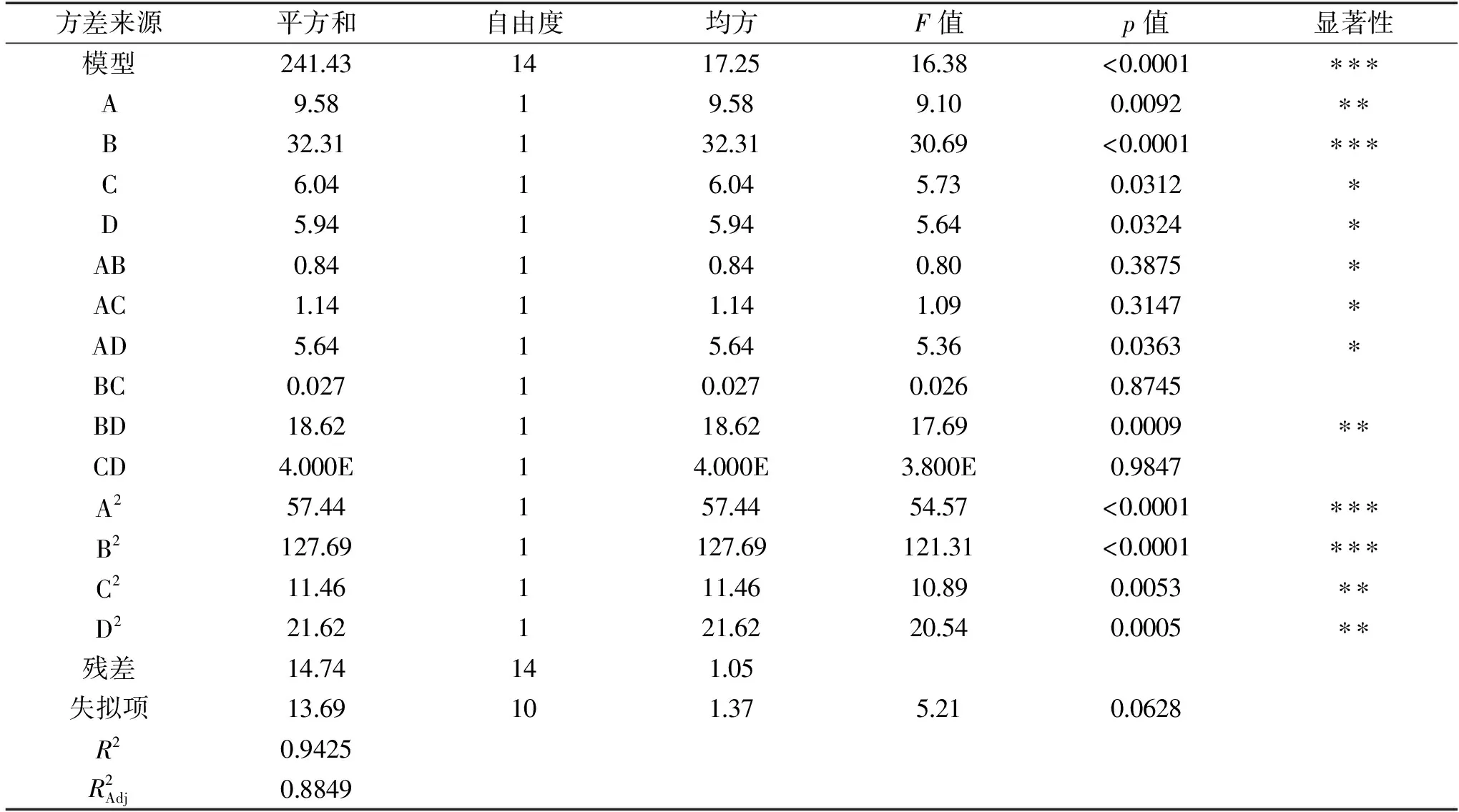
表3 回归模型方差分析表Table 3 Analysis of variance for the fitted regression model
注:***差异极度显著(p<0.0001);**差异高度显著(0.0001
2.2.2 各因素交互作用影响 根据表3的方差分析表可知,B、A2、B2差异极度显著;A、BD、C2、D2差异高度显著;C、D、AB、AC、AD差异显著;由此说明各因素之间交互作用很好,并且各因素与响应值不是简单的一次线性关系。以下为各因素交互作用显著的响应面3D分析图。
由图6可知,当碱溶温度为40 ℃,料液比为1∶12时,随着碱溶pH的提高,碱溶时间的延长,蛋白质提取率增加。图6中的等高线为椭圆形,椭圆形的轴线与A和B坐标轴存在一定的角度,故碱溶pH和碱溶时间的交互作用为显著水平。
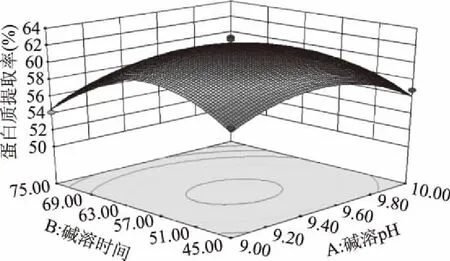
图6 碱溶pH和碱溶时间对蛋白质提取率交互影响的曲面图Fig.6 The 3-D surface of interactions between alkali solution pH and alkali solution time on protein yield
由图7可知,当碱溶时间为60 min,料液比为1∶12时,随着碱溶pH和碱溶温度的升高,蛋白质提取率增加。图7中的等高线为椭圆形,椭圆形的轴线A和C坐标轴存在一定的角度,故碱溶pH和碱溶温度的交互作用表现为显著水平。

图7 碱溶pH和碱溶温度对蛋白质提取率交互影响的曲面图Fig.7 The 3-D surface of interactions between alkali solution pH and alkali solution tempreture on protein yield
由图8可知,当碱溶时间为60 min,碱溶温度为40 ℃时,随着碱溶pH的提高,料液比的增大,蛋白质提取率增加。图8中等高线为抛物线,故碱溶时间与料液比的交互作用表现为显著水平。
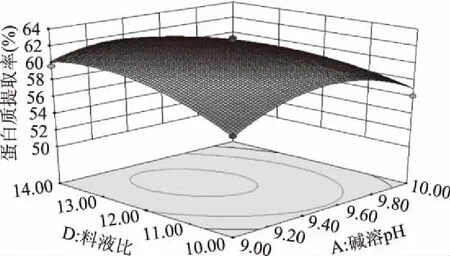
图8 碱溶pH和料液比对蛋白质提取率交互影响的曲面图Fig.8 The 3-D surface of interactions between alkali solution pH and solid material ratio on protein yield
由图9可知,当碱溶pH为9.5,料液比为1∶12时,随着碱溶时间的延长,碱溶温度的升高,蛋白质提取率缓慢增加。图9中的等高线为抛物线,但响应面走势相对平缓,故碱溶时间和碱溶温度的交互作用表现为不显著。

图9 碱溶时间和碱溶温度对蛋白质提取率交互影响的曲面图Fig.9 The 3-D surface of interactions between alkali solution time and alkali solution tempreture on protein yield
由图10可知,当碱溶pH为9.5,碱溶温度为40 ℃时,随着碱溶时间的延长,料液比的增大,蛋白质提取率增加。图10中的等高线为抛物线,响应面走势剧烈,故碱溶时间和料液比的交互作用表现为显著水平。
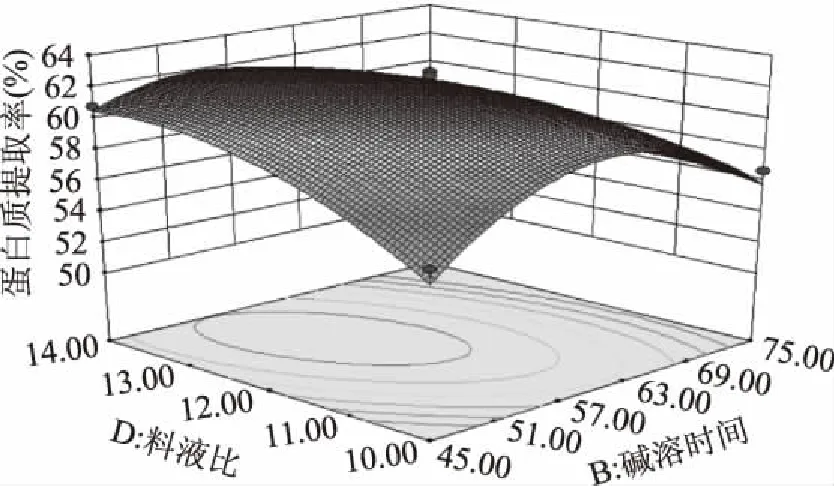
图10 碱溶时间和料液比对蛋白质提取率交互影响的曲面图Fig.10 The 3-D surface of interactions between alkali solution time and solid material ratio on protein yield
由图11可知,当碱溶pH为9.5,碱溶时间60 min时,随着碱溶温度的升高,料液比的增大,蛋白质提取率增加。图11中的等高线为椭圆形,椭圆形的轴线C和D与坐标轴存在一定微小的的角度,故碱溶温度和料液比的交互作用表现为不显著。

图11 碱溶温度和料液比对蛋白质提取率交互影响的曲面图Fig.11 The 3-D surface of interactions between alkali solution tempreture and solid material ratio on protein yield
2.2.3 最佳提取条件的确立 对回归方程进行分析计算,得出发酵豆粕乳中蛋白提取的最佳条件为:碱溶pH9.4、碱溶时间55.80 min、碱溶温度41.19 ℃、料液比1∶12.84,在此条件下蛋白质提取率为62.8352%。考虑实际情况等因素,选择碱溶pH9.4、碱溶时间56 min、碱溶温度41 ℃、料液比1∶12,得出蛋白质提取率为60.36%,其相对误差为3.9%,说明该实验经优化后得到的提取参数准确可靠,具有很好的实际意义。
2.3植物乳杆菌发酵对大豆分离蛋白品质的影响
国内对从豆粕提取大豆分离蛋白研究工艺已逐渐成熟,但与本工艺也存在一定的差异性。刘中华[20]研究微波辅助提取低温豆粕中的大豆蛋白,采用考马斯亮蓝法测定蛋白质含量,尽管提取时间相对较短为6 min,但料液比为1∶30 g/mL,造成成本过高;孙楠[21]等研究采用枯草芽胞菌种发酵豆粕,接种量为10%,且发酵时间过长为19 h,并且枯草芽胞菌产酸量比植物乳杆菌低,发酵后的分离蛋白溶解性差;李宝山[22]等探讨超声波对高温脱脂豆粕蛋白提取率的研究,结果表明超声波处理极显著提高大豆分离蛋白的提取率,但所得蛋白的水溶性差,为10%左右,远低于本提取工艺。本文通过单因素与响应面分析确定了碱溶酸沉法提取发酵豆粕中蛋白的最佳工艺,通过最佳工艺分别提取发酵前后豆粕中蛋白,并分别测其蛋白溶解性、体外消化率、酸溶蛋白含量,结果见表4。
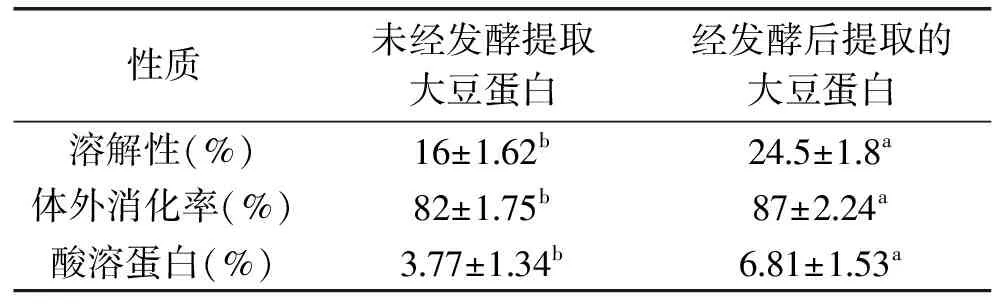
表4 发酵前后大豆蛋白溶解性、体外消化率、酸溶蛋白变化结果Table 4 The change of soybean protein solubility and in vitro digestibility,acid soluble protein before and after fermentation
注:同行肩标不同小写字母表示差异显著(p<0.05)。
由表4结果可知,脱脂豆粕在发酵后其蛋白的溶解性、体外消化率、酸溶蛋白均显著提高(p<0.05)。这与刘海燕等[23]实验结果有相似之处。造成此变化的原因可能是豆粕在发酵过程中,由于植物乳杆菌所产蛋白酶的酶解作用,部分大豆蛋白被分解,形成了分子量较小的肽类物质,从而提高了蛋白的溶解性。另外,较小分子的肽类物质更容易被酶解消化利用,故体现为体外消化率的提高。发酵酶切造成的蛋白质亲水基团暴露以及结构改变,改变了豆粕中部分蛋白的等电点,从而使其酸溶蛋白比例提高。
3 结论与讨论
本实验采用响应面法优化从发酵豆粕中提取蛋白具有明显效果,蛋白质提取率可达60.36%。证明了碱溶酸沉法提取发酵豆粕中蛋白的可行性。确定了植物乳杆菌发酵豆粕蛋白最佳提取工艺:碱溶pH9.4、碱溶时间56 min、碱溶温度41 ℃、料液比1∶12。同时脱脂豆粕经发酵后其蛋白的溶解性、体外消化率、酸溶蛋白含量较未发酵豆粕均有显著提高(p<0.05)。
本研究中所得的工艺参数受限于实验室条件,由于不同规模的微生物发酵情况存在很大不同,蛋白提取条件也随之变化,因此在扩大工业化生产的过程中,需要参照本文所得工艺做进一步的改进,具体参数有待中试研究得出。本文篇幅所限,并没有对发酵豆粕蛋白的其他品质指标(如游离总氨基酸、氨基酸分布、小肽含量等)与原始豆粕作对比研究,造成发酵豆粕提取的SPI功能性质改变的原因尚不明确,有待在深入探讨。此外,此前研究显示发酵豆粕所得蛋白的抗营养因子往往较普通SPI有显著降低,本文发酵豆粕蛋白中的胰蛋白酶抑制因子、植酸、脂肪氧化酶等抗营养因子指标上的变化,有待在今后的实验中作详细检测与对比研究。
[1]Cervantes-Pahm S K,Stein H H. Ileal digestibility of amino acids in conventional,fermented,and enzyme-treated soybean meal and in soy protein isolate,fish meal,and casein fed to weanling pigs[J]. Journal of Animal Science,2010,88(8):2674-2683.
[2]杨小佳. 固态发酵豆粕生产大豆肽及其功能特性研究[D]. 郑州:河南工业大学,2014.
[3]邓克权. 脱脂豆粕残余脂质对大豆蛋白分级分离及其结构与功能的影响[D]. 无锡:江南大学,2013.
[4]李慧芬,马成,张克顺. 植物乳杆菌发酵豆粕产L-乳酸的最佳条件优化[J]. 饲料工业,2015(5):32-36.
[5]Frias J,Song Y S,Martínezvillaluenga C,et al. Immunoreactivity and Amino Acid Content of Fermented Soybean Products[J]. Journal of Agricultural & Food Chemistry,2008,56(1):99-105.
[6]崔宪,刘容旭,姜帆,等. 植物乳杆菌发酵对大豆分离蛋白功能性质影响研究[J]. 食品工业科技,2016,37(3):77-186.
[7]Hu H,Wu J,Li-Chan E C Y,et al. Effects of ultrasound on structural and physical properties of soy protein isolate(SPI)dispersions[J]. Food Hydrocolloids,2013,30(2):647-655.
[8]Villanueva M J,Yokoyama W H,Hong Y J,et al. Effect of high-fat diets supplemented with okara soybean by-product on lipid profiles of plasma,liver and faeces in Syrian hamsters[J]. Food Chemistry,2011,124(1):72-79.
[9]李加兴,向东,周炎辉,等. 碱提酸沉法提取黄秋葵籽蛋白的工艺条件优化[J]. 食品科学,2013,34(20):23-26.
[10]王喜刚,况楠,裴云生,等. 脱脂豆粕中大豆分离蛋白提取工艺的研究[J]. 粮食与食品工业,2012,19(6):58-61.
[11]张林祥,杜广华,葛秀元,等. 检验食品中蛋白质含量标准测定方法的改进[J]. 宝鸡文理学院学报:自科版,2016,36(1):36-39.
[12]孙英杰. 超声波处理对大豆分离蛋白结构和功能性质影响研究[D]. 哈尔滨:东北农业大学,2014.
[13]李燕燕. 改性提高大米蛋白体外消化率的研究[D]. 无锡:江南大学,2015.
[14]朱平军,程茂基,江涛,等. 黑曲霉发酵豆粕对豆粕中酸溶蛋白含量影响的研究[J]. 饲料博览,2011(6):5-8.
[15]Meng G T,Ching K M,Ma C Y. Thermal aggregation of globulin from an indigenous Chinese legume,Phaseolus angularis,(red bean)[J]. Food Chemistry,2002,79(79):93-103.
[16]刘明美,齐斌,赵国琦. 不同因素对低温脱脂豆粕蛋白提取率的影响[J]. 中国畜牧杂志,2014,50(1):69-74.
[17]刘红,康玉凡. pH对大豆7S、11S球蛋白功能特性影响[J]. 粮食与油脂,2013,26(8):17-20.
[18]郑田要,杨晓泉. 热压法提取高温大豆粕中的大豆蛋白[J]. 食品与发酵工业,2009(8):175-178.
[19]章宝,单杨,李高阳. 响应面优化花生分离蛋白提取工艺的研究[J]. 食品工业科技,2012,33(11):270-274.
[20]刘中华,曾维丽. 微波辅助提取低温豆粕中的大豆蛋白[J]. 农业机械,2011(17):58-61.
[21]孙楠,杜娜,王霆. 微生物发酵法制备的豆粕中大豆分离蛋白提取[J]. 广州化工,2016(21):40-41.
[22]李宝山,王际英,张利民,等. 超声波对大豆分离蛋白提取率及性质的影响[J]. 饲料研究,2008(5):1-3.
[23]刘海燕. 乳酸菌发酵豆粕及其功效研究[D]. 长春:吉林农业大学,2012.
Studyonextractiontechnologyandqualityoffermentedsoybeanmealprotein
LIUDong1,LIURong-xu1,WUXi1,DIAOYu-xi1,WANGLin1,CUIShi-yang1,HANJian-chun1,2,*
(1.College of Food Science,Northeast Agricultural University,Harbin 150030,China;2.Academy of Heilongjiang Green Food Science,Harbin 150028,China)
Single factor experiments were carried out to investigate the effects of different alkali solution pH,alkali solution time,alkali solution temperature and solid-liquid ratio on the extraction rate of protein from fermented soybean meal. The optimum extraction technology of protein from fermented soybean meal was established by response surface optimization,the main quality index of the extracted protein was measured. The results showed that the effect of different factors on protein extraction rate was in the order of alkali solution time>alkali solution pH>alkali solution temperature>solid liquid ratio.The optimal process was as follows:alkali solution pH9.4,alkali solution time 56 min,alkali solution temperature 41 ℃,solid-liquid ratio 1∶12. Under these conditions,the extraction rate of the modified protein was 60.36%. The results showed that the solubility,invitrodigestibility and acid soluble protein content of soybean protein isolate(SPI)extracted from soybean meal fermented byLactobacillusplantarumwere significantly higher than that of non fermented soybean meal(p<0.05). It was economical and easy to use this technology to extract fermented soybean meal protein,and the quality of SPI was good,which could provide reference for the development and utilization of soybean meal protein.
fermented soybean meal;response surface;protein;extraction;protein quality
2016-11-23
刘冬(1992-),女,硕士研究生,研究方向:农产品加工及贮藏工程,E-mail:m15945788490_1@163.com。
*通讯作者:韩建春(1973-),男,博士,教授,研究方向:农产品加工,E-mail:hanjianchun@hotmail.com。
国家863计划项目(2013AA102208)。
TS214
:B
:1002-0306(2017)12-0214-07
10.13386/j.issn1002-0306.2017.12.039

